三环唑(Tricyclazole)又名克瘟灵,是由美国Elililly公司研制的具有较强内吸性的保护性杀菌剂,能迅速被水稻根、茎、叶吸收,抗雨水冲刷能力强[1-4]。主要用于防治稻瘟病,尤其对穗颈瘟病有很好的防治效果[5]。嘧菌酯(Azoxystrobin)是由先正达公司开发的广谱性杀菌剂,是一种新型甲氧基丙烯酸酯类(Strobilurins)杀菌剂,其杀菌活性高,能够同时有效地防治白粉病和霜霉病[6-7],已经被广泛用于谷物、果蔬等作物的病害防治与储藏保鲜[8]。目前关于三环唑和嘧菌酯在水稻中的报道主要以单药[1, 9]的测定为主,而同时测定水稻中三环唑唑和嘧菌酯双组分的残留分析方法以及对三环唑和嘧菌酯在稻田环境中的残留和消解动态研究鲜见报道。由于三环唑具有热不稳定性,目前多采用高效液相色谱法[9-11]、气相色谱法[12]检测水稻、土壤及稻田水中的残留。如姚金刚等[9]采用高效液相色谱法检测水稻植株、糙米及谷壳中三环唑的残留;刘家富等[12]采用气相色谱法检测糙米中的三环唑含量。嘧菌酯具有热稳定性,目前多采用气相色谱法[13-16]、气相色谱-质谱[17]、液相色谱法[18-20],液相色谱-质谱[21-22]进行检测。如吴常敏[23]采用气相色谱法检测植株和糙米中嘧菌酯的残留;高阳等[17]采用气相色谱-质谱法检测嘧菌酯在水稻中的消解动态及累积分配特征。
随着三环唑和嘧菌酯在水稻生产中的广泛应用,其在水稻上的残留及消解动态,对环境的影响也备受关注。本文研究了同时将三环唑和嘧菌酯分别施用于广西南宁、湖南长沙和黑龙江哈尔滨的水稻后,分别采用高效液相色谱法和气相色谱法检测其在水稻上的残留和消解动态,了解其对环境的影响, 以期为三环唑和嘧菌酯在水稻上最大残留限量标准的制订、在水稻上的安全、科学合理使用提供科学依据。
1 材料与方法 1.1 仪器与试剂Agilent 7890A气相色谱仪,带电子捕获检测器(ECD)(美国Agilent公司);Agilent 1260高效液相色谱仪,带紫外检测器(UV)(美国Agilent公司);JA3003分析天平(上海精密科学仪器有限公司);恒温振荡仪(金坛医疗仪器);Vortex-Genie2涡旋振荡器(上海旦鼎国际贸易有限公司);Hei-VAP旋转蒸发仪(德国Heidolph公司);湘仪TDZ5-WS (湘仪仪器开发有限公司);十二孔固相萃取装置(美国Supelco公司);Milli-Q超纯水仪(美国Millipore公司)。
w为98.5%的三环唑标准品和w为99.5%的嘧菌酯标准品(德国Dr. Ehrenstorfer公司);300 g·L-1三环唑·嘧菌酯悬浮剂(市售);CNW Bond NH2固相萃取小柱(柱体积为6 mL,内含500 mg填充材料,ANPEL公司);甲醇和乙酸乙酯均为色谱纯(CNW公司);乙腈、二氯甲烷、氯化钠和无水硫酸钠均为分析纯(成都科龙化学试剂公司);超纯水。
1.2 检测方法的建立 1.2.1 样品的制备稻田水:准确量取稻田水样品60.0 mL,经双层化学分析滤纸过滤后,收集滤液于250 mL梨形分液漏斗中,加入5.0 g氯化钠,再分别用30、30、30 mL二氯甲烷萃取3次,每次萃取2 min,过无水硫酸钠后合并二氯甲烷萃取液,于45℃条件下旋蒸近干,三环唑和嘧菌酯样品分别用甲醇和乙酸乙酯定容至5 mL,过0.22 μm有机滤膜,于进样小瓶中保存,待测。
稻田土壤:准确称取土壤样品10.0 g,加入40 mL乙腈振荡提取1 h,加入5.0 g氯化钠,涡旋1 min,于4 800 r·min-1条件下离心5 min,取20 mL上清液于45℃条件下旋蒸近干,三环唑和嘧菌酯样品分别用甲醇和乙酸乙酯定容至2 mL,过0.22 μm有机滤膜,于进样小瓶中保存,待测。
水稻植株:准确称取植株样品5.0 g,加入30 mL乙腈,匀浆2 min,于4 800 r·min-1条件下离心3 min,将上清液转移至盛有5.0 g氯化钠具塞量筒中,残渣再加入20 mL乙腈,匀浆2 min,于4 800 r·min-1条件下离心3 min,合并上清液,涡旋1 min,静置分层,取30 mL上清液于45℃条件下旋蒸近干,用4 mL乙腈洗涤浓缩瓶2次,待净化。
净化:用乙腈5 mL预淋洗CNW NH2固相萃取柱,当溶剂液面流至吸附填料表面时加入上述待净化洗涤液,再用5 mL乙腈洗脱4次,收集上样液和洗脱液,于45℃条件下旋蒸近干,三环唑和嘧菌酯样品分别用甲醇和乙酸乙酯定容至3 mL,过0.22 μm有机滤膜,于进样小瓶中保存,待测。
1.2.2 仪器条件三环唑的液相色谱检测条件:色谱柱:Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250.0 mm,5.0 μm);柱温25℃,进样体积为10 μL;流动相A为甲醇,流动相B为水;流速为0.8 mL·min-1;检测波长245 nm;采用等度洗脱,V(A):V(B)=60:40。
嘧菌酯的气相色谱检测条件:色谱柱:HP-5石英毛细管柱(30.00 m×0.32 mm×0.25 μm);载气:氮气(纯度99.999%),恒流模式,流速3 mL·min-1;进样口温度270℃;检测器温度300℃,尾吹氮气30 mL·min-1;柱流速1.5 mL·min-1,进样量1 L;柱温:初始温度100℃,保持1 min,以20℃·min-1升至250℃,保持6 min,再以10℃·min-1升至300℃,保持5 min。
1.2.3 标准溶液的配制及标准曲线的绘制三环唑:称取标准品0.010 15 g于10 mL的容量瓶中,用甲醇溶解定容,配制成质量浓度为1 000 mg·L-1的标准储备液,再用甲醇分别稀释成5.00、1.00、0.50、0.10、0.05 mg·L-1系列标准溶液,按1.2.2节的三环唑的液相色谱检测条件测定,以峰面积(y)为纵坐标,质量浓度(x)为横坐标,绘制标准曲线。
嘧菌酯:称取标准品0.010 05 g于10 mL的容量瓶中,用乙酸乙酯溶解定容,配制成质量浓度为1 000 mg·L-1的标准储备液,再用乙酸乙酯分别稀释成1.00、0.50、0.10、0.05、0.01 mg·L-1系列标准溶液,按1.2.2节的嘧菌酯气相色谱检测条件测定,以峰面积(y)为纵坐标,质量浓度(x)为横坐标,绘制标准曲线。
1.2.4 添加回收试验三环唑:在空白的水稻植株、稻田水和土壤中分别添加三环唑标准溶液,添加质量浓度均分别为0.05、0.10、1.00 mg·L-1,每个水平重复5次,按所建立的方法进行提取和检测,计算添加回收率和相对标准偏差。
嘧菌酯:在空白的水稻植株、稻田水和土壤中分别添加嘧菌酯标准溶液,添加质量浓度均分别为0.01、0.10、1.00 mg·L-1,每个水平重复5次,按所建立的方法进行提取和检测,计算添加回收率和相对标准偏差。
1.3 消解动态试验供试试剂为300 g·L-1三环唑·嘧菌酯悬浮剂,在稻田近旁另选一块与稻田种植环境一致的空白小区进行试验。按300 g·L-1三环唑·嘧菌酯悬浮剂推荐有效成分高剂量的1.5倍(有效成分为675 g·hm-2)兑水稀释后均匀喷施于处在分蘖期的水稻植株上(茎叶喷雾),于施药后2 h及1、3、5、7、14、21、30 d采集水稻植株样品, 于施药后2 h及1、3、5、7、14、21、30、45 d采集土壤和稻田水样品。
水稻植株的采集:每小区采6~12个点,剪取地表以上的水稻全株1 kg以上,切碎混匀,采用四分法留取样品500 g,于自封袋中,备用。
稻田土壤的采集:用土钻采0~10 cm土层,每小区采样不少于10个点,采样量不少于1 kg,去除杂草和碎石,混匀,采用四分法留取样品500 g,于自封袋中,备用。
稻田水的采集:多点取稻田水约500 mL,混匀后取200 mL,于塑料瓶中,备用。
以上样品运回实验室后均低温(-20℃)保存。
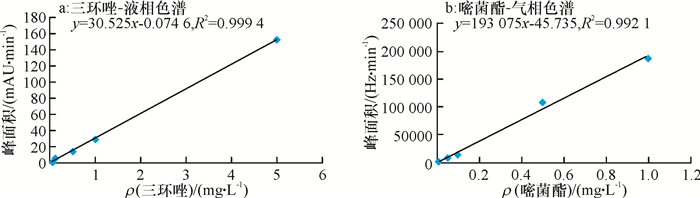
2 结果与分析 2.1 标准曲线外标法定量,三环唑和嘧菌酯峰面积(y)与质量浓度(x)呈良好线性相关(图 1),线性回归方程分别为y=30.525x-0.074 6和y=193 075x+45.735,R2分别为0.999 4和0.992 1。
|
图 1 三环唑和嘧菌酯标准曲线 Figure 1 The standard curves of tricyclazole and azoxystrobin |
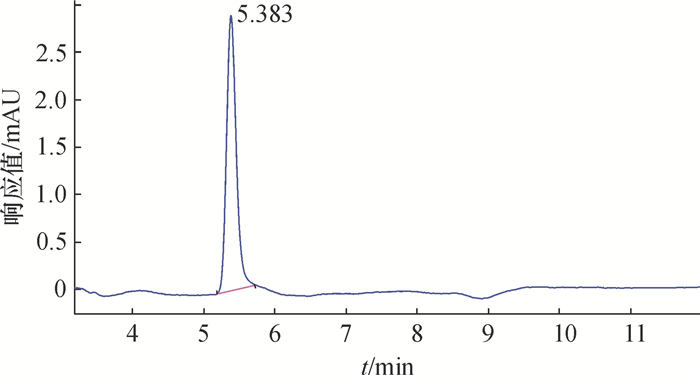
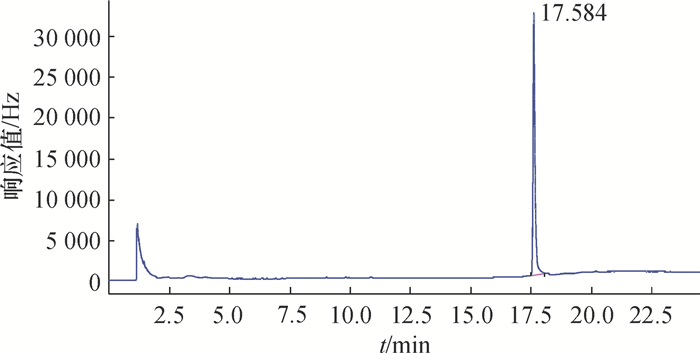
在1.2.2仪器条件下,三环唑和嘧菌酯在水稻(植株、稻田水及土壤)中的检出限(LOQ)分别为0.05和0.01 mg·L-1,三环唑和嘧菌酯的色谱图见图 2和图 3。添加回收试验结果(表 1)表明,在水稻植株中三环唑和嘧菌酯的平均回收率(相对标准偏差)分别为89.4%~100.8%(4.9%~12.9%)和95.4%~108.6%(6.0%~12.9%);在稻田水中三环唑和嘧菌酯的平均回收率(相对标准偏差)分别为81.6%~85.1%(1.0%~5.1%)和73.9%~109.7%(3.1%~6.0%);在土壤中三环唑和嘧菌酯的平均回收率(相对标准偏差)分别为78.5%~86.3%(1.8%~6.4%)和75.6%~90.4%(6.5%~8.7%),说明该方法的灵敏度、准确性及精密度均符合农药残留技术检测要求[24]。
|
图 2 三环唑的液相色谱图 Figure 2 Chromatogram of tricyclazole |
|
图 3 嘧菌酯的气相色谱图 Figure 3 Chromatogram of azoxystrobin |
|
|
表 1 三环唑和嘧菌酯在水稻植株、稻田水及土壤中的平均回收率和相对标准偏差 Table 1 Average recovery rates and RSDs of tricyclazole and azoxystrobin in rice plant, paddy water and soil |
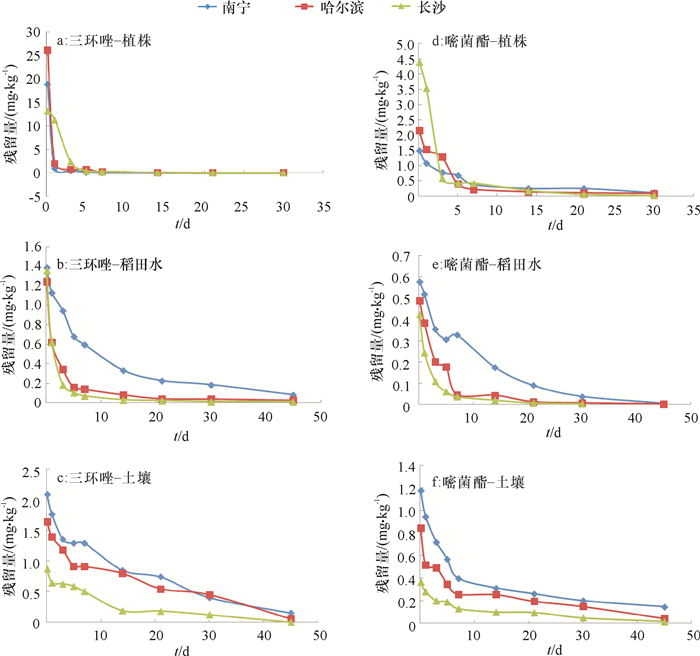
三环唑和嘧菌酯在水稻植株、稻田水和土壤中的降解动力学方程拟合结果见表 2和图 4。表 2表明,在水稻植株、稻田水和土壤中三环唑和嘧菌酯的降解均符合一级动力学特征,在广西南宁、湖南长沙和黑龙江哈尔滨3地的试验地中,三环唑在水稻植株中的半衰期(t1/2)分别为2.7、2.6和2.4 d,在稻田水中的t1/2分别为11.6、7.2和9.2 d,在土壤中的t1/2分别为13.1、10.5和11.2 d;嘧菌酯在水稻植株中的t1/2分别为9.1、4.3和6.1 d,在稻田水中的t1/2分别为7.2、4.9和6.2 d,在土壤中的t1/2分别为16.1、11.2和12.8 d,均属于易降解农药(t1/2 < 30 d)。
|
|
表 2 三环唑和嘧菌酯在水稻植株、稻田水及土壤中的消解动力学参数 Table 2 Dissipation kinetic parameters of tricyclazole and azoxystrobin in rice plant, paddy water and soil |
|
图 4 三环唑和嘧菌酯在植株、稻田水和土壤中的消解动态 Figure 4 Dissipation dynamics of tricyclazole and azoxystrobin in rice plant, paddy water and soil |
由图 4可知,三环唑和嘧菌酯在水稻植株中的原始沉积量最高,但降解较快。由表 3可知,施药后3 d,植株中三环唑的降解率达82.1%~97.1%,施药后5 d,植株中嘧菌酯的降解率达53.8%~90.1%,在三地的土壤和稻田水试验中,南宁的原始沉积量均最高(图 4c~4f),三环唑和嘧菌酯在土壤和稻田水中的降解较快,施药后14 d三环唑和嘧菌酯在土壤中的降解率分别为51.4%~78.2%和69.9%~73.6%,可见,降解率存在一定的差异,可能与试验地点的气候条件和土壤类型等因素有关。
|
|
表 3 三环唑和嘧菌酯在水稻植株、稻田水及土壤中的降解率1) Table 3 Dissipation rates of tricyclazole and azoxystrobin in rice plant, paddy water and soil |
本文研究并建立了采用高效液相色谱法和气相色谱法分别测定水稻植株、稻田水、土壤中三环唑和嘧菌酯残留量的方法,该方法操作简便,灵敏度、准确性及精密度均符合农药残留检测的技术要求。
消解动态试验结果表明:施药方式(茎叶喷雾)及水稻生长条件不同,对三环唑和嘧菌酯在土壤及稻田水中残留具有一定的影响,三环唑在南宁、长沙和哈尔滨水稻植株中的半衰期分别为2.7、2.6和2.4 d,在稻田水中的半衰期分别为11.6、7.2和9.2 d,在土壤中的半衰期分别13.1、10.5和11.2 d;嘧菌酯在南宁、长沙和哈尔滨水稻植株中的半衰期分别为9.1、4.3和6.1 d,在稻田水中的半衰期分别为7.2、4.9和6.2 d,在土壤中的半衰期分别16.1、11.2和12.8 d。消解动态的测定结果也表明,三环唑和嘧菌酯均属于易降解农药,推测施药后对环境和水稻植株是安全的,同时有相关文献报道三环唑在水稻[5,9,11]和嘧菌酯在水稻[16-17]及其他作物[13-15,25-26]上的半衰期均小于30 d。施药后3 d植株中三环唑的降解率达82.1%~97.1%,施药后5 d植株中嘧菌酯的降解率达53.8%~90.1%,而李佳等[5]和谢惠等[16]报道施药后5 d三环唑和嘧菌酯的降解率均少于65%,笔者认为可能与植株处在分蘖期进行施药及施药方式(茎叶喷雾)有关,也与试验地的气候条件有关。三环唑和嘧菌酯在植株中的原始沉积量最高,且在水稻植株、稻田水和土壤中三环唑的原始沉积量都高于嘧菌酯,笔者认为原因是三环唑的有效含量比嘧菌酯高,且采用茎叶喷雾的施药方式,三环唑本身具有较强的内吸性,能迅速地被水稻各部位吸收等。我国尚未制定三环唑和嘧菌酯在糙米中的最大残留限量(MRL),因此本文结果也可为我国制定三环唑和嘧菌酯在糙米中的MRL提供一定的科学依据。
| [1] |
杨森, 吴勇, 徐莲. 高效液相色谱法测定水稻上的三环唑[J]. 农药科学与管理, 2014, 35(8): 33-39. (  0) 0) |
| [2] |
TANG H, FANG D, LI Q, et al. Determination of tricyclazole content in paddy rice by surface enhanced Raman spectroscopy[J]. J Food Sci, 2012, 77(5): T105-T109. DOI:10.1111/jfds.2012.77.issue-5 (  0) 0) |
| [3] |
PHONG T K, NHUNG D T T, MOTOBAYASHI T, et al. Fate and transport of nursery-box-applied tricyclazole and imidacloprid in paddy fields[J]. Water Air Soil Poll, 2009, 202(1): 3-12. (  0) 0) |
| [4] |
PHONG T K, NHUANG D T T, YAMAZAKI K, et al. Behavior of sprayed tricyclazole in rice paddy lysimeters[J]. Chemosphere, 2009, 74(8): 1085-1089. DOI:10.1016/j.chemosphere.2008.10.050 (  0) 0) |
| [5] |
李佳, 龚道新, 易丽君, 等. 25%己唑醇·三环唑悬浮剂在水稻植株上的残留与消解动态[J]. 农药, 2010, 49(8): 590-592. (  0) 0) |
| [6] |
JIANG J, DING L, MICHAILIDES T J, et al. Molecular characterization of field azoxystrobin-resistant isolates of Botrytis cinerea[J]. Pestic Biochem Phys, 2009, 93(2): 72-76. DOI:10.1016/j.pestbp.2008.11.004 (  0) 0) |
| [7] |
ZHANG Y J, ZHANG X, CHEN C J, et al. Effects of fungicides JS399-19, azoxystrobin, tebuconazloe, and carbendazim on the physiological and biochemical indices and grain yield of winter wheat[J]. Pestic Biochem Phys, 2010, 98(2): 151-157. DOI:10.1016/j.pestbp.2010.04.007 (  0) 0) |
| [8] |
黄华, 陈力华, 梁骥, 等. 气相色谱法研究水稻中粉唑醇和嘧菌酯残留及其降解动态[J]. 精细化工中间体, 2013, 43(5): 71-76. (  0) 0) |
| [9] |
姚金刚, 王倩, 秦旭, 等. QuEchERS-高效液相色谱法测定水稻中三环唑含量[J]. 环境化学, 2013, 32(2): 329-330. DOI:10.7524/j.issn.0254-6108.2013.02.024 (  0) 0) |
| [10] |
李敬源, 卢丽霞. 高效液相色谱法测定三环唑原药[J]. 广州化工, 2007, 35(1): 49-51. (  0) 0) |
| [11] |
付羽, 李明, 刘玥垠, 等. 高效液相色谱法同时测定水稻及土壤中稻瘟灵和三环唑[J]. 湖北农业科学, 2012, 51(11): 2325-2328. DOI:10.3969/j.issn.0439-8114.2012.11.048 (  0) 0) |
| [12] |
刘家富, 梅文泉. 大米中三环唑残留量的气相色谱测定[J]. 西南农业学报, 2005, 18(6): 836-838. (  0) 0) |
| [13] |
尹丰平, 李雪生, 黄辉晔. 嘧菌酯在黄瓜和土壤中的残留消解动态及最终残留研究[J]. 农业环境科学学报, 2006, 25(增刊): 590-594. (  0) 0) |
| [14] |
殷利丹, 侯志广, 陈超, 等. 嘧菌酯在大豆中的残留及消解动态[J]. 农药学学报, 2011, 13(3): 304-309. (  0) 0) |
| [15] |
杨振华, 魏朝俊, 贾临芳, 等. 嘧菌酯在草莓与土壤中的残留动态研究[J]. 农业环境科学学报, 2013, 32(4): 697-700. (  0) 0) |
| [16] |
谢惠, 龚道新. 嘧菌酯在稻田水、土壤及水稻植株中的残留降解行为研究[J]. 湖南农业科学, 2013, 42(1): 80-83. (  0) 0) |
| [17] |
高阳, 徐应明, 秦旭, 等. 戊唑醇和嘧菌酯在水稻中的消解动态及累积分配特征[J]. 生态与农村环境学报, 2014, 30(2): 246-251. (  0) 0) |
| [18] |
雒丽丽, 薄海波, 毕阳, 等. 超高效液相色谱法测定水果和饮料中残留的氟嘧菌酯和嘧螨酯[J]. 色谱, 2009, 27(2): 201-205. (  0) 0) |
| [19] |
于康平, 李泽方, 徐韶康, 等. 嘧菌酯的高效液相色谱分析[J]. 农药, 2008, 47(4): 275-276. (  0) 0) |
| [20] |
DE MELO ABREU S, CABONI P, CABRAS P, et al. Validation and global uncertainty of a liquid chromatographic with diode array detection method for the screening of azoxystrobin, kresoxim-methyl, trifloxystrobin, famoxadone, pyraclostrobin and fenamidone in grapes and wine[J]. Anal Chim Acta, 2006, 573(573/574): 291-297. (  0) 0) |
| [21] |
张志勇, 简秋, 宋稳成, 等. 嘧菌酯在牧草和土壤中的残留规律研究[J]. 草业学报, 2014, 23(3): 356-361. DOI:10.11686/cyxb20140342 (  0) 0) |
| [22] |
POLATI S, BOTTARO M, FRASCAROLO P, et al. HPLC-UV and HPLC-MSn multiresidue determination of amidosulfuron, azimsulfuron, nicosulfuron, rimsulfuron, thifensulfuron methyl, tribenuron methyl and azoxystrobin in surface waters[J]. Anal Chim Acta, 2006, 579(2): 146-151. DOI:10.1016/j.aca.2006.07.034 (  0) 0) |
| [23] |
吴常敏. 嘧菌酯在水稻中的残留及消解动态[J]. 广州化工, 2013, 41(8): 139-141. (  0) 0) |
| [24] |
钱传范. 农药残留分析原理与方法[M]. 北京: 化学工业出版社, 2011, 26-28.
(  0) 0) |
| [25] |
韩波, 姚安庆, 吴慧明, 等. 嘧菌酯在柑橘和土壤中残留动态[J]. 农药, 2009, 48(12): 899-901. DOI:10.3969/j.issn.1006-0413.2009.12.015 (  0) 0) |
| [26] |
刘艳萍, 孙海滨, 曾繁娟, 等. 嘧菌酯在芒果和土壤上残留动态分析[J]. 广东农业科学, 2010, 43(10): 106-107. DOI:10.3969/j.issn.1004-874X.2010.10.041 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


