尿素循环本质上是一个将神经毒素氨转化为水溶性尿素的过程,是精氨酸、鸟氨酸和瓜氨酸的内源性生产的唯一来源,也是清除蛋白质周转造成的废氮的主要机制[1],从而避免高氨血症的发生。该循环是包括6 个步骤的系列生化反应[2],有6 种酶参与调控,依次为N–乙酰谷氨酸合成酶(N-acetyl glutamate synthetase, NAGS)、氨甲酰磷酸合成酶1(Carbamyl phosphate synthetase 1, CPS1)、精氨基琥珀酸合成酶(Argininosuccinate synthetase, ASS)、精氨琥珀酸裂解酶(Argininosuccinate lyase, ASL)、鸟氨酸氨甲酰转移酶(Omithine transcarbamylase, OTC)和精氨酸酶(Arginase, ARG)[1-2]。
在哺乳动物体内,尿素的合成几乎都是发生在肝脏中,动物肝脏通过提高对氨基酸的利用,合成更多的能够促进机体生长和发育的功能性蛋白,可提高日粮氮素的利用效率[3]。尿素氮是蛋白质代谢的产物,能较准确反映动物体内蛋白质代谢和氨基酸平衡情况。动物机体将氨基酸分解代谢产生的氨转化成尿素,其中在靠近门静脉的肝细胞通过谷氨酰胺酶(Glutaminase, GLS)和谷氨酰胺合成酶(Glutamine synthetase, GS)的作用可以控制氨的去向[4]。高蛋白日粮下,门静脉游离氨基酸浓度会上升2~4倍左右,导致氨基酸代谢加强,氨的累积增多,而氨是一种有毒性的代谢产物,影响机体神经系统,如不能及时转化成尿素,会影响机体正常代谢[5-6]。
目前氨基酸对尿素循环的影响及其分子机制在细胞水平上仍有待研究。CPS1基因在人肝癌细胞系中并不表达[7],因此本研究以仔猪原代肝细胞为研究对象,研究不同浓度的氨基酸对仔猪原代肝细胞尿素循环的影响及其可能机制,旨在开展氨基酸与尿素循环相关规律的研究,建立氨基酸与尿素循环相关规律的代谢模型,为提高猪体内氮素营养的利用提供试验依据。
1 材料与方法 1.1 材料健康的5日龄二元杂母猪,购自广东省增城市华泰大型养殖场。新生胎牛血清(FBS)、青霉素/链霉素、胰蛋白酶液为GIBCO公司产品,无氨基酸培养基购自上海江莱生物有限公司,IV型胶原酶、RIPA蛋白裂解液为百泰克公司产品,反转录试剂和RT-PCR试剂为TaKaRa公司产品。BCA蛋白浓度测定试剂盒购自Thermo Scientific公司,血氨测定试剂盒(比色法)、GLS检测试剂盒(比色法)和GS测定试剂盒(比色法)均购自南京建成生物科技有限公司,尿素检测试剂盒(比色法)购自Sigma公司。
1.2 试验方法1.2.1 肝细胞的分离和培养 根据华南农业大学动物科学学院生理生化实验室参照Farrell[8]创立的剪切消化法改良的原位2步灌流法分离纯化得到5日龄仔猪原代肝细胞,铺板于6孔板内(接种密度为1×106 mL–1,2 mL·孔–1),置于37 ℃、CO2体积分数为5%与饱和湿度条件下的细胞培养箱内培养,4 h细胞贴壁后,用生长培养液(含体积分数为10%的FBS及100 U·mL–1青霉素、100 μg·mL–1链霉素的基础培养液)全量换液,尽量去除死细胞与组织碎片,待细胞生长至覆盖培养孔约70%面积时改用含不同浓度氨基酸(1×、2×和4×)的培养基(含100 nmol·L–1胰岛素,100 nmol·L–1地塞米松和1 mg·L–1生长激素),其中1倍氨基酸的浓度(相当于猪血液中氨基酸的生理浓度)为:L–丙氨酸, 350; L–精氨酸, 100; L–天冬酰胺, 50; L–天冬氨酸, 20; L–胱氨酸, 75; L–谷氨酸, 75; 甘氨酸, 250; L–组氨酸, 100; L–异亮氨酸, 150; L–亮氨酸, 200; L–赖氨酸, 200; L–蛋氨酸, 75; L–苯丙氨酸, 100; L–脯氨酸, 200; L–丝氨酸, 200; 牛磺酸, 100; L–苏氨酸, 200; L–色氨酸, 75; L–酪氨酸, 100; L–缬氨酸, 250; L–谷氨酰胺, 500[9],单位均为μmol·L–1。并在1倍氨基酸组的基础上,采用 0.5、1.0、2.0、4.0和8.0 mmol·L–1的NH4Cl处理肝细胞,以检测不同浓度的氨对仔猪原代肝细胞培养上清中尿素浓度的影响。
1.2.2 指标测定 尿素通过偶联酶促反应测定,有色产物通过比色法(570 nm)进行测定,检测结果与样品中的尿素含量成正比;血氨采用无蛋白滤液法测定;GLS测定以37 ℃下每小时催化谷氨酰胺产生1 μmol氨为1个酶活性单位(U);GS测定以37 ℃条件下15 min内催化形成1 μmol γ–谷氨酰氧肟酸所需要的酶量为1个酶活性单位(U)。
仔猪原代肝细胞总RNA的抽提使用1步法RNA抽提试剂TRIzol,常规方法抽提,用Oligo(dT)引物和AMV反转录酶进行反转录,RT-PCR反应体系为SYBR Premix Ex Taq,上、下游引物和cDNA模板,以β-actin为内参,荧光定量PCR法检测尿素循环相关酶基因,即CPS1、ASS、ASL、OTC和ARG基因mRNA的表达。相关基因的引物序列见表1。
|
|
表 1 荧光定量PCR所用引物序列 Table 1 The primer sequences used for real-time quantitative PCR |
试验结果用平均值±标准误表示。采用SPSS 17.0软件进行统计分析,对不同处理组间的数值进行t检验。
2 结果与分析 2.1 不同浓度的氨基酸对细胞培养上清中尿素浓度的影响如图1所示,4倍氨基酸组细胞上清中尿素的浓度显著高于对照组(1×)(P<0.05),提示4倍氨基酸组肝细胞向培养液中释放更多的尿素。

|
图 1 不同浓度的氨基酸对仔猪原代肝细胞培养上清中尿素浓度的影响 Figure 1 Effects of different concentrations of amino acids on urea concentration in the culture supernatant of primary porcine hepatocytes |
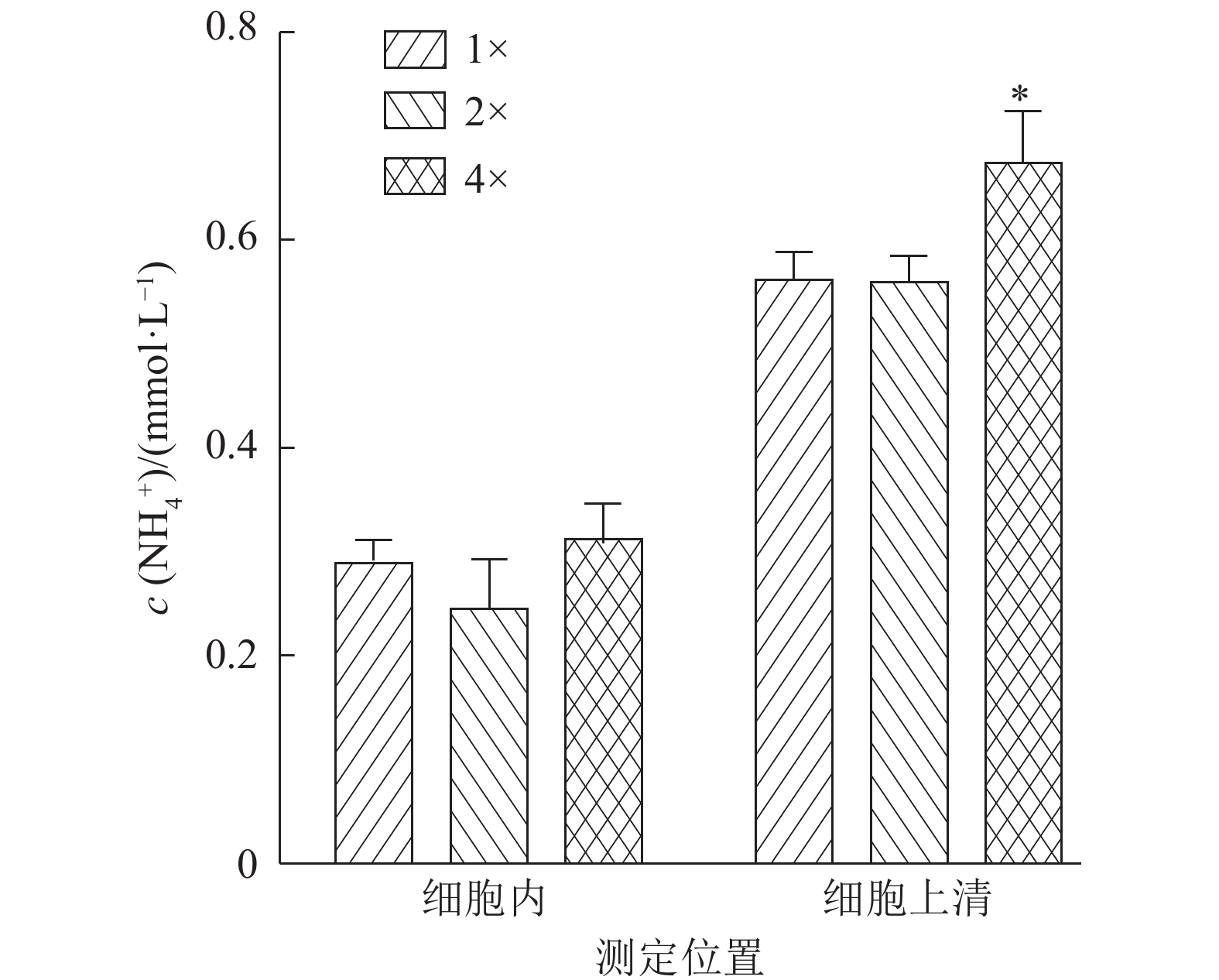
为了探究肝细胞尿素释放差异的原因,我们进一步检测了尿素生成的底物氨的浓度。结果如图2所示,细胞培养上清中4倍氨基酸显著促进了氨的浓度,而不同浓度的氨基酸对细胞内氨的浓度无显著影响(P>0.05)。提示高浓度氨基酸组能够代谢产生更多的氨,从而促进了尿素的生成。氨在肝细胞内不会形成累积,多余的氨会被释放到胞外用于尿素的合成。
|
图 2 不同浓度的氨基酸对仔猪原代肝细胞内及培养上清中氨浓度的影响 Figure 2 Effects of different concentrations of amino acids on ammonia concentration in primary porcine hepatocytes and in the culture supernatant of primary porcine hepatocytes |
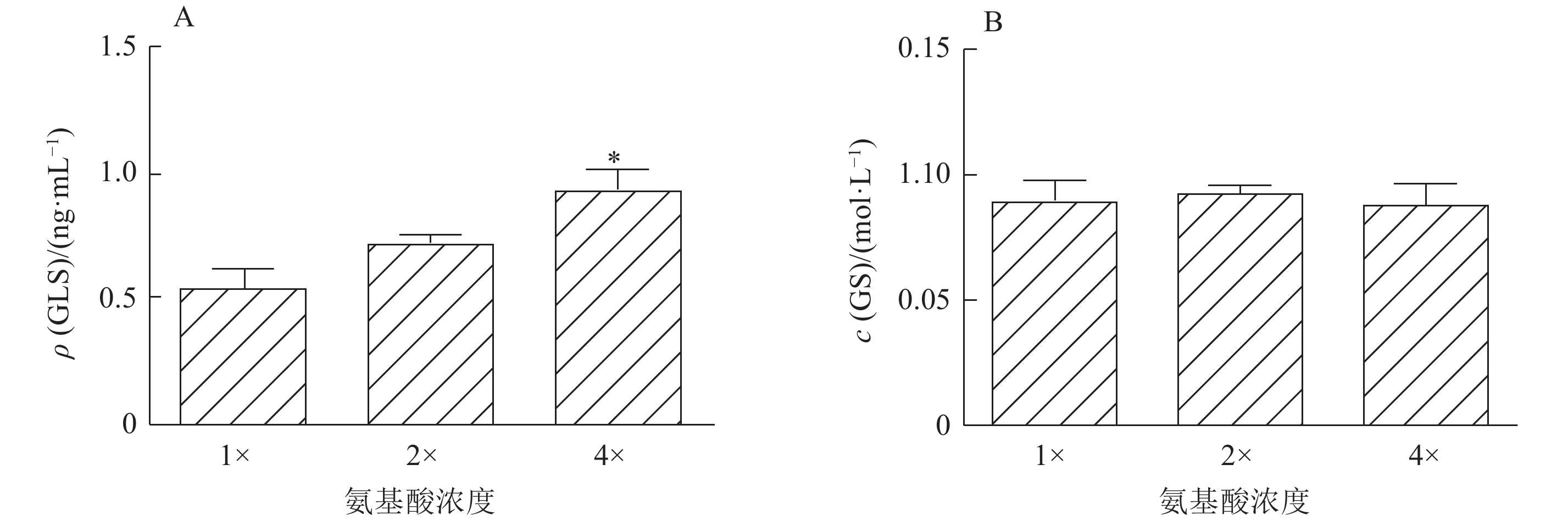
为了探究氨的主要来源,我们检测了仔猪原代肝细胞内GLS和GS的活性水平,结果显示4倍氨基酸显著促进了GLS活性(图3A),但氨基酸浓度对GS活性无显著影响(图3B),提示氨基酸浓度的提高会选择性的促进GLS的表达。
|
图 3 不同浓度的氨基酸对仔猪原代肝细胞尿素循环关键酶活性的影响 Figure 3 Effects of different concentrations of amino acids on activities of the key enzymes involved in urea cycle in primary porcine hepatocytes |
为了研究不同浓度的氨基酸对仔猪原代肝细胞尿素循环影响的分子机制,采用荧光定量PCR法检测了参与尿素循环相关酶基因mRNA的表达。结果如图4显示,4倍氨基酸可以显著提高CPS1、ASS和ASL基因mRNA的表达,而各组间OTC和ARG基因mRNA的表达水平无显著差异。

|
图 4 不同浓度的氨基酸对仔猪原代肝细胞尿素循环相关酶基因表达的影响 Figure 4 Effects of different concentrations of amino acids on the mRNA expression of the enzymes involved in urea cycle in primary porcine hepatocytes |
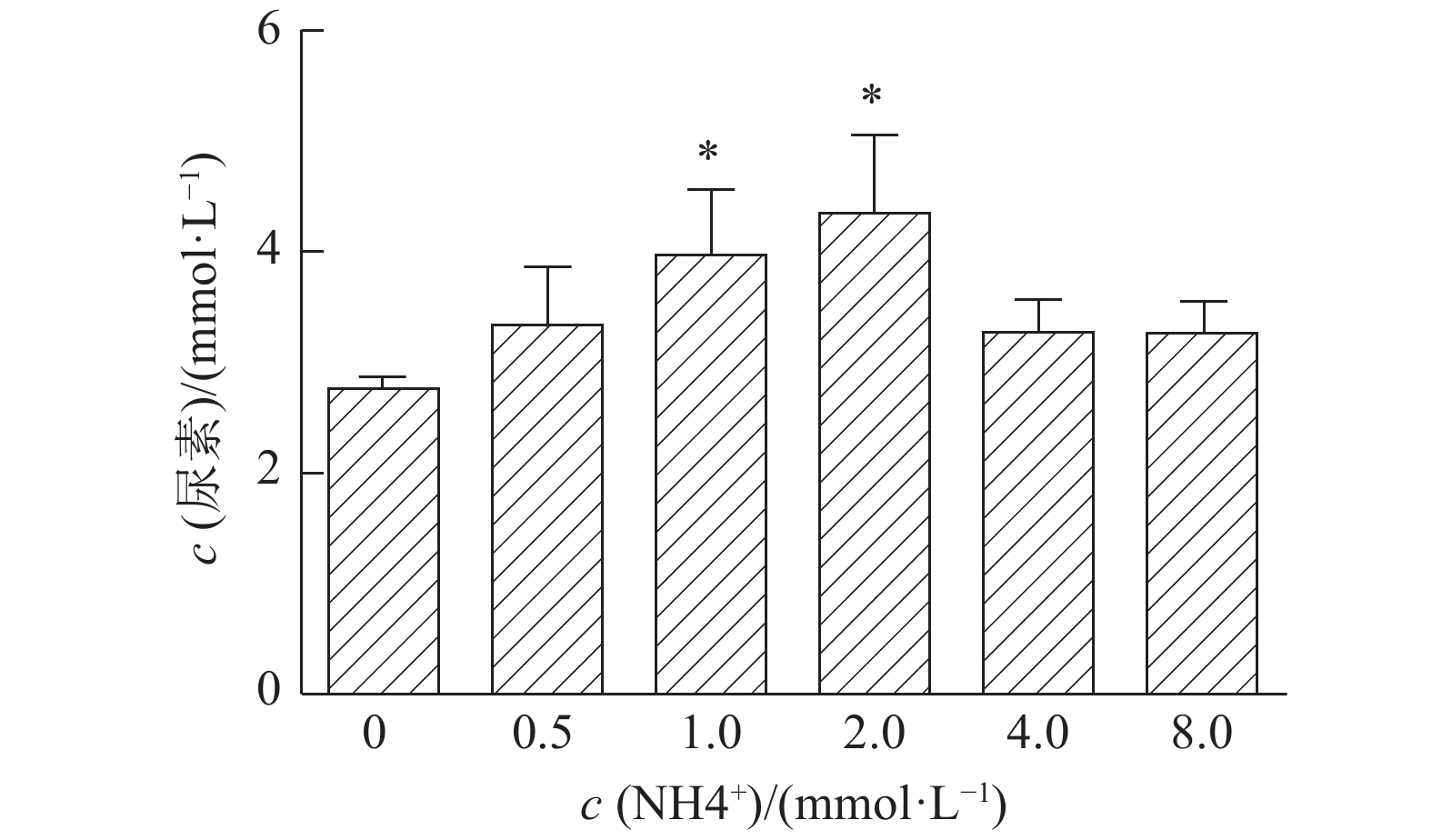
如图5所示,在1倍氨基酸组的基础上,1.0 和2.0 mmol·L–1的NH4Cl显著促进细胞上清中尿素的生成,而氨浓度达到4.0和8.0 mmol·L–1的高浓度组和对照组(0 mmol·L–1)相比无显著差异,提示氨基酸调节尿素循环的主要因素是氨,而氨的浓度如果超出肝细胞所能承受生理范围,会造成肝细胞尿素循环紊乱。
|
图 5 不同浓度的氨对仔猪原代肝细胞培养上清中尿素浓度的影响 Figure 5 Effects of different concentrations of ammonia on urea concentration in the culture supernatant of primary porcine hepatocytes |
猪活体中,当氨基酸平衡合适时,氨基酸可以更好的发挥功能,提高了氨基酸的利用效率,血清尿素氮浓度才会下降。研究表明过高的日粮蛋白质会加重消化道和肝脏的负担,影响其他营养物质(如碳水化合物等)的吸收和代谢,导致代谢性酸中毒,影响心血管功能[10]。也有研究表明,日粮蛋白质水平每下降1个百分点,粪、尿氮的释放量就下降10%[11]。
尿素循环利用是动物机体内源氮去向最重要的组成部分。动物机体将氨基酸分解代谢产生的氨转化成尿素,通过谷氨酰胺酶(GLS)和谷氨酰胺合成酶(GS)的作用控制氨的去向。GS是将谷氨酸和氨合成为谷氨酰胺,而GLS把谷氨酰胺分解为谷氨酸和氨,占肝脏氨生成量的40%,生成的氨被运输到靠近肝静脉的肝细胞中[12]。有研究表明在动物活体水平上高蛋白组(蛋白质质量分数为 13.5%)日粮可促进日粮氮在动物机体的沉积,高蛋白质水平可以提高尿素氮和氨态氮的浓度[13],研究结果与本试验一致。我们研究发现,当肝细胞周围的氨基酸浓度上升到4倍于氨基酸的生理水平,细胞中谷氨酰胺酶的活性显著增强,细胞上清中尿素和氨的浓度也有显著升高,结果也表明氨基酸的代谢产物可以发挥调节作用,促进尿素合成。其原因可能在于活体血液中过高浓度的谷氨酰胺是有毒性的,靠近门静脉的肝细胞会增强谷氨酰胺酶的表达,促进谷氨酰胺转化成谷氨酸,从而释放出氨[14]。高浓度的氨基酸虽然保证了机体对氨基酸的需求,但是氨基酸代谢的加强会选择性地促进谷氨酰胺酶的表达[15],加速氨的积累,提高肝脏中尿素的合成,从而降低日粮氮素的利用效率。
为研究氨基酸对仔猪原代肝细胞尿素循环影响的分子机制,我们用不同浓度的氨基酸处理肝细胞,检测了参与尿素循环相关酶基因的mRNA表达。结果发现,高浓度的氨基酸可以显著提高CPS1、ASS和ASL基因的mRNA表达,而各组间OTC和ARG基因的mRNA水平无显著差异。表明当氨浓度超出生理合理范围(0.2~0.3 mmol·L–1)[16],就会刺激CPS1、ASS和ASL基因的mRNA水平上调,而OTC和ARG是表达相对稳定的酶,对外界条件的变化不敏感。CPS1是尿素循环的第1步,也是该反应的限速酶,有文献报道,当日粮蛋白供应过高或缺少碳水化合物等能量供应时,CPS1基因的mRNA水平会显著上调[17-18],与本试验研究结果一致。也有文献报道,在大鼠血管平滑肌细胞中过表达ASS可以通过增强精氨酸的再生进而促进一氧化氮(NO)生成[19],从而保证尿素循环的高效性,与本试验研究结果一致。已有研究表明,ASL的调控主要发生在转录水平,其活性受氧气含量变化影响[20],氧气越充足,表达量越高,因此ASL在肝脏中的表达有位置差异性,这也是高浓度组氨基酸ASL基因mRNA水平被显著上调的可能原因之一。另有文献报道,高浓度的氨基酸通过抑制ASL乙酰化而活化酶[18],与本试验研究结果一致。精氨酸酶(ARG)是唯一存在2种同工酶的尿素循环酶,它们被不同的基因编码,ARG I在肝脏中高度表达,ARG II在肾脏中高度表达[21],本试验中检测的是肝细胞中ARG基因的mRNA水平,肾脏中高度表达的ARG II并未检测。有研究表明,灌流大鼠肝脏后,ARG II可以在静脉周肝细胞中与鸟氨酸转氨酶共表达,以促进这些细胞合成谷氨酰胺[22],这是本试验中ARG基因的mRNA水平没有显著差异的可能原因之一。有文献报道,去乙酰化酶5(Sirtuin 5, SIRT5)能够增强CPS1的活性,CPS1在SIRT5的作用下脱去乙酰基而被激活,而在敲除了SIRT3、SIRT4或SIRT5的小鼠中,OTC活性均不受影响[23],提示OTC是表达相对稳定的酶,对外界条件的变化不敏感,与本试验结果一致。
值得注意的是,血氨的生理浓度是0.2~0.3 mmol·L–1[16],但在本次处理肝细胞的试验中,浓度为1.0和2.0 mmol·L–1的氨才显著促进尿素的生成,4.0 mmol·L–1氨条件下肝细胞尿素合成受到阻碍,原因很可能是活体的血液中含有丰富的内分泌因子(如生长激素),它能显著降低尿素循环的中间产物氨基酸(如瓜氨酸、精氨酸和鸟氨酸)的浓度,减弱CPS1、ASS、ASL等酶的活性,从而抑制尿素的生成[24]。所以体外肝细胞可以比体内更适应高浓度的氨。其结果也表明氨基酸的代谢产物可以发挥调节作用,促进尿素的合成,但过量的氨会造成尿素循环紊乱,导致尿素合成的降低。
综上所述,氨基酸可以通过升高谷氨酰胺酶的水平加速氨的积累,促进CPS1、ASS、ASL等尿素循环相关酶基因的mRNA表达,从而提高尿素的生成。研究结果为开展氨基酸与尿素循环相关规律的研究,建立氨基酸与尿素循环相关规律的代谢模型提供了直接的试验依据。
| [1] |
MEW N A, LANPHER B C, GROPMAN A, et al. Urea cycle disorders overview: GeneReviews[M].Seattle: University of Washington, 1993.
(  0) 0) |
| [2] |
宋元宗. 尿素循环障碍研究新进展[J]. 中国实用儿科杂志, 2009, 24(3): 168-171. (  0) 0) |
| [3] |
FUHRMAN M P, CHARNEY P, MUELLER C M. Hepatic proteins and nutrition assessment[J]. J Am Diet Assoc, 2004, 104(8): 1258-1264. DOI:10.1016/j.jada.2004.05.213 (  0) 0) |
| [4] |
MONGIN A A, HYZINSKI-GARCIA M C, VINCENT M Y, et al. A simple method for measuring intracellular activities of glutamine synthetase and glutaminase in glial cells[J]. Am J Physiol Cell Physiol, 2011, 301(4): C814-C822. DOI:10.1152/ajpcell.00035.2011 (  0) 0) |
| [5] |
LEE B, DIAZ G A, RHEAD W, et al. Blood ammonia and glutamine as predictors of hyperammonemic crises in patients with urea cycle disorder[J]. Genet Med, 2015, 17(7): 561-568. DOI:10.1038/gim.2014.148 (  0) 0) |
| [6] |
SUMMAR M L, DOBBELAERE D, BRUSILOW S, et al. Diagnosis, symptoms, frequency and mortality of 260 patients with urea cycle disorders from a 21-year, multicentre study of acute hyperammonaemic episodes[J]. Acta Paediatr, 2008, 97(10): 1420-1425. DOI:10.1111/apa.2008.97.issue-10 (  0) 0) |
| [7] |
LIU H, DONG H, ROBERTSON K. DNA methylation suppresses expression of the urea cycle enzyme carbamoyl phosphate synthetase 1 (CPS1) in human hepatocellular carcinoma[J]. Am J Pathol, 2011, 178(2): 652-661. DOI:10.1016/j.ajpath.2010.10.023 (  0) 0) |
| [8] |
FARRELL G C. Research workshop: Techniques for primary culture of liver cells[J]. J Gastroenterol Hepatol, 1998, 13(8): 842. DOI:10.1111/j.1440-1746.1998.tb00745.x (  0) 0) |
| [9] |
XI P, JIANG Z, DAI Z, et al. Regulation of protein turnover by L-glutamine in porcine intestinal epithelial cells
[J]. J Nutr Biochem, 2012, 23(8): 1012-1017. DOI:10.1016/j.jnutbio.2011.05.009 (  0) 0) |
| [10] |
LAI S, MOLFINO A, COPPOLA B, et al. Effect of personalized dietary intervention on nutritional, metabolic and vascular indices in patients with chronic kidney disease[J]. Eur Rev Med Pharmacol Sci, 2015, 19(18): 3351-3359. (  0) 0) |
| [11] |
ZERVAS S, ZIJLSTRA R T. Effects of dietary protein and fermentable fiber on nitrogen excretion patterns and plasma urea in grower pigs[J]. J Anim Sci, 2002, 80(12): 3247-3256. DOI:10.2527/2002.80123247x (  0) 0) |
| [12] |
ZHAO S, XU W, JIANG W, et al. Regulation of cellular metabolism by protein lysine acetylation[J]. Science, 2010, 327(5968): 1000-1004. DOI:10.1126/science.1179689 (  0) 0) |
| [13] |
杜建文. 不同日粮对内蒙古白绒山羊消化道UT-B表达的影响研究[D]. 呼和浩特: 内蒙古农业大学, 2010.
(  0) 0) |
| [14] |
BARTL M, PFAFF M, GHALLAB A, et al. Optimality in the zonation of ammonia detoxification in rodent liver[J]. Arch Toxicol, 2015, 89(11): 2069-2078. DOI:10.1007/s00204-015-1596-4 (  0) 0) |
| [15] |
MODI W S, POLLOCK D D, MOCK B A, et al. Regional localization of the human glutaminase (GLS) and interleukin-9 (IL9) genes by in situ hybridization
[J]. Cytogenet Cell Genet, 1991, 57(2/3): 114-116. (  0) 0) |
| [16] |
HÄUSSINER D, SIES H. Hepatic glutamine metabolism under the influence of the portal ammonia concentration in the perfused rat liver[J]. Eur J Biochem, 1979, 101(1): 179-184. DOI:10.1111/ejb.1979.101.issue-1 (  0) 0) |
| [17] |
TILLMAN J B, DHAHBI J M, MOTE P L, et al. Dietary calorie restriction in mice induces carbamyl phosphate synthetase I gene transcription tissue specifically[J]. J Biol Chem, 1996, 271(7): 3500-3506. DOI:10.1074/jbc.271.7.3500 (  0) 0) |
| [18] |
GUAN K L, XIONG Y. Regulation of intermediary metabolism by protein acetylation[J]. Trends Biochem Sci, 2011, 36(2): 108-116. DOI:10.1016/j.tibs.2010.09.003 (  0) 0) |
| [19] |
XIE L, GROSS S S. Argininosuccinate synthetase overexpression in vascular smooth muscle cells potentiates immunostimulant-induced NO production[J]. J Biol Chem, 1997, 272(26): 16624-16630. DOI:10.1074/jbc.272.26.16624 (  0) 0) |
| [20] |
LATASA M U, CARRETERO M V, GARCIA-TREVIJANO E R, et al. Identification of argininosuccinate lyase as a hypoxia-responsive gene in rat hepatocytes[J]. J Hepatol, 2000, 33(5): 709-715. DOI:10.1016/S0168-8278(00)80300-1 (  0) 0) |
| [21] |
JENKINSON C P, GRODY W W, CEDERBAUM S D. Comparative properties of arginases[J]. Comp Biochem Physiol B Biochem Mol Biol, 1996, 114(1): 107-132. DOI:10.1016/0305-0491(95)02138-8 (  0) 0) |
| [22] |
O’SULLIVAN D, BROSNAN J T, BROSNAN M E. Hepatic zonation of the catabolism of arginine and ornithine in the perfused rat liver[J]. Biochem J, 1998, 330(Pt 2): 627-632. (  0) 0) |
| [23] |
NAKAGAWA T, LOMB D J, HAIGIS M C, et al. SIRT5 Deacetylates carbamoyl phosphate synthetase 1 and regulates the urea cycle[J]. Cell, 2009, 137(3): 560-570. DOI:10.1016/j.cell.2009.02.026 (  0) 0) |
| [24] |
BUSH J A, WU G, SURYAWAN A, et al. Somatotropin-induced amino acid conservation in pigs involves differential regulation of liver and gut urea cycle enzyme activity[J]. J Nutr, 2002, 132(1): 59-67. (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


