2. 广东省农业科学院 茶叶研究所/广东省茶树资源创新利用重点实验室,广东 广州 510640
2. Tea Research Institute, Guangdong Academy of Agricultural Sciences/Guangdong Provincial Key Laboratory of Tea Plant Resources Innovation and Utilization, Guangzhou 510640, China
全球糖尿病患者已接近4亿人,2015年约有500万人死于糖尿病及其并发症。当前,我国糖尿病患病人口超过1亿人,还有2亿多人在未来10年内有可能患上此病,糖尿病也将成为影响我国人们身心健康和生活品质的重大疾病。
糖尿病(Diabetes mellitus,DM)是由于胰岛素分泌不足或作用缺陷引起的以慢性高血糖为主,附带有脂肪和蛋白质代谢紊乱等特征的综合征。目前,糖尿病的病因和发病机制尚未完全清楚[1-2],其临床上可出现多尿、多饮、多食、消瘦等症状,严重者易发生糖尿病肾病、非酒精性脂肪肝、眼疾、神经性病变和足部溃疡等并发症[3]。常见的糖尿病分为1型和2型。1型糖尿病表现为绝对的胰岛素分泌不足,是一种在遗传易感性基础上[4],由环境诱发、T淋巴细胞介导的自身免疫性疾病[5],导致病患的胰岛 β 细胞逐渐凋亡,进而造成胰岛素分泌匮乏,患者需体外注射胰岛素来维持血糖平衡;2型糖尿病表现为相对的胰岛素分泌不足,又称为非胰岛素依赖型糖尿病,其主要原因是胰岛素受体发生病变,对胰岛素的敏感性下降,会刺激胰岛细胞大量分泌胰岛素来维持血糖平衡。随着病情的发展,胰岛细胞由于长期超负荷工作过劳受损,出现功能性障碍甚至凋亡,患者便由2型糖尿病向1型糖尿病发展[6]。目前胰岛素是治疗1型糖尿病的唯一特效药,然而注射胰岛素并不能修复受损的胰岛细胞,也不能改善胰岛素抵抗的状态,治标不治本。而在治疗2型糖尿病药品中,常用的有罗格列酮,二甲双胍等,这类药品虽然短期内见效快,但毒副作用也很明显,因此从植物资源中提取出天然的降血糖药物,已成为目前糖尿病研究的热点。
表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG),是没食子儿茶酚与没食子酸形成的酯,属于儿茶素。EGCG是大多数绿茶中含量最丰富的儿茶素,在所有植物里也以茶叶中EGCG含量最高。大量研究证实,EGCG能够通过抑制炎症因子,激活磷酸腺苷活化蛋白激酶(AMP-dependent/activated protein kinase, AMPK)、蛋白激酶B(Protein kinase B,Akt)等信号通路,维持线粒体呼吸链的正常运作,从而保护胰岛细胞,缓解胰岛素抵抗,促进细胞内的糖原积累,对糖尿病起到一定的治疗作用。本文通过总结EGCG防治糖尿病的研究进展,归纳EGCG防治糖尿病的功效与机制,为绿茶缓解代谢综合征的研究提供参考依据。
1 EGCG防治糖尿病的功效近几年,EGCG对糖尿病的防治作用受到了广泛的关注。人在饮茶后,EGCG可被肠道吸收,在肝脏中代谢,发挥其作用。尽管EGCG的生物利用度还存有争议,但大多数的试验结果表明EGCG 能够在分子水平上缓解糖尿病的各种症状及相关并发症。
动物研究表明,EGCG可改善试验体的胰岛素敏感性和葡萄糖耐受量,降低血糖和胰岛素抵抗水平,具有一定的治疗糖尿病效果[7-8]。Kao等[9]持续对SD大鼠腹腔注射EGCG后发现,内分泌因子如胰岛素、葡萄糖、甘油三酯和胆固醇水平均有所下降。在流行病学研究中,Liu等[10]评估了绿茶EGCG 对 2 型糖尿病患者的胰岛素抵抗、血脂异常等症状的影响,在试验进行16周后,服用EGCG 组的胰岛素抵抗指数和血液中的甘油三酯含量显著下降、高密度脂蛋白胆固醇显著增加;Hase等[11] 在以健康志愿者为对象的研究中发现,服用主要成分为EGCG的绿茶提取物12周后,其血糖和血胰岛素水平均有所下降。Yang等[12]研究表明EGCG 可以抑制人脐静脉内皮细胞中高糖诱导的血管炎症;Raposo等[13]发现EGCG的抗氧化作用能够预防和缓解糖尿病引起的神经性病变。这些研究表明,EGCG对于糖尿病的相关并发症具有一定的缓解作用。Wolfram等[14]还获得了EGCG和某些多肽的组合物的相关专利,用于辅助治疗和预防2型糖尿病。
2 EGCG防治糖尿病的作用机制 2.1 EGCG保护胰岛 β 细胞糖尿病与氧化应激引起的DNA损伤有关[15],活性氧(Reactive oxygen species,ROS)是糖尿病导致胰岛β细胞损伤的重要原因。Oršolić等[16]通过单细胞凝胶电泳试验发现,用四氧嘧啶诱导小鼠形成糖尿病模型所产生的ROS会损伤多个脏器细胞的DNA,使其单链断裂,推测EGCG可能通过清除自由基来缓解胰岛 β 细胞的DNA损伤,进而保护胰岛细胞。
EGCG保护胰岛细胞,防止其受损可能与消除相关炎症因子也有密切关系。Fu等[17]以雌性1型糖尿病小鼠为试验对象,为其提供含有w为0.05% EGCG的饮用水,结果发现这些小鼠糖尿病的发病期被延迟,这与细胞中抗炎症因子白细胞介素–10(IL-10)的显著增加有关。Zhang等[18]在体外的细胞试验中也证明了EGCG降血糖作用可能与抗炎作用有关,他们将RINm5F细胞与白细胞介素–1β(Interleukin-1β,IL-1β)、肿瘤坏死因子–α(Tumor necrosis factor-α,TNF-α)、干扰素–γ(Interferon-γ,IFN-γ)共同培养,经过EGCG预处理24 h后能够使细胞线粒体中产生的ROS 和膜蛋白减少,降低细胞色素C的分泌量,进而可以抑制炎症因子所诱导的胰岛 β 细胞凋亡。
除了通过抗氧化和消除炎症因子保护胰岛细胞受损外,也有文献证明EGCG可促进胰岛细胞分泌胰岛素,进而缓解糖尿病的症状。Ortsäter 等[19]以周龄较小的db/db鼠为模型,给予富含EGCG 的饲料,结果发现,与对照组相比,EGCG组小鼠机体葡萄糖耐受量增加,EGCG能提高葡萄糖刺激的胰岛素分泌量防止胰岛组织受损。Yuskavage等[20] 将EGCG与大鼠胰岛 β 细胞株、分离得到的大鼠胰岛细胞及人胰岛细胞分别培养后,各个胰岛细胞中的胰岛素分泌量均有增加,尤其是长时间培养之后,效果更为显著,表明EGCG可能通过促进胰岛 β 细胞分泌更多的胰岛素降低血糖浓度。Cai等[21]研究发现EGCG可以缓解高浓度血糖对大鼠胰岛β细胞的毒害,增加胰岛素受体底物2(Insulin receptor substrate-2, IRS2)在大鼠胰岛 β 细胞中的信号传递作用;进一步试验证明,EGCG能够通过激活AMPK信号通路来改善代谢功能,进而保护胰岛 β 细胞的完整性。Song等[22]使用链脲佐菌素(Streptozocin,STZ)诱导C57BL/KsJ小鼠成为糖尿病模型,灌胃EGCG后发现小鼠糖尿病症状有所改善,血糖水平下降,EGCG 下调了 STZ 诱导的诱导性一氧化氮合酶(Inducible nitric oxide synthase, iNOS)的过量表达,从而减少了胰岛 β 细胞的损伤,阻止了糖尿病的进一步恶化。
2.2 EGCG改善胰岛素抵抗2.2.1 AMPK和IRS/Akt/GLUT4信号通路调节 Qin等[23]用高糖饲料喂养小鼠诱导其产生胰岛素抵抗,同时又给予200 mg·kg–1的绿茶茶多酚,持续6周后,小鼠血糖、胰岛素水平均有下降,心中肌胰岛素受体、胰岛素受体底物(IRS1和IRS2)、葡萄糖转运蛋白1和4(Glucose transporter-1, GLUT1和Glucose transporter-4, GLUT4)的表达均有提高,表明EGCG具有改善胰岛素应激信号通路、改善胰岛素抵抗的作用。Cao等[24]用高糖饲料诱导Wistar大鼠产生胰岛素抵抗,再用添加绿茶茶多酚提取物的饲料喂养大鼠,通过实时荧光定量PCR监测一系列葡萄糖转运蛋白的RNA与胰岛素信号通路中一系列蛋白质的RNA表达,发现当喂食绿茶茶多酚添加含量为1 g·kg–1的食物时,肝脏中GLUT1、GLUT4、糖原合成激酶–3β(Glycogen synthase kinase-3β, GSK-3β)及IRS2的表达量均有提高;肌肉中IRS1的表达量显著提高。而在喂食2 g·kg–1的剂量时,肝脏中GLUT4、GSK-3β与磷酸肌醇–3–激酶催化亚基 β 肽(Phosphoinositide-3-kinase catalytic subunit β peptide, PIK3Cβ)的表达量有提高;肌肉中GLUT4、葡萄糖转运蛋白2(Glucose transporter-2, GLUT2)的表达量显著提高(P<0.05)。Ueda等[25]一次性给予大鼠较高剂量的EGCG(75 mg·kg–1)能够显著增加骨骼肌细胞L6的葡萄糖利用率,同时也会增加GLUT4在其细胞膜上的转运。Lin等[26]用高糖培养基诱导肝癌细胞HepG2形成胰岛素抵抗模型,加入EGCG后,发现EGCG可以减少 IRS1 的 307 位点丝氨酸残基的磷酸化,并呈剂量依赖关系;进一步研究发现,EGCG通过激活5′–磷酸腺苷(5′-adenylic acid,5′-AMP)激活的蛋白激酶(AMPK)通路来改善由于IRS1的第307号丝氨酸氨基酸残基发生磷酸化而导致的胰岛素应激信号通路的封闭,从而达到改善细胞胰岛素抵抗状态的目的。他们认为EGCG可能通过激活AMPK信号通路,抑制IRS1的第307位点的丝氨酸残基磷酸化水平,增强磷脂酰肌醇3激酶(Phosphatidylinositol 3 kinase, PI3K)的活性,提高Akt的磷酸化水平,促进糖利用率和糖原合成的效率,从而改善细胞对胰岛素应激的敏感度。Zhang等[27]用EGCG抑制地塞米松诱导的L6细胞胰岛素抵抗试验证实了上述观点,地塞米松能够增加IRS1的第307位点丝氨酸的磷酸化,降低AMPK和Akt的磷酸化水平,并且GLUT4的转运会被地塞米松所抑制;而用EGCG处理过的细胞能够提高胰岛素的敏感性,增强GLUT4在细胞膜上的转运,提高葡萄糖的摄取率。因此,EGCG是通过AMPK和Akt信号通路改善地塞米松所诱导的胰岛素抵抗。在上述研究的基础上,Li等[28]对超重的胰岛素抵抗模型wistar鼠分别静脉注射EGCG、英脱力匹特与肝素混合物,结果发现EGCG不仅能够显著抑制游离脂肪酸诱导的外周胰岛素抵抗,而且还能逆转由肝素混合物引起的一系列负反应,他们同样认为EGCG可以缓解机体内的氧化应激反应、减少蛋白激酶Cθ 的膜迁移率,激活AMPK通路和胰岛素信号通路。Cordero-Herrera等[29]研究发现EGCG能够增强经过高糖处理的HepG2细胞的胰岛素敏感性,EGCG通过消除胰岛素通路阻塞和调节葡萄糖的摄入,延迟或阻止潜在的肝脏功能障碍,他们将这些作用的机理归纳为:1)EGCG可以导致酪氨酸磷酸化水平下降,能够减少由高糖环境刺激引起的胰岛素受体和胰岛素受体底物(IRS1和IRS2)的增加;2)防止PI3K/Akt通路阻塞和AMPK的失活,减少由高糖诱导的GLUT2的水平。
2.2.2 ERK/JNK信号通路调节 Yan等[30]研究了EGCG对非肥胖糖尿病(Goto-Kakizaki,GK)大鼠肌肉细胞中线粒体代谢的影响,线粒体中过量ROS应激会激活细胞外反应激酶/c–Jun氨基端激酶(Extracellular-response kinase/c-Jun N-terminal kinase,ERK/JNK)通路,上调P53肿瘤抑制蛋白(Tumor suppressor protein p53,p53)的表达,最终导致线粒体含量减少,从而引起线粒体功能缺陷,而线粒体功能缺陷与胰岛素抵抗有密切的联系。他们以线粒体呼吸链的1个蛋白质成分(Complex 1)和电压依赖阴离子通道蛋白1(Voltage-dependent anion channel 1,VDAC1)的表达量来评估线粒体的含量,发现EGCG能抑制Complex 1和VDAC1蛋白表达的减少,表明EGCG可以避免ROS应激引起的线粒体功能缺陷。并且他们进一步研究发现,EGCG 可能是通过抑制 JNK 磷酸化来抑制 ERK/JNK-p53 通路的,从而证明了 EGCG 能够改善机体胰岛素抵抗和糖尿病症状。
2.2.3 EGCG对葡萄糖降解酶类的抑制作用 EGCG 的半数抑制浓度为16 μmol·L1,并且 EGCG 可以抑制 Caco-2 细胞中麦芽糖酶的表达,延缓葡萄糖的吸收[31]。Matsumoto等[32]和Forester等[33]都发现EGCG可以通过抑制小肠的α–淀粉酶和蔗糖酶活性起到降低餐后血糖的作用。Abe等[34]喂食小鼠儿茶素含量高的绿茶4周后,通过DNA生物芯片和实时荧光定量PCR检测发现6–磷酸葡萄糖酶和脂肪酸合成酶的表达下调,表明EGCG可能通过缓慢下调6–磷酸葡萄糖酶的表达来降低葡萄糖的生成,从而预防糖尿病。
2.2.4 EGCG对胰岛素降解酶蛋白的作用 Gan等[3]以高脂饲料诱导C57BL小鼠,建成高脂血症和高胰岛素血症的非酒精性的脂肪肝(Nonalcoholic fatty liver disease, NAFLD)模型,并在试验的最后4周对小鼠注射不同剂量的EGCG,结果发现不仅NAFLD小鼠的体质量有所减轻,EGCG 还会上调胰岛素降解酶蛋白(Insulin degrading enzyme protein, IDE)的表达,帮助清除肝脏中过量的胰岛素,进而缓解NAFLD鼠的胰岛素抵抗,并且呈现一定的剂量相关性。同时他们还认为IDE可能是一个治疗NAFLD的潜在药物作用靶点。
3 EGCG对糖尿病并发症的作用 3.1 EGCG对糖尿病并发症糖尿病肾病的抑制作用EGCG不仅对防治高血糖作用明显,对防治糖尿糖的并发症也具有一定抑制作用。
糖尿病肾病是糖尿病最严重的并发症之一,机体内一些葡萄糖依赖型的代谢通路会在糖尿病肾病的影响下被激活,例如,氧化应激反应加剧、多元醇的形成增加以及晚期糖基化终产物的积累。Yamabe等[35]在以注射STZ诱导糖尿病模型并切除大部分肾脏的小鼠为试验对象的研究中,发现对小鼠持续灌胃EGCG 50 d后,其高血糖、蛋白尿症状以及脂质过氧化反应都会受到抑制,EGCG可以减少在肾病病理条件下发生的糖基化终产物的积累和相关蛋白的表达。在各种有关糖尿病并发症的介导物中,骨调素占据关键位置,目前已证实骨调素与肾炎引起的肾损伤、梗阻性尿路病以及肾小管疾病相关[36-37]。Yoon等[38]以STZ诱导的糖尿病模型小鼠为研究对象,灌胃100 mg·kg–1的EGCG,结果表明EGCG能够通过减少骨调素的产生,缓解糖尿病肾病的症状。
3.2 EGCG对糖尿病并发症神经痛的抑制作用近来的研究已经证明,EGCG对糖尿病神经痛(Diabetic neuropathy, DNP)有一定的缓解作用。Raposo等[13]对注射STZ诱导的糖尿病小鼠进行持续10周的灌胃EGCG,通过免疫组化的方法测定脊髓中8–羟基–2′–脱氧鸟苷的表达量,以此评估伤害性神经元的含量,结果表明EGCG能够抑制伤害性神经元基因的表达,缓解DNP症状。
4 总结糖尿病的病因和发病机理十分复杂,从胰岛素的合成到最终与靶细胞内特异受体结合而引发细胞内代谢的整个过程中,其任何一个环节发生问题都可能引发糖尿病。近年来研究表明,由高糖、高脂诱导细胞线粒体内的超氧化物的过量产生是胰岛细胞受损、胰岛素抵抗及相关慢性并发症发生的共同机理,这一发现为糖尿病的治疗及相关药物的开发指明了方向。茶叶具有降血糖的功效,很大一部分原因是因为茶叶中含有儿茶素,而EGCG是茶叶中含量最高的儿茶素,也是目前茶叶保健功能研究最多、最深入的一个茶叶提取物单体。
现将EGCG预防糖尿病的主要分子机制(图1)归纳如下:1)利用抗氧化特性,抑制相关的炎症因子,下调iNOS的过量表达,减弱一氧化氮(NO)的细胞毒性伤害,保护胰岛细胞;2)激活AMPK相关的细胞代谢途径,保护胰岛 β 细胞。同时AMPK的磷酸化激活可以促进IRS-1第789号丝氨酸残基发生磷酸化,抑制其第307号丝氨酸残基磷酸化而导致的胰岛素信号通路封闭,提高糖利用率和糖原合成的效率;3)提高Akt的磷酸化水平,增强GLUT4在细胞膜上的转运率,减少血液中的葡萄糖含量;4)抑制JNK 磷酸化,阻断ERK/JNK-p53通路,防止呼吸链上的Complex 1和VDAC1的减少,维持线粒体功能的正常运作,从而改善胰岛素抵抗和糖尿病症状。
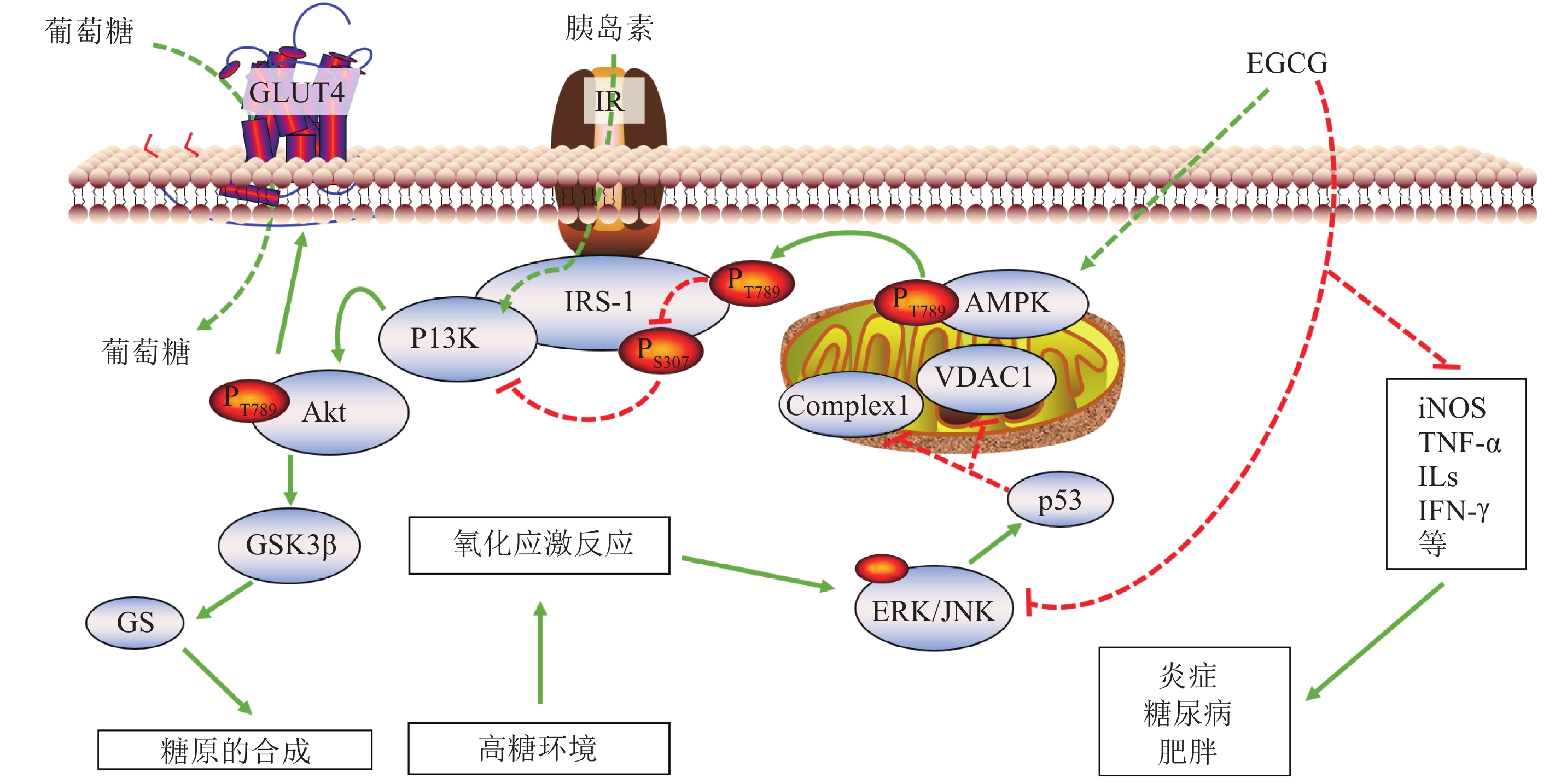
|
图 1 EGCG可能的调控途径 Figure 1 Possible regulatory pathway of EGCG |
EGCG具有开发成为治疗糖尿病的药物或辅助药物的潜质,特别是EGCG保护DNA、缓解氧化损伤的特性是治疗糖尿病和癌症的共同切入点,具有重要的医学研究价值。虽然EGCG的口服生物利用率较低,以至于有少数流行病学的相关研究对EGCG 抗糖尿病的功效提出质疑,但随着制药技术和EGCG衍生技术的发展,这一问题终将被科学解决,作为茶叶中含量最高的儿茶素,EGCG开发成防治糖尿病等代谢综合症药物具有十分广阔的前景。
| [1] |
陈晓丽, 计仁军. 糖尿病病因与发病机理[J]. 中国现代药物应用, 2008, 2(24): 189-190. DOI:10.3969/j.issn.1673-9523.2008.24.155 (  0) 0) |
| [2] |
廖志红, 余斌杰. 2型糖尿病患者脂代谢紊乱及其与血糖控制的关系[J]. 中华内分泌代谢杂志, 1998, 14(4): 277-279. (  0) 0) |
| [3] |
GAN L, MENG Z J, XIONG R B, et al. Green tea polyphenol epigallocatechin-3-gallate ameliorates insulin resistance in non-alcoholic fatty liver disease mice[J]. Acta Pharmacol Sin, 2015, 36(5): 597-605. DOI:10.1038/aps.2015.11 (  0) 0) |
| [4] |
ZHONG J, XU C, REECE E A, et al. The green tea polyphenol EGCG alleviates maternal diabetesinduced neural tube defects by inhibiting DNA hypermethylation[J]. Am J Obstet Gynecol, 2016, 215(3): 368-361. (  0) 0) |
| [5] |
WACHLIN G, AUGSTEIN P, SCHRÖDER D, et al. IL-1β, IFN-γ and TNF-α increase vulnerability of pancreatic beta cells to autoimmune destruction[J]. J Autoimmun, 2003, 20(4): 303-312. DOI:10.1016/S0896-8411(03)00039-8 (  0) 0) |
| [6] |
American Diabetes Associantion. Diagnosis and classification of diabetes mellitus[J]. J Diabetes Care, 2008, 31(Suppl 1): S55-S60. (  0) 0) |
| [7] |
ANDERSON R A, POLANSKY M M. Tea enhances insulin activity[J]. J Agric Food Chem, 2002, 50(24): 7182-7186. DOI:10.1021/jf020514c (  0) 0) |
| [8] |
TSUNEKI H, ISHIZUKA M, TERASAWA M, et al. Effect of green tea on blood glucose levels and serum proteomic patterns in diabetic (db/db) mice and on glucose metabolism in healthy humans[J]. BMC Pharmacol, 2004, 4: 18. DOI:10.1186/1471-2210-4-18 (  0) 0) |
| [9] |
KAO Y H, HIIPAKKA R A, LIAO S. Modulation of endocrine systems and food intake by green tea epigallocatechin gallate 1[J]. Endocrinology, 2000, 141(3): 980-987. DOI:10.1210/endo.141.3.7368 (  0) 0) |
| [10] |
LIU C Y, HUANG C J, HUANG L H, et al. Effects of green tea extract on insulin resistance and glucagon-like peptide 1 in patients with type 2 diabetes and lipid abnormalities: A randomized, double-blinded, and placebo-controlled trial[J]. PLoS One, 2014, 9(3): e91163. DOI:10.1371/journal.pone.0091163 (  0) 0) |
| [11] |
HASE T, KOMINE Y, MEGURO S, et al. Anti-obesity effects of tea catechins in humans[J]. J Oleo Sci, 2001, 50(7): 599-606. DOI:10.5650/jos.50.599 (  0) 0) |
| [12] |
YANG J, HAN Y, CHEN C, et al. EGCG attenuates high glucose-induced endothelial cell inflammation by suppression of PKC and NF-κB signaling in human umbilical vein endothelial cells[J]. Life Sci, 2013, 92(10): 589-597. DOI:10.1016/j.lfs.2013.01.025 (  0) 0) |
| [13] |
RAPOSO D, MORGADO C, PEREIRA-TERRA P, et al. Nociceptive spinal cord neurons of laminae IIII exhibit oxidative stress damage during diabetic neuropathy which is prevented by early antioxidant treatment with epigallocatechin-gallate (EGCG)[J]. Brain Res Bull, 2015, 110: 68-75. DOI:10.1016/j.brainresbull.2014.12.004 (  0) 0) |
| [14] |
WOLFRAM S. EGCG, a protein hydrolysate and Coenzyme Q-10; orEGCG, a protein hydrolysate and resveratrol; orEGCG, a protein hydrolysate, ligustilide or other phthalides or herbal extracts containing ligustilide or other phthalides, and Coenzyme Q-10; antidiabetic agent (insulin or non-insulin dependent diabetes): 8,129,337[P]. 2012-3-6.
(  0) 0) |
| [15] |
ORŠOLIĆ N, GAJSKI G, GARAJ-VRHOVAC V, et al. DNA-protective effects of quercetin or naringenin in alloxan-induced diabetic mice[J]. Eur J Pharmacol, 2011, 656(1/2/3): 110-118. (  0) 0) |
| [16] |
ORŠOLIĆ N, SIROVINA D, GAJSKI G, et al. Assessment of DNA damage and lipid peroxidation in diabetic mice: effects of propolis and epigallocatechin gallate (EGCG)[J]. Mutat Res, 2013, 757(1): 36-44. DOI:10.1016/j.mrgentox.2013.04.022 (  0) 0) |
| [17] |
FU Z, ZHEN W, YUSKAVAGE J, et al. Epigallocatechin gallate delays the onset of type 1 diabetes in spontaneous non-obese diabetic mice[J]. Br J Nutr, 2011, 105(8): 1218-1225. DOI:10.1017/S0007114510004824 (  0) 0) |
| [18] |
ZHANG Z, DING Y, DAI X, et al. Epigallocatechin-3-gallate protects pro-inflammatory cytokine induced injuries in insulin-producing cells through the mitochondrial pathway[J]. Eur J Pharmacol, 2011, 670(1): 311-316. DOI:10.1016/j.ejphar.2011.08.033 (  0) 0) |
| [19] |
ORTSÄTER H, GRANKVIST N, Wolfram S, et al. Diet supplementation with green tea extract epigallocatechin gallate prevents progression to glucose intolerance in db/db mice[J]. Nutr Metab (Lond), 2012, 9: 1. DOI:10.1186/1743-7075-9-11 (  0) 0) |
| [20] |
YUSKAVAGE J K. Epigallocatechin gallate in the regulation of insulin secretion[D]. Blacksburg: Virginia Polytechnic Institute and State University, 2008.
(  0) 0) |
| [21] |
CAI E P, LIN J K. Epigallocatechin gallate (EGCG) and rutin suppress the glucotoxicity through activating IRS2 and AMPK signaling in rat pancreatic β cells[J]. J Agric Food Chem, 2009, 57(20): 9817-9827. DOI:10.1021/jf902618v (  0) 0) |
| [22] |
SONG E K, HUR H, HAN M K. Epigallocatechin gallate prevents autoimmune diabetes induced by multiple low doses of streptozotocin in mice[J]. Arch Pharm Res, 2003, 26(7): 559-563. DOI:10.1007/BF02976881 (  0) 0) |
| [23] |
QIN B, POLANSKY M M, HARRY D, et al. Green tea polyphenols improve cardiac muscle mRNA and protein levels of signal pathways related to insulin and lipid metabolism and inflammation in insulin-resistant rats[J]. Mol Nutr Food Res, 2010, 54(Suppl 1): S14-S23. (  0) 0) |
| [24] |
CAO H, HININGER-FAVIER I, KELLY M A, et al. Green tea polyphenol extract regulates the expression of genes involved in glucose uptake and insulin signaling in rats fed a high fructose diet[J]. J Agric Food Chem, 2007, 55(15): 6372-6378. DOI:10.1021/jf070695o (  0) 0) |
| [25] |
UEDA M, NISHIUMI S, Nagayasu H, et al. Epigallocatechin gallate promotes GLUT4 translocation in skeletal muscle[J]. Biochem Biophys Res Commun, 2008, 377(1): 286-290. DOI:10.1016/j.bbrc.2008.09.128 (  0) 0) |
| [26] |
LIN C L, LIN J K. Epigallocatechin gallate (EGCG) attenuates high glucose-induced insulin signaling blockade in human HepG2 hepatoma cells[J]. Mol Nutr Food Res, 2008, 52(8): 930-939. DOI:10.1002/mnfr.v52:8 (  0) 0) |
| [27] |
ZHANG Z F, LI Q, LIANG J, et al. Epigallocatechin-3-O-gallate (EGCG) protects the insulin sensitivity in rat L6 muscle cells exposed to dexamethasone condition[J]. Phytomedicine, 2010, 17(1): 14-18. DOI:10.1016/j.phymed.2009.09.007 (  0) 0) |
| [28] |
LI Y, ZHAO S, ZHANG W, et al. Epigallocatechin-3-O-gallate (EGCG) attenuates FFAs-induced peripheral insulin resistance through AMPK pathway and insulin signaling pathway in vivo
[J]. Diabetes Res Clin Pract, 2011, 93(2): 205-214. DOI:10.1016/j.diabres.2011.03.036 (  0) 0) |
| [29] |
CORDERO-HERRERA I, MARTÍN M Á, GOYA L, et al. Cocoa flavonoids attenuate high glucose-induced insulin signalling blockade and modulate glucose uptake and production in human HepG2 cells[J]. Food Chem Toxicol, 2014, 64: 10-19. DOI:10.1016/j.fct.2013.11.014 (  0) 0) |
| [30] |
YAN J, FENG Z, LIU J, et al. Enhanced autophagy plays a cardinal role in mitochondrial dysfunction in type 2 diabetic Goto-Kakizaki (GK) rats: Ameliorating effects of (-)-epigallocatechin-3-gallate[J]. J Nutr Biochem, 2012, 23(7): 716-724. DOI:10.1016/j.jnutbio.2011.03.014 (  0) 0) |
| [31] |
KAMIYAMA O, SANAE F, IKEDA K, et al. In vitro inhibition of α-glucosidases and glycogen phosphorylase by catechin gallates in green tea
[J]. Food Chem, 2010, 122(4): 1061-1066. DOI:10.1016/j.foodchem.2010.03.075 (  0) 0) |
| [32] |
MATSUMOTO N, ISHIGAKI F, ISHIGAKI A, et al. Reduction of blood glucose levels by tea catechin[J]. Biosci Biotechnol Biochem, 1993, 57(4): 525-527. DOI:10.1271/bbb.57.525 (  0) 0) |
| [33] |
FORESTER S C, GU Y, LAMBERT J D. Inhibition of starch digestion by the green tea polyphenol,(-)-epigallocatechin-3-gallate[J]. Mol Nutr Food Res, 2012, 56(11): 1647-1654. DOI:10.1002/mnfr.v56.11 (  0) 0) |
| [34] |
ABE K, OKADA N, TANABE H, et al. Effects of chronic ingestion of catechin-rich green tea on hepatic gene expression of gluconeogenic enzymes in rats[J]. Biomed Res, 2009, 30(1): 25-29. DOI:10.2220/biomedres.30.25 (  0) 0) |
| [35] |
YAMABE N, YOKOZAWA T, OYA T, et al. Therapeutic potential of (-)-epigallocatechin 3-O-gallate on renal damage in diabetic nephropathy model rats[J]. J Pharmacol Exp Ther, 2006, 319(1): 228-236. DOI:10.1124/jpet.106.107029 (  0) 0) |
| [36] |
NICHOLAS S B, LIU J, KIM J, et al. Critical role for osteopontin in diabetic nephropathy[J]. Kidney Int, 2010, 77(7): 588-600. DOI:10.1038/ki.2009.518 (  0) 0) |
| [37] |
JUNAID A, AMARA F M. Osteopontin: Correlation with interstitial fibrosis in human diabetic kidney and PI3-kinase-mediated enhancement of expression by glucose in human proximal tubular epithelial cells[J]. Histopathology, 2004, 44(2): 136-146. DOI:10.1111/his.2004.44.issue-2 (  0) 0) |
| [38] |
YOON S P, MAENG Y H, HONG R, et al. Protective effects of epigallocatechin gallate (EGCG) on streptozotocin-induced diabetic nephropathy in mice[J]. Acta Histochem, 2014, 116(8): 1210-1215. DOI:10.1016/j.acthis.2014.07.003 (  0) 0) |
 2017, Vol. 38
2017, Vol. 38

