动物肠道内寄生大量的微生物,种类繁多,数量巨大,可达机体细胞数量的10倍以上。肠道微生物与宿主之间是一种共生关系。近年来一些研究表明,肠道微生物及其代谢和分泌产物在调控肠道运动、维持肠道屏障的完整性以及宿主免疫功能和能量代谢等方面均有重要影响[1-2]。也有研究显示,肠道微生物还能通过肠–脑轴影响中枢神经系统的功能,从而调控动物的行为[3]。
微生物在肠道内不仅能产生生物胺、短链脂肪酸等,在细菌死亡或细胞壁破裂后也能释放出一些自身结构性组分,如脂多糖和肽聚糖等。其中,脂多糖是革兰阴性菌细胞壁的组成成分,可以通过受损的肠道屏障进入血液循环,产生各种病理性反应,如食欲减退、消瘦和精神萎靡,严重时,还可以引起“内毒素休克”、全身性炎症和高热反应[4]。
除进入血液循环外,许多脂多糖仍停留在肠道内,随粪便排出体外。但有关这些肠道内脂多糖生理性功能尚缺乏系统研究。细胞研究表明,脂多糖可以直接作用于肠上皮细胞上的Toll样受体4(Toll like receptor 4,TLR4),激活其非特异性免疫反应[5]。也有部分研究提示肠道内脂多糖与血液中脂多糖的功能可能不尽相同,如肠道内脂多糖可提高肠道内在神经丛神经末梢的敏感性[6],还可以直接通过迷走神经在一定程度上促进小鼠采食[7]。但目前大多数脂多糖的研究均采用腹腔或静脉注射[8-9],而对于肠道内脂多糖是否能调控机体代谢和行为方面鲜有明确报道。
本研究在小鼠饮用水中添加不同细菌来源的脂多糖,观察其对动物能量稳态和行为变化的影响。研究结果对于探讨不同类型脂多糖在肠道的生理学功能具有重要意义,为进一步研制功能性脂多糖作为生理调节剂提供试验依据。
1 材料与方法 1.1 材料试验动物:5周龄C57/BL小鼠,购买于广东省医学实验中心。抗体:褐色脂肪蛋白包括解偶联蛋白1(Uncoupling protein-1,UCP-1)和过氧化物酶体激活物受体共激活因子1α(Peroxisome proliferator-activated receptor gamma coactivator 1α,PGC-1α)以及β-actin抗体,均购自美国Cell signaling technology;二抗购自北京博奥森生物技术有限公司。仪器:Bio-Rad MyCycler PCR仪(Bio-Rad公司,美国);HBPX220型梯度PCR仪(HYBRID,英国);Mx3005P荧光定量PCR仪(Sratagene,美国);MesoQMR23-060H核磁共振成像仪(纽迈,苏州);DM2500光学显微镜(LEICA,德国);脂多糖(Sigma,美国)。
1.2 试验设计腹腔注射试验:选用48只小鼠,按体质量相近原则随机分为8组,每组6只,1组为对照组,其余7组为不同浓度大肠埃希菌Escherichia coil O55:B5脂多糖腹腔注射组,每只小鼠单笼饲养,注射前6 h断料,注射半小时后给料,记录小鼠在注射后1、2和12 h的采食量。饮水试验选用24只小鼠,按体质量相近原则随机分为3组:分别为不添加的对照组、O128:B12脂多糖组和O55:B5脂多糖组(饮用水中分别添加5 μg·mL–1 E. coil O128:B12和O55:B5脂多糖)。每组8只,试验期为12周,每只小鼠单笼饲养,自由采食与饮水,每3 d更换水源,温度控制在25 ℃左右,12 h光照∶12 h黑暗,所有试验小鼠均饲喂基础饲粮。
1.3 脂肪样本的采集与HE染色试验结束后小鼠脱颈处死,剪取小鼠皮下脂肪投入体积分数为4%的甲醛溶液中固定过夜,然后经过乙醇溶液脱水,二甲苯透明,及石蜡包埋;HE染色过程,经二甲苯脱蜡,乙醇溶液脱水,苏木精伊红染色,二甲苯透明,中性树胶封片。
1.4 核团的采集和检测小鼠处死后采集全脑放于干冰速冻,然后将样品转移至冰箱中–80 ℃保存备用,提取弓状核、杏仁体、纹状体和海马体中总RNA,利用试剂TRIzol,常规方法抽提,RT-PCR检测弓状核采食调控相关基因包括刺鼠基因相关蛋白(Agouti gene-related protein,AgRP)基因和阿黑皮素原(Proopiomelanocortin,POMC)基因mRNA的表达,检测纹状体、杏仁体以及海马体中原癌基因(Proto-oncogene, c-fos)、多巴胺D2受体(Dopamine D2 receptor,DRD2)基因mRNA的表达。相关基因引物序列见表1。
|
|
表 1 荧光定量PCR所用引物序列 Table 1 Sequences of primers used for real-time quantitative PCR |
高架十字迷宫试验:在无外部因素干扰情况下,记录5 min内小鼠在开放臂的时间;旷场试验:在无外部因素干扰情况下,记录小鼠20 min内在旷场中心区活动时间,同时记录小鼠的活动情况,视频结果用ANY-maze动物行为学分析软件进行分析。
1.6 褐色脂肪Western-blot检测褐色脂肪匀浆后离心取上清,用BCA法检测蛋白浓度,取等量蛋白,加入适量的上样缓冲液(5 ×SDS),99 ℃变性10 min,将样品用SDS–聚丙烯酰胺凝胶电泳,然后将蛋白从凝胶中转移到PVDF膜上,用含质量分数为5%的脱脂奶粉的封闭液封闭2 h,然后在4 ℃孵育UCP-1和PGC-1α,β-actin抗体过夜,次日用TBST洗涤后孵育二抗2 h,结束后用TBST溶液洗涤,将膜放于发光液1 min,在凝胶成像系统中进行扫描。
2 结果与分析 2.1 脂多糖对小鼠采食和弓状核食欲肽表达的影响小鼠腹腔注射不同浓度E.coil O55:B5脂多糖对小鼠采食量的影响如图1A所示。由图1A可知,低剂量脂多糖对小鼠的累积采食量无显著影响,但随着剂量升高,脂多糖显著抑制了小鼠采食(P<0.05)。随后饮水分别添加5 μg·mL–1 E.coil O128:B12和O55:B5脂多糖,结果发现2种脂多糖均显著促进了小鼠累积采食量(图1B)。定量PCR结果表明,2种脂多糖均显著提高了弓状核AgRP mRNA的表达,而对POMC mRNA的表达无显著影响(P>0.05)(图2A、2B)。该结果说明脂多糖作用靶点不同,其对小鼠采食的影响也有差异。

|
图 1 腹腔注射与饮用水中添加脂多糖对小鼠累积采食量的影响 Figure 1 Effects of intraperitoneal injecting or drinking lipopolysaccharide on accumulative food intake of mice *表示与对照组差异显著(P<0.05,t检验);A:腹腔注射;B:饮水添加。 |
尽管2种脂多糖均能显著促进小鼠采食,但对体增质量均无明显影响(图3A);图3B和3C分别是小鼠体成分分析结果,饮水添加5 μg·mL–1 O128:B12和O55:B5脂多糖均显著降低了小鼠体内脂肪比例,增加了瘦组织比例,此外,饮水添加O55:B5脂多糖还显著提高了小鼠腓肠肌比例,显著降低了皮下脂肪比例(图3D、3E),上述结果说明2种脂多糖能改变小鼠体组成,且O55:B5脂多糖效应更强。对饲料利用率分析显示(图3F),饮水分别添加2种脂多糖均显著降低了小鼠饲料利用率。

|
图 2 饮用水中添加脂多糖对小鼠弓状核AgRP和POMC mRNA表达的影响 Figure 2 Effects of adding lipopolysaccharides to drinking water on AgRP and POMC mRNA expression in arcuate nucleus of mice *表示与对照组差异显著 (P<0.05,t检验)。 |

|
图 3 饮水添加脂多糖对小鼠生长性状的影响 Figure 3 Effects of drinking lipopolysaccharide on growth performances of mice *、**分别表示与对照组差异达到0.05、0.01的显著水平(t检验);各组织质量分数均为各组织质量与小鼠质量之比。 |
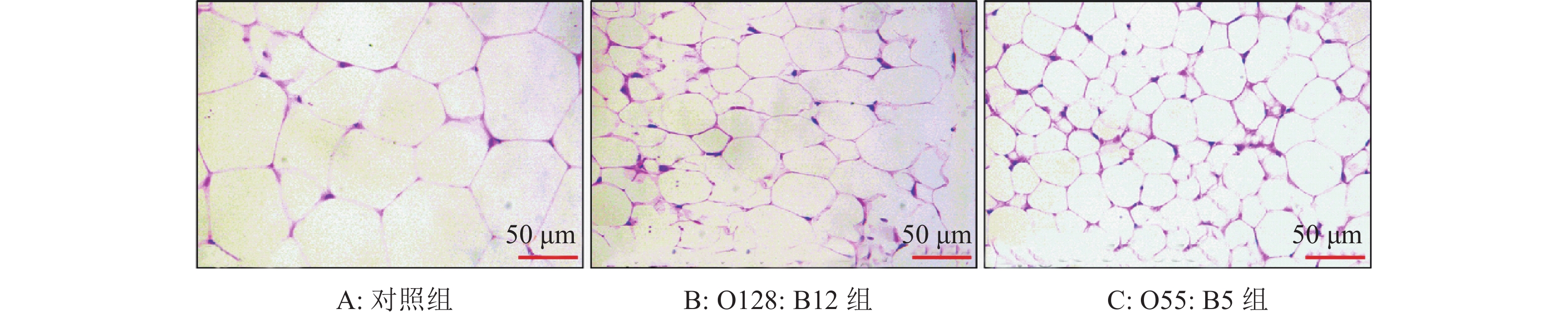
为深入研究饮水添加脂多糖降低脂肪沉积的机制,本研究进一步分析了白色脂肪细胞面积和褐色脂肪代谢相关基因的表达。结果表明,2种脂多糖均能显著降低小鼠皮下脂肪细胞的面积(图4、5)。而且,脂多糖处理组褐色脂肪UCP-1和PGC-1α蛋白表达水平显著高于对照组,以O55:B5组表达量最高(图6、7)。该结果说明,脂多糖可能通过促进脂肪分解,降低脂肪细胞大小,以减少脂肪的沉积,而与脂肪细胞数量无关。
|
图 4 小鼠皮下脂肪HE染色图 Figure 4 HE staining of subcutaneous fat in mice |

|
图 5 小鼠皮下脂肪细胞面积统计结果 Figure 5 Summary output of the area of subcutaneous fat cells in mice *表示与对照组差异显著(P<0.05,t检验)。 |

|
图 6 小鼠PGC-1α和UCP-1蛋白条带 Figure 6 PGC-1α and UCP-1 protein bands of mice |

|
图 7 小鼠褐色脂肪UCP-1和PGC-1α蛋白表达统计图 Figure 7 Summary output of the expression of UCP-1 and PGC-1α proteins in mouse brown fat *、**分别表示与对照组差异达到0.05、0.01的显著水平(t检验)。 |
为进一步分析饮水添加脂多糖对小鼠行为的影响,试验首先采用高架十字迷宫试验和旷场试验分析了小鼠的焦虑行为。如图8A和8B所示。饮水添加脂多糖后,小鼠进入高架十字迷宫开放臂的时间和旷场试验中心区的时间与对照组相比均无明显差异,说明饮水添加脂多糖对小鼠焦虑行为无影响。但在旷场试验中意外发现,脂多糖饮水添加组小鼠的自发运动距离显著高于对照组小鼠,且以O55:B5组距离最长(图8C)。该结果说明饮水添加脂多糖增加了小鼠的自发运动水平。随后,试验分别采集小鼠自发运动有关的纹状体,杏仁体和海马体,采用定量PCR分析了相关基因的表达。结果如图9所示,2种脂多糖均显著促进了海马体中c-fos和DRD2 mRNA的表达水平,而纹状体、杏仁体中该基因表达则无显著变化。

|
图 8 饮水添加脂多糖对小鼠行为变化的影响 Figure 8 Effects of drinking lipopolysaccharide on behavioral changes in mice *、**分别表示与对照组差异达到0.05和0.01的显著水平(t检验);A:高架十字迷宫中小鼠开放臂运动时间;B:旷场试验小鼠中心区运动时间;C:旷场试验小鼠运动总距离。 |

|
图 9 饮水添加脂多糖对小鼠自发运动脑核团相关基因表达的影响 Figure 9 Effects of drinking lipopolysaccharide on the expression of genes related to brain nuclei that regulate spontaneous motion of mice *、**分别表示与对照组差异达到0.05、0.01的显著水平(t检验)。 |
下丘脑是机体采食调控的重要中枢,下丘脑弓状核区的AgRP神经元和POMC神经元在整合外周和中枢食欲调节信号中发挥着关键的作用[10],其中,激活AgRP神经元能促进动物采食,而激活POMC神经元则抑制动物采食。脂多糖是革兰氏阴性菌细胞壁的重要组成成分,细菌释放的脂多糖可在不同程度上影响动物的食欲[7, 11],因脂多糖的处理时间、剂量和给药方式而异,如高剂量脂多糖能够诱导体内炎症,升高血液中炎症因子水平,如白细胞介素和肿瘤坏死因子等,这些炎症因子可直接作用于中枢系统的采食调控,降低动物食欲,引起动物厌食[8, 12]。本研究结果也表明,小鼠腹腔注射高剂量脂多糖能明显抑制其采食行为,而短期注射低剂量脂多糖对采食无明显影响。但长期低剂量的脂多糖则有促进采食的趋势。有文献报道,通过皮下埋植给予脂多糖却能促进小鼠采食,其机制被认为与瘦素信号通路和胰岛素受体敏感性有关[7, 13]。本研究通过饮水给药,也发现低剂量脂多糖能促进小鼠采食,且上调下丘脑弓状核AgRP基因mRNA的表达。该结果表明长期低剂量饮水添加脂多糖,可能通过调节脑肠轴,参与了动物的食欲调节。
3.2 饮用水中添加脂多糖对小鼠体组成及脂肪代谢的影响饲料的利用效率与动物的自主运动、基础代谢和褐色脂肪代谢水平密切相关。动物机体的脂肪组织分为白色脂肪和褐色脂肪,白色脂肪是机体内的储能器官,而褐色脂肪则主要参与氧化代谢和产热。褐色脂肪中UCP-1和PGC-1α是调控褐色脂肪线粒体的氧化呼吸的标志蛋白[14-15],这些基因表达上调可增强褐色脂肪氧化代谢,促进白色脂肪褐色化,减少脂肪沉积。有研究显示脂多糖可通过炎症通路,促使体内褐色脂肪UCP-1,PGC-1α的表达增多[16]。我们研究也发现,口服脂多糖能显著促进小鼠褐色脂肪UCP-1和PGC-1α蛋白的表达,降低白色脂肪细胞的面积和脂肪沉积水平。此前研究报道,腹腔注射高剂量脂多糖能够抑制肌肉蛋白质的合成,降低骨骼肌比例[17],本研究结果显示,饮用水中添加脂多糖却促进了小鼠腓肠肌含量的增加,我们前期研究还发现,TLR4可介导硫辛酸,通过MyD88激活PI3K信号通路,从而促进骨骼肌蛋白质沉积[18],而脂多糖是天然的TLR4配体,因此,本试验中口服脂多糖,推测可能通过类似机制促进骨骼肌蛋白质合成和肌肉肥大。
3.3 饮用水中添加脂多糖对小鼠行为变化的影响动物采食和能量代谢也受到运动和焦虑等行为的影响。已有研究表明,急性注射脂多糖可引起小鼠的抑郁行为,且自发活动降低[19]。究其机制可能与脂多糖升高中枢炎症因子TNF-α和IL-1β有关,有研究显示,中枢炎症因子的增多是导致抑郁行为的直接因素之一[20]。但本研究结果发现,饮用水中添加脂多糖对小鼠在高架十字迷宫开放臂的时间以及在旷场试验中心区域的时间并未产生明显影响,说明饮用水中添加脂多糖并未影响小鼠的焦虑行为。但进一步分析发现,饮用水中添加脂多糖能显著提高小鼠的自发运动距离。动物自发运动的程度受大脑杏仁体、纹状体和海马体等核团控制[21-23],而多巴胺神经系统在自发运动调节中尤其重要。有研究表明,多巴胺D2受体(DRD2)基因的表达受到抑制后可明显减少小鼠的自发活动能力,而敲除DRD2基因后再表达,能有效恢复小鼠的自发运动能力[24]。我们的试验结果发现,饮水添加脂多糖能显著促进海马体中c-fos、DRD2基因
本研究还发现饮用水中添加不同亚型大肠埃希菌来源脂多糖,对小鼠采食、代谢和行为的效应强弱也有差异。此前也有报道发现类似现象[25],究其原因可能与脂多糖的结构不同有关。后续可深入研究不同来源脂多糖的结构基础及生理学功能差异。综上所述,本研究表明饮用水中添加脂多糖能够促进小鼠采食和褐色脂肪代谢,且可能通过调节大脑海马体中多巴胺系统功能,影响小鼠的自发运动。研究结果对于全面认识脂多糖的生理学功能具有重要的价值,也为研发调节能量稳态的生理调节剂提供试验依据。
| [1] |
刘银辉. 肠道菌群与代谢研究进展[J]. 中国微生态学杂志, 2013, 25(3): 362-367. (  0) 0) |
| [2] |
LUO J, JIN F. Recent advances in understanding the impact of intestinal microbiota on host behavior[J]. Chinese Sci Bul, 2014, 59(22): 2169. DOI:10.1360/N972014-00120 (  0) 0) |
| [3] |
LUNA R A, FOSTER J A. Gut brain axis: Diet microbiota interactions and implications for modulation of anxiety and depression[J]. Curr Opin Biotechnol, 2015, 32: 35-41. DOI:10.1016/j.copbio.2014.10.007 (  0) 0) |
| [4] |
PASTERNAK B A, D'MELLO S, JURICKOVA II, et al. Lipopolysaccharide exposure is linked to activation of the acute phase response and growth failure in pediatric Crohn’s disease and murine colitis[J]. Inflamm Bowel Dis, 2010, 16(5): 856-869. DOI:10.1002/ibd.21132 (  0) 0) |
| [5] |
BEIN A, ZILBERSHTEIN A, GOLOSOVSKY M, et al. LPS induces hyper-permeability of intestinal epithelial cells[J]. J Cell Physiol, 2017, 232(2): 381-390. DOI:10.1002/jcp.v232.2 (  0) 0) |
| [6] |
CARVALHO F A, AITKEN J D, VIJAY-KUMAR M, et al. Toll-like receptor-gut microbiota interactions: Perturb at your own risk![J]. Annu Rev Physiol, 2012, 74: 177-198. DOI:10.1146/annurev-physiol-020911-153330 (  0) 0) |
| [7] |
DE LA SERRE C B, DE LARTIGUE G, RAYBOULD H E. Chronic exposure to low dose bacterial lipopolysaccharide inhibits leptin signaling in vagal afferent neurons[J]. Physiol Behav, 2015, 139: 188-194. DOI:10.1016/j.physbeh.2014.10.032 (  0) 0) |
| [8] |
HSING C H, HUNG S K, CHEN Y C, et al. Histone deacetylase inhibitor trichostatin aameliorated endotoxin-induced neuroinflammation and cognitive dysfunction[J]. Mediators Inflamm, 2015. DOI:10.1155/2015/163140 (  0) 0) |
| [9] |
ORLANDI L, FONSECA W F, ENES-MARQUES S, et al. Sickness behavior is accentuated in rats with metabolic disorders induced by a fructose diet[J]. J Neuroimmunol, 2015, 289: 75-83. DOI:10.1016/j.jneuroim.2015.10.014 (  0) 0) |
| [10] |
MORTON G J, CUMMINGS D E, BASKIN D G, et al. Central nervous system control of food intake and body weight[J]. Nature, 2006, 443(7109): 289-295. DOI:10.1038/nature05026 (  0) 0) |
| [11] |
LIU Y, HUANG Y, LIU T, et al. Lipopolysacharide rapidly and completely suppresses AgRP neuron-mediated food intake in male mice[J]. Endocrinology, 2016, 157(6): 2380-2392. DOI:10.1210/en.2015-2081 (  0) 0) |
| [12] |
SHAIKH A, DHADDE S B, DURG S, et al. Effect of embelin against lipopolysaccharide-induced sickness behaviour in mice[J]. Phytother Res, 2016, 30(5): 815-822. DOI:10.1002/ptr.v30.5 (  0) 0) |
| [13] |
CANI P D, AMAR J, IGLESIAS M A, et al. Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007, 56(7): 1761-1772. DOI:10.2337/db06-1491 (  0) 0) |
| [14] |
ERLANSON-ALBERTSSON C. The role of uncoupling proteins in the regulation of metabolism[J]. Acta Physiol Scand, 2003, 178(4): 405-412. DOI:10.1046/j.1365-201X.2003.01159.x (  0) 0) |
| [15] |
LIANG H, WARDW F. PGC-1α: A key regulator of energy metabolism[J]. Adv Physiol Educ, 2006, 30(4): 145-151. DOI:10.1152/advan.00052.2006 (  0) 0) |
| [16] |
KIR S, WHITE J P, KLEINER S, et al. Tumour-derived PTH-related protein triggers adipose tissue browning and cancer cachexia[J]. Nature, 2014, 513(7516): 100-104. DOI:10.1038/nature13528 (  0) 0) |
| [17] |
DUAN K, YU W, LIN Z, et al. Insulin ameliorating endotoxaemia-induced muscle wasting is associated with the alteration of hypothalamic neuropeptides and inflammation in rats[J]. Clin Endocrinol (Oxf), 2015, 82(5): 695-703. DOI:10.1111/cen.2015.82.issue-5 (  0) 0) |
| [18] |
OJANIEMI M G V, HARJU K, LILJEROOS M, et al. Phosphatidylinositol 3-kinase is involved in toll-like receptor 4-mediated cytokine expression in mouse macrophages[J]. Eur J Immunol, 2003, 33(3): 597-605. DOI:10.1002/eji.200323376 (  0) 0) |
| [19] |
DANTZER R. Depression and inflammation: An intricate relationship[J]. Biol Psychiatry, 2012, 71: 4-5. DOI:10.1016/j.biopsych.2011.10.025 (  0) 0) |
| [20] |
DANTZER R. Cytokine, sickness behavior, and depression[J]. Immunol Allergy Clin North Am, 2009, 29(2): 247-264. DOI:10.1016/j.iac.2009.02.002 (  0) 0) |
| [21] |
DECKER M W, CURZON P, BRIONI J D. Influence of separate and combined septal and amygdala lesions on memory, acoustic startle, anxiety, and locomotor activity in rats[J]. Neurobiol Learn Mem, 1995, 64(2): 156-168. DOI:10.1006/nlme.1995.1055 (  0) 0) |
| [22] |
MUTHURAJU S T S, PATI S, RAFIQUE M. Normabaric hyperoxia treatment improved locomotor activity of C57BL/6J mice through enhancing dopamine genes following fluid-percussion injury in striatum[J]. Int J Biomed Sci, 2013, 9(4): 194-204. (  0) 0) |
| [23] |
BINA P, REZVANFARD M, AHMADI S, et al. Anxiolytic-like effects and increase in locomotor activity induced by infusions of NMDA into the ventral hippocampus in rat: Interaction with GABAergic system[J]. Basic Clin Neurosci, 2014, 5(4): 267-276. (  0) 0) |
| [24] |
KLINKER F, HASAN K, PAULUS W, et al. Pharmacological blockade and genetic absence of the dopamine D2 receptor specifically modulate voluntary locomotor activity in mice[J]. Behav Brain Res, 2013, 242: 117-124. DOI:10.1016/j.bbr.2012.12.038 (  0) 0) |
| [25] |
王照娜. 大肠杆菌脂多糖的提取纯化及活性分析[D]. 天津: 南开大学, 2008. http://d.wanfangdata.com.cn/Thesis/Y1379623
(  0) 0) |
 2017, Vol. 38
2017, Vol. 38


 ,
,