2. 农业部耕地保育重点实验室/国土资源部建设用地再开发重点实验室/广东省土地利用与整治重点实验室,广东 广州,510642;
3. 华南农业大学 资源环境学院,广东 广州,510642
2. Key Laboratory of Arable Land Conservation of Ministry of Agriculture/ Key Laboratory of the Ministry of Land and Resources for Construction Land Transformation/Guangdong Province Key Laboratory of Land Use and Consolidation, Guangzhou 510642, China;
3. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China
高速公路工程建设占用和损毁了大量的土地资源,并带来水土流失等一系列环境问题,因此必须对其损毁的土地进行复垦利用和生态重建。但高速公路工程建设不但对土壤理化性质造成严重损毁,而且也严重损害了土壤微生物性状和酶活性,降低了土壤生态系统的活性,致使土地复垦和生态重建效果一直较差[1]。因此,对高速公路工程建设损毁土壤的修复不仅要考虑尽快恢复其理化性状和肥力,更要考虑恢复其微生物学性状和酶活性,恢复健康的土壤生态系统功能。
土壤微生物作为土壤生物化学反应的重要参与者,对土壤生态系统和功能有重要影响[2],并灵敏反映土壤生物学性状的变化[3]。土壤酶是土壤营养代谢的重要驱动力,参与土壤各种生物化学过程,对土壤有机质转换、腐殖质形成、有机无机胶体形成以及各营养元素的转化和释放都有重要直接作用[2]。土壤酶活性和微生物生物量等生物学性状比土壤有机质、养分含量等理化性状能更敏感地对土壤质量变化做出响应[4]。因此,本研究选取8个土壤微生物学和8个土壤酶活性指标,利用主成分分析法对不同施肥处理土壤微生物学性状和酶活性的影响进行研究,试图揭示不同施肥处理对土壤生物学性状和酶活性的影响机理,为寻找科学的施肥方法应用于工程建设损毁土地土壤的修复和可持续利用提供依据。
1 材料与方法 1.1 供试材料类芦Neyraudia reynaudiana种子采集于华南农业大学校内野生类芦,将种子播种于以河沙为基质的苗床中培养,在幼苗长至高约15 cm时,从苗床中取出,随机选取16组株高、分蘖数、鲜质量均无显著差异的幼苗(P>0.05),备用。
化肥为尿素、过磷酸钙和氯化钾,其中,尿素(分析纯)的w(N)为46.67%,过磷酸钙的w(P2O5)为17.5%,氯化钾的w(K2O)为63.09%。
土壤采自高速公路建设破坏的赤红壤,样品经自然风干,过5 mm筛,备用。牛粪取自华南农业大学养牛场新鲜牛粪,自然风干、粉碎,过2 mm筛,备用。蚓粪为华南农业大学土壤与生态实验室牛粪喂养的赤子爱胜蚓 Elsenia foetida 蚓粪,自然风干、研磨,过2 mm筛,备用。供试土壤、牛粪和蚓粪基本理化性质见表1。
|
|
表 1 土壤、牛粪和蚓粪的基本理化性质 Table 1 Basic physicochemical properties of soil, cattlemanure and vermicompost |
试验以高速公路工程建设损毁赤红壤为对照(CK), 共设3个处理,每处理4次重复。其中,施化肥处理(HF),化肥施入量按照蚓粪氮、磷、钾养分含量折算后,按氮、磷、钾等量原则投入,因此与蚓粪处理所含氮、磷、钾量一致,由3.38 g尿素、2.48 g过磷酸钙和2.48 g氯化钾调配而成;施牛粪处理(NF),牛粪施入量为75 g;施蚓粪处理(YF),蚓粪施入量也为75 g。
称取3 kg过5 mm筛的风干土,分别混合肥料后装于4 L的塑料盆中。其中,牛粪和蚓粪作为底肥一次性施入,化肥按照4︰3︰3比例分3次施入,即作为底肥施入40%,类芦生长期间追肥2次,各施入30%。土壤装盆后浇水至田间持水量的60%,静置5 d后移苗,每盆植入类芦幼苗2株,计时培养90 d。
1.3 测定及分析方法土壤微生物量碳、氮采用氯仿熏蒸–硫酸钾浸提法测定[5-6];土壤呼吸采用NaOH吸收法测定[7];微生物代谢熵(
土壤转化酶采用滴定法测定,脲酶采用苯酚钠比色法测定,过氧化氢酶采用KMnO4容量法测定[9]。酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶采用比色法测定[10-11],分别以对硝基苯磷酸盐、对硝基苯葡萄糖苷、对硝基苯乙酰氨基葡萄糖苷和二羟苯丙氨酸为底物。
1.4 数据处理利用SAS9.0统计软件对试验数据进行多重比较(DMRT)分析,显著性水平取α=0.05。利用R(ADE-4 library)[12]多元数据分析软件对试验数据进行主成分分析和判别分析,多元数据分析结果利用二维空间载荷图和得分图直观而形象地进行反映,处理间的差异显著水平用α=0.001表示。图表中的数据均为各测定数据的平均值±标准误。
2 结果与分析 2.1 不同施肥处理对土壤微生物学性状的影响施肥后,除土壤微生物碳氮比外,不同施肥处理土壤微生物学性状指标与CK差异均显著;NF和YF处理土壤微生物量碳、微生物量氮、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量显著高于HF和CK处理(P<0.05,表2)。NF处理土壤微生物量碳、微生物量氮、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量分别比CK增加了47%、107%、129%、50%、3 096%、543%和292%;YF处理的土壤微生物量碳、微生物量氮、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量分别比CK增加了56%、143%、167%、64%、3 052%、117%和305%;但HF处理除土壤微生物量氮、细菌和放线菌数量比CK略有增加外,土壤微生物量碳、土壤呼吸、代谢熵和真菌数量分别比CK降低了14%、83%、81%茅裕婷和49%,表明单施化肥处理不利于土壤微生物学性状的改善。除YF处理土壤呼吸显著高于NF处理,真菌数量显著低于NF处理外,YF和NF处理的其他微生物学性状指标差异均不显著,表明施蚓粪处理与施牛粪处理对土壤微生物活性的影响差异较小。NF处理的土壤微生物量碳、微生物量氮、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量较HF处理分别显著增加了70%、96%、1 239%、699%、300%、1 155%、272%,YF处理的相应指标较HF处理分别显著增加了80%、130%、1 458%、773%、295%、324%和285%,表明施有机肥处理比施化肥处理能显著提高土壤微生物活性。
|
|
表 2 不同施肥处理对土壤微生物学性状的影响1) Table 2 Effects of different fertilizing treatments on soil microbial characteristics |
不同施肥处理的土壤酶活性与CK差异均显著;NF和YF处理的土壤转化酶、脲酶、过氧化氢酶、酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性显著高于HF和CK处理(P<0.05,表3)。NF处理的土壤转化酶、脲酶、过氧化氢酶、酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性分别比CK增加了99%、47%、274%、76%、94%、203%、161%和170%;YF处理相应的酶活性分别较CK增加了105%、51%、203%、97%、101%、239%、119%和177%;但HF处理除土壤转化酶、脲酶和酸性磷酸酶活性比CK略有增加外,土壤β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性分别比CK降低了12%、16%、87%、2%和43%,表明单施化肥处理对提升土壤酶活性影响较小。除YF处理的土壤乙酰氨基葡萄糖苷酶活性显著高于NF处理,过氧化氢酶和多酚氧化酶活性显著低于NF处理外,YF和NF处理的其他酶活性指标差异均不显著,表明蚓粪处理和施牛粪处理对土壤酶活性的影响差异不大。NF处理的土壤转化酶、脲酶、过氧化氢酶、酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化氢酶活性较HF处理分别显著增加了61%、37%、36%、119%、259%、1 973%、175%和550%,YF处理的相应酶活性较HF处理分别显著增加了66%、40%、52%、128%、302%、1 641%、182%和428%,表明施有机肥处理比施化肥处理能显著提高土壤酶活性。
|
|
表 3 不同施肥处理对土壤酶活性的影响 1) Table 3 Effects of different fertilizing treatments on soil enzyme activities |
对不同施肥处理土壤微生物学性状和酶活性的综合变化进行主成分分析,结果(图1)显示,第1主成分(PC1)累计方差贡献率为79.76%,第2主成分(PC2)累计方差贡献率为7.59%,第1、2主成分累计方差贡献率达到87.35%,可以反映不同施肥处理对土壤微生物学性状和酶活性综合影响的绝大部分信息。
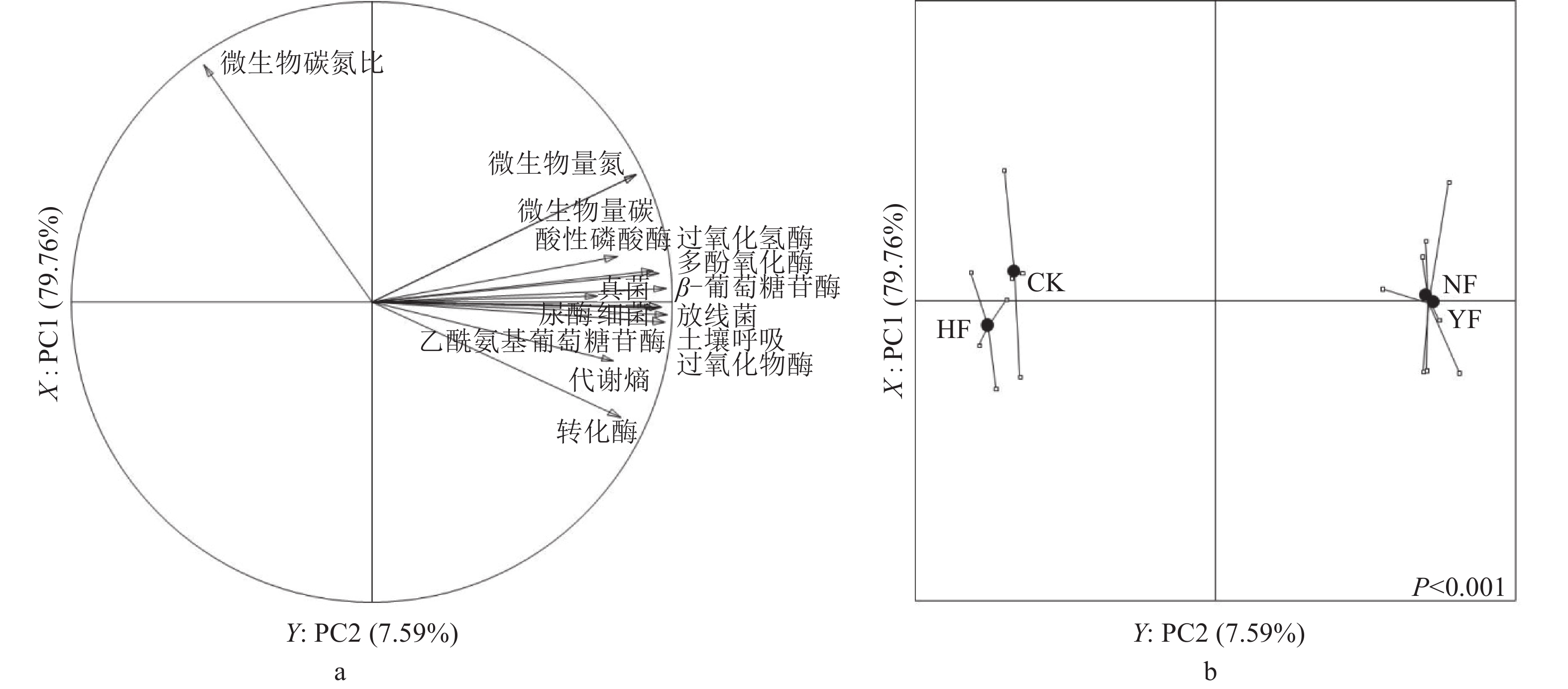
|
图 1 不同处理土壤的微生物学性状和酶活性主成分分析 Figure 1 Principal component analysis of soil microbial characteristics and enzyme activities in different treatments a:主成分载荷图,矢量箭头表示各参数变量,变量在主成分轴上的投影长短代表其对主成分的贡献,矢量箭头的余弦角度代表其相关关系;b:不同处理对土壤微生物学性状和酶活性综合影响得分图,其位置与空间载荷图上的参数矢量位置相对应。 |
PC1和PC2的空间载荷图(图1a)表明:PC1与土壤乙酰氨基葡萄糖苷酶、β–葡萄糖苷酶、过氧化物酶、过氧化氢酶、多酚氧化酶、脲酶、酸性磷酸酶、微生物量氮、微生物量碳、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量等微生物学参数密切相关,PC2主要与土壤微生物量碳氮比相关,不同施肥处理在空间上被明显区分(P<0.001,图1b)。不同施肥处理土壤微生物学性状和酶活性的差异主要受PC1的影响,沿PC1方向呈线性分布。NF和YF处理样点显著偏向土壤微生物量增多和酶活性增强的方向,而HF处理则显著偏向反方向,表明施有机肥能显著提高土壤微生物量和酶活性,单施化肥对土壤微生物量和酶活性影响较小。
3 讨论与结论本研究结果显示,施蚓粪和牛粪处理显著提高了土壤微生物量碳和微生物量氮,而施化肥处理的土壤微生物量碳和微生物量氮与CK差异不显著。这与前人发现施有机物料可以显著提高土壤微生物量碳和微生物量氮[13-15]的结果一致。这是因为蚓粪和牛粪作为有机肥施入土壤能显著提高土壤有机质和碳、氮的养分含量,有机质、全氮和碱解氮含量的提高有助于提供大量土壤微生物生长繁殖所需的物质和能量,促进土壤微生物量碳、氮的增加[16]。本研究结果显示,施牛粪和蚓粪处理的土壤细菌、真菌和放线菌数量显著高于施化肥处理和不施肥的CK处理,这和前人发现施蚓粪等有机肥可以显著提高细菌、真菌、放线菌及微生物总量[17-19]的结果一致。微生物碳氮比变化反映了土壤微生物群落结构的强烈变化[20],施蚓粪等有机肥可以显著改变微生物的种群结构[19]。细菌与真菌比可以反映土壤腐熟程度和肥力水平,细菌量越多可能土壤质量越高[21],表明施蚓粪和牛粪比施化肥能显著提高土壤质量。本研究结果显示,施蚓粪和牛粪处理的土壤呼吸显著增强,但仅施化肥处理的土壤呼吸却显著降低,甚至低于CK。这是因为施牛粪和蚓粪提高了土壤有机质水平,从而促进土壤呼吸[17, 22]。土壤代谢熵是土壤基础呼吸和微生物碳之比,比值越大说明代谢能力越强,土壤微生物群落年轻化水平越高[23],土壤质量也越高。本研究结果显示,施蚓粪和牛粪处理的土壤代谢熵显著增加,但施化肥处理的土壤代谢熵显著降低,这与前人研究发现5%蚓粪施入量土壤代谢熵显著增加[22]的结果一致,表明施蚓粪和牛粪能提高土壤微生物活性,提升土壤质量。短期内,施牛粪和施经蚯蚓处理产生的蚓粪土壤微生物学性状差异不显著,这与前人研究有所不同,值得进一步深入研究。
本研究结果显示,与CK相比,施蚓粪和牛粪处理显著提高了土壤转化酶、脲酶、过氧化氢酶、酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性,但施化肥处理的绝大多数酶活性与CK差异不显著。这与前人发现有机肥对土壤酶活性的影响显著高于无机肥[24],施有机物料可以显著提高土壤酶活性[14-15, 18, 22, 25]的结果一致。这是因为有机肥施用增加了土壤有机质,从而增加了土壤微生物的碳源,促进微生物的增殖,刺激酶活性提高[24]。有机肥不仅可作为土壤酶的底物诱导酶活性,同时有机肥自身携带的微生物和酶也可增加土壤酶活性[26]。但不同酶对不同有机肥料处理反馈并不一致,施蚓粪比施牛粪能显著提高土壤乙酰氨基葡萄糖苷酶活性,但过氧化氢酶和多酚氧化酶活性显著低于牛粪处理,这可能与植被和肥料对土壤有机质的影响有关[24]。
施蚓粪和牛粪比施化肥显著增加了土壤微生物量碳、微生物量氮、土壤呼吸、代谢熵以及细菌、真菌和放线菌数量,降低了微生物碳氮比;显著提高了土壤转化酶、脲酶、过氧化氢酶、酸性磷酸酶、β–葡萄糖苷酶、乙酰氨基葡萄糖苷酶、多酚氧化酶和过氧化物酶活性。短期内,施有机肥比施化肥更有助于改善土壤微生物学性状,提高土壤酶活性,提升工程建设损毁土壤的综合质量。施牛粪和施经蚯蚓处理牛粪产生的蚓粪对土壤微生物学性状和酶活性的影响差异不大。添加有机肥是快速修复高速公路工程建设损毁土壤的有效方式。
| [1] |
袁中友, 郭彦彪, 李强, 等. 有机无机肥配施对生态重建先锋植物类芦生长的影响[J]. 水土保持学报, 2014, 28(5): 302-308. (  0) 0) |
| [2] |
GIL-SOTRES F, TRASAR-CEPEDA C, LEIRÓS M C, et al. Different approaches to evaluating soil quality using biochemical properties[J]. Soil Biol Biochem, 2005, 37(5): 877-887. DOI:10.1016/j.soilbio.2004.10.003 (  0) 0) |
| [3] |
LAGOMARSINO A, MOSCATELLI M C, TIZIO A D, et al. Soil biochemical indicators as a tool to assess the short-term impact of agricultural management on changes in organic C in a Mediterranean environment[J]. Ecol Indic, 2009, 9(3): 518-527. DOI:10.1016/j.ecolind.2008.07.003 (  0) 0) |
| [4] |
DORAN J W, SARRANTONIO M, LIEBIG M A. Soil health and sustainability[J]. Adv Agron, 1996, 56(8): 1-54. (  0) 0) |
| [5] |
VANCE E D, BROOKES P C, JENKINSON D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biol Biochem, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6 (  0) 0) |
| [6] |
SPARLING G P. Ratio of microbial biomass carbon to soil organic carbon as a sensitive indicator of changes in soil organic matter[J]. Soil Res, 1992, 30(2): 195-207. DOI:10.1071/SR9920195 (  0) 0) |
| [7] |
WANG W J, DALAL R C, MOODY P W, et al. Relationships of soil respiration to microbial biomass, substrate availability and clay content[J]. Soil Biol Biochem, 2003, 35(2): 273-284. DOI:10.1016/S0038-0717(02)00274-2 (  0) 0) |
| [8] |
ANDERSON T H. Microbial eco-physiological indicators to asses soil quality[J]. Agric Ecos Environ, 2003, 98(1/2/3): 285-293. (  0) 0) |
| [9] |
李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008.
(  0) 0) |
| [10] |
IYYEMPERUMAL K, SHI W. Soil enzyme activities in two forage systems following application of different rates of swine lagoon effluent or ammonium nitrate[J]. Appl Soil Eco, 2008, 38(2): 128-136. DOI:10.1016/j.apsoil.2007.10.001 (  0) 0) |
| [11] |
EIVAZI F, TABATABAI M A. Glucosidases and galactosidases in soils[J]. Soil Biol Biochem, 1988, 20(5): 601-606. DOI:10.1016/0038-0717(88)90141-1 (  0) 0) |
| [12] |
THIOULOUSE J, CHESSEL D, DOLE D S, et al. ADE-4: A multivariate analysis and graphical display software[J]. Statcomput, 1997, 7(1): 75-83. (  0) 0) |
| [13] |
EBHIN MASTO R, CHHONKAR P K, SINGH D, et al. Changes in soil biological and biochemical characteristics in a long-term field trial on a sub-tropical inceptisol[J]. Soil Biol Biochem, 2006, 38(7): 1577-1582. DOI:10.1016/j.soilbio.2005.11.012 (  0) 0) |
| [14] |
PLAZA C, HEMÁNDEZ D, GARCIA-GIL J C, et al. Microbial activity in pig slurry-amended soils under semiarid conditions[J]. Soil Biol Biochem, 2004, 36(10): 1577-1585. DOI:10.1016/j.soilbio.2004.07.017 (  0) 0) |
| [15] |
KAUTZ T, WIRTH S, ELLMER F. Microbial activity in a sandy soil is governed by the fertilization regime[J]. Eur J Soil Biol, 2004, 40(2): 87-94. DOI:10.1016/j.ejsobi.2004.10.001 (  0) 0) |
| [16] |
张聪俐, 戴军, 周波, 等. 不同比例蚓粪对玉米生长以及土壤肥力特性的影响[J]. 华南农业大学学报, 2013, 34(2): 137-143. DOI:10.7671/j.issn.1001-411X.2013.02.003 (  0) 0) |
| [17] |
贾德新, 李士平, 王风丹, 等. 蚯蚓粪对豇豆根际土壤生物学特征及微生物活性的影响[J]. 浙江农业学报, 2016, 28(2): 318-323. (  0) 0) |
| [18] |
井大炜. 施用蚯蚓粪对杨树苗根际土壤生物学特征的影响[J]. 水土保持通报, 2014, 34(1): 133-137. (  0) 0) |
| [19] |
杨丽娟, 杨启迪, 周崇峻, 等. 施用蚓粪堆肥对温室番茄产量和品质及土壤微生物数量的影响[J]. 土壤通报, 2013, 44(6): 1455-1459. (  0) 0) |
| [20] |
JOERGENSEN R G, ANDERSON T H, WOLTERS V. Carbon and nitrogen relationships in the microbial biomass of soils in beech (Fagus sylvatica L.) forests
[J]. Biol Fertil Soil, 1995, 19(2): 141-147. (  0) 0) |
| [21] |
黎宁, 李华兴, 朱凤娇, 等. 菜园土壤的理化性质和微生物生态特征与种植年限的关系[J]. 生态环境, 2005, 14(6): 925-929. (  0) 0) |
| [22] |
张池, 陈旭飞, 周波, 等. 不同比例蚓粪对旱地土壤微生物学特性以及酶活性的影响[J]. 中国农业大学学报, 2014, 19(1): 118-124. (  0) 0) |
| [23] |
张宝贵, 李贵桐, 申天寿. 威廉环毛蚯蚓对土壤微生物量及活性的影响[J]. 生态学报, 2000, 20(1): 169-173. (  0) 0) |
| [24] |
李君剑, 严俊霞, 李洪建. 矿区不同复垦措施对土壤碳矿化和酶活性的影响[J]. 生态学报, 2015, 35(12): 4178-4185. (  0) 0) |
| [25] |
苏晓红, 高志岭, 刘建玲, 等. 蚯蚓粪和磷肥配施对油菜生长和土壤性质的影响[J]. 河北农业大学学报, 2010, 33(3): 8-12. (  0) 0) |
| [26] |
马晓霞, 王莲莲, 黎青慧, 等. 长期施肥对玉米生育期土壤微生物量碳氮及酶活性的影响[J]. 生态学报, 2012, 32(17): 5502-5511. (  0) 0) |
 2017, Vol. 38
2017, Vol. 38


