放线菌与人类的生产和生活关系极为密切,已知的微生物活性物质中70%以上来源于放线菌。对放线菌发酵产生的活性物质研究发现,胞内活性产物的分离纯化常面临高浓度反馈抑制、破碎菌体过程繁琐、易引入其他杂质等问题[1]。表面活性剂能够有效促进微生物发酵获得活性物质[2],吴敏等[3]通过添加表面活性剂改变了细胞膜通透性,减少了产物对细胞代谢的影响,冮洁等[4]添加表面活性剂促进重组里氏木霉Trichoderma reesei 生物合成组织纤溶酶原激活物。有研究表明添加表面活性剂可以改变细胞膜的通透性,从而促进胞内物质的外排[5-6]。
加利利链霉菌Streptomyces galilaeus为放线菌门Actinobacteria链霉菌科Streptomycetaceae链霉菌属Streptomyces,可以产生阿柔比星等蒽醌类抗肿瘤活性物质[7-8]。华南农业大学天然农药与化学生物学教育部重点实验室分离获得1株加利利链霉菌菌株AF1[9],前期研究发现AF1代谢物具有较好的抗菌活性,对路邓葡萄球菌-2363 Staphylococcus lugdunensis-2363、黄色葡萄球菌Staphylococcus aureus等革兰阳性菌敏感和香蕉枯萎病菌Fusarium oxysporum f. sp. cubense、芒果炭疽病菌Colletotrichum gloeosporioides等植物病原真菌有效,对革兰阳性耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)同样有效,但对革兰阴性菌不敏感,初步的抗菌机理研究发现,AF1代谢物能够杀灭静息革兰阳性菌细胞,与现有抗生素的抑菌作用机理有所不同[10]。前期研究在提高加利利链霉菌AF1发酵效率方面进行了培养基的优化[11]及接种方式的选择,研究过程中发现AF1菌株产生的抗菌活性物质只有部分分泌到胞外,还有部分在胞内积累,胞内抗菌活性物质占总抗菌活性物质的33%。
本文旨在探讨不同种类的表面活性剂对加利利链霉菌AF1发酵效率的影响,优化表面活性剂添加的种类、浓度和时间,减缓或消除胞内产物高浓度时的反馈抑制,从而提高抑菌活性物质的合成及胞外分泌量。
1 材料与方法 1.1 材料加利利链霉菌AF1由华南农业大学天然农药与化学生物学教育部重点实验室分离保存;MRSA购自广东省微生物菌种保藏中心。
高氏一号培养基:可溶性淀粉 20 g,KNO3 1 g,K2HPO4 0.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,水1 000 mL,固体培养基加琼脂 20 g。
LB培养基:胰蛋白胨10 g,酵母提取粉 5 g,NaCl 10 g,水1 000 mL,固体培养基加琼脂 20 g。
非离子型表面活性剂:吐温–80(Tween-80)、曲拉通X–100(Triton X-100)、山梨醇。离子型表面活性剂:十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)。特殊表面活性剂:CaCl2、二甲基亚砜(DMSO)。以上表面活性剂皆为市售分析纯。
1.2 方法1.2.1 培养条件 从高氏一号固体培养基上刮取培养7 d的加利利链霉菌 AF1 的成熟孢子于含有玻璃珠的无菌水中,180 r·min–1摇床震荡30 min后采用血球计数板计算孢子数量,调配孢子悬浮液为5×106 cfu·mL–1,取悬浮液1 mL接种于100 mL的高氏一号培养基中,置于28 ℃ 摇床 220 r·min–1培养8 d。
1.2.2 加利利链霉菌AF1抗菌活性的测定 取发酵液100 mL,6 000 r·min–1离心 15 min取上清液,用乙酸乙酯萃取3次,合并萃取液,减压蒸干后用丙酮定容至1 mL,即待测胞外 (发酵液) 活性物质。
参照文献[12]中的方法,取离心后的菌体加水,经数显高速分散匀质机磨碎细胞,加乙酸乙酯萃取,静置10 min,待菌体碎片沉降至水相底部(萃取3次),收集合并乙酸乙酯相,减压蒸干后用丙酮定容至1 mL,即待测胞内活性物质。
将灭菌后的固体LB培养基加热融化冷却至40~50 ℃,按2%(φ)的接种量,加入活化培养的MRSA菌液,混合均匀后倒入90 mm培养皿中,冷却凝固后,用9 mm打孔器打孔,在测定孔中加入待测溶液50 μL,置于37 ℃条件下培养,24 h后采用十字交叉法测量透明抗菌圈直径,试验重复3次。
1.2.3 表面活性剂对AF1菌株发酵液粗提物抗菌活性的影响 将吐温–80、山梨醇、DMSO、曲拉通X–100、CTAB、SDS、CaCl2等表面活性剂分别加入到液体高氏一号培养基中,使得表面活性剂的质量浓度分别为0、0.5、2.0、4.0、8.0、10.0 g·L–1,灭菌后按照1.2.1的方法接种培养,8 d后测定AF1菌株发酵液的抗菌活性,方法参照文献[13]。
1.2.4 表面活性剂添加时间、浓度的优化 选取的表面活性剂分别于发酵后1、3、5、7 d添加,持续发酵8 d后测定发酵液抗菌活性,试验重复3次。
采用3因素3水平响应面中心组合试验优化表面活性剂的添加质量浓度,方法参照文献[14-15],试验因素及水平见表1。进行响应面模型的验证试验。
|
|
表 1 表面活性剂的响应面中心组合试验 Table 1 Response surface design for surfactant addtion |
1.2.5 表面活性剂对AF1菌株细胞膜通透性的影响 AF1菌株培养5 d后,试验组按1.2.4的优化结果添加相应质量浓度的表面活性剂,继续培养至8 d;以不添加表面活性剂培养8 d的AF1菌株为空白对照(CK)。由于加利利链霉菌AF1在培养后期出现菌体团聚现象,分别取5 mL含菌球的发酵液于研钵中,轻轻研磨菌球团成浆后采用100 μm的细胞过滤器过滤。方法参照文献[16],取2 mL滤液加入2 mmol·L–1的亲脂性阴离子荧光染料双–(1, 3–二巴比妥酸)–三次甲基氧烯洛尔2 μL,28 ℃、180 r·min–1震荡孵育30 min,采用BD-FACSCalibur流式细胞仪检测细胞荧光强度,试验重复3次。
1.3 数据处理利用SPSS分析软件对试验数据进行差异显著性分析。参照文献[17],利用“数据探索检验”检验出试验组和空白对照组(CK)的细胞荧光强度都符合正态分布,即这2个样本可进行独立t检验。
2 结果与分析 2.1 表面活性剂对AF1菌株发酵液粗提物抗菌活性的影响表面活性剂对AF1菌株发酵液粗提物抗菌活性的影响见表2。表2结果表明:不同表面活性剂对AF1菌株发酵液的抗菌活性影响不同;相同表面活性剂在不同浓度下,AF1菌株发酵液的抗菌活性也表现出了一定的差异显著性,随活性剂添加量的增加,平均抑菌圈直径表现出先上升再下降的趋势,不同表面活性剂的初步最适添加浓度对AF1菌株抑菌圈直径的差异显著性分析见表3,确定了不同表面活性剂的初步最适添加浓度和种类。
|
|
表 2 表面活性剂对加利利链霉菌AF1抗MRSA活性的影响1) Table 2 Effect of surfactants on the MRSA bioactivity of Streptomyces galilaeus AF1 |
|
|
表 3 表面活性剂初步最适添加浓度的差异显著性分析1) Table 3 Significance test for differences among surfactants with primary optimal concentrations |
将吐温–80、山梨醇、曲拉通X–100分别按照8、4、2 g·L–1的初步最优添加量,分别于发酵1、3、5、7 d后添加,培养8 d后测定抑菌活性,结果见图1。图1表明,相同浓度的表面活性剂由于添加时间不同,AF1菌株发酵液的抑菌圈直径存在差异,3种表面活性剂的最优添加时间都是在发酵5 d后,AF1菌株发酵液的抑菌圈直径明显高于其他添加时间的抑菌圈直径,这可能因为培养前期添加表面活性剂抑制了菌体的生长,而发酵7 d后时添加,则表面活性剂与AF1菌株接触时间短,使得抗菌活性物质外排不明显,表现为抑菌圈直径小于5 d添加时的抑菌圈直径。
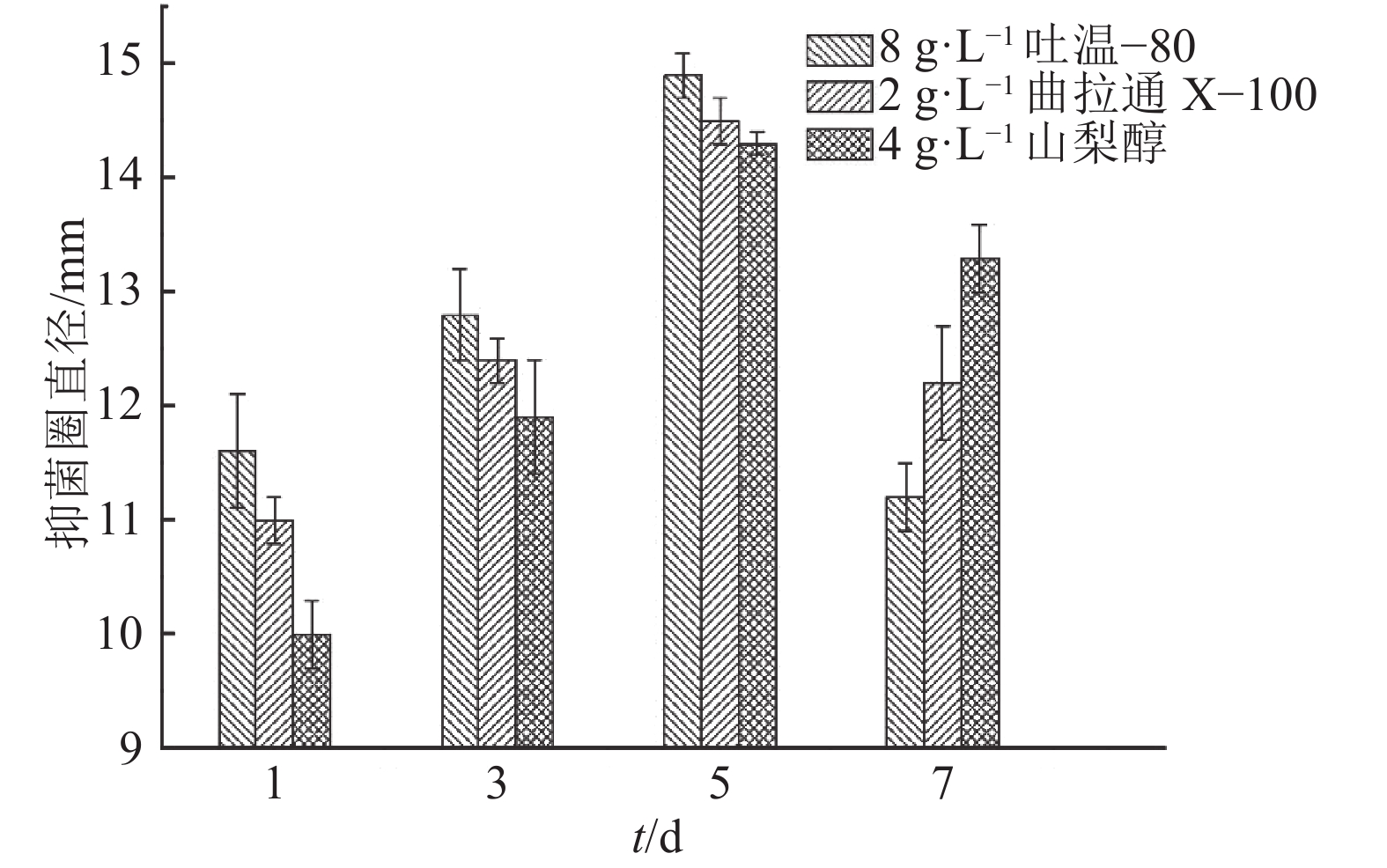
|
图 1 表面活性剂添加时间的确定 Figure 1 Determination of surfactant adding time |
在单因素试验结果的基础上,选取吐温–80、曲拉通X–100、山梨醇分别为自变量X1、X2、X3,以放线菌AF1发酵液抗菌圈直径为响应值(Y)进行响应面分析试验,结果见表4。
根据表4的试验结果,利用Design-Expert进行二次多项式拟合,得到以AF1菌株发酵液抑菌圈直径为响应值(Y)的回归方程:
Y =28.2+1.13X1+0.25X2–0.38X3+1.25X1X2+0.25X2X3–2.60X12–2.85X22–3.10X32。
|
|
表 4 表面活性剂的响应面中心组合试验设计及结果 Table 4 The response surface design and results of surfactant addition |
对回归模型进行方差分析,结果见表5,结果表明该模型极显著(P<0.000 1),具有统计学意义,失拟项不显著(P=0.117 1>0.05),该模型与试验的拟合度良好;该模型的决定系数R2=0.977 7,校正决定系数R2=0.948 9,表明该模型对因变量的解释程度达94.89%,即使用该方程模拟真实的3因素3水平的分析是可行的。由表5可以看出,方程中X1、X1X2、X12、X22、X32对Y值的影响高度显著或极显著,表明试验因素对响应值(Y)不是简单的线性关系,不仅二次项对响应值有很大的影响,表现出极显著性,而且二次项系数为负,说明该方程有极大值,优化后的添加结果:吐温–80为8.95 g·L–1、曲拉通X–100为2.09 g·L–1、山梨醇为3.89 g·L–1,理论抑菌圈直径为28.35 mm。
图2、图3、图4分别代表2个独立变量间的相互作用,其余变量保持在中心水平的响应面3D直观图及等高线图。
|
|
表 5 响应面中心组合试验的方差分析1) Table 5 Analysis of variance in the response surface of surfactant addition |
图2结果表明:保持山梨醇添加浓度不变的情况下,在一定范围内,提高吐温–80和曲拉通X–100的添加浓度,AF1菌株发酵液抑菌圈直径不断增大,到达最高点后又逐渐开始下降,呈现出低浓度促进,高浓度抑制的效果,这是因为低浓度的表面活性剂可提高细胞膜通透性,而高浓度的表面活性剂则会破坏细胞结构,甚至导致菌体破裂死亡。
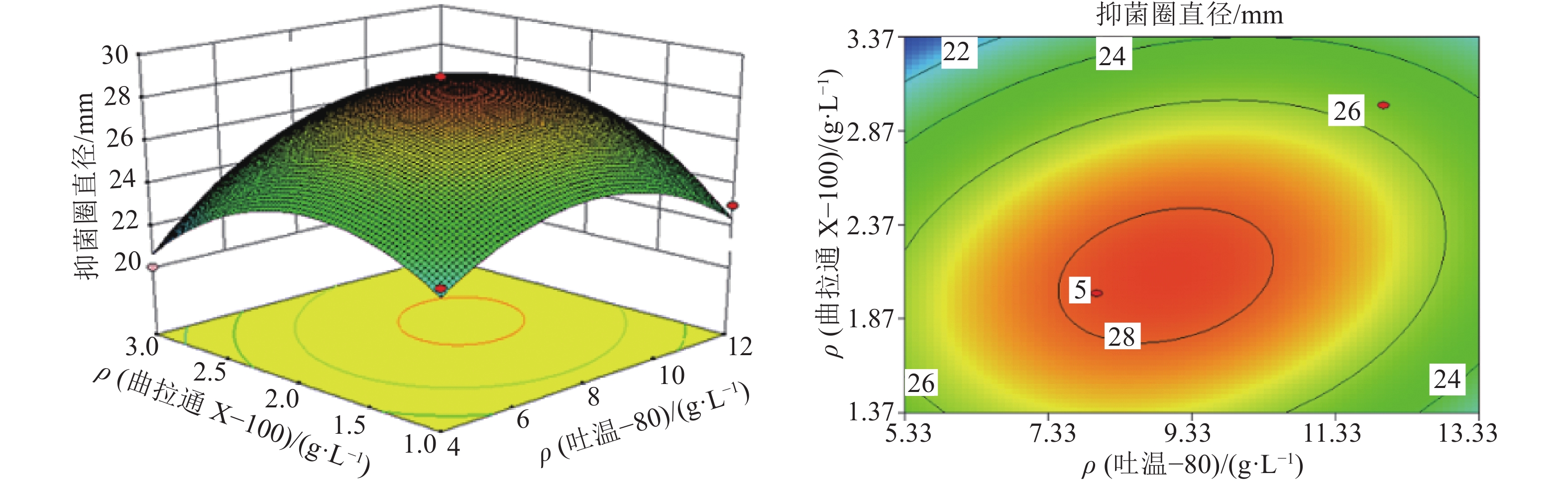
|
图 2 吐温–80与曲拉通X–100的添加质量浓度对加利利链霉菌AF1抗菌活性的交互影响 Figure 2 The interactive effects of adding concentrations of Tween-80 and Triton X-100 on antibacterial bioactivity of Streptomyces galilaeus AF1 |
图3结果表明:保持曲拉通X–100添加浓度不变的情况下,在一定范围内,提高吐温–80和山梨醇的添加浓度,AF1菌株发酵液抑菌圈直径不断增大,到达极值点后又开始逐渐下降,这是因为表面活性剂可以增加细胞膜通透性,但是浓度太高则会导致细胞膜破裂甚至死亡,所以表面活性剂对细胞生长代谢的促进具有最适浓度。
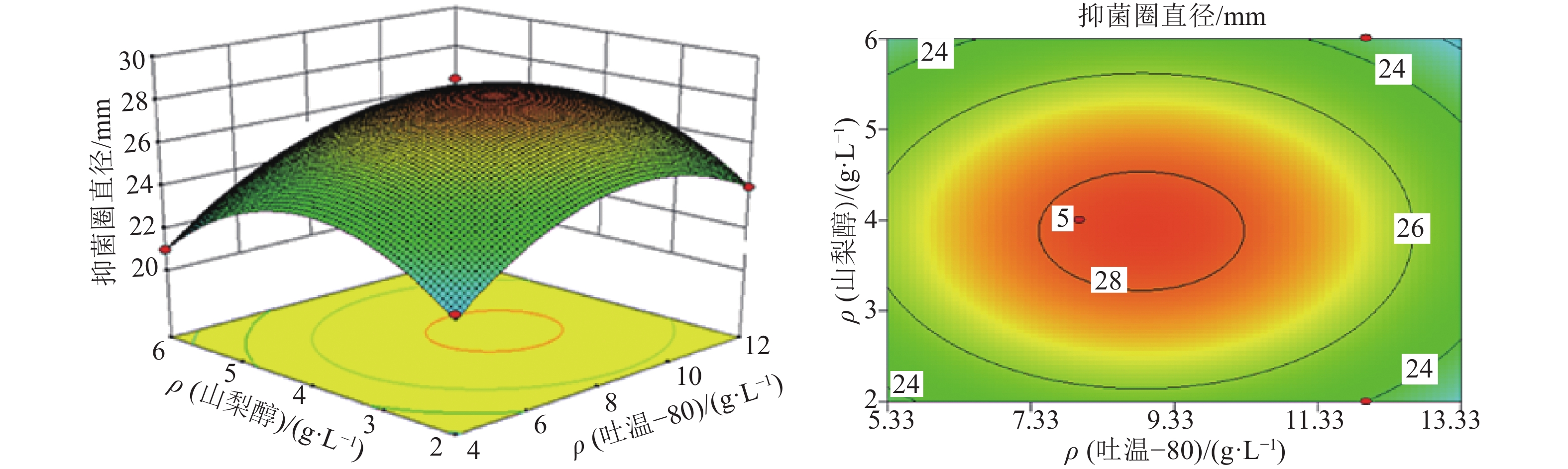
|
图 3 吐温–80与山梨醇的添加质量浓度对加利利链霉菌AF1发酵液抗菌活性的交互影响 Figure 3 The interactive effects of adding concentrations of Tween-80 and sorbitol on antibacterial bioactivity of Streptomyces galilaeus AF1 |
图4结果表明:保持吐温–80添加浓度不变的情况下,在一定范围内,提高曲拉通X–100和山梨醇的添加浓度,AF1菌株发酵液抑菌圈直径不断增大,到达极值点后又开始逐渐下降,这是因为低浓度的表面活性剂对AF1菌株细胞膜通透性的提高效果不明显,抑菌物质外排有限,导致高浓度的反馈抑制,影响AF1菌株抗菌物质的合成。高浓度的表面活性剂导致细胞膜变形甚至破裂,进而影响AF1菌株发酵合成抗菌活性物质。
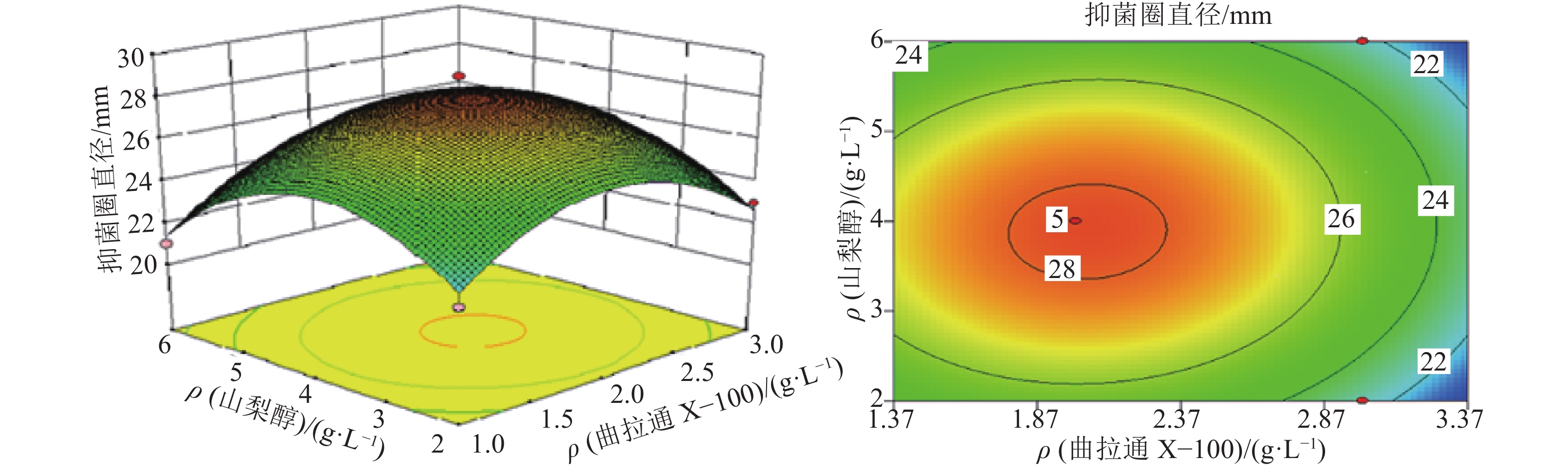
|
图 4 曲拉通X–100与山梨醇的添加质量浓度对加利利链霉菌AF1发酵液抗菌活性的交互影响 Figure 4 The interactive effects of adding concentrations of Triton X-100 and sorbitol on the antibacterial bioactivity of Streptomyces galilaeus AF1 |
为了验证响应面模型的可行性,采用最佳的表面活性剂添加质量浓度进行摇瓶试验。培养加利利链霉菌AF1菌株5 d时添加吐温–80、曲拉通X–100和山梨醇,使其质量浓度分别为8.95、2.09和3.89 g·L–1,发酵8 d后测定AF1发酵液的抑菌圈直径,设置3组平行试验,试验测得抑菌圈平均直径为27.67 mm,比理论值小2.4%。说明可以使用该响应面模型对加利利链霉菌AF1发酵液抗菌活性进行优化。
2.4 表面活性剂对细胞膜通透性的影响采用BD-FACSCalibur流式细胞仪测定AF1菌株的细胞荧光强度,对试验组和空白对照组(CK)的细胞荧光强度利用SPSS分析软件进行独立t检验,结果见表6和表7。
从表7可以看出,2组方差不显著,所以应选择“假设方差相等”行的数据作为分析结果。t值为–14.59,Sig. 双侧t检验的显著性概率为0,小于0.05,故2组数据差异显著,即试验组的细胞荧光强度显著高于空白对照组的细胞荧光强度。由于荧光染料本身是1种没有荧光的阴离子亲脂性染料,只有进入到细胞内部,与胞浆内的蛋白质结合才会发出荧光[18],因此试验组的细胞膜通透性显著高于空白对照组,说明添加表面活性剂可以显著提高加利利链霉菌AF1的细胞膜通透性,有利于活性物质的外排,降低抑菌活性物质的胞内反馈机制,提高了放线菌AF1抑菌活性物质的生物合成量,为加利利链霉菌AF1活性物质的生产及分离纯化奠定了基础。
|
|
表 6 细胞荧光强度的组统计量 Table 6 Group statistics of cell fluorescence intensity |
|
|
表 7 细胞荧光强度的独立样本检验 Table 7 Independent sample test of cell fluorescence intensity |
Huchenq等[19]研究发现表面活性剂可以抑制细胞膜中脂肪酸的合成,进而改变细胞膜的构造及通透性,使得微生物次级代谢产物更容易渗透到胞外,减缓或消除胞内的高浓度抑制效果,同时也更利于营养物质的传递,从而提高次级代谢产物的合成量。Reddy等[20]发现表面活性剂曲拉通X–100对耐热梭状芽孢杆菌Clostridium thermosulfurogenes SV2菌体的生长具有一定的抑制作用,但是可显著提高其耐热性β–淀粉酶和支链淀粉酶的产量。Ebune等[21]在研究曲霉Aspergillus ficuum发酵产生植酸酶的过程中发现添加吐温–80可以提高曲霉发酵产植酸酶的效率,而加入曲拉通X–100则不利于植酸酶的产生,罗玮[22]研究重组大肠埃希菌Escherichia coli生产L–色氨酸时发现在发酵前期添加吐温–60能够促进L–色氨酸的过量合成,原因为吐温–60和细胞接触时间较长,充分影响细胞膜通透性及代谢流分布。本研究也得到了类似的结果,添加表面活性剂影响了加利利链霉菌AF1的生长和代谢产物的合成,同属非离子型的表面活性剂也因其结构、性质和浓度的不同而影响加利利链霉菌AF1的发酵代谢,其中浓度效应表现出高浓度抑制、低浓度促进的现象,添加时间的不同也对加利利链霉菌AF1的发酵产生影响。根据单因素试验结果得知吐温–80、曲拉通X–100和山梨醇对加利利链霉菌AF1发酵效率的提高最为显著,响应面试验优化表明在发酵5 d后,添加8.95 g·L–1吐温–80、2.09 g·L–1曲拉通X–100、3.89 g·L–1山梨醇,持续发酵至8 d后,发酵液抑菌圈直径为27.67 mm,比优化前效果提高了25.45%。
| [1] |
胡志强. 表面活性剂胶束溶液中萃取发酵红曲色素的研究[D]. 广州: 华南理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1013319354.htm
(  0) 0) |
| [2] |
吕哲喆, 刘晓侠, 孙诗清, 等. 表面活性剂对天然红色素发酵的影响[J]. 药物生物技术, 2012(4): 324-327. (  0) 0) |
| [3] |
吴敏, 杨天锦, 苗茂栋, 等. 改善细胞通透性促进1,3–丙二醇生物合成[J]. 化学学报, 2009, 67(18): 2133-2138. DOI:10.3321/j.issn:0567-7351.2009.18.013 (  0) 0) |
| [4] |
冮洁, 杜连祥, 路福平, 等. 培养条件对里氏木霉306菌体形态和t-PA生物合成的影响[J]. 工业微生物, 2005, 35(4): 9-14. (  0) 0) |
| [5] |
朱艳, 袁其朋, 王航. 添加氧载体及表面活性剂对番茄红素发酵的影响[J]. 微生物学通报, 2006(1): 90-93. (  0) 0) |
| [6] |
黄文军. 不同搅拌桨及表面活性剂对黄原胶和聚γ-谷氨酸发酵的影响[D]. 武汉: 华中农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10504-1010011038.htm
(  0) 0) |
| [7] |
OKI T, YOSHIMOTO A, MATSUZAWA Y, et al. Biosynthesis of anthracycline antibiotics by Streptomyces galilaeus
[J]. J Antibiot, 1980, 33(11): 1331-1340. DOI:10.7164/antibiotics.33.1331 (  0) 0) |
| [8] |
RÄTY K, KUNNARI T, HAKALA J, et al. A gene cluster from Streptomyces galilaeus involved in glycosylation of aclarubicin
[J]. Mol Genet Genomics, 2000, 264(1): 164-172. (  0) 0) |
| [9] |
杨静, 易麟乙, 刘美, 等. 1株抗耐甲氧西林金黄色葡萄球菌放线菌的鉴定及其代谢产物活性分析[J]. 西北农林科技大学学报(自然科学版), 2014, 42(8): 8-14. (  0) 0) |
| [10] |
杨静, 廖美德. 放线菌AF1发酵液提取物对病原微生物的抑菌作用和稳定性分析[J]. 世界农药, 2014(4): 53-57. (  0) 0) |
| [11] |
杨静, 廖美德. 培养基组成成分对加利利链霉菌AF1发酵过程影响的初步探索[J]. 世界农药, 2014(5): 52-56. (  0) 0) |
| [12] |
张睿钦. 雨生红球藻细胞转化及虾青素的提取[D].青岛: 中国海洋大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012505680.htm
(  0) 0) |
| [13] |
李德才. 活跃链霉菌产那西肽发酵过程优化控制[D].芜湖: 安徽工程大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10363-1015443371.htm
(  0) 0) |
| [14] |
胡成旭, 侯欣彤, 冯永宁, 等. 响应面法优化云芝多糖提取条件的研究[J]. 食品工业科技, 2007(7): 124-126. (  0) 0) |
| [15] |
方志锋. 表面活性剂对花生壳水解特性的影响和机制研究[D]. 郑州: 河南工业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10463-1015552213.htm
(  0) 0) |
| [16] |
郭姗姗. 病毒吸附对宿主细胞膜的影响及中药的干预作用[D]. 北京: 中国中医科学院, 2006. http://cdmd.cnki.com.cn/Article/CDMD-84502-2006086178.htm
(  0) 0) |
| [17] |
赵东明, 张作海. 高职不同生源在同一教学环境下学习效果的独立T检验分析
[J]. 价值工程, 2010(13): 134. DOI:10.3969/j.issn.1006-4311.2010.13.091 (  0) 0) |
| [18] |
王远辉. 艾纳香叶中左旋龙脑与精油的制备及其抗氧化与抗菌活性研究[D]. 无锡: 江南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10295-1014148985.htm
(  0) 0) |
| [19] |
HUCHENQ A, MARQUET M, WELBY M, et al. Glutamate excretion triggering mechanism: A reinvestigation of the surfactant-induced modification of cell lipids[J]. Annales De Linstitut Pasteur Microbiologie, 1984, 135(1): 53-67. DOI:10.1016/S0769-2609(84)80043-5 (  0) 0) |
| [20] |
REDDY R M, REDDY P. Enhanced production of thermostable β-amylase and pullulanase in the presence of surfactants by Clostridium thermosulfurogenes SV2
[J]. Process Biochem, 1999, 34(1): 87-92. DOI:10.1016/S0032-9592(98)00073-9 (  0) 0) |
| [21] |
EBUNE A, AL-ASHEH S, DUVNJAK Z. Effects of phosphate, surfactants and glucose on phytase production and hydrolysis of phytic acid in canola meal by Aspergillus ficuum during solid-state fermentation
[J]. Bioresource Technol, 1995, 54(3): 241-247. DOI:10.1016/0960-8524(95)00133-6 (  0) 0) |
| [22] |
罗玮. 重组大肠杆菌高效生产嘌呤核苷磷酸化酶和L-色氨酸的研究[D]. 杭州: 浙江大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10335-1011246864.htm
(  0) 0) |
 2017, Vol. 38
2017, Vol. 38


