1986年余增亮等[1]发现重离子注入的生物学效应,并成功将重离子注入到水稻Oryza sativa L.中。此后,重离子辐照作为创制新种质和发掘有利突变的有力工具,广泛应用于作物育种和模式植物功能基因的研究[2]。生物体内某些对辐射较敏感部位(即辐射敏感靶)受到重离子的撞击而离子化,引起DNA链断裂,在修复时可能造成交换、倒置、异位等现象,从而引起突变[3]。已有的研究表明,重离子辐射能诱导植物表型[4]、基因组及其表达[5]、转录组[6]、蛋白质组[7]和信号传导途径[8]等发生变异。
水稻叶片是光合作用的直接器官,叶片的颜色、形状和大小对株型起决定作用,通过影响水稻的光合效率而影响产量和品质[9]。研究水稻叶片发生变异的突变体、揭示其生物学效应和产生变异的分子机制,已成为研究控制水稻叶片相关性状基因的主要方法之一。本试验围绕水稻重离子诱变产生的叶片性状发生变异的2个突变体(m2和m3)展开研究,以野生型为对照,分析了m2和m3植株早、晚2季的农艺性状,以及2个突变体的遗传特性,旨在为相关基因的定位及克隆奠定基础,为水稻育种提供潜在的种质资源。
1 材料与方法 1.1 材料本研究所用的4个水稻材料分别为籼稻种质BBS(野生型,Wild type)﹑粳稻种质02428、以及突变体m2和m3。突变体m2﹑m3均来自BBS的重离子诱变后代,辐射处理于2013年2月在兰州近代物理研究所用重离子加速器(HIRFL)对BBS干种子进行辐照(辐照剂量:100 Gy,剂量率:60 Gy·min–1)。以突变体m2和m3作母本分别与粳稻种质02428杂交获得F1代,再自交得到的F2群体,用作遗传分析。
1.2 田间种植及管理水稻干种子先用自来水浸种24 h,室温下催芽24 h,露白后在事先准备好的大田播种育秧,早季秧龄31 d、晚季秧龄18 d。4个水稻材料均按6×6的小区规格种植,F2群体采用双垄种植(每行种植125株),行、株距均为20 cm,单株栽植。早季于2016年3月5日播种、4月6日移植;晚季于2016年7月23日播种、8月10日移植。早、晚季均种植于华南农业大学校内教学科研试验基地,常规栽培管理。
1.3 生物学效应分析针对m2的窄叶突变特性,2016年早季着重对m2的株高、主穗质量、主穗实粒数、主穗总粒数及主穗结实率、剑叶至倒3叶的部分性状(长、宽、叶夹角、卷曲度)进行调查,按照张克勤等[10]的方法测定叶夹角和卷曲度(Leaf rolling index,LRI),于齐穗期随机选取中间5个单株的主茎叶片进行测量,量取叶尖与叶耳连线和叶着生茎秆的夹角,即为叶夹角;开花后20 d分别测定主茎着生叶片最宽处自然卷曲(指内卷)后叶缘间距离(L),然后把叶片展开,测量其宽度(D),按如下公式计算LRI,每一个叶位5次重复。
| ${\rm{LRI}} = \left( {L - D} \right)/D \times 100\text{%}\,\text{。}$ |
针对m3的叶片枯萎特性,于2016年早、晚季重点观察其叶片枯萎情况。同时,2016年早季对m3的株高、主穗质量、主穗实粒数、主穗总粒数、主穗结实率、千粒质量和剑叶长宽等进行调查。
对照均为野生型BBS,采用SPSS19.0软件对数据进行统计分析。
1.4 遗传分析2016年早晚季于华南农业大学校内教学科研试验基地分别种植02428(父本)、m2、m3以及F1代和F2代群体,F1代观察各个个体的表型性状,F2代调查突变表型和正常表型的单株数,统计分离比,用SPSS19.0进行正态分析和卡平方检验。
2 结果与分析 2.1 突变体的表型鉴定与农艺学参数与野生型BBS相比,m2剑叶极显著变窄,剑叶、倒2叶、倒3叶宽度分别是野生型的60.09%、58.18%、40.85%,株高下降了15.83%(表1)。此外,m2植株倒3叶叶片明显内卷,卷曲度比野生型BBS分别增加了12.09%、30.80%和24.62%;m2植株倒2叶和倒3叶与茎秆的叶夹角均增加,差异达极显著或显著水平(表2)。观察发现,m2表现出高度不育。m2和野生型BBS各生育期的植株表型如图1所示。
|
|
表 1 野生型BBS以及突变体m2和m3 的农艺性状1) Table 1 Agronomic traits of wild type BBS, m2 and m3 |
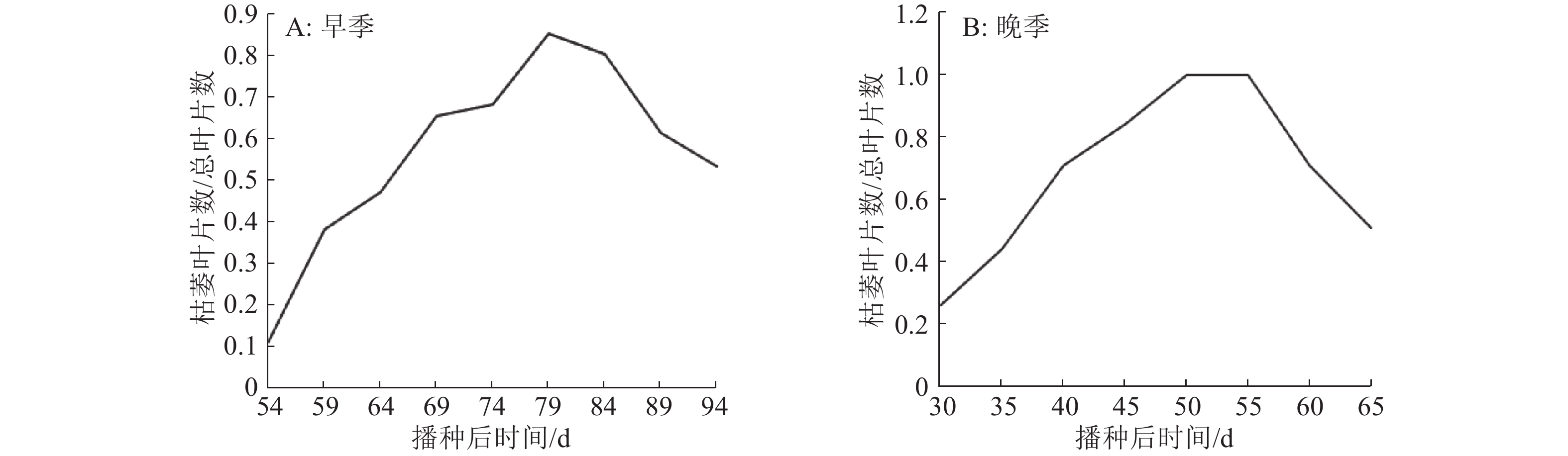
2016年早季,m3在播种后第45天,主茎第9片叶从叶尖开始枯萎。之后,主茎和其他分蘖上新抽出的叶片随着生长的进程,表现出叶枯症状。播种后第62天,心叶未完全展开就已经完全枯黄,且之前表现正常的叶片也开始逐渐枯萎(图2)。在孕穗期(播种后第79天)枯萎叶片数量占总叶数的比例达到最大,此时m3仍然有正常叶存在(图3A)。播种后第82天,主茎和其他分蘖上新长出的叶片均呈正常表型,直至黄熟。2016年晚季,m3在播种后第30天开始出现叶尖枯萎现象。播种后第35天,心叶未完全展开就已枯黄(图2B、2F),播种后第50天枯萎叶数占总叶数的比例达到最大,此时m3整株叶片都表现为枯萎症状(图3B),分蘖后期(播种后第55天),m3新抽出叶片和分蘖恢复正常(图2C、2D)。除叶枯表型始现、突变叶片占比达到最大和突变表型开始恢复的时间以及叶枯表型的严重程度不一样外,2016年早、晚2季m3叶枯表型的变化趋势基本一致。此外,m3主穗总粒数、主穗质量较野生型分别下降了45.39%和47.71%,差异均达极显著水平(表1)。
|
|
表 2 野生型BBS和突变体m2叶片的卷曲度及叶夹角1) Table 2 Leaf rolling indexes and leaf angles of m2 and wild type BBS |

|
图 1 野生型BBS与m2各生育期表型 Figure 1 Phenotypes of wild type BBS and m2 at different stages A:幼苗期;B:分蘖盛期;C:成熟期 |

|
图 2 野生型BBS与m3各生育期表型 Figure 2 Phenotypes of wild type BBS and m3 at different stages A:幼苗期;B:分蘖前期;C:分蘖盛期;D:成熟期;E:分蘖期叶片(1、2、3分别为m3抽出1、2、3 d的叶片);F:m3分蘖期的心叶;G:m3抽出1 d的叶片展开照片 |
|
图 3 2016年早、晚季m3枯萎叶数随时间的变化 Figure 3 The changes of the necrotic leaf numbers of m3 with time in early and late seasons in 2016 |
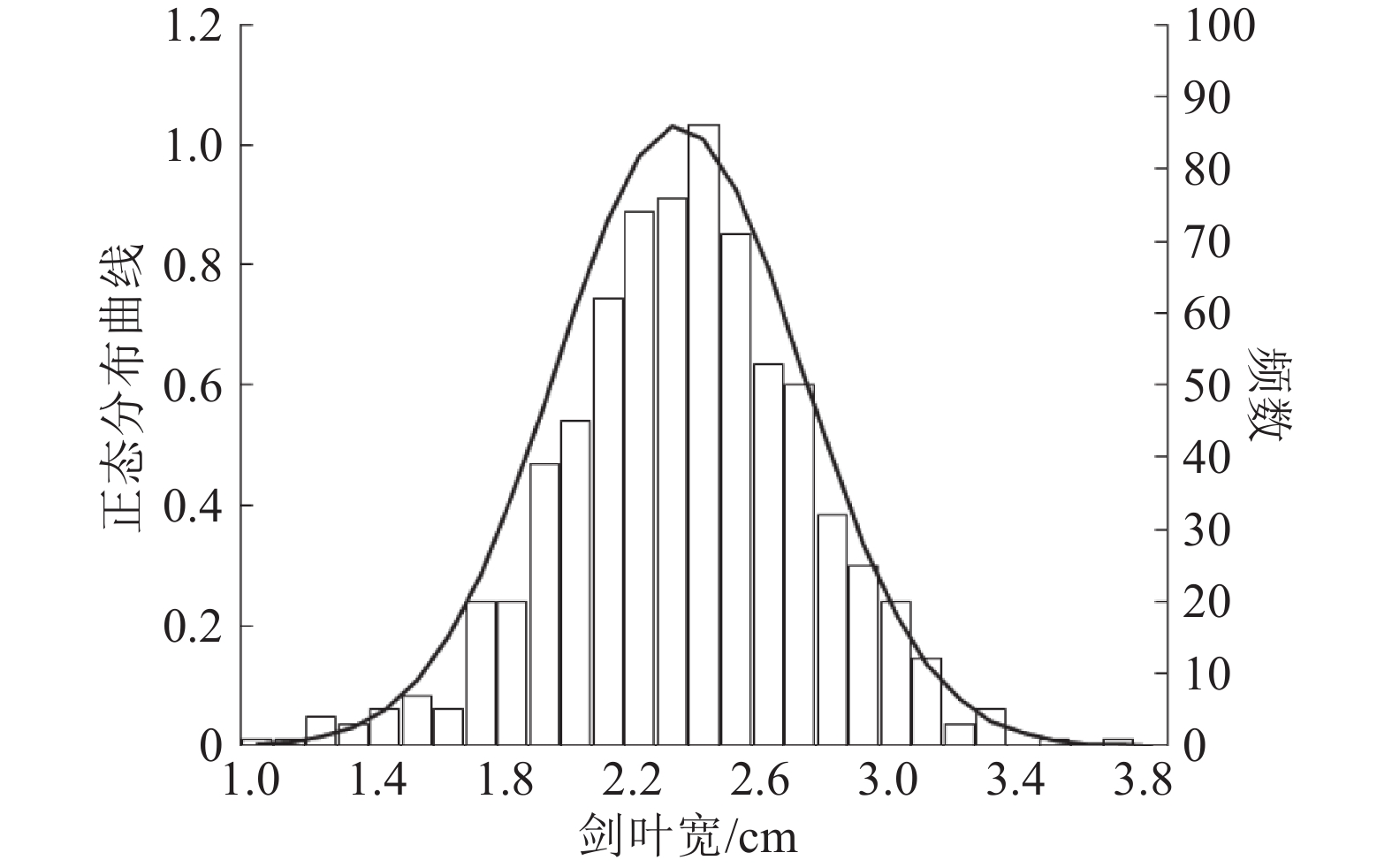
2016年早季重点观察了F1代植株,发现m2/02428的F1代植株叶宽介于两亲本之间;m3/02428的F1代植株从苗期至成熟期均未出现叶片枯萎现象,株型介于两亲本之间。上述结果说明m2和m3的突变表型均由隐性基因控制。2016年晚季对02428/m2的F2群体721个单株的剑叶宽展开调查,经分析发现剑叶宽分布范围为1.0~3.8 cm,不同剑叶宽的频率分布图为连续的柱状图形(图4),且服从正态分布(P=0.096 2>0.05),说明m2的剑叶宽变异表型受多基因控制。
来源于m3/02428的F2群体共777株,其中,正常植株598株、叶枯表型植株179株,经卡平方检验,正常个体与叶枯个体的分离比符合3∶1分离比,χ2=0.205 9<χ2(0.05,1)=3.840,说明m3的叶片枯萎表型受1对隐性核基因控制。
|
图 4 m2/02428的F2群体剑叶宽的分布频数 Figure 4 The frequency distribution of flag leaf width in the F2 generation of m2 and 02428 cross |
重离子诱变具有变异率高、变异谱宽、变异快、稳定周期短和简便易行等优点[11]。由于重离子电离峰(Bragg峰)更尖锐,使得重离子与生物体相互作用区域更集中,集中受损的区域可随离子能级的大小而改变[12]。低剂量(10~40 Gy)的重离子辐照处理水稻种子,对于株高、根长和幼苗鲜质量有促进作用,而对发芽率和叶片数量没有显著影响。中能重离子辐射对发芽率和存活率影响显著,对幼苗株高无显著影响[4]。在诱变频率方面,Xu等[13]研究发现低能辐射组60 000个M2代水稻植株中,有2 823个可观察到形态学突变,突变率为4.71%;中能组有3 132个呈现形态学突变,突变率为5.22%。本研究中,从2 500个中能(100 Gy)重离子诱变M2代植株中筛选到2个可稳定遗传的叶片发生变异的突变体(m2和m3),获得目标突变体的频率为0.08%。重离子辐射诱变育种前景广阔,已有的文献表明,重离子辐照育种在组织培养、转基因操作、分子标记辅助育种和航天诱变育种等方面均有应用,必将极大丰富种质资源[14]。随着分子生物学的发展,可以直接从分子水平上对突变体进行鉴定[15]。在今后的研究中,重离子诱变配合高通量测序筛选技术将成为水稻性状改良和作物遗传育种的有效方法之一。
3.2 m2在水稻品种改良及遗传育种中的应用潜力迄今为止,对水稻株型的概念仍有争议。总的来说,株型的根本是株叶形态[16]。袁隆平[17]认为理想水稻株型的株高100 cm左右,上3叶修长,倒3叶50 cm左右,倒2叶比剑叶长10%以上并高过穗尖,倒3叶叶尖达到穗中部。m2突变体株高96.34 cm,除剑叶(35.66 cm)外,倒2、倒3叶的长度均在50 cm左右。水稻叶片挺直可以减少叶片之间的遮光,从而改善水稻群体的光合效率,提高产量[18] 。m2突变体叶片内卷,使其从苗期至成熟期,叶片都能保持挺直,在作物品种改良和遗传育种应用中具有很大的可塑性。未来超级杂交水稻育种将基于籼粳杂交,通过精准分子设计与全基因组分子标记辅助选择技术选育新品种[19]。因此,通过籼粳杂交将优良的叶形相关基因和高产优质基因组合到一起,培育具有籼粳杂种优势和理想株型的优良品种,是未来水稻株型育种的一个方向[20]。本试验中m2的育性降低,但从m2与02428杂交的F2代群体中选择得到了1批株型与m2极其相似且育性正常的单株(文中未列出),通过多代自交有望得到株型大幅改善的育种材料。
3.3 水稻叶片早衰突变体水稻叶片提前枯萎是叶片早衰最明显的形态特征[20]。已报道的水稻叶片早衰突变体有30多个,这些突变体主要是通过EMS、60Co辐射、T-DNA插入、空间诱变和自然变异获得。叶片早衰突变以隐性突变为主,除OsSAP[21]为线粒体基因外,其他突变基因均为细胞核基因。控制水稻叶片早衰表型的基因广泛分布在水稻的12条染色体上,在第3、4、11染色体上分布较多,目前已有少部分控制叶衰表型的基因得到了克隆验证。
叶片一旦早衰,将极大影响水稻的生长发育,进而影响产量和品质。综观目前已报道的水稻叶片早衰突变体,鲜见与m3表型相同的突变体,因此,控制m3突变表型的基因很可能是一个新基因,对其进行研究有利于加深我们对水稻叶片衰老遗传机理的理解,为水稻抗衰老育种提供新的基因资源。m3植株的叶片苗期正常,之后叶片枯萎,持续一段时间后新抽的叶片又恢复正常。推测可能存在一种机制能够弥补m3突变表型带来的损伤,对m3展开进一步的研究很有可能发现新的控制水稻叶片衰老的分子机制。
| [1] |
余增亮, 何建军, 邓建国, 等. 离子注入水稻诱变育种机理初探[J]. 安徽农业科学, 1989(1): 12-16. (  0) 0) |
| [2] |
HIRANO T, KAZAMA Y, ISHII K, et al. Comprehensive identification of mutations induced by heavy-ion beam irradiation in Arabidopsis thaliana
[J]. Plant J, 2015, 82(1): 93-104. (  0) 0) |
| [3] |
韦祖生, 李开绵. 作物诱变育种及突变体鉴定与筛选研究进展[J]. 江西农业学报, 2007, 19(10): 38-41. (  0) 0) |
| [4] |
LING A P K, UNG Y C, HUSSEIN S, et al. Morphological and biochemical responses of Oryza sativa L. (cultivar MR219) to ion beam irradiation
[J]. JZUSB, 2013, 14(12): 1132-1143. (  0) 0) |
| [5] |
RAKWAL R, KIMURA S, SHIBATO J, et al. Growth retardation and death of rice plants irradiated with carbon ion beams is preceded by very early dose- and time-dependent gene expression changes[J]. Mol Cells, 2008, 25(2): 272-278. (  0) 0) |
| [6] |
HWANG J E, HWANG S, KIM S, et al. Transcriptome profiling in response to different types of ionizing radiation and identification of multiple radio marker genes in rice[J]. Physiol Plant, 2014, 150(4): 604-619. (  0) 0) |
| [7] |
WANG W, GU D P, ZHENG Q, et al. Leaf proteomic analysis of three rice heritable mutants after seed space flight[J]. Adv Space Res, 2008, 42(6): 1066-1071. (  0) 0) |
| [8] |
KIM S, SONG M, LEE K J, et al. Genome-wide transcriptome profiling of ROS scavenging and signal transduction pathways in rice (Oryza sativa L.) in response to different types of ionizing radiation
[J]. Mol Biol Rep, 2012, 39(12): 11231-11248. (  0) 0) |
| [9] |
冯章丽. 水稻叶色突变体基因定位研究进展[J]. 黑龙江农业科学, 2014(9): 135-139. (  0) 0) |
| [10] |
张克勤, 戴伟民, 樊叶杨, 等. 水稻剑叶角度与主穗产量的遗传剖析[J]. 中国农学通报, 2008, 24(9): 186-192. (  0) 0) |
| [11] |
颉红梅, 卫增泉, 郝冀方, 等. 重离子束辐照育种概述[C]//西部地区第二届植物科学与开发学术讨论会论文摘要集, 乌鲁木齐: 中国植物学会, 2001: 119.
(  0) 0) |
| [12] |
ISHII K, KAZAMA Y, MORITA R, et al. Linear energy transfer-dependent change in rice gene expression profile after heavy-ion beam irradiation[J]. PLoS One, 2016, 11(7): 1-11. (  0) 0) |
| [13] |
XU X, LIU B M, ZHANG L L, et al. Mutagenic effects of heavy ion irradiation on rice seeds[J]. Nucl Instrum Methods Phys Res B, 2012, 290(1): 19-25. (  0) 0) |
| [14] |
李文建, 周利斌, 陈积红, 等. 重离子诱变育种及其应用[C]//第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会会议论文摘要集, 兰州: 中国微生物学会, 2011.
(  0) 0) |
| [15] |
SHI J, LU W, SUN Y. Comparison of space flight and heavy ion radiation induced genomic/epigenomic mutations in rice (Oryza sativa)
[J]. Life Sci Space Res, 2014, 1(1): 74-79. (  0) 0) |
| [16] |
王昆, 罗琼, 蔡庆红, 等. 水稻株型的研究进展[J]. 湖南农业科学, 2013(17): 1-4. (  0) 0) |
| [17] |
袁隆平. 杂交水稻超高产育种[J]. 杂交水稻, 1997, 12(6): 1-6. (  0) 0) |
| [18] |
XIANG J J, ZHANG G H, QIAN Q, et al. SEMI-ROLLED LEAF1 encodes a putative glycosylphosphatidylinositol: Anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells
[J]. Plant Physiol, 2012, 159(4): 1488-1500. (  0) 0) |
| [19] |
张宝来. 水稻叶片衰老的研究进展[J]. 天津农业科学, 2013, 19(4): 19-24. (  0) 0) |
| [20] |
郑庆伟. 中国农科院等提出高产优质超级杂交水稻设计育种新模型[J]. 农药市场信息, 2016(7): 48. (  0) 0) |
| [21] |
UBAIDILLAH M, KIM K, KIM Y H, et al. Identification of a drought-induced rice gene, OsSAP, that suppresses bax-induced cell death in yeast
[J]. Mol Biol Rep, 2013, 40(11): 6113-6121. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


