甜玉米Zea mays L. saccharata Sturt.是玉米胚乳淀粉合成基因发生隐性突变形成的特殊玉米类型,我国从20世纪80年代开始引进并有计划有规模地进行甜玉米育种与生产[1]。近年来,我国的甜玉米种植面积迅速扩大,据统计至2012年全国种植面积约有32.3万hm2,成为广东、广西、浙江和云南等南方地区的重要优势作物,面积和产量均居世界第2[2],近年来种植面积仍不断攀升。种子活力(Seed vigor)是种子质量的重要指标,一般种子达到生理成熟时,其活力也达到了最高点,随后便开始了不同程度的活力下降,直至丧失或死亡,这种伴随着贮藏时间的增加发生、发展的自然不可逆过程,叫种子老化[3]。已有一些有关甜玉米种子活力的相关报道,樊龙江等[4]对甜玉米种子活力低下的因素进行了分析,认为种子引发和包衣等技术有利于提高甜玉米种子活力。徐秀兰等[5]研究认为甜玉米种子携带的真菌与活力关系密切。王青峰等[6]发现超甜玉米种子活力的广义遗传力和狭义遗传力均较高,13个自交系亲本的广义遗传力值均达到极显著水平。Styer等[7]对4种类型的玉米(brittle-1、shrunken-2、sugar和normal)种子活力进行了差异分析,发现sh2型种子活力最低,在逆境条件下发芽表现最差。欧阳西荣等[8]发现老化种子对玉米幼苗生长和植株发育均有影响,老化种子植株比高活力种子植株产量低。我国种植的甜玉米类型大多是sh2sh2基因型,成熟种子淀粉含量少、制种产量低、不易贮藏、价格高,随着甜玉米种植面积日益扩大,而农村劳力减少,因此提高种子活力,简化栽培措施十分必要。本研究以2个甜玉米品种为材料,采用人工加速老化法分析老化处理对甜玉米种子生理特性的影响,为甜玉米种子贮存及大田生产提供参考。
1 材料与方法 1.1 试验材料供试甜玉米品种为‘农甜88’和‘农甜99’,由华南农业大学玉米实验室提供的当年制种的新杂交种子。
1.2 试验方法 1.2.1 人工老化处理将每个品种种子取3 000粒置于纱网袋,薄层平铺放于老化箱中网架上,以41 ℃、相对湿度90%的条件进行人工加速老化处理,老化处理时间分别为0(对照)、1、2、3、4、5、6 d,共7个处理。老化结束后,将种子取出风干至原质量。
1.2.2 发芽试验将过2 mm孔径筛的河沙用清水冲洗后130 ℃烘干5 h,然后按照标准发芽方法进行发芽试验,于光照培养箱中25 ℃、全天光照条件下沙培发芽,将种子播于4 cm深的沙床发芽盒,盖沙2 cm,4 d后统计发芽势、发芽率、发芽指数和活力指数[9]。
1.2.3 生理指标测定称取老化处理0、2、4和6 d的2个甜玉米品种种子各10 g测定其电导率。称取的老化后种子用自来水冲洗3次,滤纸吸干后放入15 mL的刻度试管中加双蒸水10 mL,加塞后静置于25 ℃恒温培养箱。在室温条件下用电导仪测定浸泡4、8、12和24 h的种子浸出液电导率,测完后放入沸水中煮沸10 min,冷却至室温测定绝对电导率,按下式计算相对电导率(REC):
| ${\rm {REC}} = \frac{\text{煮沸前浸出液电导率} }{\text{绝对电导率}} \times 100\text{%}\;\text{。}$ |
参照胡晋[10]TTC改进法测定脱氢酶(Dehydrogenase,DHA)活性,用愈创木酚法测定过氧化物酶(Peroxidase,POD)活性[11],以1 min内D470 nm变化0.01作为1个酶活性单位(U)。剥取萌发1 d的的玉米种子胚(不同老化处理时间均10粒),采用硫代巴比妥酸法测定丙二醛(Malondialdehyde,MDA)含量[11]。
1.2.4 SRAP标记多样性分析DNA的提取采用CTAB法。按照Li等[12]提出的经典引物,由上海生工合成,引物组合见表1。PCR体系和PCR反应条件参照文献[13]。PCR产物用体积分数为6%变性的聚丙烯酰胺凝胶电泳,银染显色,以1和0记录带的有和无。
|
|
表 1 多样性分析采用的SRAP引物名称及序列 Table 1 The SRAP primers and sequences for genetic diversity analyses |
采用Microsoft Excel和SAS 9.2软件进行表型数据方差及相关性分析,使用POPGENE VERSION 1.31 软件进行玉米群体内遗传多样性和遗传结构的分析[14]。
2 结果与分析 2.1 甜玉米种子老化过程中种子活力的变化不同老化处理时间的‘农甜88’和‘农甜99’种子发芽势、发芽率、发芽指数和活力指数见表2。由表2可知,随老化处理时间的增加,2个甜玉米品种的种子活力相关指标均呈下降趋势。‘农甜88’种子老化处理0(对照)和1 d时的发芽势、发芽率、发芽指数和活力指数均维持在一个较高的水平;老化处理2 d的种子除发芽率外其他指标均显著低于对照;随着老化时间的延长,各指标均显著降低,老化处理6 d的种子发芽势、发芽率、发芽指数和活力指数分别比对照降低了18.32%、10.73%、19.43%和41.85%,活力指数降幅最大。‘农甜99’在老化处理0和1 d时各指标均较高;老化处理2 d的种子仅发芽率显著低于对照;老化处理3 d的种子除发芽势外,发芽率、发芽指数和活力指数均显著低于对照;老化处理6 d的种子发芽势、发芽率、发芽指数和活力指数分别比对照降低了43.15%、15.38%、23.60%和45.70%,活力指数降幅最大。‘农甜88’表现出更强的耐老化能力。
|
|
表 2 ‘农甜88’和‘农甜99’经不同老化处理时间后种子活力指标比较1) Table 2 Comparisons of vigor indexes of ‘Nongtian88’ and ‘Nongtian99’ seeds after different aging time |
由图1可知,在种子老化和浸泡初期,2个甜玉米品种种子的REC与对照相比变化不明显;随着老化和浸泡时间的增加,2个品种浸出液中内含物质外渗量均明显增多,REC呈增加趋势。2个品种REC均在浸泡4~8 h期间上升缓慢,浸泡8 h以后快速上升。2个品种老化处理2和4 d的REC差异不大,处理 6 d的相对电导率显著增加,说明老化处理6 d时对种子细胞膜的结构破坏更大。相关性分析结果(表3)表明,‘农甜88’种子不同浸泡时间浸出液的REC与其发芽势、发芽率、发芽指数和活力指数均呈极显著负相关;‘农甜99’种子不同浸泡时间浸出液的REC与其发芽指数和活力指数呈极显著负相关,与发芽势和发芽率相关性不显著。
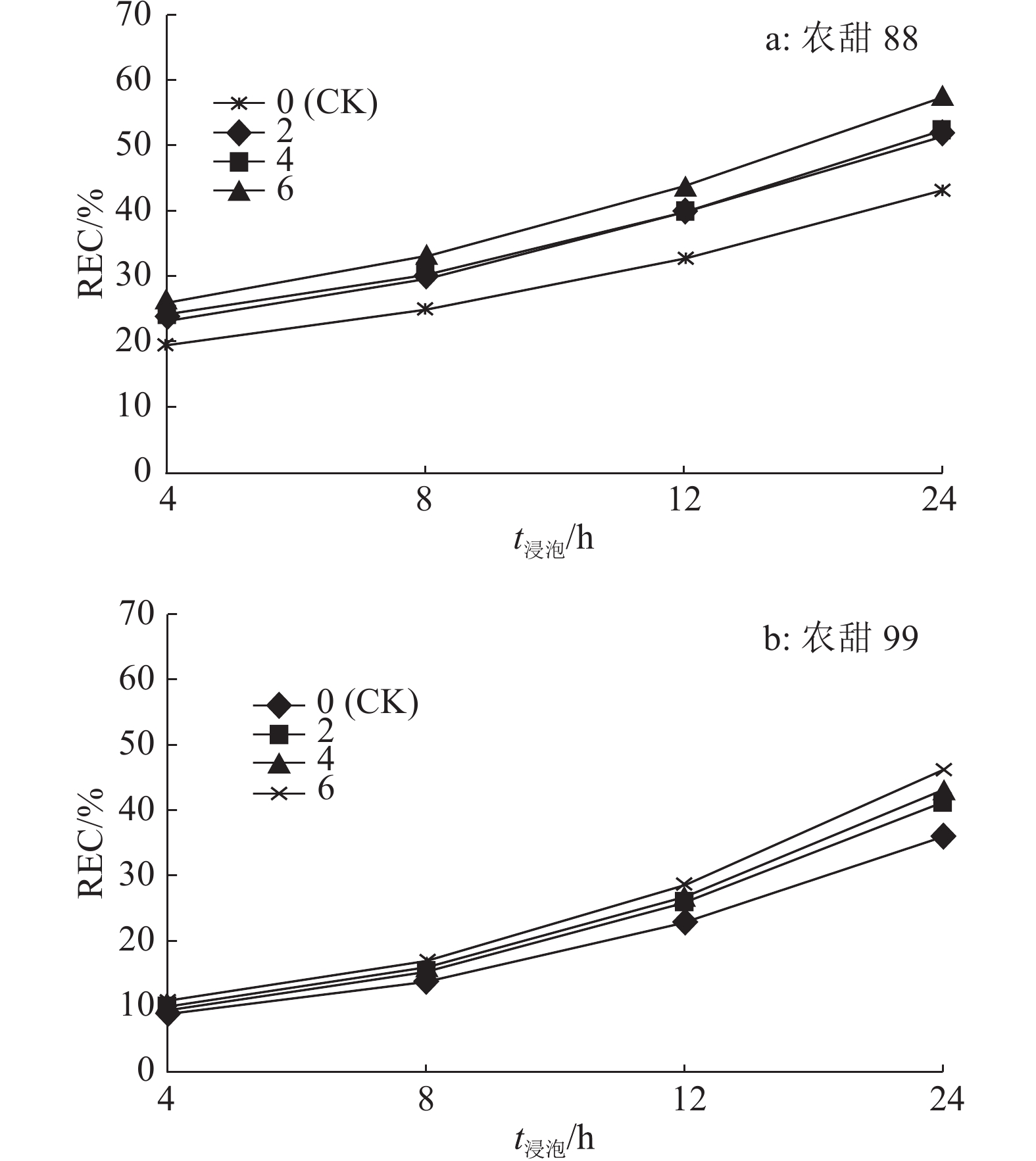
|
图 1 甜玉米种子老化后的相对电导率(REC) Figure 1 Relative electrical conductivity rates of sweet corn seeds after different aging time |
由图2a可知,随着老化时间的增加,‘农甜88’和‘农甜99’种子DHA活性逐渐下降。老化处理0~1 d的种子DHA活性下降速度较快;老化2~6 d的种子下降速度相对一致;老化处理6 d,‘农甜88’和‘农甜99’种子DHA活性分别比对照下降了69.78%和71.74%。由相关性分析结果(表3)可知,‘农甜88’和‘农甜99’种子DHA活性与发芽势、发芽率、发芽指数和活力指数均呈极显著正相关,说明DHA活性可作为检测种子活力的一个指标。
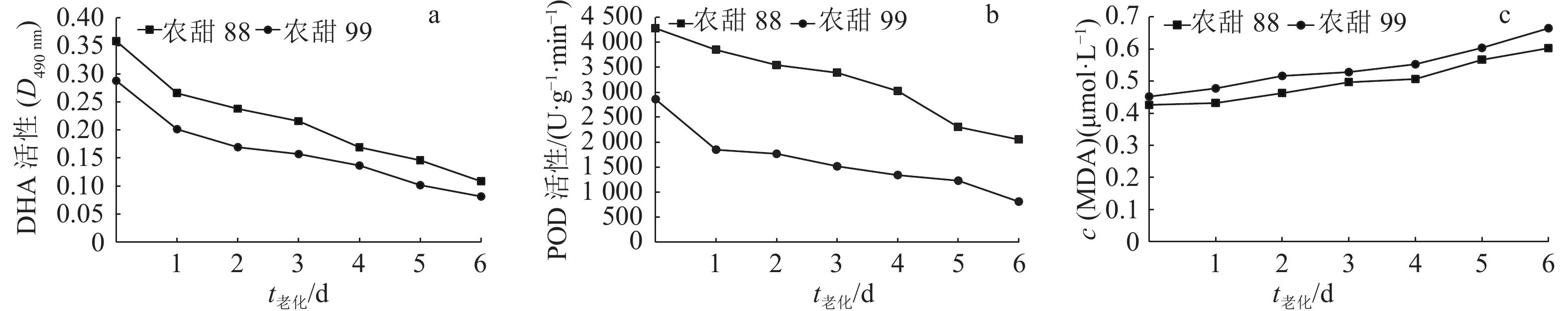
|
图 2 甜玉米种子老化后酶活性和MDA含量 Figure 2 Enzyme activities and MDA content of sweet corn seeds after different aging time |
由图2b可知,随着老化时间的增加,‘农甜88’和‘农甜99’种子POD活性逐渐下降。老化处理1 d时,‘农甜99’种子的POD活性下降明显快于‘农甜88’;老化处理5 d的‘农甜88’种子的POD活性迅速下降;老化处理6 d的农甜88’和‘农甜99’种子POD活性分别比对照降低了52.02%和71.60%。表3的相关性分析表明,‘农甜88’种子POD活性与发芽势、发芽率、发芽指数和活力指数均呈极显著正相关,‘农甜99’种子POD活性与发芽率、发芽势、发芽指数和活力指数均呈显著或极显著正相关,说明POD活性可作为检测种子活力的一个指标。
2.5 甜玉米种子老化过程中MDA含量的变化由图2c可知,随着老化时间的增加,‘农甜88’和‘农甜99’种子MDA含量呈逐渐上升的趋势。老化处理6 d的‘农甜88’和‘农甜99’种子MDA含量分别比对照提高了41.50%和47.08%,不同的老化处理时间,‘农甜99’种子MDA含量均高于‘农甜88’。表3相关性分析表明,‘农甜88’种子MDA含量与发芽势、发芽率、发芽指数和活力指数均呈极显著负相关;‘农甜99’种子MDA含量与发芽率、发芽势、发芽指数和活力指数均呈显著或极显著负相关。说明人工老化破坏了种子质膜的完整性,使质膜透性增大、种子活力和发芽能力降低,且不同品种种子膜脂过氧化程度耐受能力不同。
|
|
表 3 老化处理后甜玉米种子发芽指标与生理指标的相关性1) Table 3 Correlations between germination indexes and physiological indexes of sweet corn seeds after aging treatment |
遗传多样性分析结果(表4)表明,2个甜玉米品种的等位基因数、有效等位基因数和基因多样性均随着老化时间的增加而下降。老化处理3 d的‘农甜88’种子和老化处理2 d的‘农甜99’种子等位基因数、有效等位基因数和基因多样性均比对照低;与老化处理1 d相比,老化处理6 d的‘农甜88’种子和‘农甜99’种子等位基因数、有效等位基因数和基因多样性分别下降29.35%和23.58%、25.00%和20.00%、96.99%和83.35%。可见,随着老化时间的增加,甜玉米种子遗传多样性下降,部分带型在老化过程中丢失,种子遗传物质的完整性受到了破坏。
|
|
表 4 不同老化时间甜玉米种子的遗传多样性分析 Table 4 The genetic diversity analyses of sweet corn seeds after different aging time |
种子在贮存过程中,种子活力随贮存时间增加而降低,表现为发芽势、发芽率、发芽指数和活力指数的降低。本试验中,随老化时间的增加,2个甜玉米品种的种子发芽势等指标均降低,在4个指标中,发芽率下降幅度最小,而种子活力指数降低幅度最大,可见老化对种子活力的影响更大。欧阳西荣等[8]研究发现,高活力种子发芽势强、活力指数高、幼苗鲜质量和干质量均较大、植株干物质积累速度较快、叶面积较大、每穗粒数较多且植株稍高。可见,种子活力与作物的营养生长及产量直接相关。本试验中‘农甜99’种子活力较‘农甜88’种子活力丧失更快,表明不同品种耐老化能力不同。不同耐老化能力的品种应选择不同的贮藏条件,以延缓种子老化、最大程度保留种子活力。甜玉米品种中存在种子活力差异的变异,可为选育种子活力高的甜玉米品种提供参考。
质膜受损是种子老化过程中主要生理变化之一,电导率测定是检测种子膜泄漏最普遍的方法。乔燕祥等[15]研究发现,随着玉米种子活力降低,REC升高,张海艳[16]以糯玉米为材料得出了类似结论。本试验中,随着老化时间的延长,2个甜玉米种子浸出液的REC均上升,‘农甜88’的发芽势等4个发芽指标与REC均呈极显著负相关,‘农甜99’的发芽指数和活力指数与REC呈极显著负相关。因此,REC可作为检测甜玉米种子老化程度的指标之一。
种子老化过程中还伴随着一些生化酶活性的变化。汪晓峰等[17]发现,老化的种子中磷脂、抗坏血酸含量以及POD活性低于正常种子,而自由氨基酸、MDA含量及磷脂酶A活力高于正常种子,同时老化种子还伴随有结合脂的形成。刘建军等[18]发现,玉米种子POD活性随着老化程度的加深而下降。本试验中,随老化时间的增加,DHA和POD活性逐渐降低,MDA含量升高,且这3个指标均与种子活力呈显著或极显著相关。因此,DHA、POD活性及MDA含量也可作为衡量甜玉米种子老化程度的指标之一。
种子老化过程中膜类脂被氧化,一些降解酶如淀粉酶和蛋白酶等被释放,破坏种子内的遗传物质和贮藏物质。乔燕祥等[19]对Mo17种子进行老化处理,发现老化后种子的部分EST同工酶酶谱丢失,染色体出现单桥、双桥、断片和落后等畸变类型。张晗等[20]对糯玉米地方品种进行老化处理后发现品种群体内遗传多样性下降。本试验中,2个甜玉米品种的等位基因数、有效等位基因数和基因多样性等均随着老化时间的增加而减少,表明种子老化处理破坏了种质资源遗传物质的完整性。
致谢:感谢华南农业大学农学院周玉亮博士对于本研究相关试验的帮助与指导!
| [1] |
李小琴, 王青峰. 广东省甜玉米发展现状与对策探讨[J]. 作物杂志, 2007(3): 32-34. (  0) 0) |
| [2] |
罗军, 万忠, 谭俊, 等. 2013年广东甜玉米产业发展形势与对策建议[J]. 广东农业科学, 2014, 41(5): 42-45. (  0) 0) |
| [3] |
胡晋. 种子学[M]. 2版. 北京: 中国农业出版社, 2014.
(  0) 0) |
| [4] |
樊龙江, 颜启传. 甜玉米种子活力低下原因及其种子处理技术研究进展[J]. 中国农学通报, 1996(6): 24-26. (  0) 0) |
| [5] |
徐秀兰, 吴学宏, 张国珍, 等. 甜玉米种子携带真菌与种子活力关系分析[J]. 中国农业科学, 2006, 39(8): 1565-1570. (  0) 0) |
| [6] |
王青峰, 宫庆友, 沈凌云, 等. 超甜玉米种子活力研究[J]. 种子, 2007, 26(6): 4-7. (  0) 0) |
| [7] |
STYER R C, CANTLIFFE D J. Dependence of seed vigor during germination on carbohydrate source in endosperm mutants of maize[J]. Plant Physiol, 1984, 76(1): 196-200. (  0) 0) |
| [8] |
欧阳西荣, 徐辉, 李丽. 种子老化对玉米幼苗生长和植株发育的影响[J]. 中国农学通报, 2002, 18(6): 31-35. (  0) 0) |
| [9] |
张海艳. 低温对鲜食玉米种子萌发及幼苗生长的影响[J]. 植物生理学报, 2013, 49(4): 347-350. (  0) 0) |
| [10] |
胡晋. 对种子活力测定方法: TTC定量法的改进[J]. 种子, 1986(Z1): 71-72. (  0) 0) |
| [11] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
(  0) 0) |
| [12] |
LI G, QUIROS C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: Its application to mapping and gene tagging in Brassica
[J]. Theor Appl Genet, 2001, 103(2): 455-461. (  0) 0) |
| [13] |
赵炜, 刘冠明, 王晓明, 等. 应用SRAP标记分析甜玉米自交系的遗传差异[J]. 玉米科学, 2007, 15(S1): 154-156. (  0) 0) |
| [14] |
YEH F, YANG R, BOYLE T, et al. POPGENE, the user-friendly shareware for population genetic analysis [M]. Edmonton: Molecular Biology and Biotechnology Centre, University of Alberta, Canada, 1997.
(  0) 0) |
| [15] |
乔燕祥, 高平平, 马俊华, 等. 两个玉米自交系在种子老化过程中的生理特性和种子活力变化的研究[J]. 作物学报, 2003, 29(1): 123-127. (  0) 0) |
| [16] |
张海艳. 糯玉米种子老化过程中种子活力和生理特性的变化[J]. 玉米科学, 2015, 23(1): 92-96. (  0) 0) |
| [17] |
汪晓峰, 丛滋金. 膜质变等生化变化与玉米种子老化[J]. 种子, 1993(1): 68-69. (  0) 0) |
| [18] |
刘建军, 马俊华, 孟俊文, 等. 玉米种子老化过程中抗氧化酶活性的变化[J]. 山西农业科学, 2013, 41(9): 907-910. (  0) 0) |
| [19] |
乔燕祥, 高平平, 王果萍, 等. 玉米种子老化过程中EST同工酶变化与染色体畸变的研究[J]. 植物遗传资源学报, 2003, 4(2): 114-118. (  0) 0) |
| [20] |
张晗, 卢新雄, 张志娥, 等. 种子老化对玉米种质资源遗传完整性变化的影响[J]. 植物遗传资源学报, 2005, 6(3): 271-275. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


