2. 海南省农业科学院 热带果树研究所,海南 海口 571100
2. Institute of Tropic Fruit Trees, Hainan Academy of Agricultural Science, Haikou 571100, China
莲雾Syzygium samarangense为桃金娘科Myrtaceae蒲桃属Myrtaceae植物,原产于东南亚热带地区,在我国华南地区栽培,是极具特色的热带水果,享有‘水果皇帝’之称。但是莲雾正造果成熟期在6月下旬至7月下旬,适逢高温多雨,裂果严重,还受荔枝、龙眼等传统水果的冲击,价格往往偏低。通过产期调控技术改变莲雾的产期,使果实在冬春季节成熟,或者通过有计划的生产,使得果实分期分批上市,这些措施都可以大大提高其经济效益。莲雾的产期调控关键技术之一是控制营养生长,采用控水、淹水等水分胁迫处理,以及冬季自然低温胁迫处理均能有效控制营养生长。但这些胁迫处理都会对树体产生一定的伤害,如何有效控制营养生长,但又不会对树体产生过度的伤害,是莲雾产期调节成败的关键。
关于低温对莲雾的影响研究已有报道,张绿萍等[1]通过测定莲雾的半致死温度比较了6个莲雾品种的抗寒性;魏秀清等[2]研究了‘农科一号’莲雾从10 ℃降至–5 ℃的过程中叶片抗氧化酶活性的变化,并通过分析认为该莲雾的半致死温度为–1.2 ℃。陈惠等[3]利用自然低温试验和人工气候箱模拟低温对莲雾寒冻害低温等级指标进行了分级。这些研究主要从莲雾经受极端低温条件方面进行研究,而在冬季自然低温胁迫下,莲雾在接收低温诱导的过程中,产生了怎样的生理变化,仍鲜有报道。
关于莲雾水分胁迫的研究,黄胜等[4]在树冠滴水线附近开挖环状沟,在沟内灌水,连续处理30 d,结果表明淹水处理明显促进了莲雾开花。Tuladhar等[5]研究了淹水处理对莲雾根系结构的影响,发现淹水处理减少了根周皮的细胞层数。但关于水分胁迫对莲雾生理生化特性的影响,有待进一步研究。
本研究以盆栽‘印度红’莲雾为试材,根据生产上进行催花处理前控制营养生长需要的时间,以及达到控制营养生长但又不会对树体造成严重的伤害为度,设计在控制条件下的低温、干旱和淹水胁迫试验,研究这些胁迫处理对莲雾相对含水量、丙二醛(Malondiadehyde,MDA)含量和抗氧化系统的影响,以明确这些控制营养生长的胁迫处理对莲雾胁迫相关生理指标的影响,以期为生产上合理采用胁迫控制营养生长提供理论依据。
1 材料与方法 1.1 材料和处理生长健壮一致的3年生盆栽‘印度红’莲雾嫁接苗(砧木为蒲桃)20株,当枝梢上的叶片转绿成熟后,即叶绿素相对含量达到50~60时,分别转到控温室中进行以下4个处理:25 ℃正常浇水处理;25 ℃干旱处理,土壤相对含水量控制在20 %;25 ℃淹水处理,土壤相对含水量约50 %;低温处理,温度为15 ℃,正常浇水。在处理的第21 天,淹水处理的盆栽树排水3 d后恢复淹水处理。所有的盆栽莲雾在35 d后解除胁迫处理,低温胁迫处理树恢复到25 ℃条件下生长,干旱处理树恢复浇水,淹水处理树排除积水。分别在处理前,处理的7、14、21、28、35 d和解除胁迫后第2天采集样品。以单株为试验单元,每处理设5次重复。
1.2 土壤含水量的测定用土壤水分测定仪测定土壤的含水量。
1.3 叶片相对含水量的测定叶片相对含水量测定按Zhou等[6]的方法。
| ${\text{相对含水量}} = \frac{{\text {初始鲜质量}}{ - }{\text {干质量}}}{{\text {饱和鲜质量}}{-} {\text {干质量}}} \times 100 \text{%} \text{。}$ |
丙二醛含量测定参照Huang等[7]的方法。采用硫代巴比妥酸比色法,用分光光度计于波长532和600 nm处测定光密度(D),鲜样测定。
| ${{b}}({\rm MDA}) = {\displaystyle{{{D_{532\;{\rm nm}}} - {D_{600\;{\rm nm}}}} \over {1.55 \times {{10}^5}}}}\text{。}$ |
超氧化物歧化酶(Superoxide dismutase,SOD)活性测定采用氮蓝四唑(Nitroblue tetrazolium,NBT)还原法,按Giannoplitis等[8]的方法进行。以还原50% NBT为1个酶活性单位。抗坏血酸过氧化氢酶(Ascorbic acid peroxidase,APX)活性的测定参照Nakano等[9]的方法进行。根据抗坏血酸(Ascorbic acid,AsA)的摩尔消光系数为2.8 mmol–1·L–1·cm–1计算酶活性,鲜样测定。
1.6 叶片抗坏血酸和还原型谷胱甘肽含量的测定取莲雾叶片加入5 mL 50 g·L–1的三氯乙酸溶液研磨提取,4℃ 10 000 r·min–1离心15 min,上清液定容至5 mL,用于测定AsA和还原型谷胱甘肽(Reduced glutathione,GSH)含量。AsA含量测定参照Law等[10]的方法,GSH含量测定参照Ellman[11]的方法,鲜样测定。
1.7 数据处理数据均在Microsoft Excel 2010中进行计算、整理和绘图,取平均值±标准误用于数据分析和绘图。
2 结果与分析 2.1 胁迫处理对莲雾枝梢生长的影响干旱、淹水和低温处理3 周后,莲雾没有新梢抽生,芽处于休眠状态(图1A、1B、1C),而对照枝梢顶端可观察到萌动的芽(图1D);莲雾经过5周的胁迫处理,解除胁迫1周后,未观察到新梢抽生(图1E、1F、1G),而对照植株新梢已经伸长和展叶(图1H)。结果表明干旱、淹水和低温处理抑制了莲雾新梢的生长,抑制了营养生长。

|
图 1 干旱、淹水和低温胁迫处理对‘印度红’莲雾枝梢生长的影响 Figure 1 Effects of drought, water logging and chilling stresses on shoot growth of ‘Yinduhong’ Syzygium samarangense A~D为处理3 周的枝梢生长状态,其中,A:干旱处理,B:淹水处理,C:低温处理,D:对照;E~F为经胁迫处理5 周后再解除胁迫1 周时的枝梢生长状态,其中,E:干旱处理,F:淹水处理,G:低温处理,H:对照 |
如图2所示,在整个试验处理期间,常温下生长的对照植株和低温处理植株的叶片相对含水量维持在较高水平,均在92%以上。淹水处理的植株叶片相对含水量随淹水时间的延长而降低并低于对照,在处理的第21天,淹水处理植株的相对含水量降至最低,排水并再次淹水处理后,相对含水量有所升高。干旱处理的植株叶片相对含水量随处理时间的延长而降低并低于对照植株,在处理的第37天即恢复灌水后第2天,叶片相对含水量恢复到对照水平。结果说明淹水和干旱等水分胁迫处理会减少莲雾叶片的相对含水量,而15 ℃低温处理并未影响植株叶片的相对含水量。
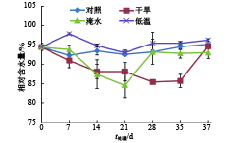
|
图 2 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片相对含水量的影响 Figure 2 Effects of drought, water logging and chilling stresses on relative water content in leaves of ‘Yinduhong’ Syzygium samarangense |
在整个试验处理期间,常温下生长的对照植株叶片MDA含量稳定并维持在较低的水平,而干旱、淹水和低温处理植株的叶片MDA含量较对照升高。在处理的第7天,干旱、淹水和低温胁迫处理植株的MDA质量摩尔浓度分别比对照高16.0%、41.3%和30.4%;在处理的第28天,干旱、淹水和低温胁迫处理植株的MDA质量摩尔浓度分别比对照高34.3%、37.2%和27.0%(图3)。结果说明干旱、淹水和低温胁迫处理会增加莲雾叶片的MDA含量。
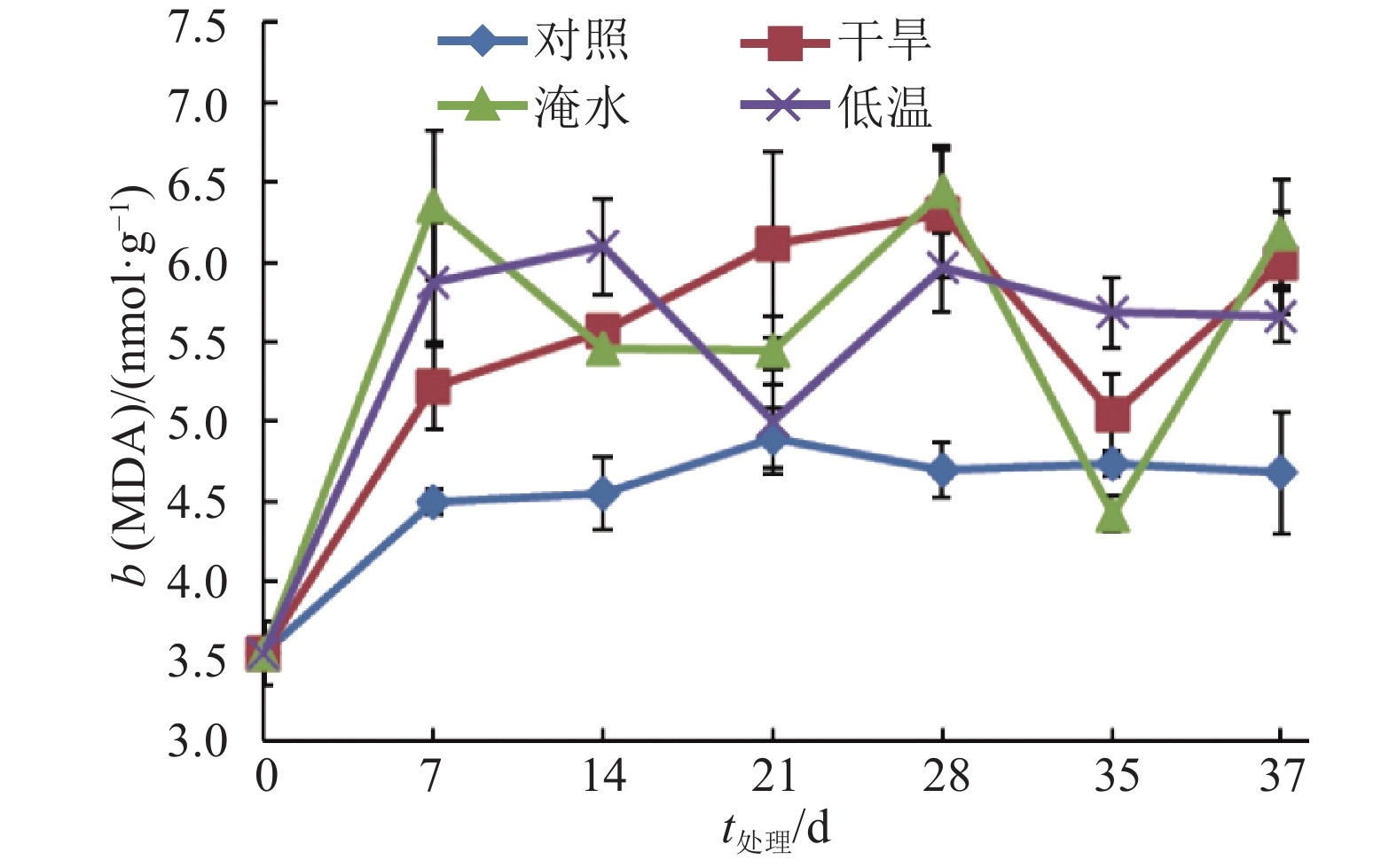
|
图 3 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片丙二醛含量的影响 Figure 3 Effects of drought, water logging and chilling stresses on malondialdehyde content in leaves of ‘Yinduhong’ Syzygium samarangense |
如图4所示,在整个试验处理期间,常温下生长的对照植株叶片SOD活性变化不大,并维持在较低的水平。干旱、淹水和低温胁迫处理在一定程度上提高了叶片的SOD活性。在干旱处理0 ~ 35 d,叶片SOD活性总体高于对照,但恢复灌水后第2天,叶片SOD活性与对照相当;在处理的0~14 d,淹水处理植株叶片的SOD活性增加,之后下降并在解除淹水处理后恢复到对照水平;在0~28 d,低温处理植株的SOD活性增加,28 d之后SOD活性下降。结果表明干旱、淹水和低温胁迫处理会诱导SOD活性增加。
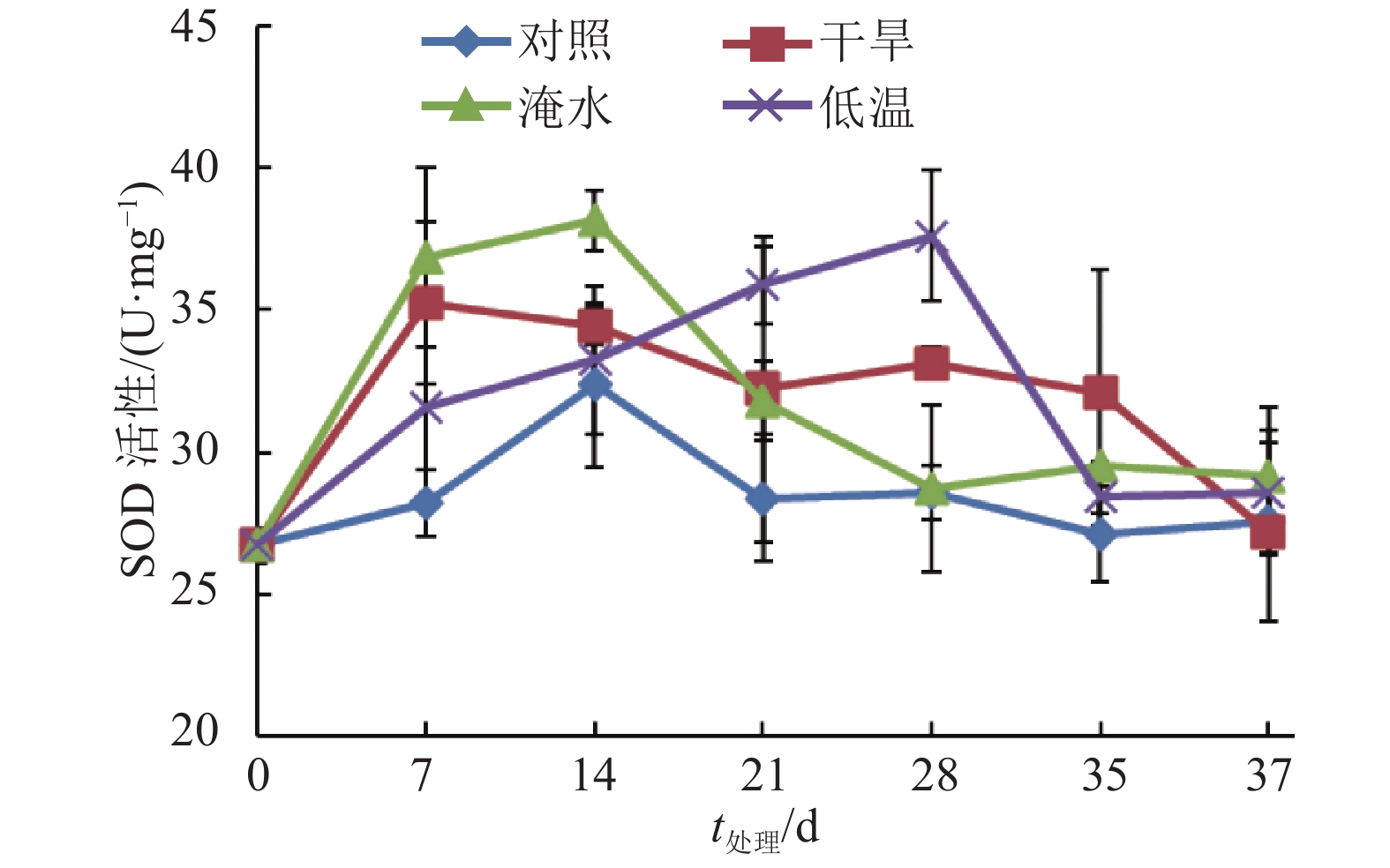
|
图 4 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片SOD活性的影响 Figure 4 Effects of drought, water logging and chilling stresses on SOD activity in leaves of ‘Yinduhong’ Syzygium samarangense |
如图5所示,在整个胁迫处理期间,常温下生长的对照植株叶片APX活性稳定并低于各胁迫处理植株的活性,而干旱、淹水和低温处理植株的叶片APX活性在处理的前期升高,之后平稳维持在高于对照的水平。在处理的第28天,干旱、淹水和低温胁迫处理植株的APX活性分别比对照高33.5%、29.0%和27.6%。结果说明干旱、淹水和低温胁迫处理会使莲雾叶片的APX活性增加。
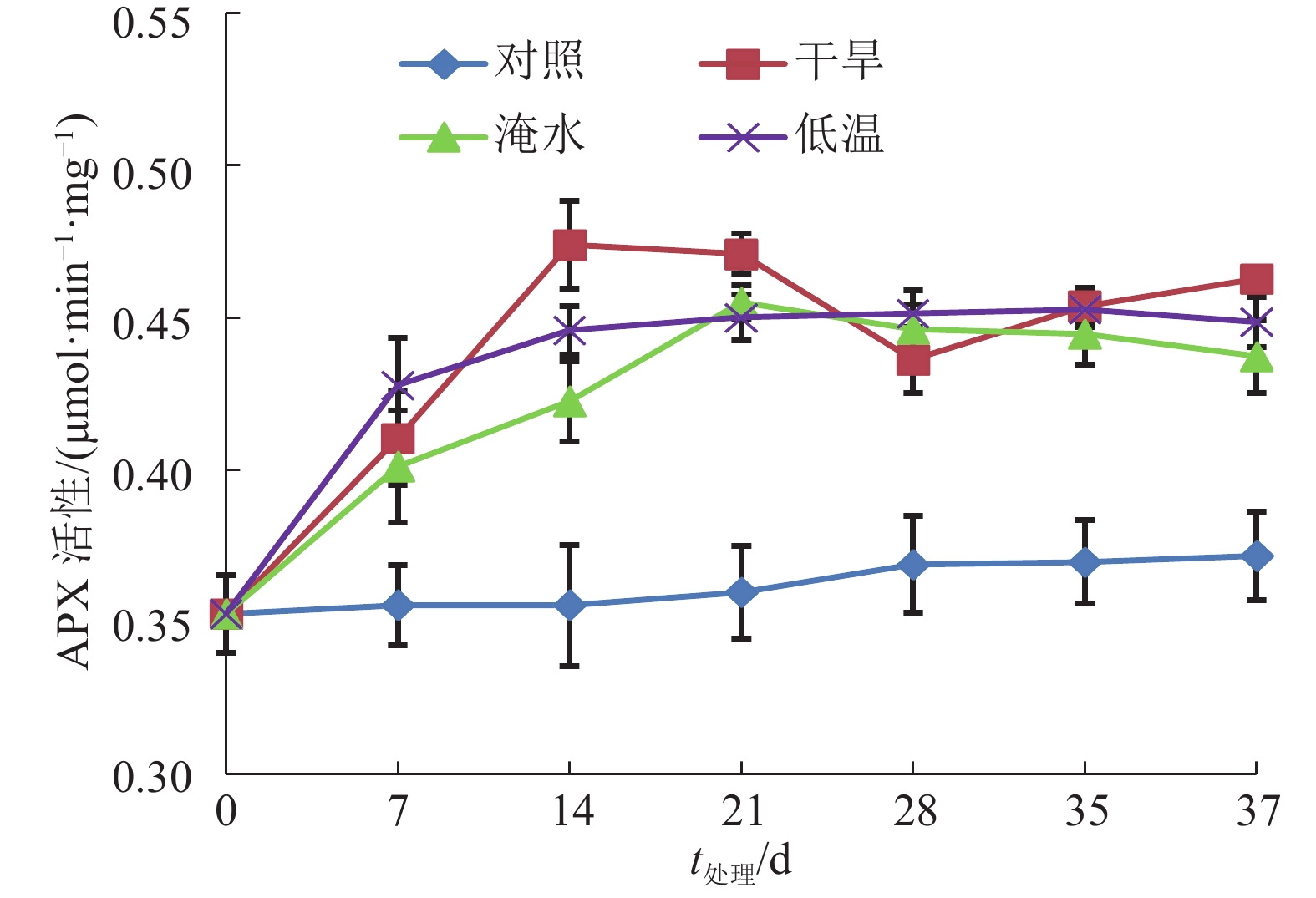
|
图 5 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片APX活性的影响 Figure 5 Effects of drought, water logging and chilling stresses on APX activity in leaves of ‘Yinduhong’ Syzygium samarangense |
如图6所示,在胁迫处理期间,常温下生长的对照植株叶片AsA含量稳定并保持在较低的水平。干旱和淹水植株的叶片AsA含量在处理的0~14 天前升高,之后下降,在处理的第35 天下降至最低,解除胁迫后含量增加。低温胁迫处理的植株叶片AsA含量在处理的第7和第14 天达到最大,之后下降,解除胁迫处理后AsA含量增加。在处理的第14 天,干旱、淹水和低温胁迫处理植株的AsA质量摩尔浓度分别比对照高270.2%、287.6%和191.8%。结果说明干旱、淹水和低温胁迫处理会使莲雾叶片的AsA含量增加。
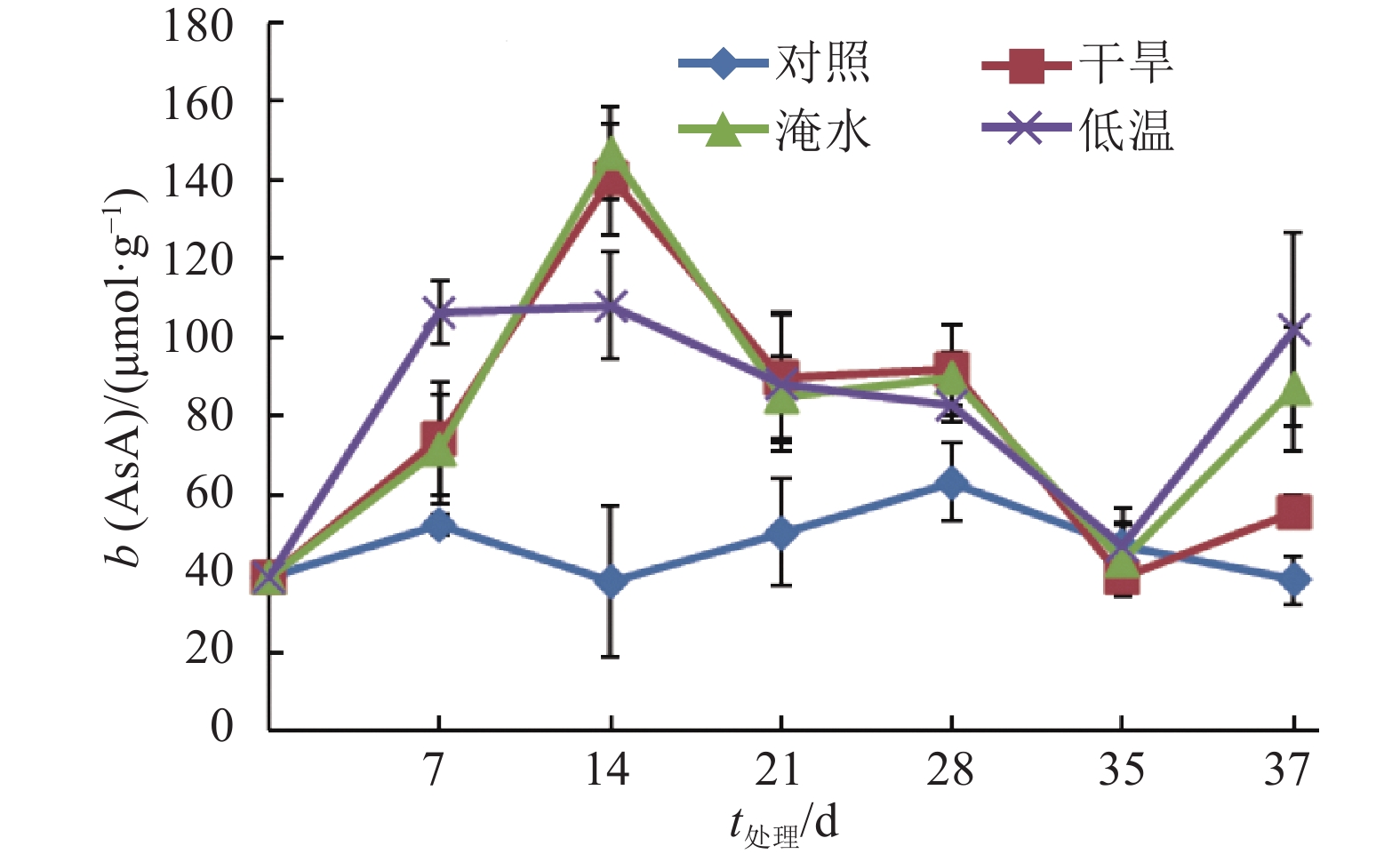
|
图 6 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片AsA含量的影响 Figure 6 Effects of drought, water logging and chilling stresses on AsA content in leaves of ‘Yinduhong’ Syzygium samarangense |
如图7所示,在胁迫处理期间,常温下生长的对照植株叶片GSH含量较稳定并比胁迫处理植株的GSH含量低;干旱、淹水和低温处理植株的叶片GSH含量总体随处理时间的延长而增加;在处理的第21天,干旱、淹水和低温胁迫处理植株的GSH含量分别比对照高36.6%、38.3%和40.0%。结果说明干旱、淹水和低温胁迫处理会使莲雾叶片的GSH含量增加。
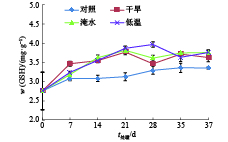
|
图 7 干旱、淹水和低温胁迫处理对‘印度红’莲雾叶片GSH含量的影响 Figure 7 Effects of drought, water logging and chilling stresses on GSH content in leaves of ‘Yinduhong’ Syzygium samarangense |
叶片相对含水量是反映植物水分状况的重要指标,植株必须有相对较高的含水量才可以维持正常的生理活动,有效地保持叶绿体的结构和功能,使植株进行有效光合作用[12],当植物受到干旱、淹水等水分胁迫时,或由于低温、渗透胁迫所导致的水分胁迫时,相对含水量会下降[6, 13-14]。本试验中,干旱和淹水胁迫均导致叶片相对含水量下降,结果与前人研究玉米受到干旱胁迫后相对含水量降低[14]的结果相一致。对于低温胁迫处理,莲雾叶片的相对含水量并没有由于低温的处理而下降,这可能与低温下蒸腾作用减少有关,也可能是莲雾对15 ℃的低温具有较高的耐受性。
干旱和淹水等水分胁迫,以及低温胁迫会诱发植物发生氧化胁迫,氧化胁迫与活性氧产生和清除的平衡受到破坏有关[15]。在正常情况下,植物体内拥有的活性氧清除系统可使活性氧浓度控制在造成伤害的水平之下。活性氧的清除系统也称为抗氧化系统,主要有抗氧化酶和抗氧化物质。SOD是含金属辅基的抗氧化酶,能够催化超氧阴离子自由基通过歧化反应转化为氧气和过氧化氢(H2O2),保护暴露于氧气中的细胞,而H2O2可被APX、谷胱甘肽过氧化物酶和过氧化氢酶等其他抗氧化酶清除,其中的APX与H2O2的亲和性最强[16]。AsA和GSH属于抗氧化物质,可以直接清除H2O2,AsA-GSH循环在植物应对胁迫清除活性氧中发挥重要的作用[17]。当植物处于逆境时,植物可以通过提高抗氧酶的活性和抗氧化物的含量来提高活性氧的清除能力,但随着胁迫的加深,活性氧的生成速率超过清除能力时,活性氧积累,植物体内发生氧化胁迫[18],氧化胁迫的发展会加剧膜脂过氧化作用,而膜脂过氧化产物MDA和活性氧会使生物膜遭受严重的伤害,膜通透性增加进而引发一系列的生理失调,最终导致植物死亡[19-20]。
本试验中,干旱、淹水和低温胁迫使莲雾膜脂过氧化产物MDA含量升高,表明植株受到一定程度的伤害,但SOD和APX活性,以及AsA和GSH含量比对照高,表明这几种胁迫处理提高了抗氧化酶活性和抗氧化物质的含量。郭欣欣等[21]对不结球白菜进行淹水胁迫处理,发现在胁迫处理的初期,APX活性、GSH和AsA含量均提高,但随着胁迫的加深和植株伤害程度的加深,三者均明显下降。而本试验结果所表现的抗氧化系统受到胁迫的诱导,与不接球白菜淹水处理初期的结果类似,这可能与本试验中采用的胁迫处理对莲雾并未造成严重的伤害有关。
莲雾进行催花前,需要控制新梢生长,使树体的营长生长停顿,以减少养分的消耗,有利于花芽分化。适度的干旱、淹水和低温处理均可以胁迫芽进入休眠,抑制新梢的抽生。而催花前控制营养生长需要持续30 d以上[4, 22],因此,本研究选用35 d的胁迫处理,使得控制营养生长的胁迫处理有足够的时间。试验结果表明,处理后能有效控制新梢的抽生,对胁迫相关指标的测定结果表明,干旱、淹水和低温胁迫处理均诱导产生抗氧化反应,虽然这3种胁迫处理均导致叶片MDA含量升高,对树体产生了一定的伤害,但解除胁迫处理后,叶片相对含水量可以恢复到对照水平,表明本试验的胁迫处理并未对树体造成过度的伤害。因此,本研究表明,利用适度的干旱胁迫可有效控制营养生长;15 ℃的低温可以使莲雾停止生长;莲雾对淹水胁迫具有较强的耐受性,生产上可以采用淹水处理来控制营养生长。本试验的胁迫处理方法可以为莲雾的控梢催花技术提供依据。
| [1] |
张绿萍, 蔡永强, 金吉林, 等. 莲雾不同种的低温半致死温度及抗冷适应性[J]. 果树学报, 2012, 29(2): 291-295. (  0) 0) |
| [2] |
魏秀清, 许玲, 章希娟, 余东, 等. 莲雾对低温胁迫的生理响应及抗寒性分析[J]. 果树学报, 2016, 33(1): 73-80. (  0) 0) |
| [3] |
陈惠, 杨凯, 李丽纯, 等. 莲雾寒冻害低温等级指标的确定[J]. 生态学杂志, 2017, 36(4): 1047-1052. (  0) 0) |
| [4] |
黄胜, 陈雄进. 促进莲雾提早开花调节产期措施研究[J]. 热带农业工程, 2016, 40(2): 38-41. (  0) 0) |
| [5] |
TULADHAR A, OHTSUKA S, NII N. Anatomical study of wax apple (Syzygium samarangense) roots under flooded condition
[J]. Acta Hort, 2016(1110): 85-90. (  0) 0) |
| [6] |
ZHOU B, GUO Z, LIU Z. Effects of abscisic acid on antioxidant systems of Stylosanthes guianensis(Aublet)Sw. under chilling stress
[J]. Crop Sci, 2005, 45: 599-605. (  0) 0) |
| [7] |
HUANG M, GUO Z. Responses of antioxidative system to chilling stress in two rice cultivars differing in sensitivity[J]. Bio Plant, 2005, 49(1): 81-84. (  0) 0) |
| [8] |
GIANNOPLITIS C N, RIES S K. Superoxide dismutase: I: Occurrence in higher plants[J]. Plant Physiol, 1977, 59(2): 309-314. (  0) 0) |
| [9] |
NAKANO Y, ASADA K. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22(5): 867-880. (  0) 0) |
| [10] |
LAW M Y, CHARLES S A, HALLIWELL B. Glutathione andascorbic acid in spinach (Spinacia oleracea) chloroplasts
[J]. Biochem J, 1983, 210(3): 899-903. (  0) 0) |
| [11] |
ELLMAN G L. Tissue sulfhydryl groups[J]. Arch of Biochem and Biophys, 1959, 82(1): 70-77. (  0) 0) |
| [12] |
王东清, 李国旗, 王磊. 干旱胁迫下红麻和大麻状罗布麻水分生理及光合作用特征研究[J]. 西北植物学报, 2012, 32(6): 1198-1205. (  0) 0) |
| [13] |
谢小玉, 马仲炼, 白鹏, 等. 辣椒开花结果期对干旱胁迫的形态与生理响应[J]. 生态学报, 2014, 34(13): 3797-3705. (  0) 0) |
| [14] |
刘承, 李佐同, 克军, 等. 水分胁迫及复水对不同耐旱性玉米生理特性的影响[J]. 植物生理学报, 2015, 51(5): 702-708. (  0) 0) |
| [15] |
LIU Y K, HE C Z. Regulation of plant reactive oxygen species (ROS) in stress responses: Learning from AtRBOHD[J]. Plant Cell Rep, 2016, 35(5): 995-1007. (  0) 0) |
| [16] |
李泽琴, 李静晓, 张根发. 植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J]. 遗传, 2013, 35(1): 45-54. (  0) 0) |
| [17] |
NIE Z J, HU C X, SUN X C, et al. Effects of molybdenum on ascorbate-glutathione cycle metabolism in Chinese cabbage (Brassica campestris L. ssppekinensis)
[J]. Plant Soil, 2007, 295(1/2): 13-21. (  0) 0) |
| [18] |
ANDERSON M D, PRASAD T K, STEWART C R. Changes in isozyme profiles of catalase, peroxidase and glutathione reductase during acclimation to chilling in mesocotyls of maize seedlings[J]. Plant Physiol, 1995, 109(4): 1247-1257. (  0) 0) |
| [19] |
HODGSON R A J, RAISON J K. Superoxide production by thylakoids during chilling and its implication in the susceptibility of plants to chilling-induced photoinhibition[J]. Planta, 1991, 183(2): 222-228. (  0) 0) |
| [20] |
RIKIN A, ATSMON D, GITTER G. Chilling injury in cotton (Gossypium L.): Prevention by abscisic acid
[J]. Plant Cell Physiol, 1979, 20(8): 1537-1546. (  0) 0) |
| [21] |
郭欣欣, 李晓锋, 朱红芳, 等. 淹水胁迫对不接球白菜抗坏血酸–谷胱甘肽循环的影响[J]. 植物生理学报, 2015, 51(12): 2181-2187. (  0) 0) |
| [22] |
胡晓雪, 杨荣萍, 陈贤, 等. 莲雾的产期调节[J]. 福建果树, 2008, 147(4): 48-51. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


