2. 生物反应器与药物开发教育部工程研究中心,吉林 长春 130118
2. Engineering Research Center for Bioreactor and Pharmaceutical Development, Ministry of Education, Changchun 130118, China
微小RNA(microRNA,miRNA)是一类长度约为20~25个核苷酸的非编码RNA[1],miRNA可与靶mRNA分子的3′非翻译区(3′UTR)结合,抑制mRNA的翻译,以抑制靶蛋白的表达,进而影响细胞的生长、发育、凋亡等过程[2]。结核病(Tuberculosis, TB)是由结核分枝杆菌Mycobacterium tuberculosis(MTB)感染所引起的一种人畜共患传染病。MTB为胞内寄生菌,主要宿主是巨噬细胞。巨噬细胞具有吞噬与消化异物的功能,是抵抗呼吸道传播疾病免疫反应中最早的效应细胞,是机体抗细菌感染的首道防线[3]。MTB进入肺部后,肺泡巨噬细胞可通过模式识别受体对MTB进行识别、结合、吞噬,激活细胞内免疫反应,发挥抗结核作用来清除感染。MTB也可以通过自身结构或分泌蛋白、酶等抵抗宿主细胞的免疫杀伤,从而在巨噬细胞中存活[4-6]。研究发现MTB入侵巨噬细胞后,miRNA参与了机体抗结核感染的过程[7]。Das等 [8]用H37Rv和H37Ra侵染THP-1巨噬细胞后,THP-1细胞中miR-29a-3p表达量升高,miRNA表达微阵列显示分别上调了1.86和1.56倍,吉林农业大学病原微生物与免疫学科研团队前期试验发现用H37Rv、H37Ra和BCG侵染巨噬细胞后,miR-29a-3p表达出现不同程度的上调[9],由此推测miR-29a-3p在一定程度上参与了MTB的侵染过程[8-10]。
本研究利用Target Scan、miRDB、PicTar等生物信息学软件查找miR-29a-3p靶基因并设计引物,通过转染pEZX-AM02-miR-29a-3p载体抑制小鼠巨噬细胞中miR-29a-3p的表达,观察转染后巨噬细胞凋亡率及相关靶基因表达水平的变化,探讨miR-29a-3p在巨噬细胞抗MTB感染机制中的作用,为揭示结核病发病机制提供试验依据。
1 材料与方法 1.1 材料DMEM培养基、胎牛血清(FBS)、Trizol试剂、GeneMark无内毒素质粒抽提试剂盒、pEZX-AM02-miR-29a-3p抑制载体及阴性对照、反转录引物、反转录试剂盒、荧光定量试剂盒、miR-29a-3p引物及内参基因为RNU6、转染试剂EndoFectinTM-Max购于GeneCopoeia;靶基因引物由上海生工合成;Annexin V-Alexa Fluor 647/PI凋亡检测试剂盒购于康润公司。B31614高速冷冻离心机(德国贝克曼);Infinite 2000 酶标仪(TECAN);DL-CJ-2ND超净台(北京东联哈尔仪器制造有限公司);NU-5500E CO2恒温培养箱(NUAIR上海压缩机有限公司);AX10荧光倒置显微镜(德国卡尔蔡司);ETC811 PCR仪(东胜创新生物科技有限公司);Mx3000P荧光定量PCR仪(安捷伦科技有限公司);C6流式细胞仪(美国BD)。
1.2 方法1.2.1 巨噬细胞培养 RAW 246.7细胞由吉林农业大学病原微生物与免疫学科研团队冻存,37 ℃水浴复苏后接种于DMEM完全培养基(含体积分数10%的FBS),在37 ℃、体积分数为5% CO2的恒温培养箱中培养,显微镜下观察细胞状态和培养基颜色,适时更换培养液,取对数生长期的细胞接种于6孔细胞培养板。
1.2.2 抑制载体转化 将pEZX-AM02-miR-29a-3p抑制载体及阴性对照载体转化于大肠埃希菌DH5α感受态细胞,涂布于含氨苄抗性的LB培养基平板上,37 ℃条件下过夜培养后,从平板上挑取菌落至氨苄抗性的LB液体培养基中,37 ℃条件下摇床培养,第3天取菌液10 mL按试剂盒说明书提取质粒,酶标仪检测质粒纯度和浓度,提取的质粒用于细胞转染。
1.2.3 载体转染 采用脂质体瞬时转染法,当细胞生长达到对数生长期时,以1 000 r·min–1离心5 min,收集细胞、重悬、计数,将浓度调整为2×105 mL–1接种于6孔细胞培养板,于培养箱内培养,待细胞汇合度达到70%~80%时进行转染。按照转染试剂说明书操作,试验组细胞转染pEZX-AM02-miR-29a-3p,抑制载体对照组细胞转染pEZX-AM02,转染试剂对照组只添加转染试剂,空白对照组细胞不做任何处理,每组3个重复。携带红色荧光蛋白报告基因的pEZX-AM02载体,转染进细胞并成功表达会在显微镜下出现红色荧光,可于倒置荧光显微镜下观察细胞生长与质粒转染情况。
1.2.4 荧光定量PCR检测 RAW 246.7细胞在转染24、36和48 h后,采用Trizol法提取细胞总RNA。将总RNA (1 μg)逆转录为miRNA反应所需的cDNA,反应程序为37 ℃ 60 min,85 ℃ 5 min。将细胞总RNA(1 μg)反转录为cDNA, 反应程序为两步法:第1步65 ℃ 5 min;第2步42 ℃ 60 min,85 ℃ 5 min。miRNA反应以通用引物为上游引物及All-in-OneTM miRNA qPCR primer为实时定量miRNA特异引物,使用SYBR法扩增miR-29a-3p片段,以RNU6B作为内参。miRNA反应以β-actin作为内参。反应条件为:95 ℃变性 10 s,60 ℃退火 20 s,72 ℃延伸15 s,重复40个循环。Ct值根据
|
|
表 1 基因引物序列 Table 1 Sequences of gene primers |
1.2.5 检测细胞凋亡率 转染细胞培养至24、36和48 h,用流式细胞术检测凋亡率。将培养箱中转染的细胞板取出,去上清液后加入PBS溶液洗涤1次,用胰酶消化使贴壁细胞悬浮,1 000 r·min–1离心10 min,弃培养基用4 ℃预冷的PBS溶液洗细胞2次,用250 μL 1×Binding Buffer重新悬浮细胞,调节其浓度为1×10 6 mL–1,取100 μL的细胞悬液于5 mL流式管中,加入5 μL Annexin V/Alexa Fluor 647,室温避光孵育5 min后加入20 μg·mL–1的碘化丙啶溶液10 μL,避光室温反应15 min,在反应管中加400 μL PBS溶液,进行流式细胞仪分析。
1.3 数据处理Alexa Fluor 647/PI双染试剂盒检测正常细胞、死亡细胞、晚期凋亡及早期凋亡所占的比例;将Alexa Fluor 647+/PI–判断为早期凋亡,Alexa Fluor 647+/PI+判断为晚期凋亡,以上2种凋亡率相加即总凋亡率。分别检测各试验组24、36和48 h的细胞凋亡率,结果以平均数±标准差表示。
利用流式细胞仪CFlow Plus软件分析结果。荧光定量PCR及流式分析结果所有数据均采用GraphPad Prism 6统计软件进行方差分析及t检验。
2 结果与分析 2.1 pEZX-AM02-miR-29a-3p载体转染携带红色荧光蛋白报告基因的pEZX-AM02载体,转染进细胞并成功表达会发出红色荧光。利用荧光显微镜观察细胞内荧光蛋白的表达情况,发现对照抑制载体pEZX-AM02和pEZX-AM02-miR-29a-3p抑制载体都成功转入细胞,并在细胞内成功表达(图1),从图1可以看出36 h转染效果最佳,效率最高。
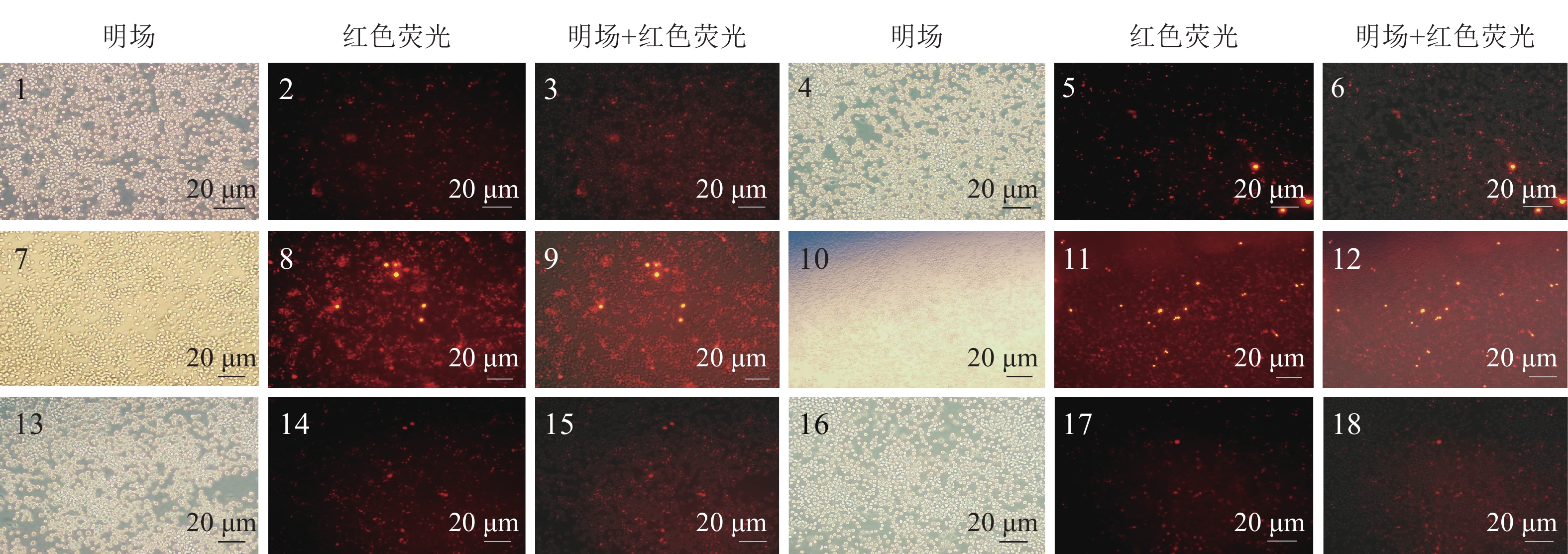
|
图 1 miRNA抑制对照以及pEZX-AM02-miR-29a-3p转染RAW264.7细胞 Figure 1 RAW264.7 cells tranfected with miRNA inhibitor control or pEZX-AM02-miR-29a-3p 1~3为24 h的抑制载体对照(pEZX-AM02);4~6为24 h的pEZX-AM02-miR-29a-3p载体;7~9为36 h的抑制载体对照(pEZX-AM02);10~12为36 h的pEZX-AM02-miR-29a-3p载体;13~15为48 h的抑制载体对照(pEZX-AM02);16~18为48 h的pEZX-AM02-miR-29a-3p载体 |
转染24、36和48 h不同处理组凋亡相关基因的表达见图2。与空白对照组、转染试剂对照组及抑制载体对照组相比,转染pEZX-AM02-miR-29a-3p载体后,miR-29a-3p表达量降低,24、36和48 h表达量分别为0.16±0.01、0.04±0.01和0.09±0.01。与空白对照组、转染试剂对照组及抑制载体对照组相比,pEZX-AM02-miR-29a-3p抑制载体组中miR-29a-3p的靶基因caspase3、caspase7、caspase8、Bcl-2、Mcl-1等都随着转染时间的延长,发生了不同程度的变化且差异显著。与其他各对照组相比,转染24、36 h时pEZX-AM02-miR-29a-3p抑制载体组中caspase3相对表达量升高,48 h相对表达量降低,24、36和48 h的相对表达量分别为2.66±0.02、2.09±0.05和0.64±0.01。与其他各对照组相比,转染24、36和48 h时pEZX-AM02-miR-29a-3p抑制载体组中caspase7相对表达量升高,24、36和48 h分别为7.41±0.10、11.08±0.08和1.20±0.06。与其他各对照组相比,转染24、36 h时pEZX-AM02-miR-29a-3p抑制载体组中caspase8相对表达量升高,转染48 h时,与转染试剂对照组及抑制载体对照组相比caspase8相对表达量升高,caspase8在转染24、36和48 h的相对表达量分别为3.53±0.08、3.78±0.03和1.91±0.09。与其他各对照组相比,在转染36、48 h时pEZX-AM02-miR-29a-3p抑制载体组中Bcl-2相对表达量升高,在转染24 h时与抑制载体对照组相比Bcl-2相对表达量升高,24、36和48 h 的相对表达量分别为1.41±0.02、2.58±0.05和7.75±0.19。与空白对照组、转染试剂对照组相比,转染24 h时pEZX-AM02-miR-29a-3p抑制载体组中Bax相对表达量升高;与其他各对照组相比,在转染36、48 h时pEZX-AM02-miR-29a-3p抑制载体组中Bax相对表达量升高,24、36和48 h 的相对表达量分别为3.00±0.08、16.15±0.17和6.65±0.14。在转染24 h时,与抑制载体对照组相比,pEZX-AM02-miR-29a-3p抑制载体组中Mcl-1相对表达量降低,与空白对照组、转染试剂对照组相比Mcl-1相对表达量不变;与其他各对照组相比,在转染36、48 h时pEZX-AM02-miR-29a-3p抑制载体组中Mcl-1相对表达量升高,24、36和48 h的相对表达量分别为1.48±0.01、11.55±0.08和5.69±0.14。与空白对照组、抑制载体对照组相比,转染24 h时pEZX-AM02-miR-29a-3p抑制载体组中Bax/Bcl-2相对表达量升高,在转染36 h时与其他各对照组相比相对表达量升高,在转染48 h时与转染试剂对照组相比相对表达量降低,与空白对照组、抑制载体对照组相比相对表达量不变,24、36和48 h的相对表达量分别为2.13±0.08、6.26±0.20和0.86±0.03。在转染24 h时pEZX-AM02-miR-29a-3p抑制载体组中Bax/Mcl-1相对表达量较其他各对照组高,在转染48 h时Bax/Mcl-1相对表达量与其他各对照组相近,24、36、48 h的相对表达量分别为2.03±0.06、1.40±0.02和1.17±0.03。转染后24~48 h,pEZX-AM02-miR-29a-3p抑制载体组中caspase7、caspase8、Bax、Mcl-1及Bax/Bcl-2相对表达量均呈现先升高后降低的趋势,36 h达到最高水平。在巨噬细胞中抑制miR-29a-3p表达后,miR-29a-3p可通过靶向提高caspase7、caspase8、Bax、Mcl-1等基因的相对表达量来调控细胞凋亡水平。
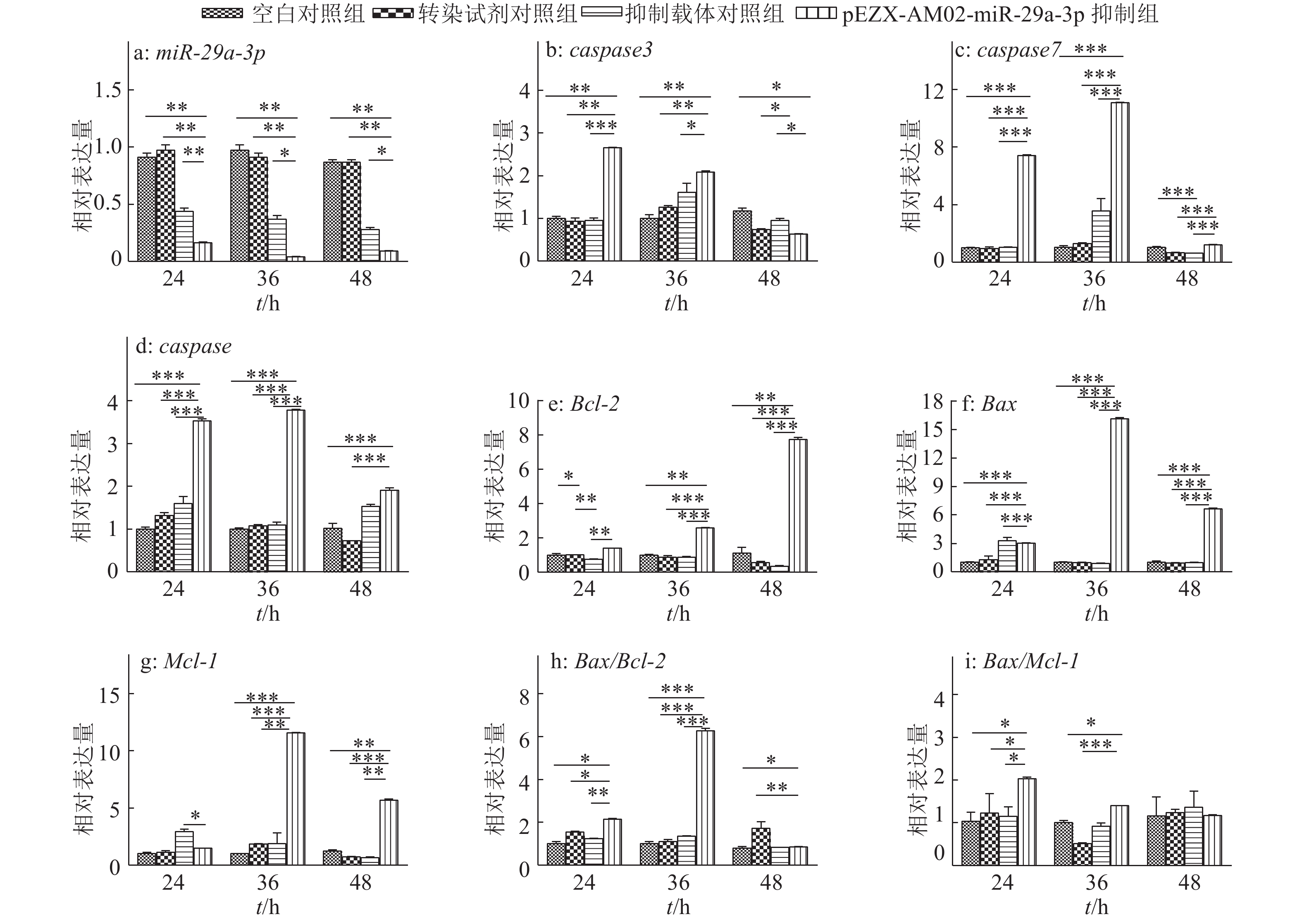
|
图 2 不同处理组凋亡相关基因24、36和48 h的表达 Figure 2 The expression of genes related to apoptosis in different groups at 24, 36 and 48 h after transfection “*”、“**”和“***”分别表示与对照组在0.05、0.01和0.005水平差异显著(Welch法) |
凋亡早期变化在细胞膜表面,磷脂酰丝氨酸(PS)由膜内暴露在外表面,Annexin V可以结合到PS 。由流式分析图(图3)及数据分析图(图4)可知,检测pEZX-AM02-miR-29a-3p载体转染RAW264.7细胞后得出Annexin V与PS结合增强,PS暴露增加,凋亡率升高,且24、36和48 h细胞凋亡率分别为23.47%±2.06%、76.47%±5.26%和51.90%±1.01%,均比阴性抑制载体对照组凋亡率高且差异极显著(P<0.01)。其中pEZX-AM02-miR-29a-3p载体转染RAW264.7后36 h的凋亡率为最高。
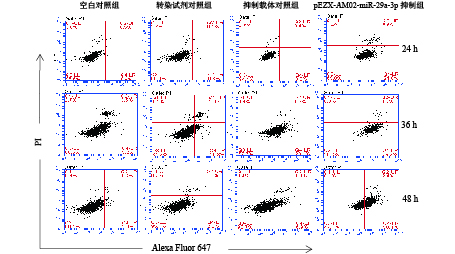
|
图 3 流式细胞术检测巨噬细胞凋亡 Figure 3 Macrophages apoptosis detected by flow cytometry |

|
图 4 巨噬细胞凋亡率 Figure 4 Macrophages apoptosis rate “*”、“**”和“***”分别表示与对照组在0.05、0.01和0.005水平差异显著(Welch 法) |
本试验中pEZX-AM02-miR-29a-3p抑制载体转染RAW264.7细胞后,于转染24、36和48 h后荧光定量PCR检测发现抑制小鼠巨噬细胞中miR-29a-3p的表达,且36 h时miR-29a-3p表达量最低,与之对应,流式细胞术检测到细胞凋亡率升高,且36 h时细胞凋亡率最高,为促凋亡作用。另外miR-29a-3p的靶基因中促凋亡基因caspase3、caspase7、caspase8及凋亡关键基因Bax表达量出现不同程度的升高。虽然其中抑凋亡基因Bcl-2与Mcl-1也检测到升高,但是这2个基因是通过与Bcl-2家族的促凋亡基因相互作用而影响着凋亡作用的。Bax/Mcl-1与Bax/Bcl-2表达量变化也相对升高,且Bax/Bcl-2表达量变化趋势与流式细胞术结果一致,为促凋亡作用,且36 h促凋亡作最强。caspase酶是半胱氨酸天冬氨酸酶,与细胞凋亡密切相关,其中caspase8为启动者,caspase3、caspase7为执行者。它们能够调节细胞的生长、发育和免疫应答,尤其是一些不正常细胞的凋亡。MTB侵入巨噬细胞后,会引起caspase酶活化,同时也会引起其他部分基因发生变化。不同毒力的MTB感染巨噬细胞后,引起细胞凋亡的程度会不同。毒力株主要以TNF-α和caspase酶等通路抑制细胞凋亡。结核分枝杆菌毒力株感染巨噬细胞后,可通过Mcl-1和Bcl-2 家族的促凋亡基因结合,从而抑制Bcl-2 家族促凋亡基因活性,抑制细胞凋亡,使MTB存活。MTB感染巨噬细胞以后,Bcl-2和Bax会大量表达,Bcl-2和Bax两者的比例会影响凋亡结果,Bcl-2的表达量高会利于细胞存活,而Bax表达量高则会促进凋亡,另外Mcl-1能够抑制部分的促凋亡基因表达,如Bak和Bax,从而抑制巨噬细胞凋亡[11-14]。Sharbati等[10]用鸟型分枝杆菌亚种感染人源单核细胞巨噬细胞后miR-29a-3p表达量上升,caspase3、caspase7等表达下调,马烽[15]发现miR-29a-3p可以通过靶向抑制IFN-γ的表达影响并控制细胞受到细菌感染的免疫反应。
结核分枝杆菌作为结核病的致病菌,其本身的存活与宿主免疫反应息息相关,而研究证实miRNAs参与了结核分枝杆菌通过多种机制逃逸巨噬细胞的免疫杀伤,如抑制巨噬细胞凋亡、抑制溶酶体水解酶降解酸化、抑制吞噬体成熟、干扰抗原呈递、避免反应氧和反应氮产物的毒性反应、抑制自噬等,使MTB在体内复制[16-17]。其中巨噬细胞的凋亡作用可以有效控制MTB的散播及生长,对MTB的清除具有重要意义。而miRNA可通过靶向关键基因,调控凋亡或信号转导的过程,进而影响宿主细胞对MTB的清除。本试验为阐叙miR-29a-3p在MTB感染巨噬细胞过程中的作用提供了一定的试验依据,也为靶向调控治疗结核病、筛选新的结核病诊断标志物奠定了一定的理论基础。
本研究表明,pEZX-AM02-miR-29a-3p载体抑制小鼠巨噬细胞中miR-29a-3p的表达;抑制miR-29a-3p表达可通过靶向上调caspase7、caspase8、Bcl-2、Mcl-1等基因的表达促进巨噬细胞的凋亡。
| [1] |
GRIFFITHS-JONES S, GROCOCK R J, VAN DONGEN S, et al. miRBase: microRNA sequences, targets and gene nomenclature[J]. Nucleic Acids Res, 2006, 34: 140-144. (  0) 0) |
| [2] |
O’CONNELL R M, RAO D S, CHAUDHURI A A, et al. Physiological and pathological roles for microRNAs in the immune system[J]. Nat Rev Immunol, 2010, 10(2): 111-22. (  0) 0) |
| [3] |
FENTON M J, VERMEULEN M W. Immunopathology of tuberculosis: Roles of macrophages and monocytes[J]. Infect Immun, 1996, 64(3): 683-690. (  0) 0) |
| [4] |
AUGENSTREICH J, ARBUES A, SIMEONE R, et al. ESX-1 and phthiocerol dimycocerosates of Mycobacterium tuberculosis act in concert to cause phagosomal rupture and host cell apoptosis
[J]. Cell Microbiol, 2017, 19(7): e12726. (  0) 0) |
| [5] |
GUPTA A, KAUL A, TSOLAKI A G, et al. Mycobacterium tuberculosis: Immune evasion, latency and reactivation
[J]. Immunobiology, 2012, 217(3): 363-374. (  0) 0) |
| [6] |
LIU M, WU L, XIANG X, et al. Mycobacterium tuberculosis, effectors interfering host apoptosis signaling
[J]. Apoptosis, 2015, 20(7): 883-891. (  0) 0) |
| [7] |
包孟, 付玉荣, 伊正君. 微小RNA在机体抗结核免疫及结核诊断中的研究进展[J]. 中华结核和呼吸杂志, 2015, 38(12): 918-921. (  0) 0) |
| [8] |
DAS K, SAIKOLAPPAN S, DHANDAYUTHAPANI S. Differential expression of miRNAs by macrophages infected with virulent and avirulent Mycobacterium tuberculosis
[J]. Tuberculosis, 2013, 93(Suppl): 47-50. (  0) 0) |
| [9] |
李金妹. 不同分枝杆菌侵染对巨噬细胞免疫相关基因及microRNAs表达的影响[D]. 长春: 吉林农业大学, 2015.
(  0) 0) |
| [10] |
SHARBATI J, LEWIN A, KUTZLOHROFF B, et al. Integrated microRNA-mRNA-analysis of human monocyte derived macrophages upon Mycobacterium avium subsp. hominissuis infection
[J]. Plos One, 2011, 6(6): e20258. (  0) 0) |
| [11] |
董伟杰, 李微, 刘丹霞, 等. 不同毒力结核分枝杆菌感染对巨噬细胞caspase-3及Bcl-2表达的影响
[J]. 中国病原生物学杂志, 2013(4): 302-306. (  0) 0) |
| [12] |
SLY L M, HINGLEYWILSON S M, REINERr N E, et al. Survival of Mycobacterium tuberculosis in host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2 family member Mcl-1
[J]. J Immunol, 2003, 170(1): 430-437. (  0) 0) |
| [13] |
KOZIEL J, MACIAGGUDOWSKAN A, MIKOLAJCZYK T, et al. Phagocytosis of Staphylococcus aureus by macrophages exerts cytoprotective effects manifested by the upregulation of antiapoptotic factors
[J]. PLoS One, 2009, 4(4): e5210. (  0) 0) |
| [14] |
刘云霞, 张万江. 结核分枝杆菌与巨噬细胞相互作用的研究进展[J]. 中国细胞生物学学报, 2012(6): 617-622. (  0) 0) |
| [15] |
马烽. microRNA介导的IL-10与IFN-γ表达的转录后调控机制研究[D]. 杭州: 浙江大学, 2011.
(  0) 0) |
| [16] |
杨静, 董剑. miRN A与结核分枝杆菌感染的研究进展[J]. 重庆医学, 2015(8): 1132-1134. (  0) 0) |
| [17] |
RAJARAM M V, NI B, DODD C E, et al. Macrophage immunoregulatory pathways in tuberculosis[J]. Semin Immumol, 2014, 26(6): 471-485. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


