随着人类对天然林的过度开发,林木资源日益减少,而快速发展的人工林正逐渐成为重要的森林资源来源。由于树种选择不当等原因,产生了大量的低效人工林。为此,低效人工林的改造逐渐成为研究热点。土壤作为植物生长的基质,是树木生长的载体。土壤养分,特别是氮、磷、钾是影响陆地植物群落生产力的重要因素[1];土壤质量也影响着林木经济效益和生态效益[2]。有关学者研究发现,林分改造后的低效人工林的土壤养分及酶活性均有改善[3-5]。加勒比松Pinus caribaea于1961年从古巴引进我国,具有生长快、适应性强、耐瘠薄等特点[6],是热带及亚热带重要的外来树种。但由于纯松林的结构简单、生态效益差,引发了地力衰退等一系列环境问题[7],因此引入阔叶树种对纯松林进行林分改造,是一条提高林分质量的有效途径。目前,有关学者对加勒比松的育种[8-9]、水土保持[10-12]和土壤[2, 13-16]开展过一些研究,但是鲜见改造后的加勒比松林土壤特性的报道。笔者对此进行研究,以期为广东省低效松林的抚育改造提供参考。
1 材料与方法 1.1 试验地概况试验地位于广东省佛山市林业与科学研究所(23°06′N、113°00′E),属于南亚热带季风气候。年平均气温21.8 ℃,年平均降雨量1 638 mm;汛期主要集中在春夏两季,降雨量占全年的八成左右。台风季节主要出现在7—10月。
试验林为25年生加勒比松人工林,位于5°的缓坡上,总面积10 hm2,株行距7 m×7 m,密度为204 株·hm–2。样地林分组成简单,乔木仅1层,且林冠稀疏,郁闭度为0.6。林下层植物稀少,灌木优势种有黄毛润楠Machilus chrysotricha、山指甲Ligustrum sinense和光叶山黄麻Trema cannabina,其重要值分别为33.33%、26.54%和33.33%,草本优势种有求米草Oplismenus undulatifolius和山菅兰Dianella ensifolia,其重要值分别为68.99%和20.37%。土壤是强酸性的赤红壤,林地凋落物量少[14],存在轻微土壤侵蚀,土壤N、P、K年流失量分别为341.0、6.5和701.0 g·hm–2[11-12]。
2005年5月对加勒比松林进行改造,在一部分加勒比松林的株间和行间插种黎蒴Castanopsis fissa、大叶相思Acacia mangium、红桂木Artocarpus nitidus ssp.Lingnanensis和油茶Camellia oleifera(简称P1样地),在一部分加勒比松林的株间和行间插种荷木Schima superba、光叶山矾Symplocos lancifolia、竹节树Carallia brachiata和油茶(简称P2样地),使改造后的松树林株行距为3.5 m×3.5 m,另外保留一块加勒比松林作为对照 (CK)。2016年4月,在2种改造后的和作为对照的加勒比松林各建立20 m×20 m的3个样地。3个样地的树木生长状况见表1。P1、P2和对照样地的凋落物储量分别为:1.61、2.27和0.18 kg·m–2。
|
|
表 1 3个样地加勒比松林基本特征 Table 1 Growth characteristics of three sample plots of Pinus caribaea stand |
2016年5月在3块样地各以5点取样法在0~20和20~40 cm土层分别采集土壤样品,带回试验室,分析土壤化学性质和酶活性。土壤pH采用GB 7859—87的电位法测定;土壤有机质含量采用GB 7857—87的重铬酸钾氧化–外加热法测定;土壤全氮含量用半微量凯氏法测定;用氢氧化钠碱熔法将土壤样品溶融后提取待测液,用钼蓝比色法测全磷含量,用火焰光度计测全钾含量;土壤碱解氮含量采用GB 7849—87的碱解–扩散法测定;土壤速效磷含量采用0.5 mol·L–1碳酸氢钠法测定;土壤速效钾含量采用GB 7856—87的1 mol·L–1乙酸铵浸提–火焰光度法测定[16]。
用高锰酸钾滴定法测定过氧化氢酶活性,用扩散法测定脲酶活性,用磷酸苯二钠比色法测定磷酸酶活性[17]。每个土壤样品做3次重复测定,结果取重复测定的算数平均值。
1.3 数据处理运用SPSS 17.0软件对各样地土壤养分含量和酶活性等性状指标进行多重比较及彼此间的相关性分析,P<0.05为显著差异,P<0.01为极显著差异。
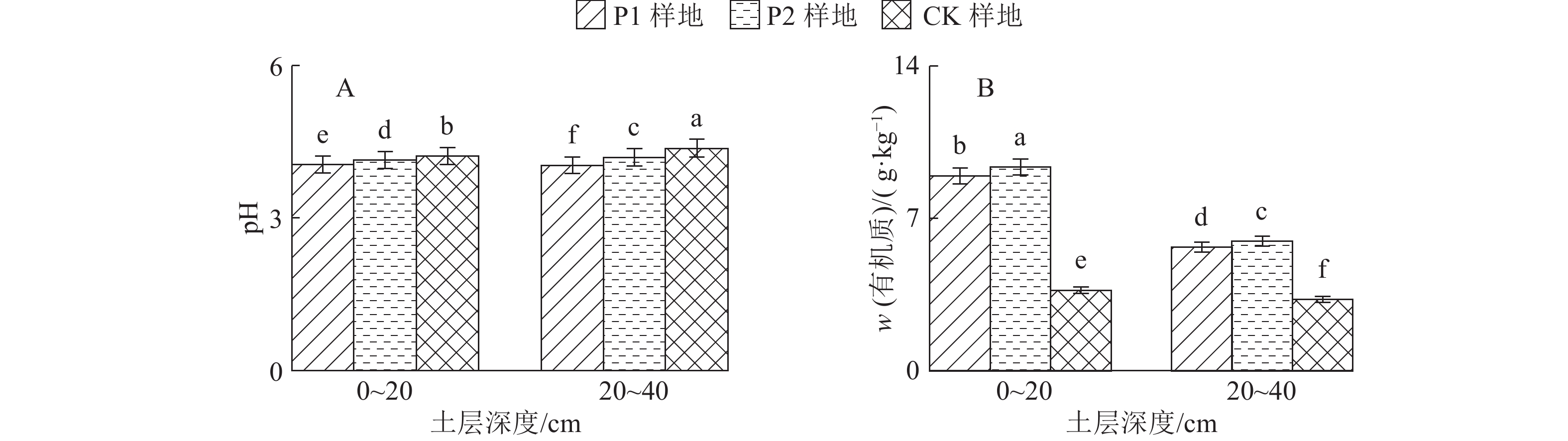
2 结果与分析 2.1 土壤化学性质不同样地的土壤pH见图1A。P1、P2和CK样地0~20 cm土层的土壤pH分别为4.05、4.14和4.22,20~40 cm土层的土壤pH分别为 4.04、4.20和4.37,均在4.0~5.0范围内,属酸性土壤。不同土层土壤之间差异显著(P<0.05),其中CK样地土壤的pH显著大于P2样地,而后者显著大于P1样地(P<0.05)。
|
图 1 各样地不同土层土壤pH和有机质含量 Figure 1 Soil pH and organic matter contents in different soil layers of three sample plots 各图中柱子上方凡是具有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s法) |
P1、P2和CK样地0~20 cm土层的土壤有机质分别为8.95、9.36和3.70 g·kg–1,20~40 cm土层的土壤有机质分别为5.68、5.95和3.28 g·kg–1(图1B),0~20及20~40 cm土层P2样地的土壤有机质含量显著大于对应土层的P1样地的土壤有机质含量,而后者显著高于CK样地的土壤有机质含量(P<0.05)。3个样地0~20 cm土层的土壤有机质含量均显著大于对应的20~40 cm土层土壤(P<0.05)。
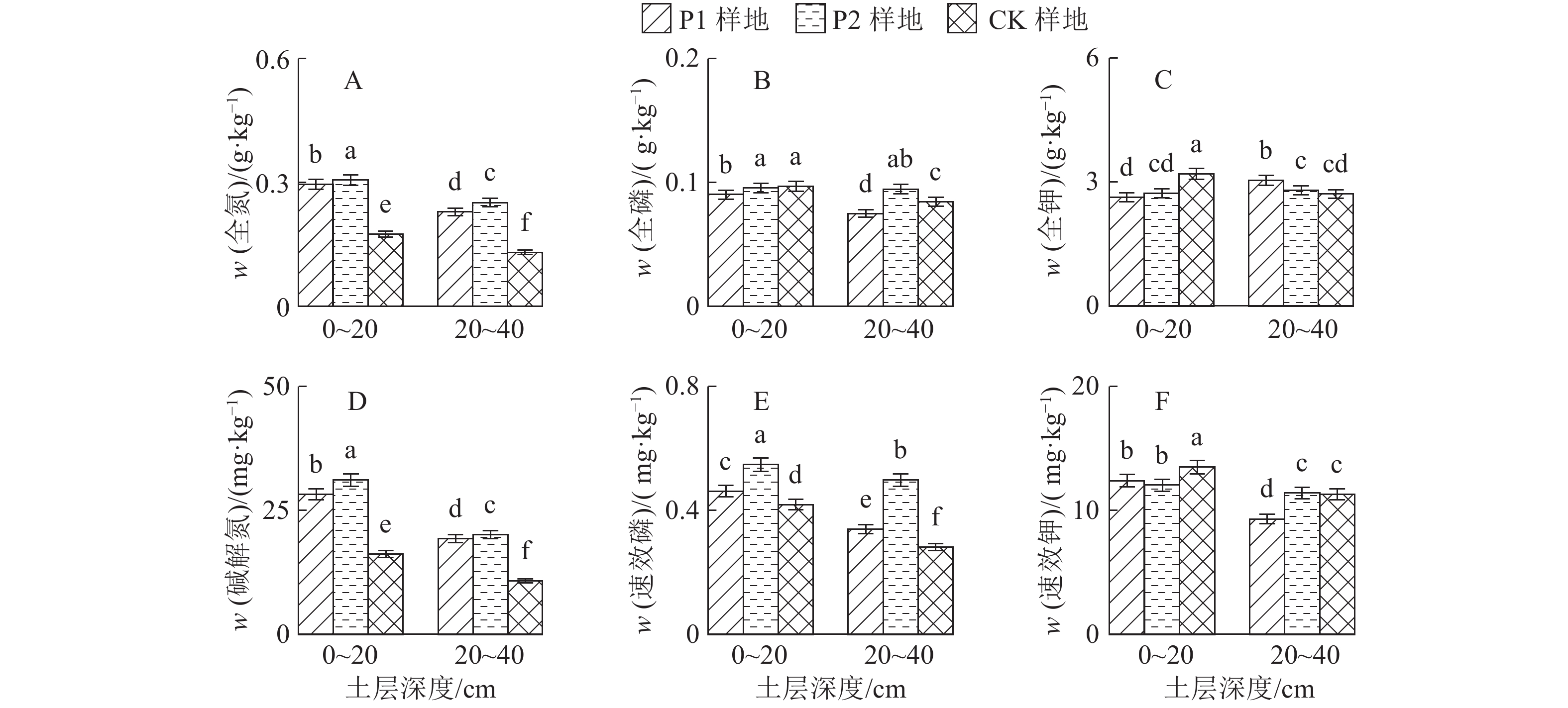
P1、P2和CK样地0~20 cm土层的土壤全氮分别为0.30、0.31和0.18 g·kg–1,20~40 cm土层的土壤全氮分别为0.23、0.25和0.13 g·kg–1(图2A),CK样地0~20及20~40 cm土层土壤的全氮含量显著小于对应土层的P1和P2样地。3个样地0~20 cm土层的土壤全氮含量显著大于对应的20~40 cm土层土壤(P<0.05)。
P1、P2和CK样地0~20 cm土层土壤的全磷分别为0.09、0.10和0.10 g·kg–1,20~40 cm土层土壤的全磷分别为0.07、0.09和0.08 g·kg–1(图2B),0~20 cm土层P1样地的土壤全磷含量显著小于P2和CK样地,20~40 cm土层P1样地的土壤全磷含量显著小于CK样地,CK样地显著小于P2样地(P<0.05)。3个样地0~20 cm土层的土壤全磷含量大于对应的20~40 cm土层土壤,且P1和CK样地差异显著(P<0.05)。
P1、P2和CK样地0~20 cm土层的土壤全钾分别为2.63、2.72和3.20 g·kg–1,20~40 cm土层的土壤全钾分别为3.04、2.79、2.71 g·kg–1(图2C),其中CK样地0~20 cm土层的土壤全钾含量显著大于其他样地相同土层土壤(P<0.05),20~40 cm土层的土壤全钾含量呈现P1样地>P2样地>CK样地。P1和P2样地0~20 cm土层的土壤全钾含量小于对应的20~40 cm土层土壤,CK样地则相反。
P1、P2和CK样地0~20 cm土层的土壤碱解氮分别为28.24 、31.15和16.20 mg·kg–1,20~40 cm土层的土壤碱解氮分别为19.31、20.14和10.80 mg·kg–1(图2D)。P2样地0~20和20~40 cm土层的碱解氮含量显著大于P1样地的相应土层,而后者又显著大于CK样地相应土层。3个样地0~20 cm土层的碱解氮含量显著大于对应的20~40 cm土层土壤(P<0.05)。
|
图 2 各样地不同土层的土壤养分含量 Figure 2 Soil nutrient contents in different soil layers of three sample plots 各图中柱子上方凡是具有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s法) |
P1、P2和CK样地0~20 cm土层的土壤速效磷分别为0.46、0.55和0.42 mg·kg–1,20~40 cm土层的土壤有效磷分别为0.34、0.50和0.28 mg·kg–1(图2E)。0~20及20~40 cm土层P2样地的速效磷含量显著大于对应土层的P1样地,后者显著大于CK样地。3个样地0~20 cm土层的速效磷含量显著大于对应的20~40 cm土层土壤(P<0.05)。
P1、P2和CK样地0~20 cm土层的土壤速效钾分别为12.42、12.03 和13.50 mg·kg–1,20~40 cm土层的土壤速效钾分别为9.31、11.40和11.29 mg·kg–1(图2F)。CK样地0~20 cm土层的土壤速效钾含量显著高于P1与P2样地(P<0.05),P1样地20~40 cm土层的土壤速效钾含量显著低于其他样地(P<0.05)。3个样地0~20 cm土层的速效钾含量显著大于对应的20~40 cm土层土壤(P<0.05)。
2.2 土壤酶活性P1、P2和CK样地0~20 cm土层的土壤过氧化氢酶活性分别为0.661、0.585和0.200 mL·g–1,20~40 cm土层的土壤过氧化氢酶活性分别为0.321、0.307和0.259 mL·g–1(图3A),P1样地0~20 cm土层的土壤过氧化氢酶活性显著高于P2样地,后者显著高于CK样地(P<0.05)。P1与P2样地20~40 cm土层的土壤过氧化氢酶活性显著高于CK样地(P<0.05)。P1和P2样地0~20 cm土层的土壤过氧化氢酶活性显著大于对应的20~40 cm土层土壤,CK样地则相反。

|
图 3 各样地不同土层土壤酶活性 Figure 3 Soil enzyme activities in different soil layers of three sample plots 各图中柱子上方凡是具有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s法) |
P1、P2和CK样地0~20 cm土层的土壤磷酸酶活性分别为238.512、297.459和105.077 mg·kg–1,20~40 cm土层的土壤磷酸酶活性分别为146.489、203.843、84.416 mg·kg–1,均为P2样地>P1样地>CK样地(图3B)。3个样地0~20和20~40 cm土层的土壤磷酸酶活性有显著差异(P<0.05)。3个样地0~20 cm土层的土壤磷酸酶活性显著大于对应的20~40 cm土层土壤的磷酸酶活性(P<0.05)。
P1、P2和CK样地0~20 cm土层的土壤脲酶活性分别为103.430、102.464和101.134 mg·kg–1,20~40 cm土层的土壤脲酶活性分别为96.380、100.804和94.756 mg·kg–1(图3C)。3个样地0~20 cm土层的土壤脲酶活性无显著差异,而P2样地20~40 cm土层的土壤脲酶活性显著高于其他样地土壤(P<0.05)。P1和CK样地0~20 cm土层的土壤脲酶活性显著大于相应20~40 cm土层土壤,P2样地2层土壤的土壤脲酶活性相近。
2.3 土壤酶活性和土壤养分指标间的相关分析对所有样地的土壤酶活性和土壤养分含量分别进行Pearson相关分析,由表2可以看出,过氧化氢酶活性与有机质、全氮、碱解氮含量呈极显著正相关(P<0.01),与全钾含量呈极显著负相关(P<0.01),与pH呈显著负相关,与速效磷呈显著正相关(P<0.05);磷酸酶活性与有机质、全氮、碱解氮和速效磷含量呈极显著正相关(P<0.01),与pH和全钾含量呈显著负相关(P<0.05);脲酶活性与有机质、全氮、全磷、碱解氮和速效磷含量呈极显著正相关(P<0.01),与速效钾呈显著正相关(P<0.05)。
|
|
表 2 土壤酶活性和土壤养分含量间的相关分析1) Table 2 Correlation analyses between soil enzyme activities and soil nutrients in three sample plots |
P1、P2和CK样地不同深度的土壤pH均为4.0~4.5,属酸性土壤。佛山地处南亚热带,终年高温多雨,风化淋溶引起强烈的脱硅、盐基淋失和富铁铝化过程,风化释放的钾、钠、钙、镁等元素随水向下层土壤移动,导致上层土壤呈酸性。
土壤有机质、全氮、碱解氮和速效磷含量均为P2样地>P1样地>CK样地,林分改造后的P1、P2样地的凋落物储量分别为CK样地的9和12倍。相关研究表明,凋落物量与土壤有机质、全氮含量呈极显著线性相关[18]。森林凋落物是森林碳库和养分库的重要物质[19-20],可以调节土壤有机物[21]。凋落物数量和质量影响土壤动物和微生物的活动及酶活性,促进凋落物分解,进而影响归还到土壤中的有机质和养分[22]。此外,土壤有机质的主要来源依赖于凋落物的分解、根系分泌物和其他的代谢产物。改造过的样地由于根系分泌物较多,凋落物分解能力较强,从而促进有机酸的释放,使土壤难溶性磷得到释放[23] ,因此有机质含量[24]、氮和有效磷含量均较高。相反,CK样地的林下植被稀少、凋落物少,影响养分回归土壤。另外,南方雨量充沛,林下植被稀少会导致相对严重的水土、速效养分流失。因此CK样地的有机质、氮和速效磷含量比林分改造后的P1、P2样地低。
P1、P2和CK样地0~20 cm土层的土壤全磷含量均较低,0~20 cm土层的土壤全钾含量为CK样地>P1 样地>P2 样地。由于佛山地处亚热带,年平均气温高且降雨量多,这种气候特点促使土壤的风化速率加快和磷素淋溶增加,导致了全磷含量的整体偏低。林分改造后的P1和P2样地0~20 cm土层的土壤钾含量比CK样地低,原因是林分改造后土壤氮含量增加,土壤更易达到氮饱和的状态。同时,佛山地区年降雨量多,大量的雨水伴随着NO3– 的淋溶程度的加强,引起土壤表层的K+ 作为NO3– 的电荷平衡离子从土壤中淋失[25],所以上土层的钾含量也相对较低。
改造后的林分凋落物增多,积累于地表腐烂后,形成较厚的腐殖质层,同时根系在林地土壤表层分布较密集,有利于表层土壤肥力的改善。土壤表层的有机质和养分在雨水淋溶时向土壤下层迁移的过程中不断减少[26],所以林分改造样地的上层土壤的各种养分含量通常显著大于下层土壤。
3.2 不同样地的土壤酶活性土壤酶活性与土壤有机质和养分密切相关。林分改造后,P1和P2样地的过氧化氢酶和磷酸酶活性均显著高于CK样地。过氧化氢酶参与生物呼吸作用过程中各种有机物的生物化学氧化反应,因此其活性可以表征土壤腐质化强度和有机质积累程度[27]。磷酸酶在土壤磷素循环中起重要作用,其活性高低可表征土壤的供磷能力[28]。P1和P2样地的土壤有机质含量高,有利于微生物的生长代谢,同时,阔叶树种和林下植物的根系分泌,也提高了过氧化氢酶和磷酸酶活性[29]。由Pearson相关分析可知,过氧化氢酶活性与有机质、全氮和碱解氮含量极显著正相关。因此,林分改造样地的过氧化氢酶活性高,有利于土壤腐殖质形成和土壤有机质的积累,使土壤肥力提高。3个样地上、下土层的磷酸酶活性均表现为P2样地>P1样地>CK样地,磷酸酶活性的增强,可加速有机磷的循环,增加磷的有效性。相比于CK样地,经过改造的P2、P1样地的磷酸酶活性增加,从而促进磷的活化,因此土壤有效磷含量相应较高。本研究中土壤磷酸酶活性与土壤有机质、全氮、碱解氮和速效磷含量存在极显著正相关性,这与王晶苑等[29]和于群英[30]的研究结果一致,表明林分改造的样地土壤磷酸酶活性提高,有利于土壤有机质、氮和有效磷的积累。
脲酶是酰胺酶的一种,大量研究表明,土壤脲酶活性与有机质和氮含量关系密切,且大多呈正相关关系[31-33] ,脲酶直接参与尿素在土壤中的转化与生化作用[34],能促进有机分子中肽键的水解,有助于土壤速效氮的转化[35],与本研究结果一致。也有学者认为,脲酶活性与有机质和氮含量呈负相关[36-39]。由于酶活性受pH、温度、紫外线、重金属盐等多种因素的共同影响,其中土壤含水量、温度过高或过低都能影响土壤微生物和动物的生长和繁衍,引起酶活性的钝化[40],因此在不同环境中,对脲酶与有机质和氮素之间关系的研究结果存在差异。
林分改造通过调整树种与林分结构,能提高林分的生态和社会效益。选择好树种以及安排好混交组合是改造的关键[41]。P2 样地的大部分养分指标高于P1 样地,表明在加勒比松林下栽植荷木、光叶山矾、竹节树和油茶的组合模式比栽植藜蒴、大叶相思、红桂木和油茶的组合模式更有利于土壤肥沃,改造效果更好。
| [1] |
韩世忠, 郑雄, 马红亮, 等. 不同园林树种叶片N·P·K养分内吸收作用[J]. 安徽农业科学, 2013, 541(25): 10319-10322. (  0) 0) |
| [2] |
LIE G, XUE L, ZENG S. Impact of litter removal on soil characteristics under a Pinus caribaea stand
[J]. Toxicol Environ Chem, 2016, 98(5/6): 571-584. (  0) 0) |
| [3] |
蒋谦才, 张晖, 何美儿, 等. 生态公益林改造对土壤理化性质的影响[J]. 林业科技开发, 2009, 23(2): 80-82. (  0) 0) |
| [4] |
郭雄飞, 陈璇, 黎华寿, 等. 不同林分改造模式对土壤酶活性及微生物数量的影响[J]. 中南林业科技大学学报, 2015, 35(9): 30-34. (  0) 0) |
| [5] |
郭雄飞, 黎华寿, 杨玥, 等. 宫胁法造林对佛山市森林土壤质量的影响[J]. 西北林学院学报, 2016, 31(6): 58-64. (  0) 0) |
| [6] |
傅静丹, 薛立, 郑卫国, 等. 加勒比松凋落物对土壤性状的影响[J]. 林业科学研究, 2009, 22(2): 303-307. (  0) 0) |
| [7] |
陈奶发, 郭宜强, 汪水前. 马尾松人工纯林林分存在问题及对策[J]. 亚热带水土保持, 2008, 20(1): 41-43. (  0) 0) |
| [8] |
洑香香, 赵虎, 王玉. 松属近缘种形态和分子鉴定及其亲缘关系探讨[J]. 林业科学, 2011, 47(10): 51-58. (  0) 0) |
| [9] |
宗亦臣, 郑勇奇, 陈贰, 等. 加勒比松杂交育种试验[J]. 东北林业大学学报, 2011, 39(3): 1-4. (  0) 0) |
| [10] |
郑科, 郎南军, 杨新民, 等. 干热河谷山合欢、加勒比松林地雨季中末期水文侵蚀效应的研究[J]. 水土保持学报, 2003, 17(2): 84-88. (  0) 0) |
| [11] |
薛立, 史小玲, 冯慧芳, 等. 加勒比松林凋落物对地表径流和氮、磷流失的影响[J]. 植物生态学报, 2009, 33(5): 878-884. (  0) 0) |
| [12] |
薛立, 傅静丹, 郑卫国, 等. 有无枯落物覆盖对加勒比松林地表径流及其K流失的影响[J]. 林业科学研究, 2010, 23(4): 510-514. (  0) 0) |
| [13] |
薛立, 邝立刚, 陈红跃, 等. 不同林分土壤养分、微生物与酶活性的研究[J]. 土壤学报, 2003, 40(2): 280-285. (  0) 0) |
| [14] |
陆耀东, 薛立, 曹鹤, 等. 去除地面枯落物对加勒比松(Pinus caribaea)林土壤特性的影响
[J]. 生态学报, 2008, 28(7): 3205-3211. (  0) 0) |
| [15] |
薛立, 冯慧芳, 潘澜, 等. 湿地松林和加勒比松林的土壤特性研究[J]. 华南农业大学学报, 2010, 31(3): 52-55. (  0) 0) |
| [16] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
(  0) 0) |
| [17] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.
(  0) 0) |
| [18] |
赵萌. 杉木人工林土壤微生物数量及其与土壤因子的关系[D]. 长沙: 中南林业科技大学, 2007.
(  0) 0) |
| [19] |
王相娥, 薛立, 谢腾芳. 凋落物分解研究综述[J]. 土壤通报, 2009, 40(6): 1473-1478. (  0) 0) |
| [20] |
卢广超, 邵怡若, 薛立. 氮沉降对凋落物分解的影响研究进展[J]. 世界林业研究, 2014, 27(1): 35-42. (  0) 0) |
| [21] |
JIANG Y, YIN X, WANG F. The influence of litter mixing on decomposition and soil fauna assemblages in a Pinus koraiensis mixed broad-leaved forest of the Changbai Mountains, China
[J]. Eur J Soil Biol, 2013, 55(1): 28-39. (  0) 0) |
| [22] |
杨新芳, 鲍雪莲, 胡国庆, 等. 大兴安岭不同火烧年限森林凋落物和土壤C、N、P化学计量特征[J]. 应用生态学报, 2016, 27(5): 1359-1367. (  0) 0) |
| [23] |
宋金凤. 凋落物中的有机酸及其对森林土壤的磷释放效应[D]. 哈尔滨: 东北林业大学, 2003.
(  0) 0) |
| [24] |
王志超, 杜阿朋, 赵知渊, 等. 3种密度邓恩桉人工林凋落物贮量与土壤有机质的研究[J]. 中南林业科技大学学报, 2013, 33(4): 56-60. (  0) 0) |
| [25] |
赵晶, 闫文德, 郑威, 等. 樟树人工林凋落物养分含量及归还量对氮沉降的响应[J]. 生态学报, 2016, 36(2): 350-359. (  0) 0) |
| [26] |
李洁, 周彤彤, 侯晓丽, 等. 冰雪灾害对粤北杉木林土壤养分状况和酶活性的影响[J]. 西南林业大学学报, 2016, 36(4): 36-41. (  0) 0) |
| [27] |
薛立, 赖日石, 陈红跃, 等. 不同坡位造林地酶活性与土壤养分的关系[J]. 土壤通报, 2002, 33(4): 278-280. (  0) 0) |
| [28] |
王渭玲, 杜俊波, 徐福利, 等. 不同施肥水平对桔梗土壤微生物和土壤酶活性的影响[J]. 中国中药杂志, 2013, 38(22): 3851-3856. (  0) 0) |
| [29] |
王晶苑, 张心昱, 温学发, 等. 氮沉降对森林土壤有机质和凋落物分解的影响及其微生物学机制[J]. 生态学报, 2013, 33(5): 1337-1346. (  0) 0) |
| [30] |
于群英. 土壤磷酸酶活性及其影响因素研究[J]. 安徽技术师范学院学报, 2001, 15(4): 5-8. (  0) 0) |
| [31] |
白翠霞, 耿玉清, 梁伟. 八达岭地区主要森林类型土壤脲酶活性研究[J]. 四川农业大学学报, 2005, 23(4): 424-427. (  0) 0) |
| [32] |
杜天庆, 苗果园. 豆科牧草根际土壤脲酶活性的研究[J]. 中国生态农业学报, 2007, 15(1): 25-27. (  0) 0) |
| [33] |
陈彩虹, 叶道碧. 4 种人工林土壤酶活性与养分的相关性研究[J]. 中南林业科技大学学报, 2010, 30(6): 64-68. (  0) 0) |
| [34] |
张清明, 冯瑞芝, 张保华, 等. 盐胁迫下吡虫啉对棉田土壤微生物数量及酶活性的影响[J]. 水土保持研究, 2014, 21(3): 25-30. (  0) 0) |
| [35] |
薛立, 傅静丹, 郑卫国, 等. 3种人工幼林的土壤微生物和酶活性研究[J]. 中南林业科技大学学报, 2008, 28(4): 98-100. (  0) 0) |
| [36] |
兰雪, 戴全厚, 喻理飞, 等. 喀斯特退化森林不同恢复阶段土壤酶活性研究[J]. 农业现代化研究, 2009, 30(5): 620-624. (  0) 0) |
| [37] |
刘淑娟, 张伟, 王克林. 桂西北喀斯特峰丛洼地不同植被演替阶段的土壤脲酶活性[J]. 生态学报, 2011, 31(19): 5789-5796. (  0) 0) |
| [38] |
姜海燕, 闫伟, 袁秀英. 大兴安岭兴安落叶松林土壤酶活性研究[J]. 内蒙古农业大学学报(自然科学版), 2013, 34(1): 48-51. (  0) 0) |
| [39] |
叶莹莹, 刘淑娟, 张伟, 等. 喀斯特峰丛洼地植被演替对土壤微生物生物量碳、氮及酶活性的影响[J]. 生态学报, 2015, 35(21): 6974-6982. (  0) 0) |
| [40] |
杨万勤, 王开运. 土壤酶研究动态与展望[J]. 应用与环境生物学报, 2002, 8(5): 564-570. (  0) 0) |
| [41] |
陈红跃. 生态公益林林分改造树种选择的技术路线探讨[J]. 广东林业科技, 2008, 24(1): 83-87. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


