伪狂犬病病毒(Pseudorabies virus, PRV)属疱疹病毒科α疱疹病毒亚科,可感染各个年龄段的猪,导致母猪发生流产、产死胎和木乃伊胎,新生仔猪的大量死亡及成年猪的呼吸道症状等,对养猪业危害巨大。采用基因缺失疫苗免疫结合相应的鉴别诊断方法可以有效区分疫苗免疫动物与野毒感染动物,是防控伪狂犬病的重要措施[1]。但自2011年以来,我国猪伪狂犬病卷土重来,老病新发[2-4]。对新分离毒株的研究表明,新流行毒株处于一个相对独立的分支,与以往分离株遗传关系较远,且比原有毒株致病性更强[2, 5-6]。经PRV基因缺失疫苗免疫的猪场也未能控制猪伪狂犬病,表明Bartha-K61等传统疫苗已不再能提供完全保护[6-8]。因此,有必要研究针对当前流行毒株的疫苗以控制该病的流行为害。
本研究拟采用同源重组技术构建针对当前PRV流行株的gE/gI缺失突变株,并评价其增殖能力、遗传稳定性及免疫原性,为进一步研制相应的gE/gI缺失弱毒疫苗或灭活疫苗奠定一定的基础。
1 材料与方法 1.1 试验动物4周龄SPF级雌性昆明系小鼠,购自南方医科大学实验动物中心。
1.2 试验毒株和试剂PRV AH株病毒,分离自我国安徽某发病猪群的流产仔猪,经鉴定属PRV流行毒株[9];BHK-21细胞、Escherichia coli DH5α、pEGFP-N1质粒均由华南农业大学兽医学院微生物教研室保存;pMD®18-T、限制性内切酶Hind Ⅲ、PstⅠ、EcoR Ⅴ、T4 DNA连接酶、PrimeSTAR®HS DNA聚合酶购自TaKaRa公司;苯酚、三氯甲烷、蛋白酶K、RNase酶、低熔点琼脂糖购自Sigma公司;Lipofectamine® 2000 Reagent购自Invitrogen公司;质粒抽提试剂盒、DNA凝胶回收试剂盒购自Omega公司;DMEM细胞营养液与胎牛血清购自Gibco公司。
1.3 方法 1.3.1 引物设计参照GenBank登录的PRV ZJ01(GI:32187339)序列,用Primer5.0软件分别设计同源臂左臂(LA)和同源臂右臂(RA)的引物,LA和RA分别位于gE基因的上、下游。参照GenBank登录的pEGFP-N1序列(GI:1377911),设计引物扩增EGFP基因的完整表达盒。设计引物分别用于扩增gE基因、EGFP基因短片段,用于重组病毒的检测。引物由生工生物(上海)有限公司合成。引物序列见表1。
|
|
表 1 本试验所涉及的引物 Table 1 Primers used in this study |
以PRV AH株基因组为模板,采用PrimeSTAR®HS DNA聚合酶分别扩增同源臂左臂LA,同源臂右臂RA,PCR反应条件为:94 ℃预变性5 min;94 ℃变性45 s,退火45 s,72 ℃延伸2 min,循环30次;72 ℃末次延伸10 min。LA、RA序列的PCR扩增最适退火温度分别为60和55 ℃。以pEGFP-N1为模板,采用EGFP-R1、EGFP-R2引物扩增EGFP基因的表达盒,PCR反应条件为:94 ℃预变性5 min;94 ℃变性1min,55 ℃退火1 min,72 ℃延伸2 min,循环30次,72 ℃终延伸10 min。
1.3.3 重组转移质粒的构建与鉴定将LA PCR产物与pMD®18-T连接构建pMD-LA,经Hind Ⅲ和PstⅠ双酶切后与经同样酶切的RA PCR产物连接构建重组转移质粒pMD-LA-RA。将pMD-LA-RA与EGFP基因的表达盒经EcoRⅤ酶切后连接,使EGFP插入到LA、RA之间,构建携带EGFP基因表达盒的重组转移质粒pMD-LA-EGFP-RA。重组转移质粒pMD-LA-RA与pMD-LA-EGFP-RA进行酶切与测序鉴定。
1.3.4 重组病毒的构建与筛选将重组转移质粒pMD-LA-EGFP-RA转染BHK-21细胞,4 h后用PRV AH株接种转染的细胞,使质粒与病毒基因组在细胞内发生同源重组,收集病变细胞进行空斑纯化,以EGFP为筛选标记,筛选出含绿色荧光的空斑,即可获得gE/gI基因缺失且携带EGFP基因的重组病毒PRV AH gE –/gI –/EGFP+。为了剔除EGFP基因,将重组转移质粒pMD-LA-RA转染BHK-21细胞后,用PRV AH gE –/gI –/EGFP+接种转染的细胞,进行第2次同源重组,然后进行空斑纯化,筛选出不出现绿色荧光的空斑,即可获得gE/gI基因缺失的重组病毒PRV AH gE –/gI –。
1.3.5 重组病毒的鉴定将重组病毒PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –接种BHK-21细胞,病变后提取病变细胞的基因组作为模板,用gE、EGFP基因检测引物进行PCR扩增,以验证重组病毒构建是否成功。同时通过荧光显微镜观察重组病毒PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –接种BHK-21细胞后绿色荧光的表达情况,以进一步鉴定重组病毒。为了进一步确定PRV AH gE –/gI –的缺失区域,利用LA-F2/RA-R2引物进行PCR扩增,并进行测序及序列比对。
1.3.6 重组病毒的生物学特性研究将重组病毒PRV AH gE –/gI –/EGFP+、PRV AH gE –/gI –和亲本毒PRV AH株以1感染复数(Multiplicity of infection,MOI)的量接种长成单层的BHK-21细胞,于不同时间点分别取样,测定半数细胞培养物感染量(TCID50),以不同时间点的–lg(TCID50)值绘制各病毒的一步生长曲线,评价PRV AH gE –/gI –的增殖能力。将PRV AH gE –/gI –在BHK-21细胞上连续传代15代,提取每代重组病毒的基因组,利用LA-F2/RA-R2引物进行PCR扩增及序列测定,评价病毒的遗传稳定性。将PRV AH gE –/gI –灭活,与Montanide Gel佐剂按体积比9∶1制备灭活疫苗,以105.0TCID50、106.0TCID50免疫4周龄昆明系小鼠,4周后加强免疫1次,于免疫前及首次免疫后2、4、5、6、7、8周分别眼球采血,测定血清中和抗体效价,并于首次免疫后8周分别以100 LD50的PRV经典毒株和PRV AH对免疫小鼠进行攻毒,以评价PRV AH gE –/gI –的免疫保护效果。
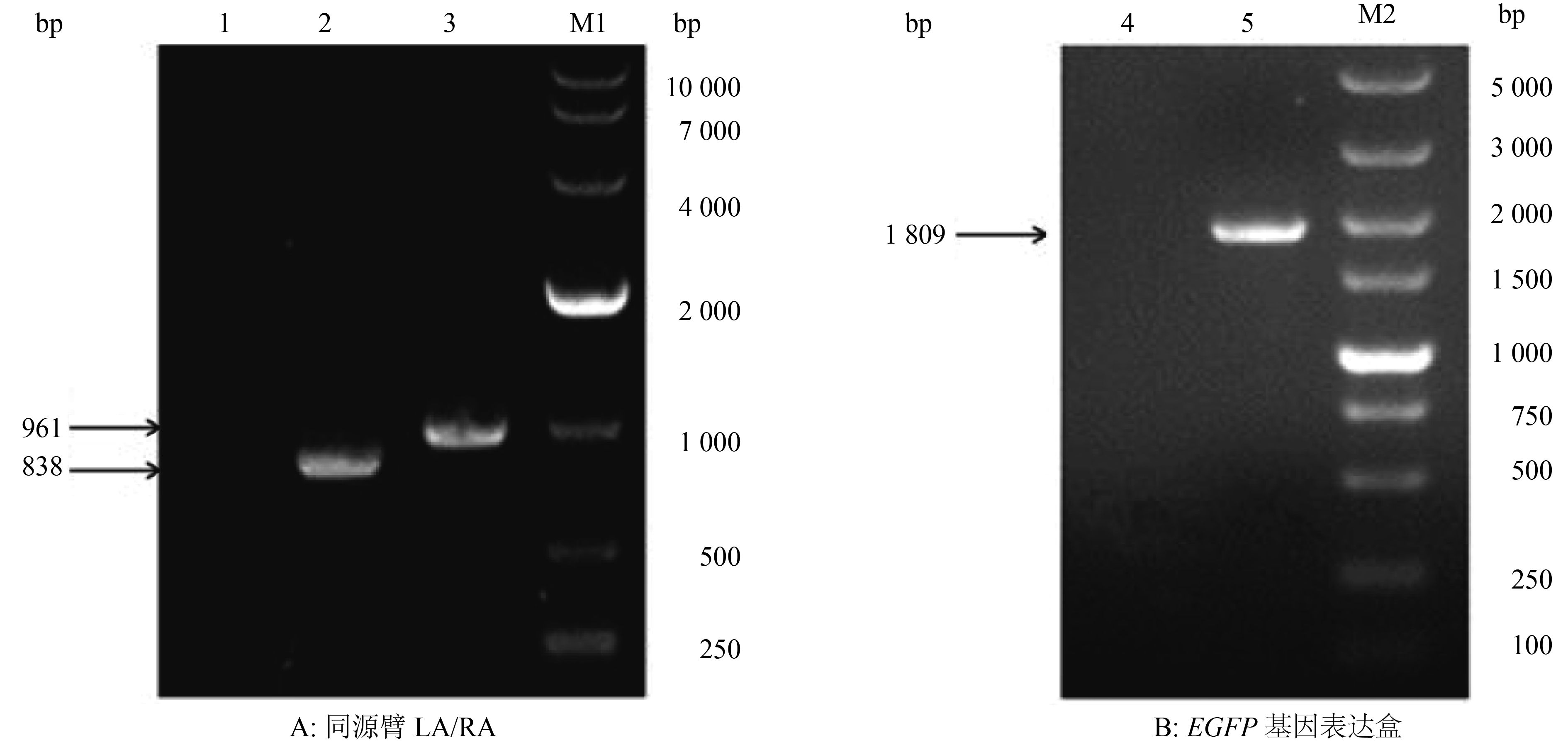
2 结果与分析 2.1 同源臂及EGFP基因表达盒的PCR扩增提取PRV AH病毒基因组为模板,用同源左臂LA和同源右臂RA的引物进行PCR扩增,PCR产物经10 g·L–1琼脂糖凝胶电泳检测,获得了LA和RA的特异性扩增条带,大小约为838和961 bp,与预期结果相符(图1A)。
以提取的pEGFP-N1质粒为模板,用扩增EGFP基因表达盒的引物进行PCR,PCR产物经10 g·L–1琼脂糖凝胶电泳检测,获得了大小约为1 809 bp的特异性扩增条带,与预期结果相符(图1B)。
|
图 1 同源臂LA/RA与EGFP基因表达盒的PCR扩增结果 Figure 1 PCR amplication of homologous arm LA/RA and EGFP gene expression cassette 1:阴性对照;2:LA;3:RA;M1:DL10000 DNA Marker;4:阴性对照;5:EGFP基因表达盒;M2:DL5000 DNA Marker |
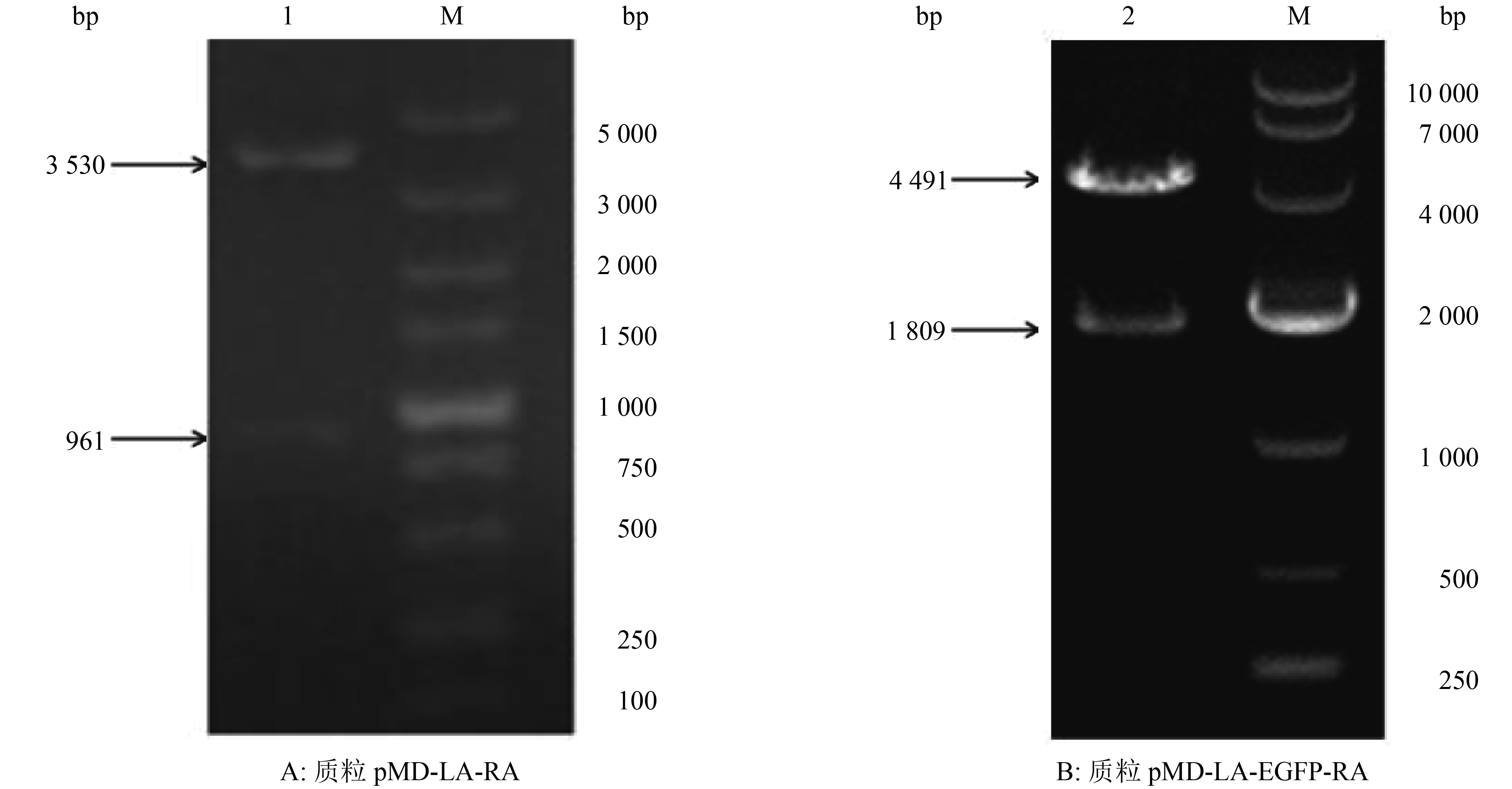
将重组转移质粒pMD-LA-RA用PstⅠ和Hind Ⅲ进行双酶切,酶切产物经10 g·L–1琼脂糖凝胶电泳检测,从图2A中可以看到2条特异性条带,大小约为3 530和961 bp,分别与pMD-LA和RA的预期大小相符。
将重组转移质粒pMD-LA-EGFP-RA用EcoRⅤ进行单酶切,酶切产物经10 g·L–1琼脂糖凝胶电泳检测,从图2B中可以看到2条特异性条带,大小约为4 491和1 809 bp,分别与pMD-LA-RA和EGFP基因表达盒的预期大小相符。
对酶切鉴定正确的重组转移质粒pMD-LA-RA和pMD-LA-EGFP-RA进一步进行测序鉴定,测序结果表明重组转移质粒构建成功。
|
图 2 重组质粒的酶切鉴定结果 Figure 2 Identification of recombinant plasmid by restriction enzyme digestion M:DL5000 DNA Marker;1:PstⅠ+ Hind Ⅲ;2:EcoR Ⅴ |
采用EGFP-F2/EGFP-R2、gE-F/gE-R 2对引物对重组病毒PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –进行PCR鉴定,结果(图3)显示,从PRV AH gE –/gI –/EGFP+中可以扩增出EGFP基因,但不能扩增出gE基因,表明PRV AH gE –/gI –/EGFP+已缺失gE基因,且成功插入EGFP基因(图3A);而从PRV AH gE –/gI –中既不能扩增出EGFP基因,也不能扩增出gE基因,表明PRV AH gE –/gI –不仅缺失gE基因,也成功将标记基因EGFP删除(图3B)。

|
图 3 重组病毒PRV-AH gI –/gE –/EGFP+与PRV-AH gI –/gE –的PCR鉴定结果 Figure 3 Identification of recombinant virus PRV-AH gI –/gE –/EGFP+ and PRV-AH gI –/gE – by PCR M:DL5000 DNA Marker;1~4:EGFP扩增结果(775 bp);5~7:gE片段扩增结果(292 bp);1、5:PRV-AH gI –/gE –/EGFP+; 2:pEGFP-N1;3、6:PRV AH;4、7:阴性对照;8~10:EGFP片段扩增结果(775 bp);11~13:gE片段扩增结果(292 bp);8、11:PRV AH gI –/gE –;9:pEGFP-N1;10、13:阴性对照;12:PRV AH |
在PCR鉴定的基础上,将重组病毒PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –接种BHK-21细胞,通过荧光显微镜观察,PRV AH gE –/gI –/EGFP+接种细胞出现绿色荧光,而PRV AH gE –/gI –接种细胞不发荧光,进一步表明标记基因EGFP被成功剔除(图4)。

|
图 4 重组病毒感染BHK-21细胞的病变情况 Figure 4 Cytopathic effect of BHK-21 cells infected by recombinant viruses A1、B1、C1:普通光观察PRV AH、PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –感染BHK-21细胞的病变;A2、B2、C2:荧光观察PRV AH、PRV AH gE –/gI –/EGFP+及PRV AH gE –/gI –感染BHK-21细胞的病变;A3、B3、C3:普通光与荧光观察结果的叠加图(merge);D1、D2、D3:未感染病毒的BHK-21细胞 |
利用LA-F2/RA-R2引物从PRV AH gE –/gI –基因组中扩增出大小约310 bp的条带,经测序并与PRV ZJ01株(KM061380.1)序列比对,结果显示PRV AH gE –/gI –基因组缺失区域对应于PRV ZJ01株碱基位点的121 349~124 032,缺失区域长2 684 bp,包括gI基因3'端906 bp、gE基因5'端1 675 bp及gI与gE之间的序列103 bp。
2.4 重组病毒的生物学特性研究将重组病毒PRV AH gE –/gI –/EGFP+、PRV AH gE –/gI –和亲本毒株PRV AH接种BHK-21细胞,以接毒后的时间为横坐标,以–lg(TCID50)值为纵坐标绘制各病毒的一步生长曲线(图5),结果显示,在接毒后不同时间,特别是在接毒后54 h前,重组病毒PRV AH gE –/gI –的TCID50均低于亲本PRV AH毒株,表明gE、gI基因的缺失对PRV的增殖有一定的影响,这也与gE、gI基因的功能相符。PRV AH株在接毒后第48小时滴度最高,TCID50为10–7.63 mL–1,PRV AH gE –/gI –株滴度达到最高的时间略有延后,在接毒后的第54 小时滴度最高,TCID50为10–7.13 mL–1。

|
图 5 重组病毒和亲本病毒的生长曲线 Figure 5 The growth curve of recombinant viruses and parental strain |
将PRV AH gE –/gI –在BHK-21细胞上连续传代15代,对各代病毒进行PCR扩增及序列测定,结果表明从每代病毒中均可扩增出大小约为310 bp的条带,且扩增区域未见突变,表明重组病毒PRV AH gE –/gI –具有良好的遗传稳定性。
将PRV AH gE –/gI –灭活疫苗免疫小鼠,105.0TCID50免疫组在首次免疫后6周(二免后2周) 小鼠血清中出现PRV中和抗体,106.0TCID50免疫组在首次免疫后4周出现PRV中和抗体,在首次免疫后7周,各组免疫小鼠血清中和抗体水平达到最高(表2)。首次免疫后8周,以100 LD50的PRV经典毒株和PRV AH对免疫小鼠进行攻毒,免疫剂量为每只小鼠105.0TCID50时,经PRV AH株攻毒后保护率为62.5%(5/8),经PRV经典株攻毒后保护率为50%(4/8);免疫剂量为每只小鼠106.0TCID50时,经PRV AH株、PRV经典株攻毒后均无死亡,保护率为100%(8/8),表明106.0TCID50免疫剂量的PRV AH gI –/gE –灭活疫苗免疫小鼠对致死剂量PRV AH株、PRV经典株均可获得完全保护。
|
|
表 2 不同剂量PRV AH gE –/gI –灭活疫苗免疫小鼠后的中和抗体水平 Table 2 Neutralizing antibody titers of immunized mice with different dosages of PRV AH gE –/gI – inactivated vaccine |
近几年来,伪狂犬病在我国许多猪场再次流行,给养猪业造成了严重的经济损失。为了控制PRV流行毒株对猪群的巨大危害,国内已有多位学者开展了流行毒株基因缺失疫苗的研究。Wang等[10]通过同源重组技术构建了PRV TJ株的gE缺失突变株,该毒株免疫6周龄的仔猪对TJ株的致死性攻击可获得完全保护。Gu等[11]、Tong等[12]分别利用细菌人工染色体技术(BAC)、同源重组技术构建了PRV gI –/gE –双缺失突变株,并且以该毒株制备的疫苗对仔猪及母猪均具有很好的免疫保护效果。多位学者通过细菌人工染色体技术(BAC)、同源重组技术、CRISPR/Cas9系统构建了PRV TK –/gI –/gE –三缺失突变株,并评价了该毒株对仔猪的免疫保护效果[13-16]。
本研究以在国内猪场分离的流行毒株PRV AH为亲本毒株,采用同源重组技术构建了gE、gI双缺失突变株。同源重组技术的关键步骤之一是构建转移载体,本研究在构建转移载体时,采用PCR技术扩增2条同源臂,其中同源左臂长838 bp,包含部分gD基因和部分gI基因,同源右臂长961 bp,包含部分gE基因、全部US9基因和部分US2基因。将构建的转移载体与亲本毒株PRV AH进行同源重组后通过空斑纯化获得了PRV gE –/gI –双缺失突变株,经测序鉴定该突变株缺失了2 684 bp。
在本研究中,进行同源重组时不是采用转移载体与病毒基因组共转染细胞的方式,而是采用先将转移载体转染细胞,然后再用病毒感染已转染细胞的方式,这样使病毒基因组以自然感染的方式进入转染细胞,与转移载体发生同源重组,这样既省去了提取病毒基因组的繁琐步骤,也不用考虑病毒基因组的纯度及完整性等对同源重组效率的影响。
本研究构建的基因缺失突变株具有良好的增殖能力、遗传稳定性及免疫原性,免疫小鼠后对致死剂量PRV经典毒株及流行毒株均可提供完全保护,有望作为一种新的疫苗候选株用于PRV的防控。同时该毒株缺失了PRV gE基因,在增殖过程中不能表达gE糖蛋白,因此以该毒株制备的疫苗免疫动物后不能刺激动物机体产生抗gE糖蛋白的抗体,可与目前常用的PRV gE鉴别诊断试剂盒配合使用,用于疫苗免疫动物和野毒感染动物的鉴别诊断,从而有利于猪场伪狂犬病根除计划的实施。
| [1] |
童光志, 陈焕春. 伪狂犬病流行现状及我国应采取的防制措施[J]. 中国兽医学报, 1999, 19(1): 1-2. (  0) 0) |
| [2] |
彭金美, 安同庆, 赵鸿远, 等. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J]. 中国预防兽医学报, 2013, 35(1): 1-4. (  0) 0) |
| [3] |
童武, 张青占, 郑浩, 等. 免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J]. 中国动物传染病学报, 2013, 21(3): 1-7. (  0) 0) |
| [4] |
叶培根. 猪伪狂犬病: 剖析猪伪狂犬病的新动向[J]. 北方牧业, 2013, 12: 23. (  0) 0) |
| [5] |
AN T Q, PENG J M, TIAN Z J, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012[J]. Emerg Infect Dis, 2013, 19(11): 1749-1755. DOI:10.3201/eid1911.130177 (  0) 0) |
| [6] |
WU R, BAI C, SUN J, et al. Emergence of virulent pseudorabies virus infection in Northern China[J]. J Vet Sci, 2013, 14(3): 363-365. DOI:10.4142/jvs.2013.14.3.363 (  0) 0) |
| [7] |
YU X L, ZHOU Z, HU D M, et al. Pathogenic pseudorabies virus, China, 2012[J]. Emerg Infect Dis, 2014, 20(1): 102-104. DOI:10.3201/eid2001.130531 (  0) 0) |
| [8] |
LUO Y Z, LI N, CONG X, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J]. Vet Microbiol, 2014, 174(1/2): 107-115. (  0) 0) |
| [9] |
向柯宇, 潘慧, 吉艺宽, 等. 猪伪狂犬病病毒新流行株主要糖蛋白的分子特征分析[J]. 华南农业大学学报, 2016, 37(3): 23-28. DOI:10.7671/j.issn.1001-411X.2016.03.004 (  0) 0) |
| [10] |
WANG C H, YUAN J, QIN H Y, et al. A novel gE-deleted pseudorabies virus (PRV) provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population in China
[J]. Vaccine, 2014, 32(27): 3379-3385. DOI:10.1016/j.vaccine.2014.04.035 (  0) 0) |
| [11] |
GU Z Q, DONG J, WANG J C, et al. A novel inactivated gE/gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge
[J]. Virus Res, 2015, 195: 57-63. DOI:10.1016/j.virusres.2014.09.003 (  0) 0) |
| [12] |
TONG W, LI G X, LIANG C, et al. A live, attenuated pseudorabies virus strain JS-2012 deleted for gE/gI protects against both classical and emerging strains
[J]. Antiviral Res, 2016, 130: 110-117. DOI:10.1016/j.antiviral.2016.03.002 (  0) 0) |
| [13] |
ZHANG C L, GUO L H, JIA X R, et al. Construction of a triple gene-deleted Chinese pseudorabies virus variant and its efficacy study as a vaccine candidate on suckling piglets[J]. Vaccine, 2015, 33(21): 2432-2437. DOI:10.1016/j.vaccine.2015.03.094 (  0) 0) |
| [14] |
HU R M, ZHOU Q, SONG W B, et al. Novel pseudorabies virus variant with defects in TK, gE and gI protects growing pigs against lethal challenge
[J]. Vaccine, 2015, 33(43): 5733-5740. DOI:10.1016/j.vaccine.2015.09.066 (  0) 0) |
| [15] |
CONG X, LEI J L, XIA S L, et al. Pathogenicity and immunogenicity of a gE/gI/TK gene-deleted pseudorabies virus variant in susceptible animals
[J]. Vet Microbiol, 2016, 182: 170-177. DOI:10.1016/j.vetmic.2015.11.022 (  0) 0) |
| [16] |
LIANG X, SUN L Q, YU T, et al. A CRISPR/Cas9 and Cre/Lox system-based express vaccine development strategy against re-emerging Pseudorabies virus[J]. Sci Rep, 2016, 6: 19176. DOI:10.1038/srep19176 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


