2. 广东第二师范学院 生物与食品工程学院/广东高校应用生态工程技术开发中心,广东 广州 510303
2. Biology and Food Engineering Institute, Guangdong University of Education/Guangdong Development Center of Applied Ecology and Ecological Engineering in Universities, Guangzhou 510303, China
磷脂酰肌醇3–激酶(Phosphoinositide 3-kinase, PI3K)是一类特异性催化磷脂酰肌醇(Phosphatidylinositol,PI)磷酸化的激酶家族[1],具有丝氨酸–苏氨酸激酶的活性及磷脂酰肌醇激酶的活性[2],可以使肌醇环上的3’—OH磷酸化,磷酸化的肌醇脂作为第2信使调节下游分子。PI3K信号通路广泛存在细胞中,是参与细胞生长、增殖与分化调节的典型信号转导通路[3-4]。在卵巢卵泡发育过程中,PI3K信号通路在调节原始卵泡库卵泡休眠、生存与激活中起着关键作用[5]。在PI3K通路中,PTEN、TSC、FOXO3、P27抑制原始卵泡的激活,而PI3K、PDK1、AKT、mTOR和rpS6可以促进原始卵泡的激活。任何一个抑制因子的缺失都会导致整个原始卵泡库的过度激活和卵泡的快速耗竭,从而引起卵巢早衰[5];任何一个激活因子的缺失都会导致原始卵泡从休眠阶段直接凋亡[5]。这些抑制因子与激活因子相互作用,共同调节原始卵泡休眠与激活。同时,PI3K信号通路在有腔卵泡的募集、选择、优势化、排卵[6-8]及颗粒细胞的增殖和分化等生物学过程中起关键调控作用。
rpS6基因编码的蛋白质称为核糖体蛋白S6(rpS6),rpS6是PI3K信号通路的一个重要的下游效应因子[5, 9],该蛋白是核糖体40S小亚基的组成成分,主要通过磷酸化和去磷酸化发挥作用,广泛参与蛋白质合成、细胞增殖、控制某些类型细胞的大小等生命活动[10]。目前,PI3K信号通路关键基因及rpS6基因在猪卵巢卵泡中的表达规律尚不清楚。本研究观察了不同发育阶段的长大二元母猪卵巢卵泡发育特点,检测了PI3K信号通路关键基因和rpS6基因的mRNA表达水平及磷酸化的rpS6(p-rpS6)在不同时期猪卵巢卵泡中的表达规律,这些工作将对进一步了解PI3K信号通路在猪卵巢卵泡发生过程中的分子调控机制具有重要意义。
1 材料与方法 1.1 材料试验动物:选自广东省中山市某猪场的12日龄、30日龄、70日龄、20月龄黄体期(3胎次)、20月龄卵泡期(3胎次)和48月龄(4年8胎)的长大二元杂母猪各3头进行屠宰,其中,20月龄母猪被鉴定开始发情后,分别在黄体期(从发情开始至第13天)及卵泡期(发情开始后的第13至第19天)时屠宰。
组织采样:猪屠宰后迅速采集卵巢组织,一侧卵巢放于w为4%的多聚甲醛中固定,以备进行组织学分析;另一侧卵巢组织,迅速放入DEPC处理过的5.0 mL离心管后投进液氮中冷冻,然后保存于–80 ℃,用于RT-qPCR、Western blot试验。
主要试剂:HE染色试剂盒购自广州市外显子生物技术有限公司;总RNA提取试剂Trizol、PrimeScript®1st Strand cDNA Synthesis Kit、定量用SYBR®Premix Ex TaqTM试剂盒、PrimeStar高保真DNA聚合酶、DL2000、DL500均购自TaKaRa公司;p-rpS6购自上海优宁维生物科技有限公司。其他均为常规化学试剂。
1.2 组织学染色观察制备每个时期卵巢的石蜡切片,取3张有代表性切片进行梯度乙醇溶液(φ为90%、70%)脱色,苏木素染色1 min,自来水浸泡15 min,梯度乙醇溶液(φ为70%、90%)漂洗,伊红染色20 min,脱水,透明,封片。显微镜拍照观察。
1.3 反转录定量PCR (RT-qPCR)参照Invitrogen TRIzol操作说明书,提取母猪卵巢组织的总RNA;总RNA的RT-qPCR参照TaKaRa公司的试剂盒说明书进行操作。根据每个基因的NCBI的GenBank登录号设计定量PCR引物,基因信息和引物序列见表1。RT-qPCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃ 退火30 s,72 ℃延伸15 s,循环40次;72 ℃延伸40 s。在PCR反应过程中,设置获得熔解曲线的程序。
|
|
表 1 RT-qPCR引物序列 Table 1 Sequences of primers for RT-qPCR |
取约100 mg卵巢组织,加入1 mL组织裂解液和10 μL 100 mmol·L–1的苯甲基黄酰氟(Phenylmethanesulfonyl fluoride, PMSF)。钵体研磨,冰上静置30 min,移至1.5 mL离心管中。4 ℃高速离心机以12 000 r·min–1离心30 min,取上清,用液氮保存。取已定量蛋白,按1∶4的体积比加入5×电泳上样缓冲液,沸水煮5 min,12 000 r·min–1离心3 min,待用。上样(考马斯亮蓝G-250法检测总蛋白定量,每个样品的上样量为80 μg总蛋白)。SDS-PAGE胶电泳、蛋白转膜、室温封闭1.5 h,抗体孵育,ECL显色,样品膜放置暗箱中曝光定影。
1.5 软件和数据的统计分析采用Primer Premier 5.0软件设计引物;采用DNASTAR、Vector NTI 8.0软件分析基因序列;用NCBI、Ensemble搜索相关基因序列信息;数据分析采用Excel软件,使用SSR法进行多重比较分析。
2 结果与分析 2.1 不同时期猪卵巢组织的形态学观察12日龄仔猪的卵巢体积很小,呈新月形。HE染色结果表明,此时期卵巢皮质边缘有大量的原始卵泡(图1A),皮质与髓质交界处可见少量初级卵泡,颗粒细胞的层数在2~3层(图1B)。30日龄仔猪卵巢皮质仍然以原始卵泡为主,次级卵泡的数量增加,但其颗粒细胞层数在5层左右(图1C)。70日龄仔猪卵巢上则出现较多次级卵泡,其颗粒细胞层数多在5层以上,可观察到少量的3级卵泡(图1D)。20月龄母猪卵泡期的卵巢上有大量的成熟卵泡(图1E、1F),而20月龄黄体期与48月龄老年期母猪卵巢可见大体积的黄体,并且48月龄母猪卵巢皮质边缘较难观察到原始卵泡(图1G、1H)。

|
图 1 不同时期猪卵巢的卵泡组织学观察 Figure 1 Representative microphotographs of porcine ovaries at different stages A:12日龄,B:12日龄,C:30日龄,D:70日龄,E:20月龄(卵泡期),F:20月龄(卵泡期),G:20月龄(黄体期),H:48月龄;a:原始卵泡,b:初级卵泡,c:次级卵泡,d:3级卵泡,Oo:卵母细胞,GC:颗粒细胞,spGC:扁平颗粒细胞,AF:闭锁卵泡,CL:黄体 |
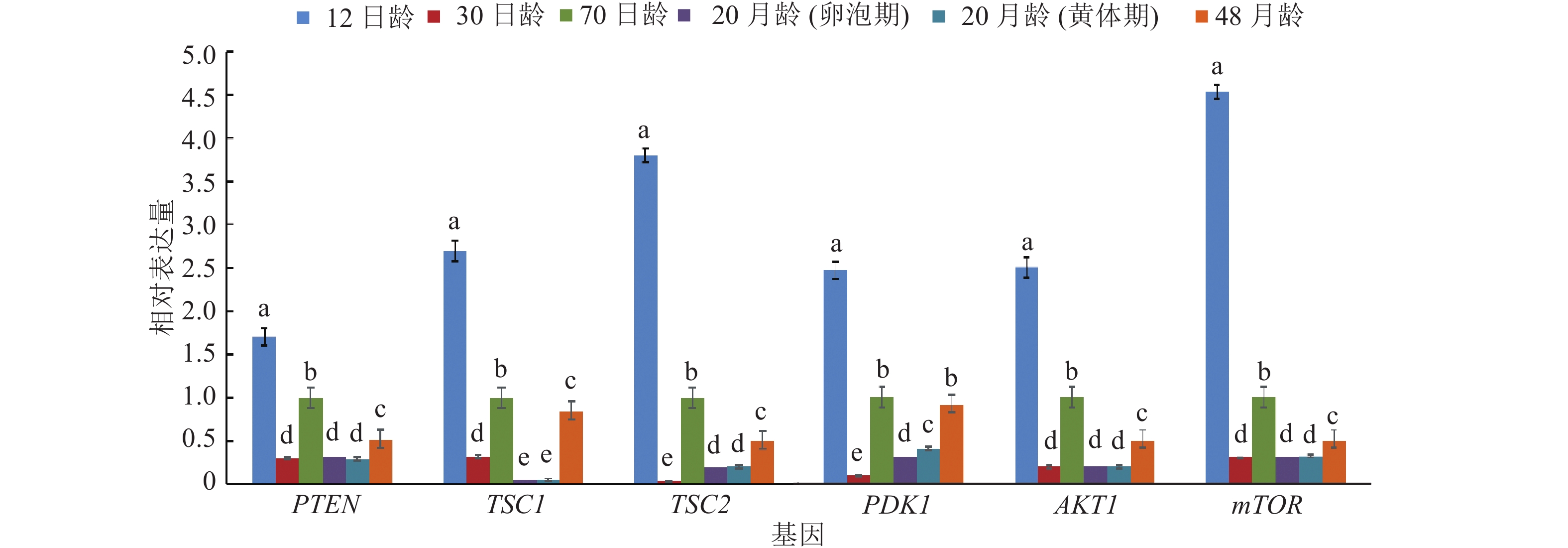
由图2所示,不同时期猪卵巢PI3K信号通路中各关键基因包括PTEN、TSC1、TSC2、PDK1、mTOR和AKT1,表达规律均表现为:在12日龄表达量最高, 显著高于其他时期(P<0.05),70日龄、48月龄的表达量次之,30日龄、20月龄卵泡期及黄体期的表达量相对较低。
|
图 2 不同时期猪卵巢PI3K信号通路关键基因的mRNA表达 Figure 2 Ovarian mRNA expression levels of key genes of PI3K signaling pathway in pigs at different stages 相同基因不同颜色的柱子上方凡具有一个相同小写字母者,表示差异不显著(P>0.05, SSR法) |
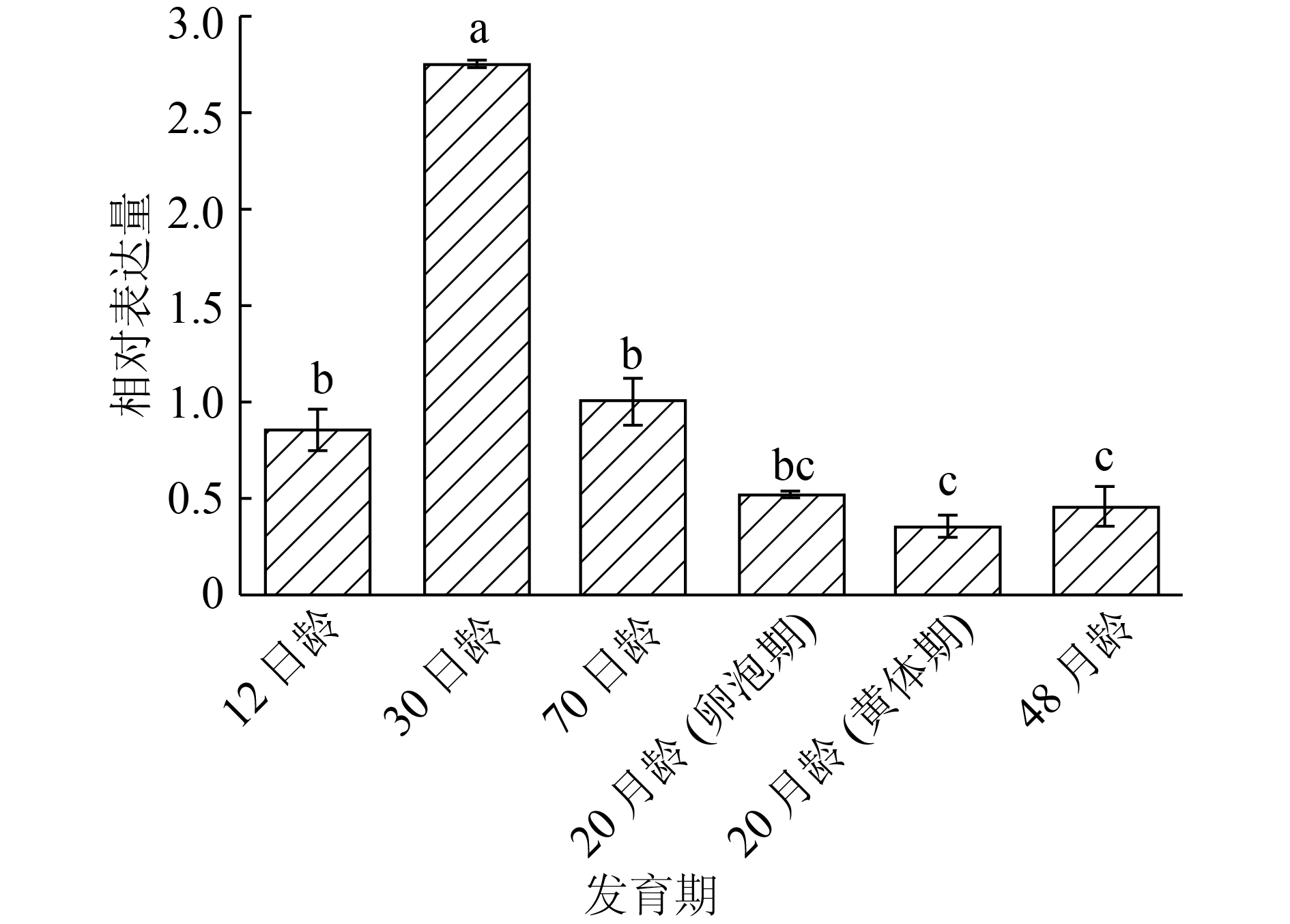
由图3所示,下游基因中的rpS6在30日龄的表达量最高;12日龄表达量与70日龄表达量显著高于20月龄(黄体期)和48月龄的表达量。
|
图 3 不同时期猪卵巢rpS6基因的mRNA表达 Figure 3 Ovarian mRNA expression levels of rpS6 gene in pigs at different stages 柱子上方凡具有一个相同小写字母者,表示差异不显著(P>0.05, SSR法) |
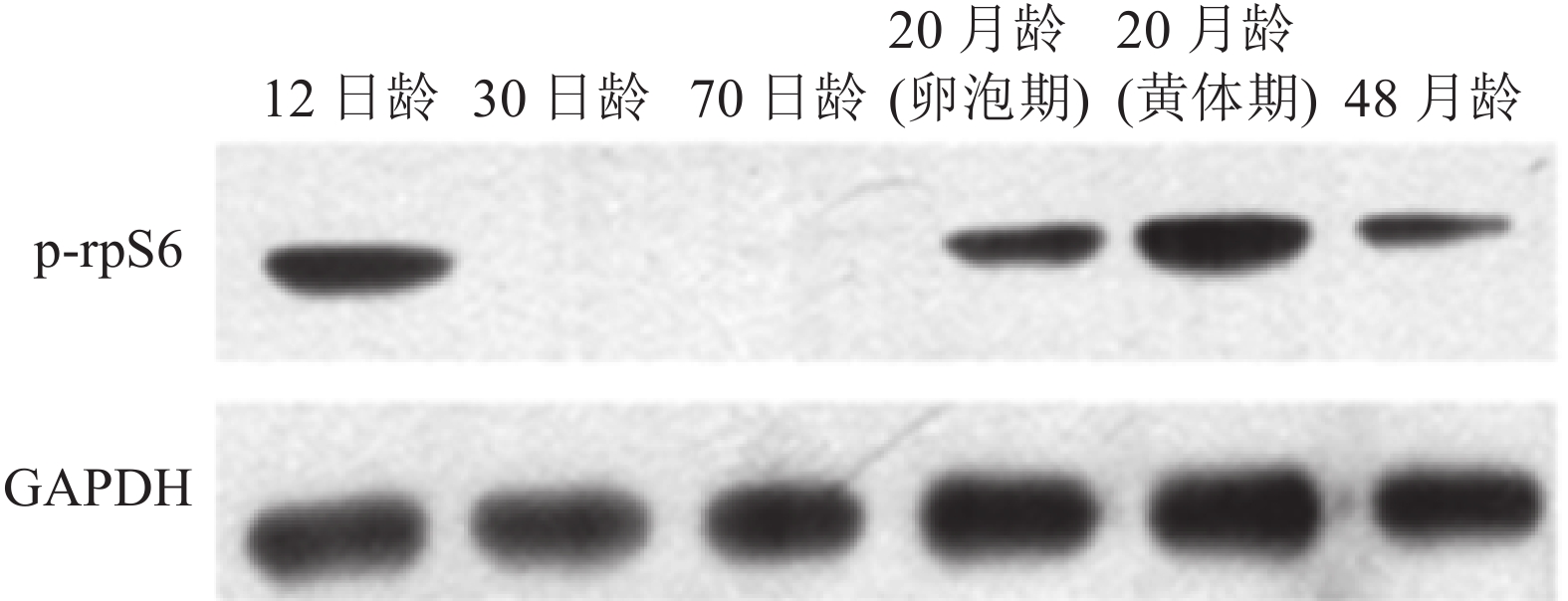
采用Western blot法检测p-rpS6蛋白在不同时期猪卵巢组织中的表达水平,结果显示,p-rpS6在12日龄、20月龄(卵泡期)、20月龄(黄体期)、48月龄表达丰度较高,30日龄与70日龄表达丰度在一个较低的水平(图4)。
|
图 4 不同时期猪卵巢p-rpS6蛋白的表达 Figure 4 Ovarian expressions of p-rpS6 protein in pigs at different stages |
哺乳动物卵巢卵泡由原始卵泡依次发育成初级卵泡、次级卵泡和有腔卵泡后,经历募集、选择、优势化以及成熟排卵闭锁等一系列连续复杂的过程[11-12]。本研究发现,12日龄的卵巢有着大量的原始卵泡,少量的初级卵泡,说明卵泡发生开始于12日龄之前。到30日龄,原始卵泡中卵母细胞的体积大于12日龄,但是其颗粒细胞层数仍在5层左右,说明30日龄原始卵泡的卵母细胞在迅速增长。70日龄的卵巢出现3级卵泡,卵泡体积明显增大,但30日龄与70日龄的卵母细胞体积大小相当,说明这段时间颗粒细胞的增殖与增长是卵泡体积变大的主要原因,早期的卵泡发育中颗粒细胞的增殖缓慢,而卵母细胞经历了极快速的增长,这些结果与前人的报道[13-15]一致。而20月龄卵泡期的卵巢上观察到大量的成熟卵泡,此时的母猪一般在第3胎次,母猪繁殖性能较好。48月龄老年期的卵巢皮质边缘较难观察到原始卵泡,说明该时期的卵巢原始卵泡接近耗竭,而此时期的母猪一般处于淘汰期,繁殖性能较差。这些结果与母猪的繁殖生理状态一致。
3.2 PI3K通路关键基因的表达与卵泡发生的关系多个研究发现PI3K信号通路可以调节卵母细胞的生长、调控原始卵泡的休眠与激活、促进颗粒细胞的增殖和分化[16-17],而且卵巢卵泡内PI3K信号通路表达水平的微调是调节原始卵泡存活或者激活的关键[9]。本研究发现PI3K信号通路关键基因PTEN、TSC1、TSC2、PDK1、mTOR、AKT1在每个时期都有一定水平的表达,说明PI3K通路可能参与卵巢卵泡的生长发育,这与Fan等[7]和Brown等[18]在小鼠卵巢卵泡上研究PI3K信号通路的结果一致。6个基因在12日龄高水平表达,而12日龄的卵巢有着大量的原始卵泡和少量的初级卵泡,说明了此时期PI3K通路的主要功能可能是维持原始卵泡休眠与存活,这与Reddy等[19]的研究结果一致。与30日龄的卵巢相比,70日龄的卵巢出现较多次级卵泡,颗粒细胞增长迅速,6个基因表达量都显著的上调,说明了此时期PI3K通路不仅参与卵泡的发生,同时可能参与颗粒细胞的增殖与分化,这与Fan等[20]的研究结果一致。
3.3 rpS6基因和磷酸化rpS6对卵泡发生的调控大量研究表明,rpS6基因编码核糖体蛋白S6主要通过磷酸化和去磷酸化发挥作用,广泛参与蛋白质合成、细胞增殖、控制某些类型细胞的大小及其他生理过程[10, 21-22]。在本研究中发现,rpS6基因的表达趋势与PTEN、TSC1、TSC2、PDK1、Akt1、mTOR基因不一致,说明rpS6基因在卵巢卵泡的发育过程中可能表现出与其他6个基因不一样的功能。与12日龄的卵巢相比,30和70日龄卵巢中rpS6基因的mRNA表达水平较高,但是p-rpS6几乎不表达,可能与该时期卵巢卵泡的特点有关。30日龄卵巢上出现大量的次级卵泡,70日龄卵巢上出现有3级卵泡,这2个时期与12日龄相比,卵母细胞的体积更大,数目更多,RNA合成相对比较旺盛[23],所以这2个时期的rpS6的mRNA表达水平相对较高。而p-rpS6需要去磷酸化,并与U3组成核蛋白复合体,参与18S前体rRNA的成熟加工[24],可能是导致在30、70日龄卵巢几乎检测不到p-rpS6的原因。此外,大量研究表明p-rpS6可以提高细胞周期蛋白cdc2、cyclinB的翻译,促进排卵[25]。20月龄卵泡期的p-rpS6表达量较高,而此时期的卵巢上有大量的成熟卵泡,说明p-rpS6可能参与卵巢卵泡的成熟与排卵。综上所述,PI3K通路下游的p-rpS6,能够作为促进蛋白质翻译与核糖体生物合成的效应因子参与卵泡发生的调控,但具体的作用机制还需要进一步研究。
| [1] |
王笑, 王甄真, 陈雁. PI3K/AKT信号通路在维持血糖平衡中的作用[J]. 生命科学, 2013(2): 133-139. DOI:10.3785/j.issn.1008-9209.2012.11.063 (  0) 0) |
| [2] |
MABUCHI S, KURODA H, TAKAHASHI R, et al. The PI3K/AKT/mTOR pathway as a therapeutic target in ovarian cancer[J]. Gynecol Oncol, 2015, 137(1): 173-179. DOI:10.1016/j.ygyno.2015.02.003 (  0) 0) |
| [3] |
CANTLEYL C. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296(5573): 1655-1657. DOI:10.1126/science.296.5573.1655 (  0) 0) |
| [4] |
ENGELMANJ A, LUO J, CANTLEY L C. The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism[J]. Nat Rev Genet, 2006, 7(8): 606-619. DOI:10.1038/nrg1879 (  0) 0) |
| [5] |
REDDY P, ZHENG W, LIU K. Mechanisms maintaining the dormancy and survival of mammalian primordial follicles[J]. Trends Endocrin Met, 2010, 21(2): 96-103. DOI:10.1016/j.tem.2009.10.001 (  0) 0) |
| [6] |
ZELEZNIK A J, SAXENA D, LITTLE-IHRIG L. Protein kinase B is obligatory for follicle-stimulating hormone-induced granulosa cell differentiation[J]. Endocrinology, 2003, 144(9): 3985-3994. DOI:10.1210/en.2003-0293 (  0) 0) |
| [7] |
FAN H Y, RICHARDS J S. Minireview: Physiological and pathological actions of RAS in the ovary[J]. Mol Endocrinol, 2010, 24(2): 286-298. DOI:10.1210/me.2009-0251 (  0) 0) |
| [8] |
GONZALEZ-ROBAYNA I J, FALENDERA E, OCHSNER S, et al. Follicle-stimulating hormone (FSH) stimulates phosphorylation and activation of protein kinase B (PKB/Akt) and serum and glucocorticoid-lnduced kinase (Sgk): Evidence for a kinase-independent signaling by FSH in granulosa cells[J]. Mol Endocrinol, 2000, 14(8): 1283-1300. DOI:10.1210/mend.14.8.0500 (  0) 0) |
| [9] |
ZHENG W, NAGARAJU G, LIU Z, et al. Functional roles of the phosphatidylinositol 3-kinases (PI3Ks) signaling in the mammalian ovary[J]. Mol Cell Endocrinol, 2012, 356(1/2): 24-30. (  0) 0) |
| [10] |
RUVINSKY I, SHARON N, LERER T, et al. Ribosomal protein S6 phosphorylation is a determinant of cell size and glucose homeostasis[J]. Gene Dev, 2005, 19(18): 2199-2211. DOI:10.1101/gad.351605 (  0) 0) |
| [11] |
BLACK J L, ERICKSON B H. Oogenesis and ovarian development in the prenatal pig[J]. Anat Rec, 1968, 161(1): 45-55. DOI:10.1002/(ISSN)1097-0185 (  0) 0) |
| [12] |
GOSDEN R G, TELFER E. Numbers of follicles and oocytes in mammalian ovaries and their allometric relationships[J]. Proceedings of the Zoological Society of London, 1987, 211(1): 169-175. DOI:10.1111/jzo.1987.211.issue-1 (  0) 0) |
| [13] |
BLAKE J A, EPPIG J T, RICHARDSON J E, et al. The mouse genome database (MGD): Integration nexus for the laboratory mouse[J]. Nucleic Acids Res, 2001, 29(1): 91-94. DOI:10.1093/nar/29.1.91 (  0) 0) |
| [14] |
RINGWALD M, DAVIS G L, SMITH A G, et al. The mouse gene expression database GXD[J]. Nucleic Acids Res, 1997, 32(1): 489-497. (  0) 0) |
| [15] |
EPPIG J J. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction, 2001, 122(6): 829-838. DOI:10.1530/rep.0.1220829 (  0) 0) |
| [16] |
徐春琳, 路晓琳, 闫晓楠, 等. PI3K/Akt/NF-κB信号通路在FSH促进卵巢癌细胞增殖与侵袭中的作用[J]. 中华妇产科杂志, 2012, 47(2): 134-138. (  0) 0) |
| [17] |
JOHN G B, SHIDLER M J, BESMER P, et al. Kit signaling via PI3K promotes ovarian follicle maturation but is dispensable for primordial follicle activation[J]. Dev Biol, 2009, 331(2): 292-299. DOI:10.1016/j.ydbio.2009.05.546 (  0) 0) |
| [18] |
BROWN C, LAROCCA J, PIETRUSKA J, et al. Subfertility caused by altered follicular development and oocyte growth in female mice lacking PKB alpha/Akt1[J]. Biol Reprod, 2010, 82(2): 246-256. DOI:10.1095/biolreprod.109.077925 (  0) 0) |
| [19] |
REDDY P, ADHIKARI D, ZHENG W, et al. PDK1 signaling in oocytes controls reproductive aging and lifespan by manipulating the survival of primordial follicles[J]. Mol Genet, 2009, 18(15): 2813-2824. (  0) 0) |
| [20] |
FAN H Y, LIU Z, CAHILL N, et al. Targeted disruption of Pten in ovarian granulosa cells enhances ovulation and extends the life span of luteal cells[J]. Mol Endocrinol, 2008, 22(9): 2128-2140. DOI:10.1210/me.2008-0095 (  0) 0) |
| [21] |
FINGAR D C, BLENIS J. Target of rapamycin (TOR): An integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression[J]. Oncogene, 2004, 23(18): 3151-3171. DOI:10.1038/sj.onc.1207542 (  0) 0) |
| [22] |
NYGARD O, NILSSON L. Translational dynamics. Interactions between the translational factors, tRNA and ribosomes during eukaryotic protein synthesis[J]. Eur J Biochem, 1990, 191(1): 1-17. DOI:10.1111/ejb.1990.191.issue-1 (  0) 0) |
| [23] |
朱士恩. 动物生殖生理学[M]. 北京: 中国农业出版社, 2006: 359.
(  0) 0) |
| [24] |
FOURNIER M J, MAXWELL E S. The nucleolar snRNAs: Catching up with the spliceosomal snRNAs[J]. Trends Biochem Sci, 1993, 18(4): 131-135. DOI:10.1016/0968-0004(93)90020-N (  0) 0) |
| [25] |
张春林, 李科瑛, 刘明兰, 等. 卵母细胞生发泡破裂(GVBD)发生前后脱卵丘细胞对猪卵母细胞体外成熟的影响[J]. 农业生物技术学报, 2014, 22(9): 1090-1096. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


