降香黄檀Dalbergia odorifera俗称海南黄花梨、花梨木,是常绿半落叶乔木树种。原产于海南岛,后广东、广西及福建陆续引种[1-2]。降香黄檀心材可以作为高级工艺品、高档家具、名贵乐器和装饰的上等材料,其心材提取物“降香”具有镇痛、止血和提气等功效[3]。然而,降香黄檀心材在自然条件下形成非常缓慢,因此如何加快其心材形成一直是珍贵树种研究的重点[3]。Mattson等[4]研究发现干旱等环境胁迫可以增加树体的次生代谢,孟慧等[2]调查了多个地点的降香黄檀,初步发现干旱地区的心材生长和品质明显优于多雨水地区。因此,研究干旱对树木心材形成的影响很有必要。而心材形成是一个缓慢的过程,短期内很难看出效果。另外,为了研究不同土壤含水量是如何影响心材形成的,就需要研究土壤含水量对生理过程相关参数的影响,相关参数包括树木生长、树体水势、树干呼吸速率(Rs)和边材氮含量等。树干呼吸是树木重要的生理过程,占森林总呼吸的5%~40%[5-7]。目前,树干呼吸速率研究主要集中在日变化[8-9]、季节动态[8]以及相关影响因子,如树干温度[10]、大气CO2浓度[11]、林木年龄[12]、林木径阶[13]、边材材积[14]、边材氮含量[15-16]、空间差异[17-18]等方面。研究认为,干旱能够显著降低树干呼吸速率[19-21],同时适当灌溉增加了旱季树干呼吸速率[22],但是对生长季没有显著影响[23]。然而,国内外有关不同土壤含水量下林木树干呼吸速率及其与生长、水势和边材氮含量之间的关系研究鲜见报道。
心材形成受到树木生长、代谢酶(氮含量)以及碳原料代谢 (树干呼吸速率)等因素影响,基于这些关系,本研究人工设置了4个土壤含水量梯度,以降香黄檀为研究对象,检测了各土壤含水量梯度下树木胸径生长、枝条水势、树干呼吸速率和边材氮含量等旱季变化,以便了解其特征,了解土壤含水量对树体水势、树干呼吸速率、生长和氮含量的影响,以及相互间的关系,为降香黄檀心材形成后续研究提供基础数据。
1 材料与方法 1.1 试验地概况试验地位于广东省佛山市高明区更合镇绿缘科技有限公司(22°47′N, 112°32′E),该地属亚热带季风气候,平均海拔43.9 m,年均降雨量为1 681.2 mm,其中旱季(10月—翌年3月)降雨量约为562 mm。年均气温为23.4 ℃,月均最低温为19.3 ℃(1月),月均最高温为33.8 ℃(7月)。降香黄檀林分为2009年种植,种植密度为2.5 m × 2.5 m,生长情况(平均值±SD):胸径(6.63±1.54) cm,树高(5.63±0.92) m,南北冠幅(3.46±0.47) m。土壤为花岗岩发育的红壤,平均深度超过1 m,各处理土壤理化性质见表1。
|
|
表 1 试验地各处理土壤理化性质 Table 1 The soil physical and chemical characteristics of all treatments in experimental field |
试验于2016年5月底进行,选择向南坡、地形平整、长势健康一致的林分,采用随机区组设计,每个小区20 m×20 m样地,设置4个处理水平,3次重复,其中重度干旱(Heavy drought,HD):薄膜隔绝整个行间距(≈2.0 m)的雨水;轻度干旱(Light drought,LD):薄膜隔绝半个行间距(≈1.3 m)的雨水;旱季灌溉(Dry-season irrigation,DI):旱季(10月—翌年3月)浇水;对照(CK):不做处理。
在HD和LD处理各小区每2排树行间,采用竹子、塑料管和不锈钢丝等搭建长约20 m、宽约2.0 m(HD)或1.3 m(LD)、高约0.8~1.0 m的支架,附上 0.16 mm的高厚度塑料薄膜,形成从上坡到下坡的引水槽。DI处理各小区中,各行间均安装自动喷灌系统,于旱季(10月—翌年3月)每3 d的08:00时定量灌溉,根据每月的灌溉分配量,灌溉量约为该月降雨量(600 mm)的日均灌溉量,如遇雨天则对灌溉时间进行适当人为调整。每个小区周围均用1.5 m深的隔水塑料板隔开,定期对引水槽进行清理,使得水流畅通。土壤墒情自动检测系统(AZS-2C,中国)每小时测定1次土壤约30 cm深的体积含水量。
1.3 研究内容与方法 1.3.1 树干呼吸速率用Li-8100土壤呼吸碳通量监测系统(LI-COR,USA)检测树干呼吸速率,并参考文献[24]用PVC管自制了树干专用呼吸室。研究认为,间隔2周是最优的树干呼吸速率测定和采样周期[25],故本研究从2016年10月16日到2017年2月21日每隔2周测定树干胸径处(1.3 m高处)向南面的呼吸速率,测定时间09:00—12:00,每次测定的同时,用电子温度计测量呼吸面附近的树干表皮1 cm处温度。各小区中部选择2株(每处理6株)样株,共24株,样株平均胸径(平均值±SD):HD为(8.8±1.7) cm,LD为(8.5±1.4) cm,DI为(9.0±1.8) cm,CK为(8.4±1.5) cm。
1.3.2 枝条水势从24株呼吸测定样株上取带叶小枝,于树干呼吸速率测定当天06:00,用压力室(PMS Instrument Company, Albany, OR, USA)测定枝条水势(Ψpd),3次重复。
1.3.3 树干胸径生长量日变化用树木茎杆生长监测仪(DRL26,捷克)检测各处理树木胸茎日动态变化,同时于每月底用胸径尺测定24株样株胸径,与仪器进行校准。
1.3.4 边材氮含量为了避免取样对树干呼吸速率的影响,选择样株周围4~5株树,每株取外边材1 cm样品,在65 ℃条件下烘干至恒质量,磨碎过0.25 mm筛,氮含量用元素分析仪测定(Flash EA1112, USA)。
1.3.5 相关公式由于自制呼吸室与树干表面积的不规则形状,因此按照系统默认设置所测的树干呼吸速率需要进行校正。校正公式如下:
| $R'= \frac{{\left[ {V + V' - {\rm{\pi }}{{\left( {\displaystyle\frac{D}{2}} \right)}^2} d} \right] S R}}{{V S'}},$ | (1) |
式中,R和R′分别为矫正前、后的树干呼吸速率,μmol·m–2·s–1;V为系统默认的同化室容积(4 823.9 cm3);V′为自制呼吸室的实际容积,cm3;D为自制呼吸室直径,cm;d为同化室插入呼吸室的深度,cm;S为系统默认的同化室面积(317.8 cm2);S′为自制呼吸室覆盖的树干表面积,cm2。
树干呼吸速率与温度之间的拟合关系如下:
| ${R_{\rm{s}}} = {R_0} {\rm{exp}}\left( {\beta \theta} \right),$ | (2) |
式中,Rs为树干呼吸速率,μmol·m–2·s–1;θ为树干温度;R0、β为常数。
温度敏感系数(Q10)计算公式[26]如下:
| ${Q_{10}} = {\rm{exp}}\left( {10\beta } \right)\text{。}$ | (3) |
所有试验数据采用Microsoft Excel 2010输入并整理绘图,使用SPSS19.0软件(IBM,USA)进行ANOVA方差分析,回归方程的显著性采用F检验,回归系数采用t检验。
2 结果与分析 2.1 土壤含水量与枝条水势如图1a所示,经过一段时间的处理,各处理旱季土壤含水量差异显著(P<0.01),基本保持DI>CK>LD>HD的次序,且总体呈现下降趋势。如图1b所示,枝条水势也表现出下降趋势,各处理从11月底开始表现出显著差异(P<0.01)。如图2所示,土壤含水量和枝条水势存在显著线性回归关系(P<0.001)。
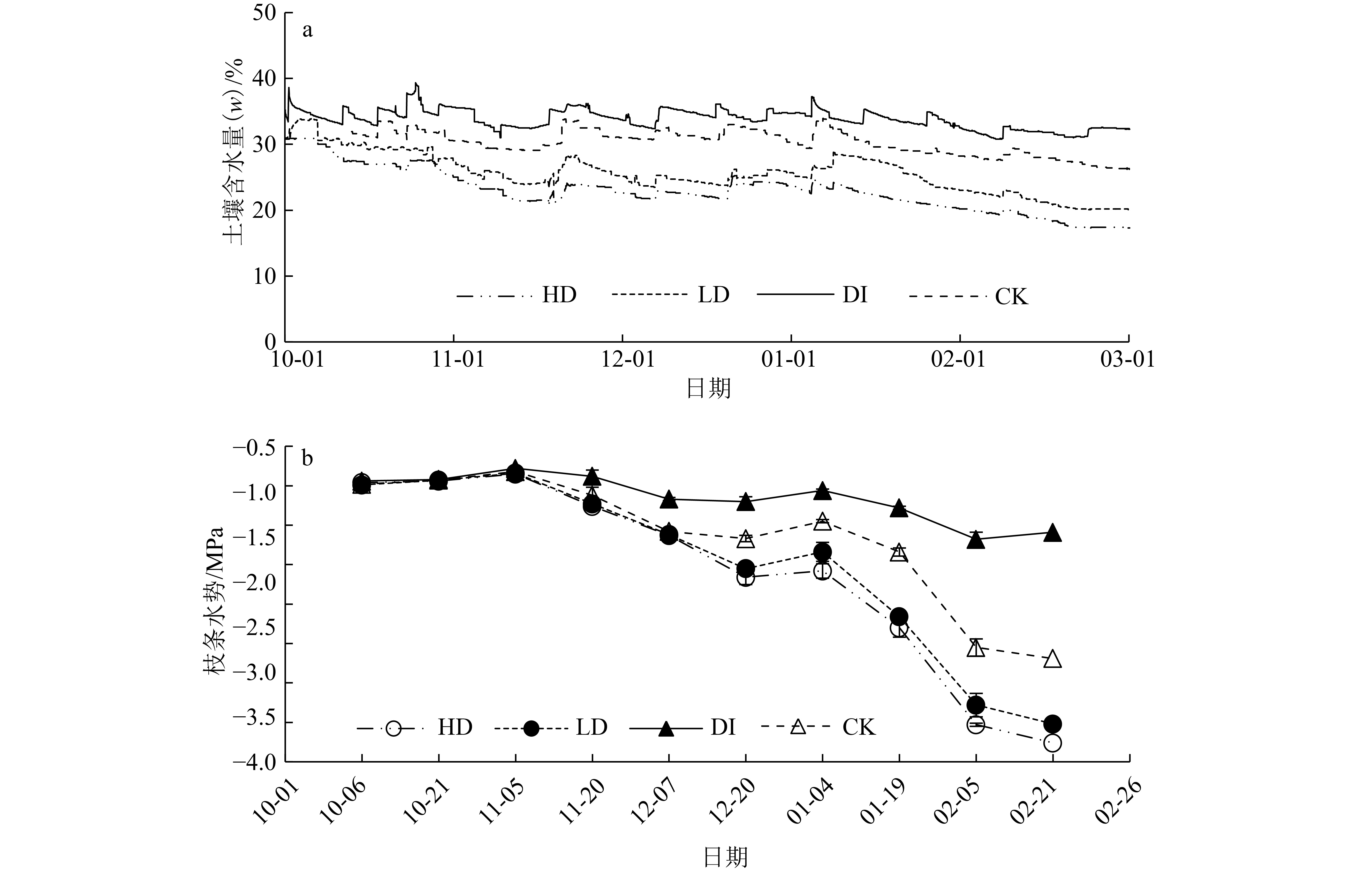
|
图 1 土壤含水量与枝条水势旱季变化 Figure 1 The changes of soil moisture content and predawn shoot water potential during dry season |
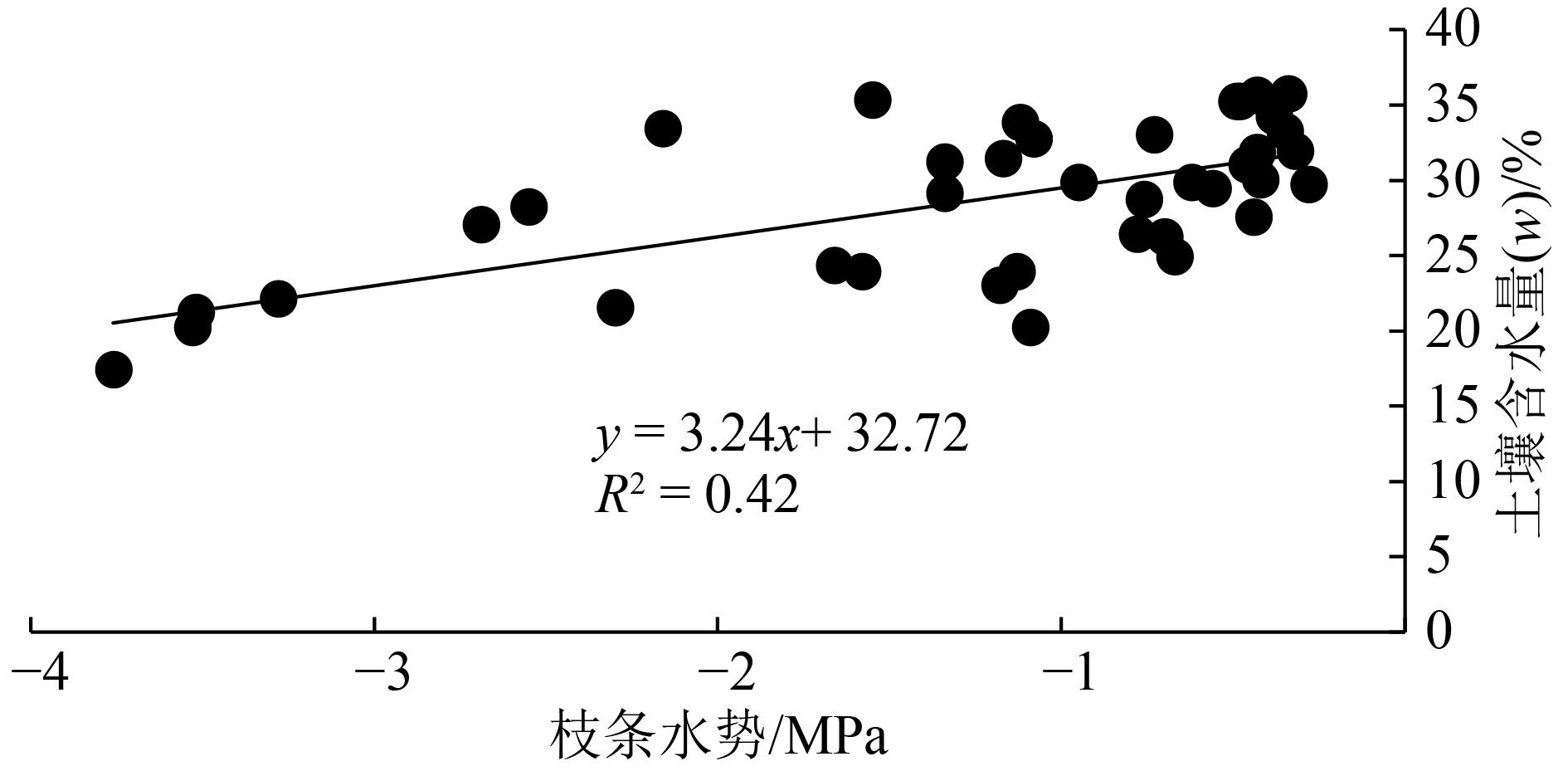
|
图 2 土壤含水量与枝条水势的回归分析 Figure 2 The regression analysis of soil moisture content and predawn shoot water potential |
由表2可见,各处理的树干呼吸速率与树干温度均具有良好的指数函数关系(P<0.001),各处理的温度敏感系数(Q10)排序为DI>CK>LD>HD,各回归方程的决定系数(R2)均在0.65以上。树干温度和树干呼吸速率均呈现旱季下降趋势,且在1月达到最低。各处理树干温度只在气温较低的冬季表现差异显著(图3a),树干呼吸速率始终差异显著(P<0.05),总体表现为旱季灌溉增加树干呼吸速率,而干旱降低树干呼吸速率(图3b)。
|
|
表 2 树干呼吸速率(Rs)基于树干温度(θ)的回归方程和温度敏感系数(Q10) Table 2 Regression equations and temperature sensitive coefficients (Q10) between stem respiration rate(Rs) and stem temperature (θ) in all treatments |
树干胸径生长量在12月中旬之前基本保持不变,12月下半月开始显著下降,整个旱季,各处理均差异显著(P<0.05),DI和CK处理显著高于HD和LD处理(图3c)。12月之前,边材氮含量保持不变,12月开始降低,且各处理只在12月和次年1月表现出显著差异(图3d)。
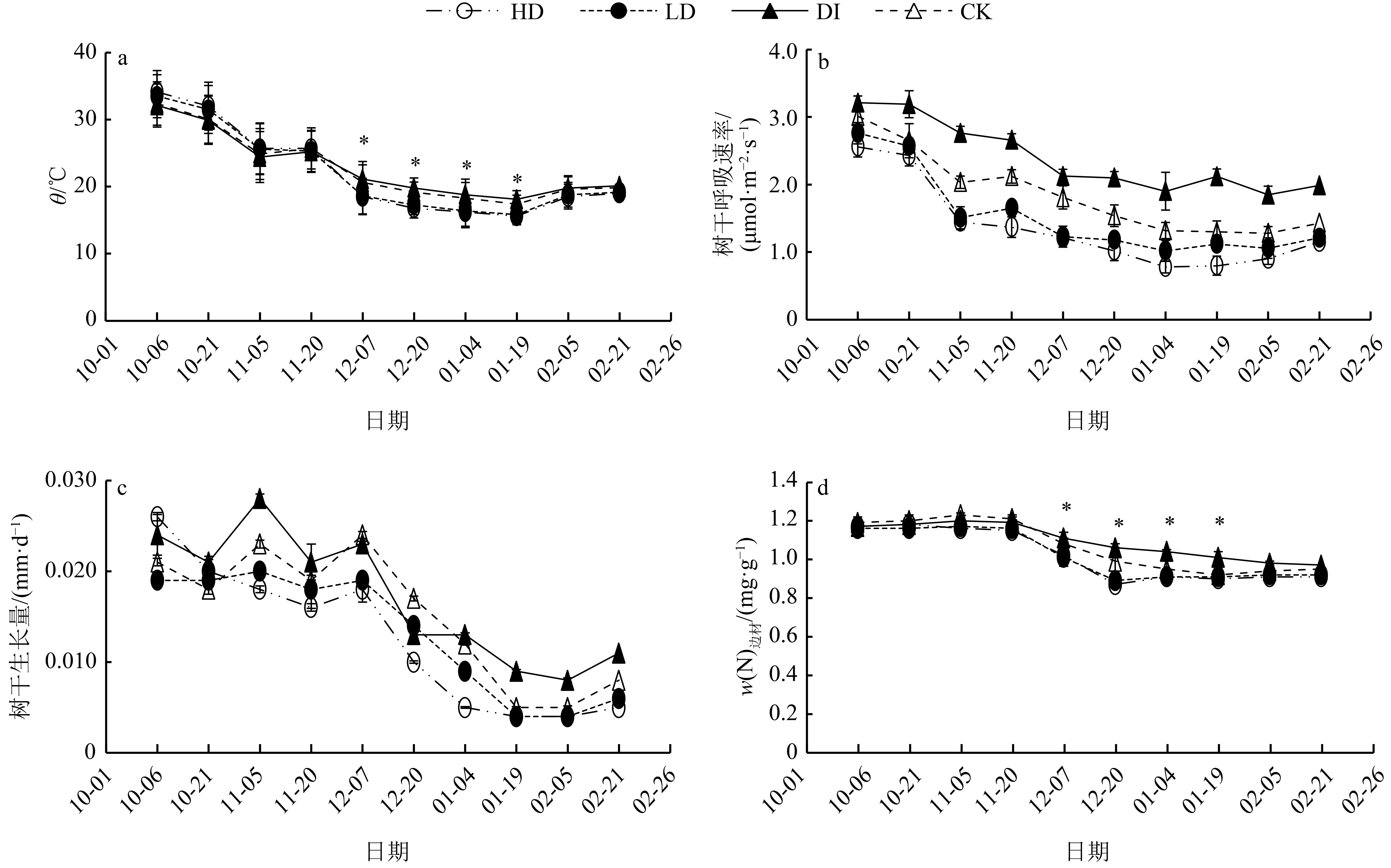
|
图 3 树干温度、呼吸速率、生长量和边材氮含量的旱季变化 Figure 3 Changes of stem temperature, stem respiration rate, stem growth and sapwood nitrogen content during dry season “*”表示相同日期各处理在0.05水平差异显著(ANOVA 方差分析法) |
树干呼吸速率与树干生长量和边材氮含量均具有显著回归关系(P<0.001),树干呼吸速率解释了56%的树干生长量(图4a),边材氮含量解释树干呼吸速率68%的旱季变化(图4b)。枝条水势显著地(P<0.001)解释了49%的树干呼吸速率、48%的树干生长量和63%边材氮含量的旱季变化(图5)。
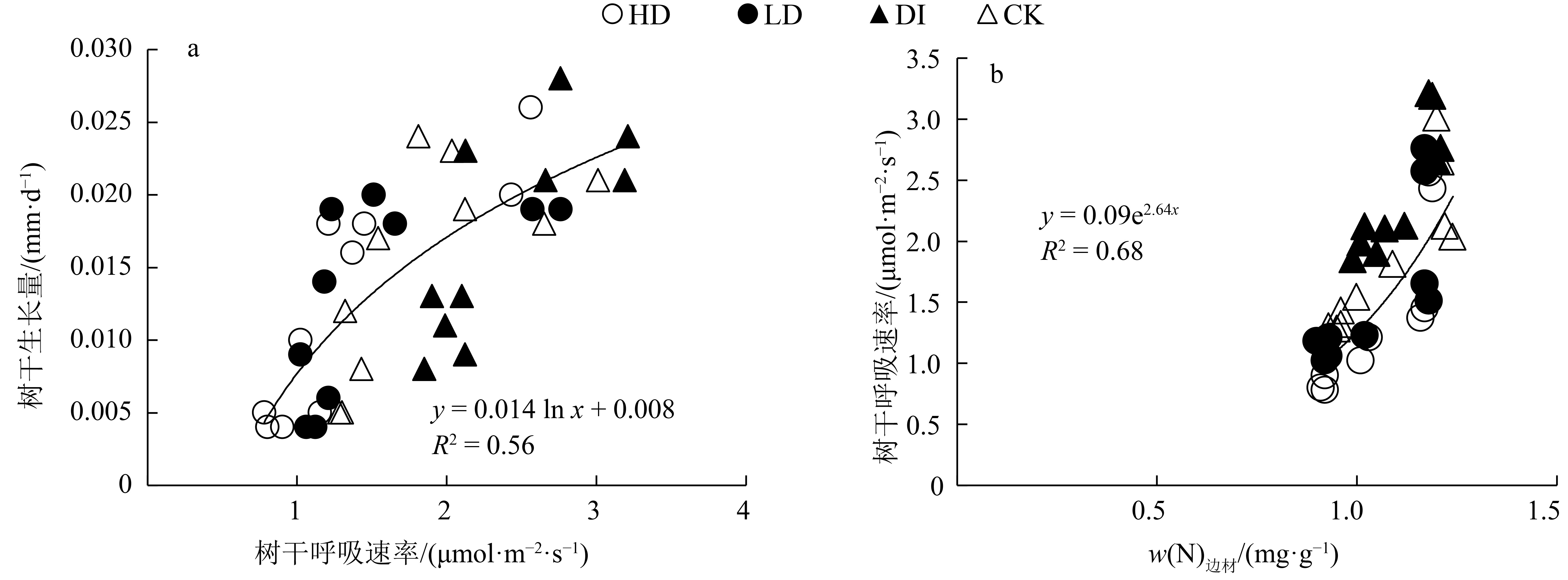
|
图 4 树干呼吸速率与树干生长量、边材氮含量间的关系 Figure 4 Relationships among stem respiration rate, stem growth and sapwood nitrogen content |
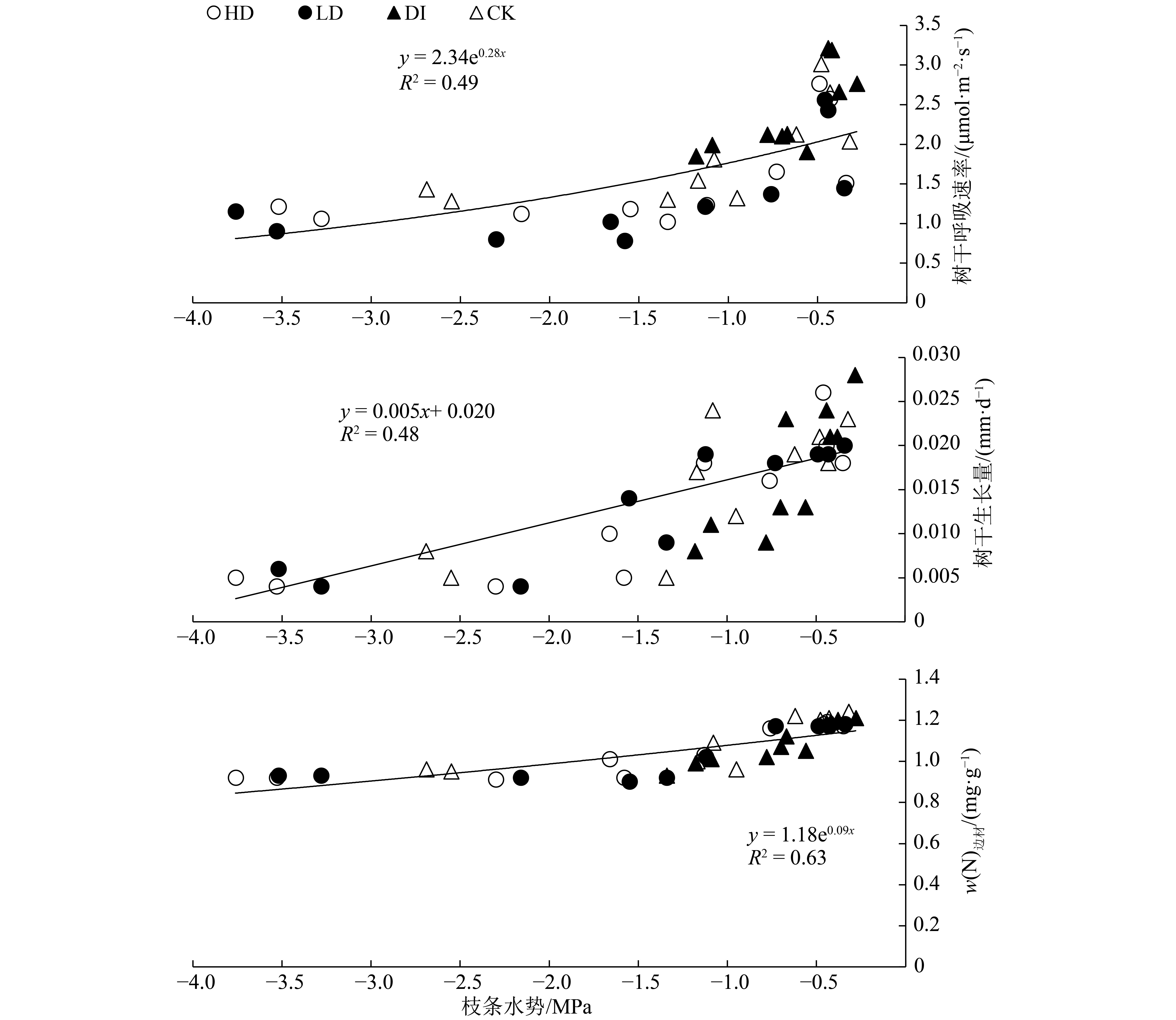
|
图 5 枝条水势与树干呼吸速率、生长量和边材氮含量间的关系 Figure 5 Relationships amony predawn shoot water potential, stem respiration rate, stem growth and sapwood nitrogen content |
本研究中,土壤含水量与树体水分状况呈显著线性关系,旱季各处理土壤含水量的下降导致枝条水势也表现下降趋势[27-28]。树干呼吸速率与树干温度表现正指数关系,因此两者均随着旱季气温下降呈现下降趋势。旱季下降的气温使得树干酶活性降低,进而使得树干呼吸速率下降[29]。随着冬季气温的下降,树体进入休眠期,胸径生长量显著降低。旱季加水补充了树体旱季水分限制,使得生长增加[28],而干旱造成树体水分胁迫,加速树体进入休眠期,使得生长受限。各处理树干温度和边材氮含量只在冬季表现出显著差异,Maier[23]研究显示冬季树干氮含量受树干温度影响,冬季气温下降,相比于加水和对照处理,干旱处理的树干温度降低更加显著,导致边材氮含量下降更多。
3.2 土壤含水量影响树干呼吸速率各处理的温度敏感系数差异说明土壤含水量已经影响树干呼吸速率对外界温度的响应[30],类似结果也出现在模拟氮沉降对树干呼吸速率影响的研究中[31]。在本研究中,旱季灌溉增加树干呼吸速率,而干旱降低树干呼吸速率。
Hartmann等[19]研究指出,干旱能减少植物全株的呼吸速率,干旱可以通过降低木质部CO2含量[20-21]、呼吸底物浓度[23, 32]、韧皮部运输[33]和细胞能量需求[34]来降低树干呼吸速率。另外,干旱导致的较低的细胞膨压[35]也可能是降低树干呼吸速率的因素[21, 36]。然而,有关灌溉加水对树干呼吸速率的研究却很有限。Maier等[22]研究表明,灌溉和施肥能增加休眠季树干呼吸速率,但对生长季树干呼吸速率没有显著影响[23],这些结果与本文的研究结果相一致。较低的土壤含水量是旱季树木生理代谢的主要限制因子,而旱季加水刚好缓和了水的缺失,这可能增强了树体维持代谢的某些生理机制[28]。因此,旱季加水增强了树干呼吸速率可能因为树体生理所需能量的增加。
3.3 变量关系分析本研究得出,树干呼吸速率与树干生长量呈显著正回归关系,这与前人研究结果[15, 28, 23]一致。说明旱季树干呼吸速率越强,树体生长越旺盛。旱季树干呼吸速率和边材氮含量也表现为正回归关系,两者的关系因树种不同而有所差异。挪威云杉Picea abies和一些寒带树种[17]树干呼吸速率与边材氮含量没有显著关系[15]。然而,Ryan[14]研究认为许多植物组织呼吸均与组织氮含量呈线性关系。北美乔松P. strobus和火炬松P. teada树干呼吸速率和边材氮含量呈正相关[16, 23]。边材氮含量影响边材蛋白质含量,而蛋白质在树干呼吸速率中发挥重要作用[23],因而边材氮含量的变化会显著影响树干呼吸速率。本研究认为,树干呼吸速率受边材氮含量的显著影响,这可能会使得养分条件差异显著或不同施肥处理的树干呼吸速率产生误差,因而需要把边材氮含量作为约束条件的全新的呼吸计算公式。
基于枝条水势与树干呼吸速率、树干生长量和边材氮含量这一系列显著的回归关系,可见土壤含水量很可能通过改变树体组织含水量(水势),进而使得树干呼吸速率、树干生长量和边材氮含量相互影响。同时,心材形成可能也受树体含水量的影响,下一步应该重点研究不同土壤含水量对树干木质部不同部位,如外边材、内边材、过渡区域和内外心材的非结构性碳水化合物含量变化的影响,以及和心材形成的关系。这些研究结果将为降香黄檀心材形成的后续研究提供基础数据。另外,基于树干呼吸速率与枝条水势、树体生长量和边材氮含量的显著关系,树干呼吸速率可能也会对树木心材形成有一定指示作用。
| [1] |
倪臻, 王凌晖, 吴国欣, 等. 降香黄檀引种栽培技术研究概述[J]. 福建林业科技, 2008, 35(2): 265-268. (  0) 0) |
| [2] |
孟慧, 谢彩香, 杨云, 等. 降香黄檀产地适宜性分析[J]. 时珍国医国药, 2010, 21(9): 2304-2306. (  0) 0) |
| [3] |
崔之益, 徐大平, 杨曾奖, 等. 心材形成机理与人工促进研究进展[J]. 世界林业研究, 2016, 29(6): 33-37. (  0) 0) |
| [4] |
MATTSON W J, HAACK R A. The role of drought in outbreaks of plant-eating insects[J]. Bio Sci, 1987, 37(2): 110-118. (  0) 0) |
| [5] |
MASEYK K, GRÜNZWEIG J M, ROTENBERG E, et al. Respiration acclimation contributes to high carbon-use efficiency in a seasonally dry pine forest[J]. Global Change Biol, 2008, 14(7): 1553-1567. DOI:10.1111/j.1365-2486.2008.01604.x (  0) 0) |
| [6] |
WIESER G, GRUBER A, BAHN M, et al. Respiratory fluxes in a Canary Islands pine forest[J]. Tree Physiol, 2009, 29(3): 457-466. DOI:10.1093/treephys/tpp008 (  0) 0) |
| [7] |
GUIDOLOTTI G, REY A, D'ANDREA E, et al. Effect of environmental variables and stand structure on ecosystem respiration components in a Mediterranean beech forest[J]. Tree Physiol, 2013, 33(9): 960-972. DOI:10.1093/treephys/tpt065 (  0) 0) |
| [8] |
YAN Y, ZHAO M, XU X, et al. Diurnal and seasonal change in stem respiration of Larix principis-rupprechtii trees, northern China
[J]. PLoS One, 2014, 9(2): e89294. DOI:10.1371/journal.pone.0089294.eCollection2014 (  0) 0) |
| [9] |
BADER M K F, MILDNER M, BAUMANN C, et al. Photosynthetic enhancement and diurnal stem and soil carbon fluxes in a mature Norway spruce stand under elevated CO2[J]. Environ Exp Bot, 2016, 124: 110-119. DOI:10.1016/j.envexpbot.2015.12.005 (  0) 0) |
| [10] |
YANG Q, XU M, CHI Y, ZHENG Y, et al. Relationship between stem CO2 efflux and stem temperature at different measuring depths in Pinus massoniana trees
[J]. Acta Ecologica Sinica, 2016, 36(4): 229-235. DOI:10.1016/j.chnaes.2016.05.001 (  0) 0) |
| [11] |
MILDNER M, BADER M K F, BAUMANN C, et al. Respiratory fluxes and fine root responses in mature Picea abies trees exposed to elevated atmospheric CO2 concentrations
[J]. Biogeochemistry, 2015, 124(1): 95-111. (  0) 0) |
| [12] |
肖复明, 汪思龙, 杜天真, 等. 湖南会同林区杉木人工林呼吸量测定[J]. 生态学报, 2005, 25(10): 2514-2519. DOI:10.3321/j.issn:1000-0933.2005.10.008 (  0) 0) |
| [13] |
REINMANN A B, TEMPLER P H. Reduced winter snowpack and greater soil frost reduce live root biomass and stimulate radial growth and stem respiration of red maple (Acer rubrum) trees in a mixed-hardwood forest
[J]. Ecosystems, 2016, 19(1): 129-141. DOI:10.1007/s10021-015-9923-4 (  0) 0) |
| [14] |
RYAN M G. Growth and maintenance respiration in stems of Pinus contorta and Picea engelmannii
[J]. Can J Forest Res, 1990, 20(1): 48-57. DOI:10.1139/x90-008 (  0) 0) |
| [15] |
STOCKFORS J, LINDER S. Effect of nitrogen on the seasonal course of growth and maintenance respiration in stems of Norway spruce trees[J]. Tree Physiol, 1998, 18(3): 155-166. DOI:10.1093/treephys/18.3.155 (  0) 0) |
| [16] |
VOSE J M, RYAN M G. Seasonal respiration of foliage, fine roots, and woody tissues in relation to growth, tissue N, and photosynthesis[J]. Global Change Biol, 2002, 8(2): 182-193. DOI:10.1046/j.1365-2486.2002.00464.x (  0) 0) |
| [17] |
LAVIGNE M B. Comparing stem respiration and growth of jack pine provenances from northern and southern locations[J]. Tree Physiol, 1996, 16(10): 847-852. DOI:10.1093/treephys/16.10.847 (  0) 0) |
| [18] |
SALOMÓN R L, VALBUENA-CARABAÑA M, GIL L, et al. Temporal and spatial patterns of internal and external stem CO2 fluxes in a sub-Mediterranean oak
[J]. Tree physiol, 2016, 36(11): 1409-1421. (  0) 0) |
| [19] |
HARTMANN H, ZIEGLER W, KOLLE O, et al. Thirst beats hunger declining hydration during drought prevents carbon starvation in Norway spruce saplings[J]. New Phytol, 2013, 200(2): 340-349. DOI:10.1111/nph.12331 (  0) 0) |
| [20] |
TESKEY R O, McGUIRE M A. CO2 transported in xylem sap affects CO2 efflux from Liquidambar styraciflua and Platanus occidentalis stems, and contributes to observed wound respiration phenomena
[J]. Trees, 2005, 19(4): 357-362. DOI:10.1007/s00468-004-0386-z (  0) 0) |
| [21] |
SAVEYN A, STEPPE K, LEMEUR R. Drought and the diurnal patterns of stem CO2 efflux and xylem CO2 concentration in young oak (Quercus robur)
[J]. Tree Physiol, 2007, 27(3): 365-374. DOI:10.1093/treephys/27.3.365 (  0) 0) |
| [22] |
MAIER C A, ZARNOCH S J, DOUGHERTY P M. Effects of temperature and tissue nitrogen on dormant season stem and branch maintenance respiration in a young loblolly pine (Pinus taeda) plantation
[J]. Tree Physiol, 1998, 18(1): 11-20. DOI:10.1093/treephys/18.1.11 (  0) 0) |
| [23] |
MAIER C A. Stem growth and respiration in loblolly pine plantations differing in soil resource availability[J]. Tree Physiol, 2001, 21(16): 1183-1193. DOI:10.1093/treephys/21.16.1183 (  0) 0) |
| [24] |
XU M, DEBIASE T A, QI Y. A simple technique to measure stem respiration using a horizontally oriented soil chamber[J]. Can J Forest Res, 2000, 30(10): 1555-1560. DOI:10.1139/x00-083 (  0) 0) |
| [25] |
WANG Y D, WANG H M, WANG Z L, et al. Optimizing manual sampling schedule for estimating annual soil CO2 efflux in a young exotic pine plantation in subtropical China
[J]. Eur J Soil Biol, 2012, 52: 41-47. DOI:10.1016/j.ejsobi.2012.06.002 (  0) 0) |
| [26] |
ATKIN O K, TJOELKER M G. Thermal acclimation and the dynamic response of plant respiration to temperature[J]. Trends Plant Sci, 2003, 8(7): 343-351. DOI:10.1016/S1360-1385(03)00136-5 (  0) 0) |
| [27] |
GRANDA V, DELATORRE C, CUESTA C, et al. Physiological and biochemical responses to severe drought stress of nine Eucalyptus globulus clones: A multivariate approach
[J]. Tree Physiol, 2014, 34(7): 778-786. DOI:10.1093/treephys/tpu052 (  0) 0) |
| [28] |
RODRÍGUEZ-CALCERRADA J, MARTIN-STPAUL N K, LEMPEREUR M, et al. Stem CO2 efflux and its contribution to ecosystem CO2 efflux decrease with drought in a Mediterranean forest stand
[J]. Agr Forest Meteor, 2014, 195/196: 61-72. DOI:10.1016/j.agrformet.2014.04.012 (  0) 0) |
| [29] |
GAUMONT-GUAY D, BLACK T A, GRIFFIS T J, et al. Influence of temperature and drought on seasonal and interannual variations of soil, bole and ecosystem respiration in a boreal aspen stand[J]. Agr Forest Meteor, 2006, 140(1/2/3/4): 203-219. (  0) 0) |
| [30] |
ADU-BREDU S, YOKOTA T, HAGIHARA A. Temperature effect on maintenance and growth respiration coefficients of young, field-grown hinoki cypress (Chamaecyparis obtusa)
[J]. Ecol Res, 1997, 12(3): 357-362. DOI:10.1007/BF02529465 (  0) 0) |
| [31] |
孙涛, 刘瑞鹏, 李兴欢, 等. 模拟氮沉降对东北地区兴安落叶松树干呼吸的影响[J]. 生态学报, 2015, 35(11): 3684-3691. (  0) 0) |
| [32] |
WERTIN T M, TESKEY R O. Close coupling of whole-plant respiration to net photosynthesis and carbohydrates[J]. Tree Physiol, 2008, 28(12): 1831-1840. DOI:10.1093/treephys/28.12.1831 (  0) 0) |
| [33] |
SEVANTO S, McDOWELL N G, DICKMAN L T, et al. How do trees die? A test of the hydraulic failure and carbon starvation hypotheses[J]. Plant Cell Environ, 2014, 37(1): 153-161. DOI:10.1111/pce.2014.37.issue-1 (  0) 0) |
| [34] |
ATKIN O K, MACHEREL D. The crucial role of plant mitochondria in orchestrating drought tolerance[J]. Ann Bot, 2009, 103(4): 581-597. DOI:10.1093/aob/mcn094 (  0) 0) |
| [35] |
ZWEIFEL R, ZIMMERMANN L, ZEUGIN F, et al. Intra-annual radial growth and water relations of trees: implications towards a growth mechanism[J]. J Exp Bot, 2006, 57(6): 1445-1459. DOI:10.1093/jxb/erj125 (  0) 0) |
| [36] |
SAVEYN A, STEPPE K, LEMEUR R. Daytime depression in tree stem CO2 efflux rates: Is it caused by low stem turgor pressure?
[J]. Ann Bot, 2007, 99(3): 477-485. DOI:10.1093/aob/mcl268 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


