黄柏Phellodendron chinense是芸香科黄檗属落叶乔木,主产四川、贵州、云南等地;作为一种来源广泛的中药材,有着很好的开发前景。近几年来,对黄柏的研究较多,临床应用也非常广,可用于治疗流行性脑脊髓膜炎、细菌性痢疾、肺炎、肺结核、肝硬化、过敏性药疹等疾病[1-2]。膏药病是黄柏的重要枝干病害之一,发生在黄柏大小枝条和主干上,形成膏药状菌膜[3]。发病轻者树势衰弱,重者枝杆枯死,对黄柏生产带来极大的损失。膏药病病原菌属于担子菌亚门隔担耳属Septobasidium或卷担子属Helicobasidium[4-5],病菌以菌丝体在患病枝干上越冬,次年春夏间在温度和湿度适宜时,菌丝继续生长形成子实层。担孢子借气流和介壳虫传播,使病害蔓延扩大,4—12月均可发生[1]。目前在膏药病病原检测鉴定[6]、传播途径、发病过程[7-8]、致病机理及影响因素[9]和病害防治[10]等方面取得了很大进展,但对于黄柏膏药病仅限于症状、发病规律及病原[3]的初步研究,鲜见其抗性生理方面的报道,造成该病害病原的致病机理和寄主抗病机理的研究进展比较缓慢。
经过实地访查,四川大邑药材种植基地黄柏膏药病发病率较高,若不及时防治,黄柏产量会大幅度下降,同时其药材质量降低,会造成巨大的经济损失。植物抗性鉴定是优异资源发掘、利用和保护的基础[11],因而研究黄柏的抗性生理评价指标对黄柏抗性育种、黄柏资源抗性鉴定、抗性种质材料的筛选及建立黄柏遭受胁迫的预警与调控机制都具有重要意义。本研究针对3种林分条件下黄柏被膏药病病原侵染后抗性生理指标的变化情况,从病理生理学角度对黄柏膏药病进行分析,为进一步研究有效防治膏药病的新途径提供理论基础。
1 材料与方法 1.1 试验地概况样地1、2设在四川省大邑县斜源镇仰天窝药场,样地3设在䢺江镇华山林场,树种为川黄柏,林分类型为人工林,树龄为2~10年,属于黄柏膏药病发生较为集中的区域。土壤均为暗棕壤土,土层厚度30~50 cm,肥力较好,样地坡度4~14 °,属亚热带湿润季风气候,雨量充足,年均气温15 ℃左右,年降雨量1 300 mm以上,有丰富的中药材资源。3个样地面积均为5 hm2,在每块样地中心、上下林缘各选择1块30 m×30 m区域作为调查标准地,试验样地情况见表1。
|
|
表 1 试验样地调查情况 Table 1 Investigated information of sample plots |
2016年3—11月,每15 d对3个样地进行调查,了解各样地黄柏膏药病的分布、发病程度。采用踏查法调查发病率和病情指数,在每个标准地4个角及中心各选4株黄柏,共20株进行调查。按下列标准进行病害调查统计,并计算发病率及病情指数。病害分级标准:0级(无病斑);1级(1~3个病斑);2级(4~6个病斑);3级(7~12个病斑);4级(大于12个病斑)。
| $\begin{array}{l}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\text{发病率}} = \displaystyle\frac{{{\text{病株数}}}}{{{\text{株数总和}}}} \times 100\text{%} \text{,}\\[12pt]{\text{病情指数}} = \displaystyle\frac{{\sum {\left( {{\text{病级株数}} \times {\text{代表数值}}} \right)} }}{{{\text{株数总和}} \times {\text{发病最重级的代表值}}}} \times 100 \;\text{。}\end{array}$ |
每次调查在3个样地设置的标准地里随机挑选3株感染膏药病的黄柏,剥取发病部位的树皮,同时选择邻近无病黄柏3株,在其病株采集材料的相同或相近的部位采集树皮,分别放入不同的采样袋并做好标记。
1.3 黄柏抗性生理指标的测定 1.3.1 树皮含水量称取新鲜树皮10 g切成小块,置于无菌水中浸泡至饱和状态,用吸水纸吸去表面水分称质量,然后放于培养皿中,105 ℃条件下烘干24 h,再称干质量,即可得树皮含水量,用树皮相对肿胀度表示:
| $\begin{aligned}{\text{相对肿胀度}} = \qquad\qquad \qquad \qquad \\[4pt] \frac{{{\text{样品鲜质量}} - {\text{样品饱和烘干质量}}}}{{{\text{样品饱和质量}} - {\text{样品饱和烘干质量}}}} \times 100\text{%}\text{。}\end{aligned}$ |
可溶性蛋白含量采用考马斯亮蓝G250法[12]测定。
| $w\left( {{\text{蛋白质}}} \right) = \frac{{mV}}{{1 \,\, 000{m_{\rm{f}}}V_{\rm s}}}\text{,}$ |
式中,V为样液总体积,Vs为测定时所取样液体积,m为标准曲线中查得的蛋白质质量,mf为样品鲜质量。
1.3.3 酶活性超氧化物歧化酶(Superoxide dismutase,SOD)活性采用氮蓝四唑(Nitro-blue tetrazolium,NBT)光化还原法进行测定,以抑制NBT光化还原的50%为1个酶活力单位(U)[13]。
| ${\rm{SOD}} {\text{活性}} = \frac{{\left( {{{D^\prime}_{470\;{\rm{nm}}}} - {D_{470\;{\rm{nm}}}}} \right)V}}{{0.5{{D^\prime}_{470 \,\, {\rm{nm}}}}{m_{\rm{f}}}{V_{\rm{s}}}}}\text{,}$ |
式中,
过氧化物酶(Peroxidase,POD)活性采用愈创木酚法[14]测定。
| ${\rm{POD}}{\text{活性}} = \frac{{\varDelta {D_{470\;{\rm{nm}}}}V}}{{0.01{m_{\rm{f}}}{V_{\rm{s}}}t}}\text{。}$ |
苯丙氨酸裂解酶(Phenylalaninammo nialyase,PAL)活性采用Mandal等[15]的方法测定。
| ${\rm{PAL}}{\text{活性}} = \frac{{d\varDelta {D_{290\;{\rm{nm}}}}}}{{0.01tV}},$ |
式中,d为酶液稀释倍数。
1.3.4 丙二醛含量采用硫代巴比妥酸加热比色法测定丙二醛(Malondialdehyde,MDA)浓度[16]。
| $\begin{array}{l}c\left( {{\rm{MDA}}} \right) = 6.45\left( {{D_{532\;{\rm{nm}}}} - {D_{600\;{\rm{nm}}}}} \right) - 0.56{D_{450\;{\rm{nm}}}},\\[8pt]\;\;\;\;\;\;\;\;\;\;\;\;b\left( {{\rm{MDA}}} \right) = \displaystyle\frac{{2c\left( {{\rm{MDA}}} \right)V}}{{{m_{\rm{f}}}}} \times {10^{ - 3}}\text{。}\end{array}$ |
采用Excel 2010和SPSS 19.0软件进行数据统计分析,取平均值±标准差用于作图,进行线性回归、方差和相关性分析,最小显著差法(LSD)法进行显著性分析。
2 结果与分析 2.1 林分因子对发病率和病情指数的影响调查结果表明,3个样地的发病率和病情指数(图1)均呈现3—7月明显上升趋势,7—8月为膏药病发生最严重的月份,随后病斑及病株数量无显著增加,始终保持在高值。大邑县仰天窝药场的样地1感病程度显著高于样地2(P<0.05),结合表2相关性分析,说明种植于阴坡的黄柏更易感病。华山林场样地3的发病率与病情指数都显著最高,相关性分析结果(表2)表明,树种组成和黄柏膏药病发生呈极显著负相关(P<0.01),说明树种组成越复杂,发病率和病情指数越低,样地3的林分组成简单(黄柏纯林),有利于病害在林间蔓延;树龄的影响比树种组成稍小,和发病率及病情指数呈显著相关;坡向和坡度与黄柏膏药病发生呈显著负相关;样地3相对于另外2个样地环境荫蔽潮湿;海拔和郁闭度3个样地差异不大,未将二者列入差异性分析。综上,在光照不充分、环境潮湿、林分组成单一、坡度平缓且树龄较大的黄柏林较易感病。
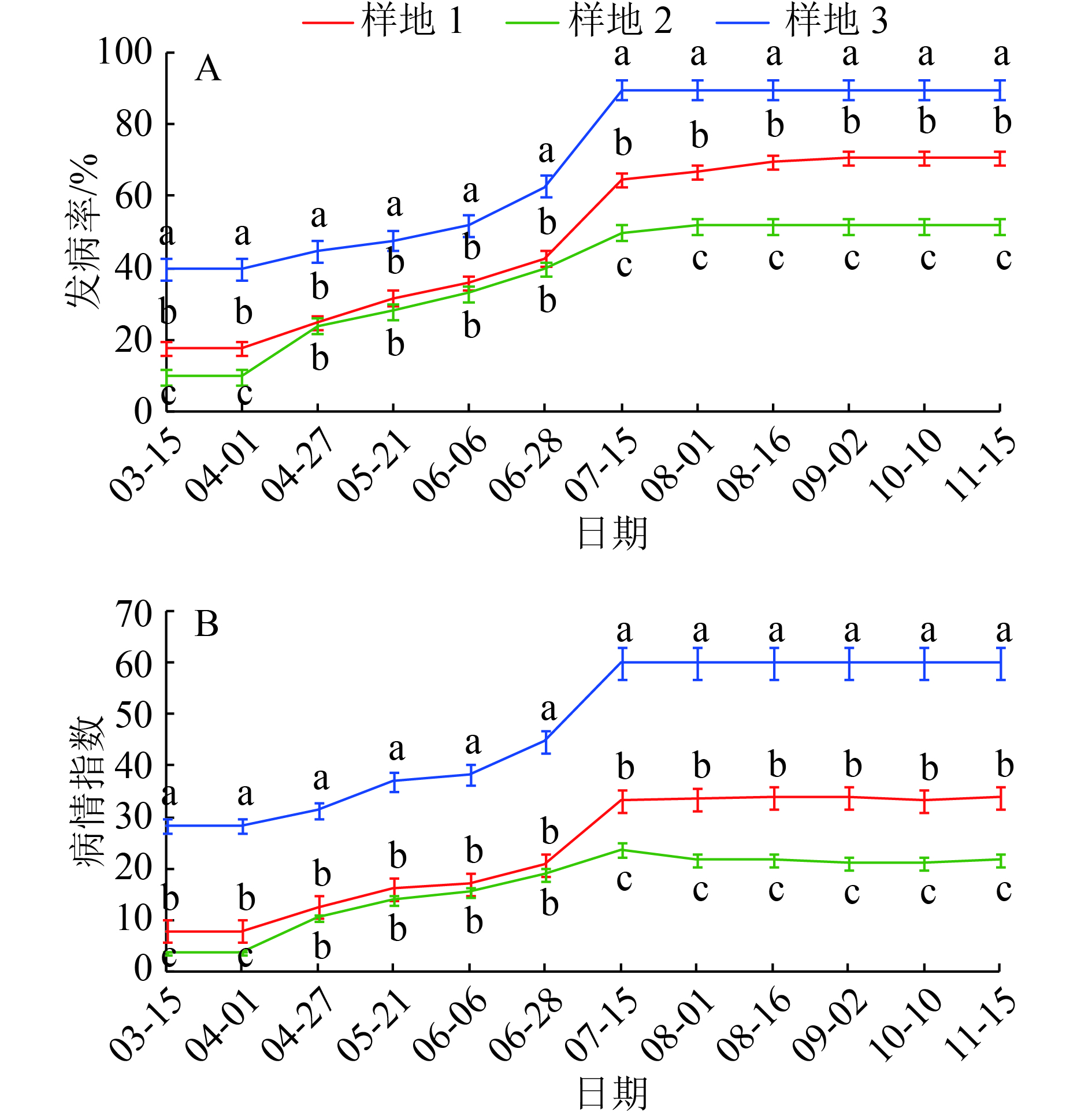
|
图 1 黄柏膏药病发病率和病情指数的动态变化 Figure 1 Dynamic changes of incidence and disease index of plaster disease in Phellodendron chinense 各图中相同日期不同曲线数据点上(下)方,凡是具有一个相同小写字母者,表示不同样地间差异不显著(P>0.05, LSD法) |
|
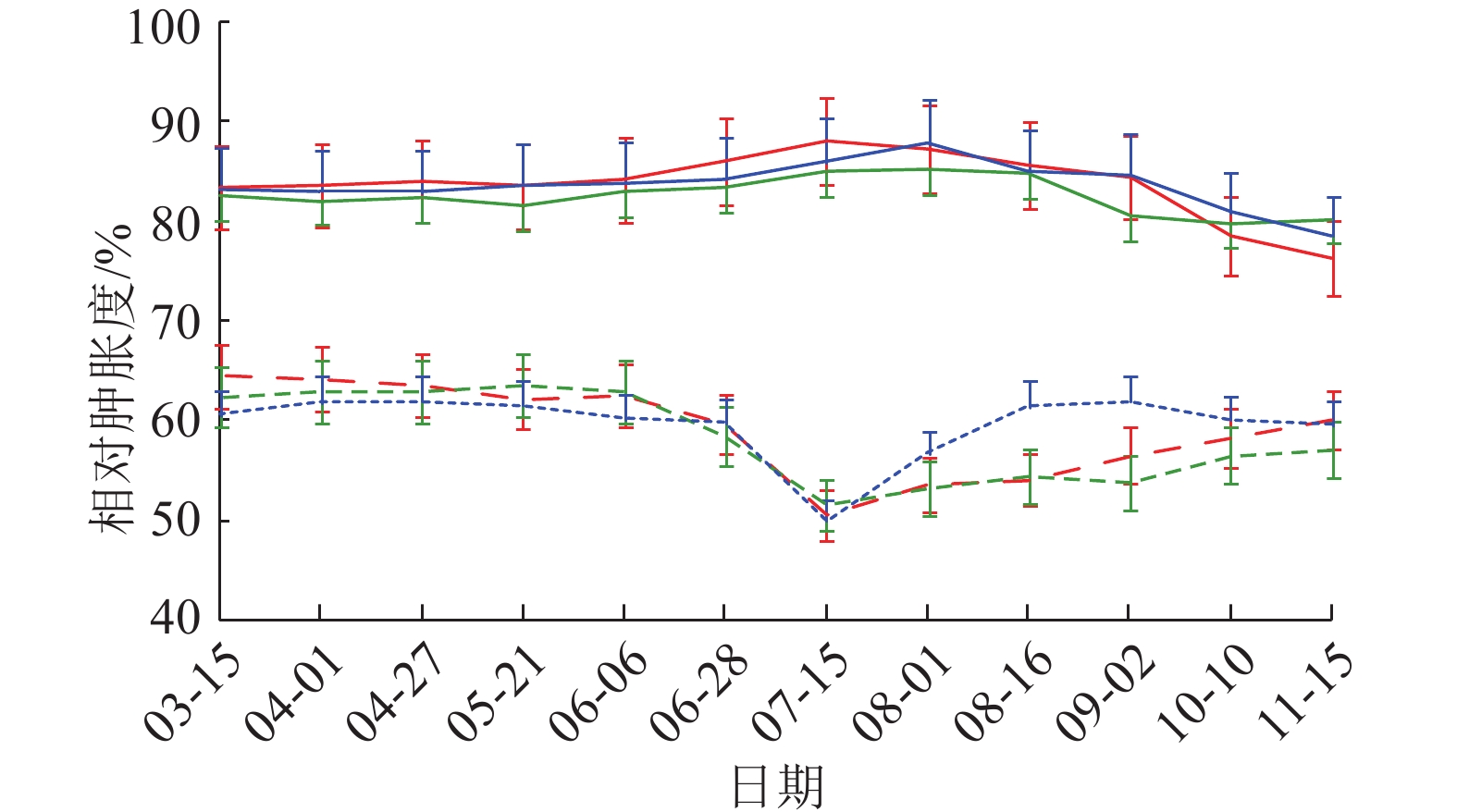
图 2 黄柏树皮相对肿胀度动态变化 Figure 2 Dynamic changes of relative swelling in Phellodendron chinense bark 红、绿、蓝色线条分别表示样地1、2、3;实线表示健康黄柏,虚线表示感病黄柏 |
|
|
表 2 林分因子与发病率、病情指数的相关性1) Table 2 Correlations between stand factors and disease incidence, disease index |
树皮相对肿胀度随时间变化有2种趋势(图2),健康树皮相对肿胀度呈现缓慢增加后再下降的趋势,而感病树皮相对肿胀度呈现先下降后增加的趋势,在7—8月二者差异尤为明显。从病害危害角度看,健康树皮含水量较高且水平趋于稳定,树木生理代谢旺盛。相反,树皮在受到膏药病侵染后,树皮失水开裂,代谢能力和抗逆境能力减弱,在多数情况下能降低林木的抗病性,病情指数较高。相关性分析(表3)表明,相对肿胀度与发病率、病情指数呈极显著负相关。由此可见,黄柏树皮含水量与感病程度成反比,随感病程度增加,树皮相对肿胀度降低。
|
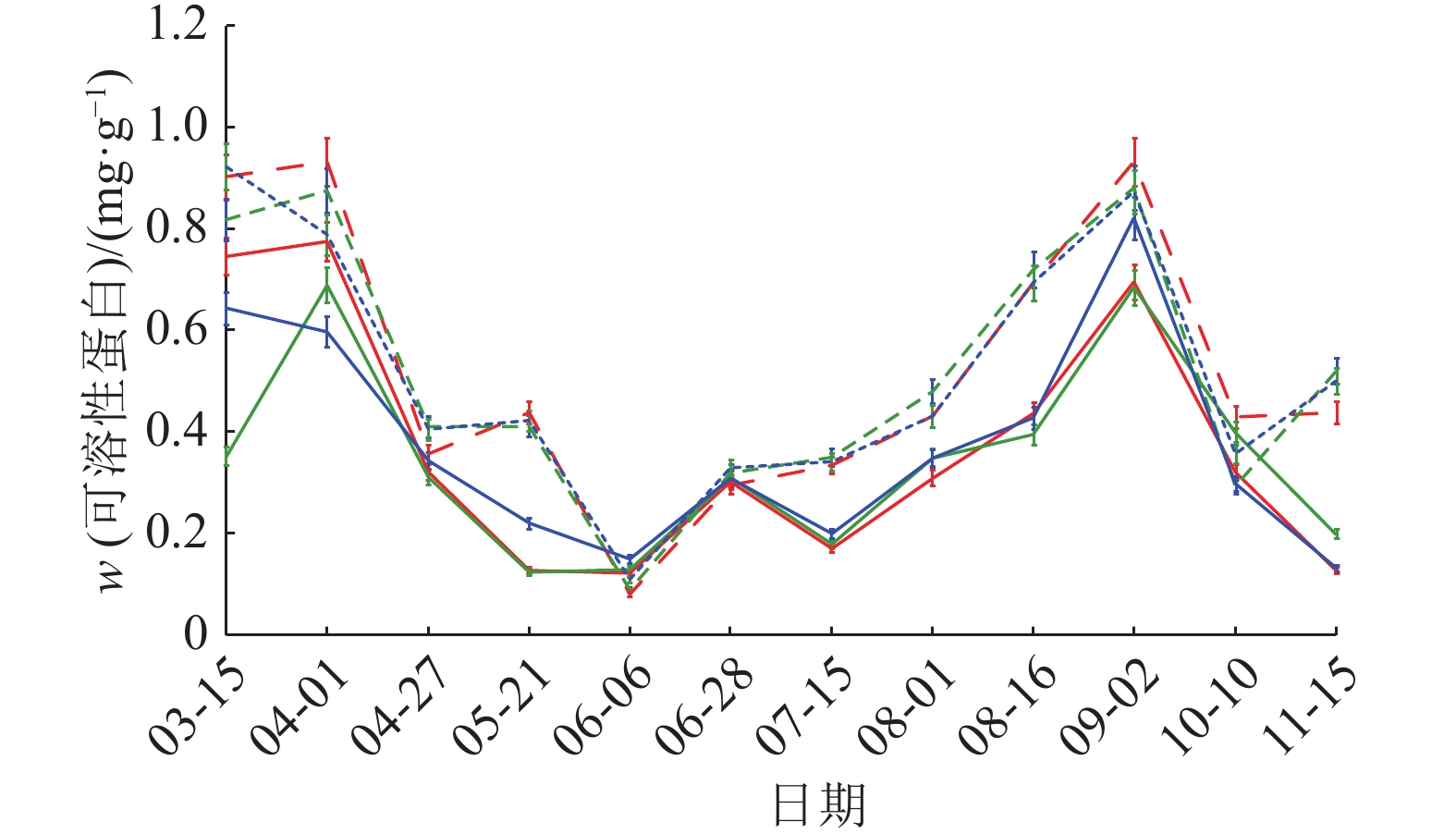
图 3 可溶性蛋白含量动态变化 Figure 3 Dynamic change of soluble protein content 红、绿、蓝色线条分别表示样地1、2、3;实线表示健康黄柏,虚线表示感病黄柏 |
|
|
表 3 生理指标与发病率、病情指数的相关性1) Table 3 Correlation between physiological index and disease incidence, disease index |
由图3可见,3个样地黄柏树皮可溶性蛋白含量变化趋势相似,先降低后升高,在8—9月达到高峰,而后下降。样地3健康和感病黄柏的可溶性蛋白含量高于其余2个样地,3个样地的感病树皮的含量高于健康树皮,说明可溶性蛋白含量的升高在一定程度上有助于提高黄柏的抗病性。相关性分析结果表明,该指标的变化与发病率、病情指数相关性不显著(表3)。
|
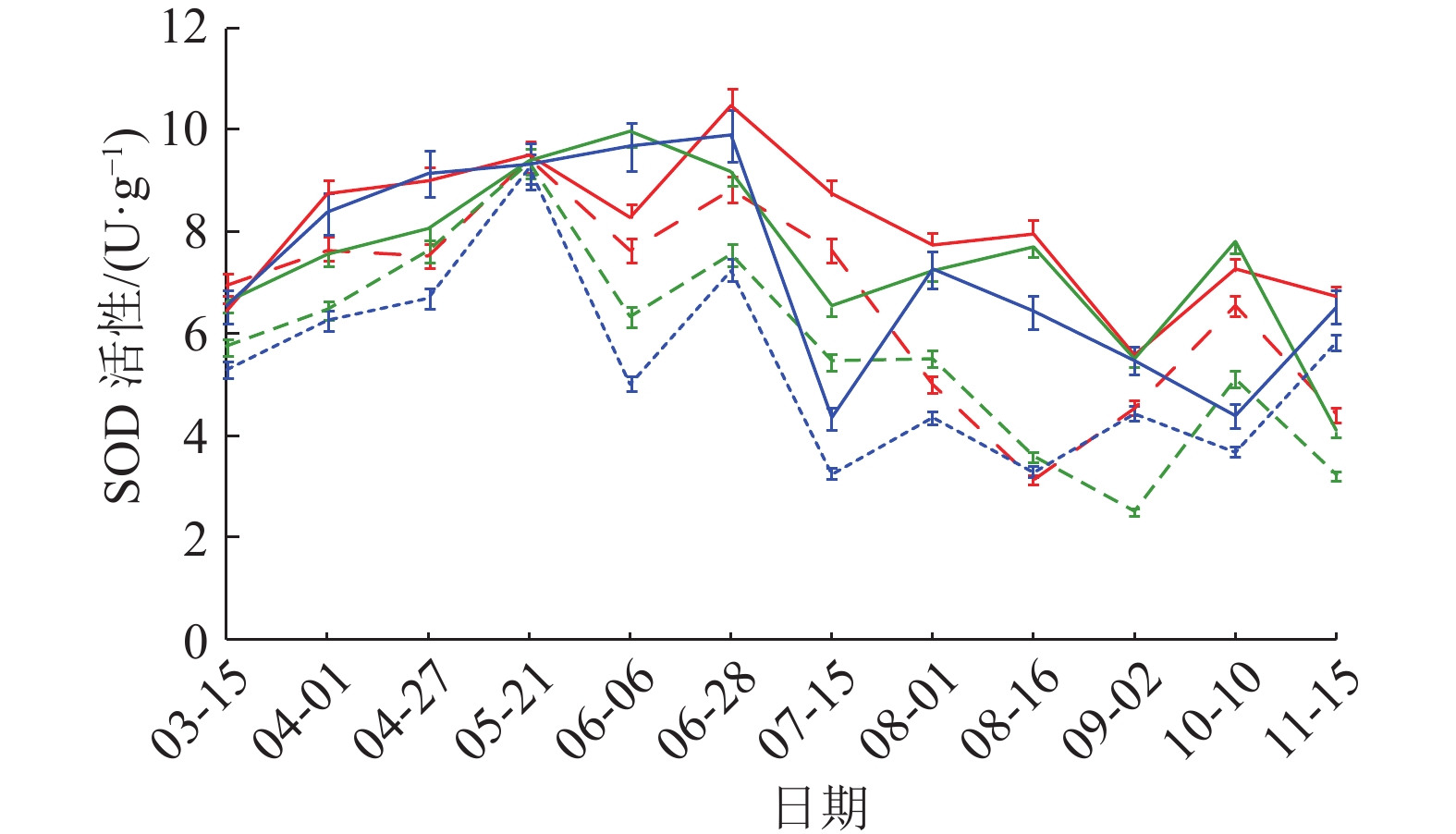
图 4 SOD活性动态变化 Figure 4 Dynamic change of SOD activity 红、绿、蓝色线条分别表示样地1、2、3;实线表示健康黄柏,虚线表示感病黄柏 |
SOD活性变化曲线(图4)显示,3个样地健康黄柏树皮SOD活性高于感病树皮,动态变化也较为规律,呈先上升后下降趋势,5—6月达到峰值,随后趋于稳定。感病树皮SOD活性3—11月波动较大,5月出现峰值以后均又下降。不论健康还是感病树皮,样地1和样地2普遍高于样地3,相关性分析结果(表3)表明,SOD活性与发病率和病情指数呈显著负相关。
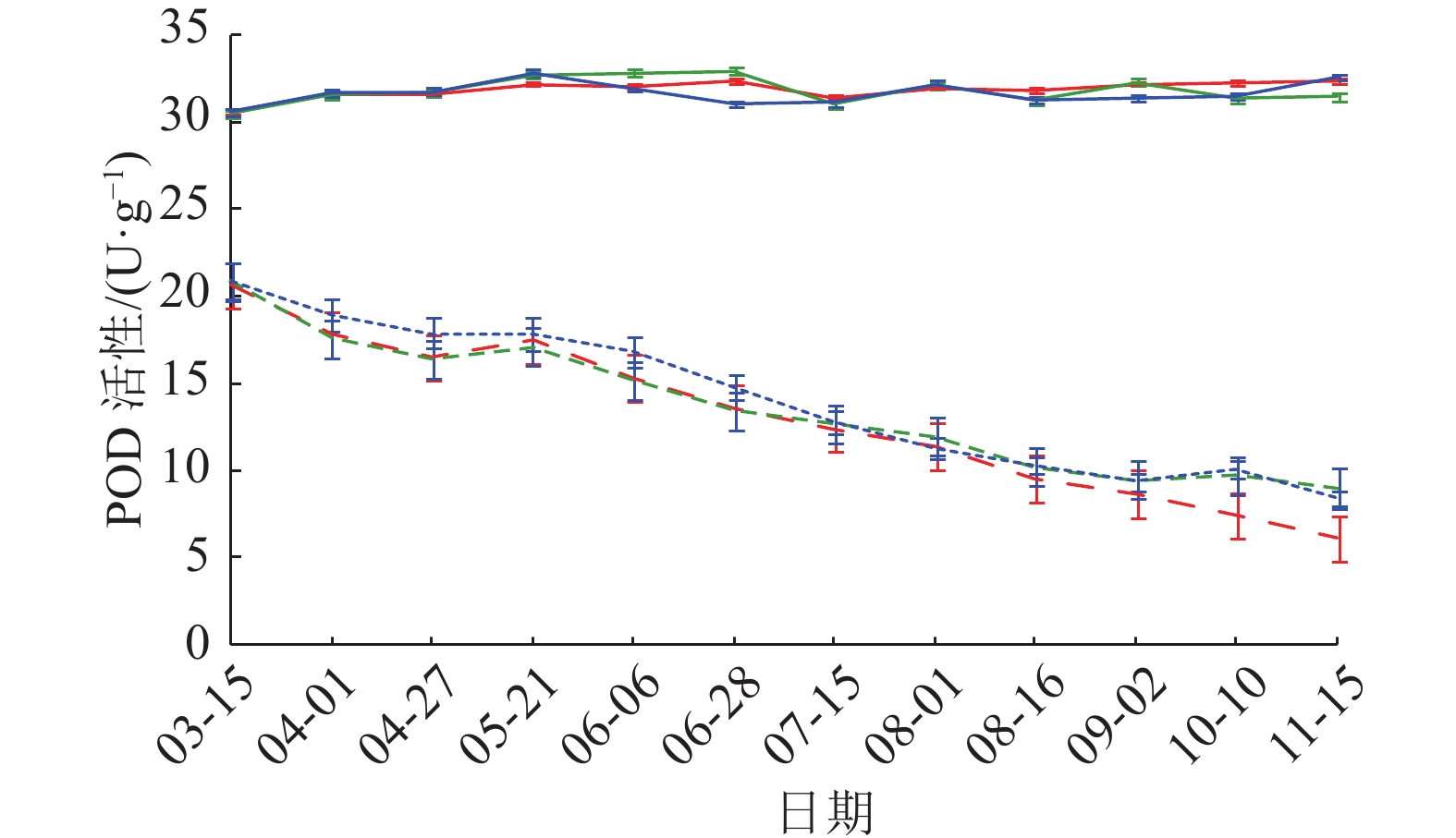
POD活性变化曲线(图5)显示,3个样地健康黄柏树皮3—11月POD活性比较稳定,基本维持在31 U·g-1左右,各时间点均无明显差异;感病黄柏树皮POD活性低于健康树皮,3个样地均呈现持续下降趋势,且样地间差异不明显。相关性分析(表3)表明,POD活性与发病率和病情指数均为极显著负相关。
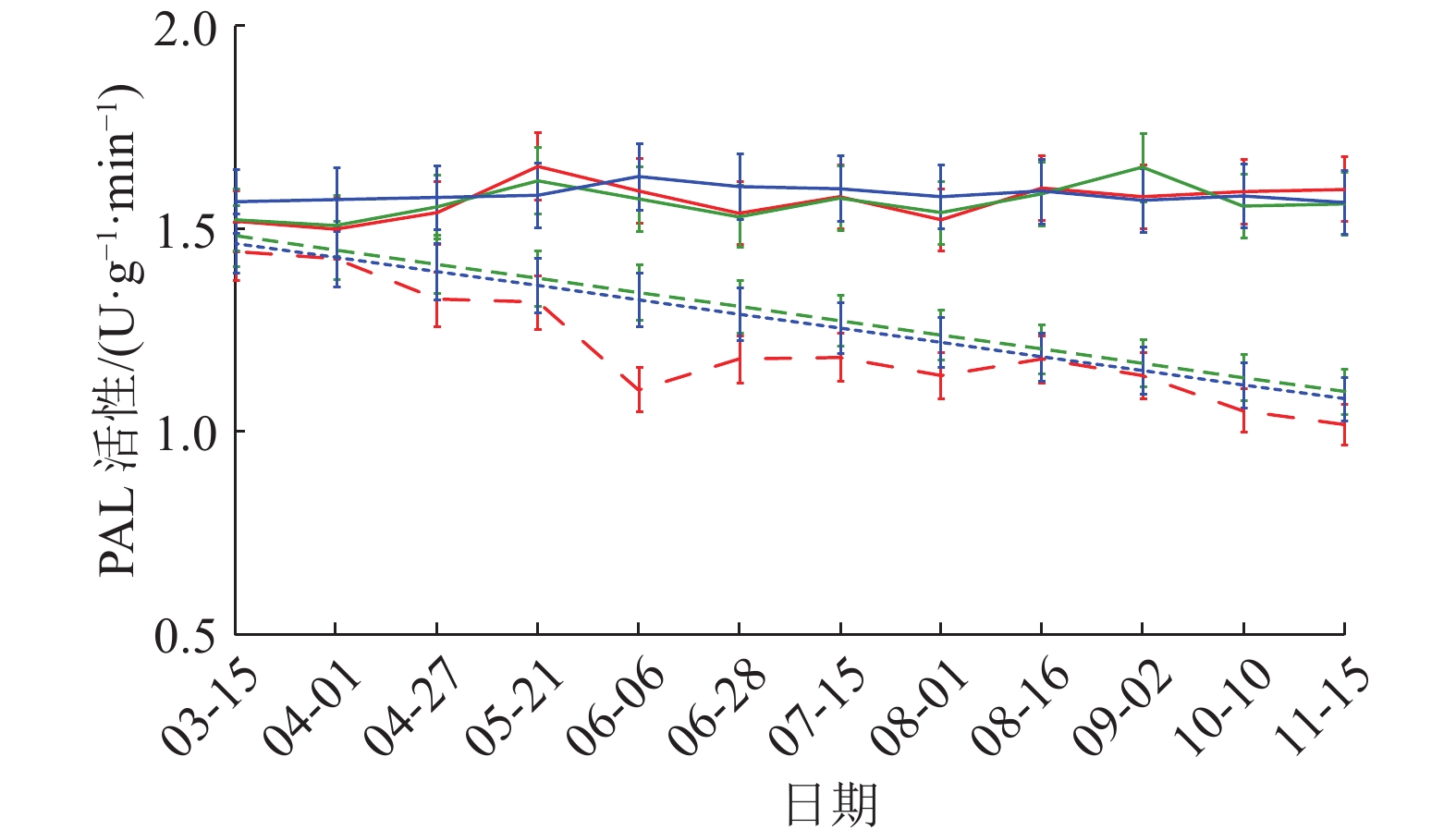
PAL活性变化曲线(图6)显示,3个样地健康黄柏树皮各个时间点PAL活性高于感病树皮,且3—11月PAL活性维持稳定,各月无明显差异。感病树皮PAL活性随时间呈下降趋势,3个样地差异不明显。相关性分析结果与POD一致,PAL活性与发病率和病情指数为极显著负相关(表3)。
|
图 5 POD活性动态变化 Figure 5 Dynamic change of POD activity 红、绿、蓝色线条分别表示样地1、2、3;实线表示健康黄柏,虚线表示感病黄柏 |
|
图 6 PAL活性动态变化 Figure 6 Dynamic change of PAL activity 红、绿、蓝色线条分别表示样地1、2、3;实线表示健康黄柏,虚线表示感病黄柏 |
|
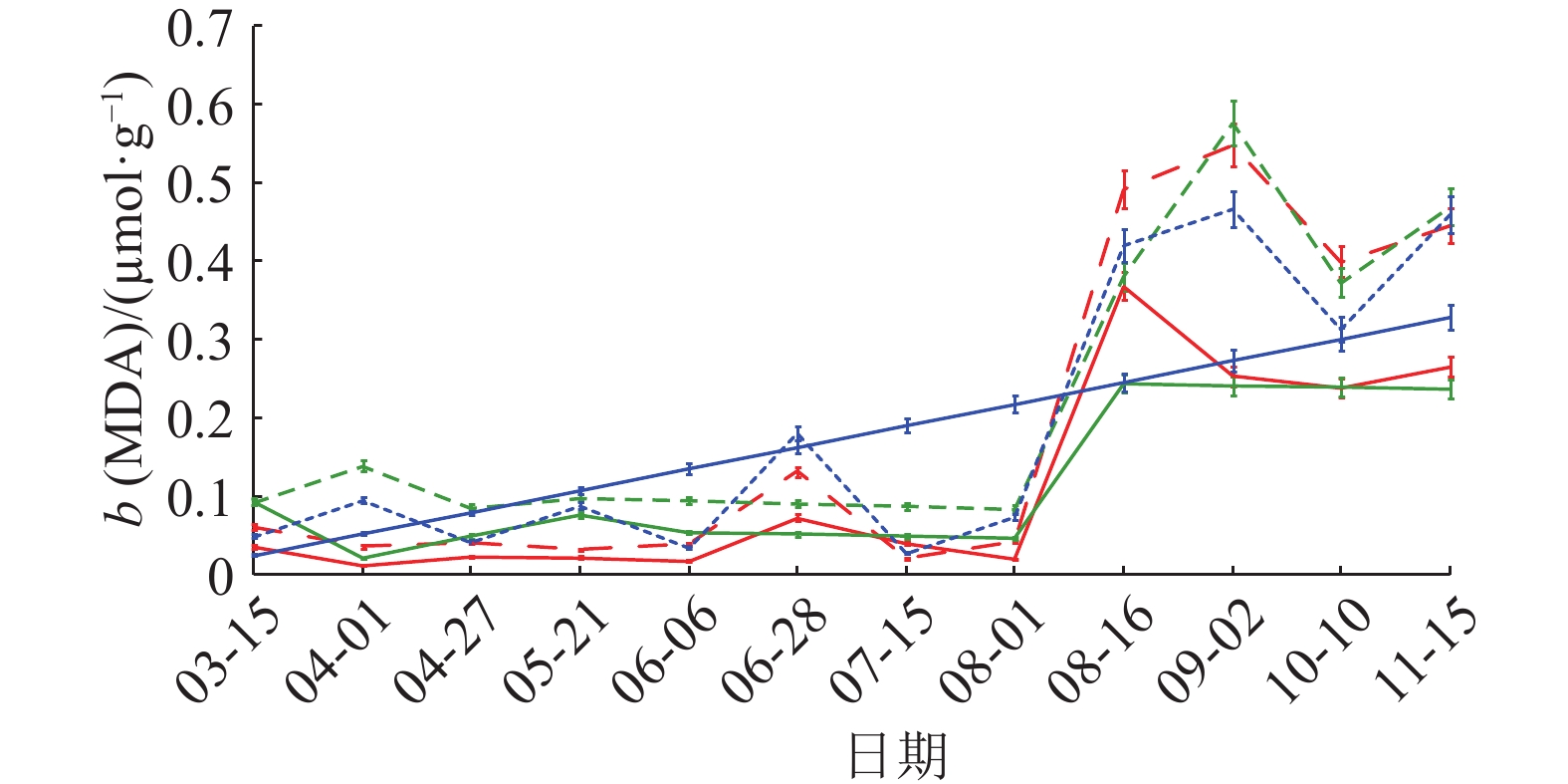
图 7 丙二醛含量动态变化 Figure 7 Dynamic change of MDA content |
MDA含量变化曲线(图7)显示,健康与感病黄柏树皮变化趋势相似,3—7月MDA含量较低,7—8月呈急剧增长,8月中旬或9月初达到峰值。比起健康黄柏,感病树皮MDA含量增长更为明显,3个样地感病树皮MDA含量在各时间点高于健康树皮。相关性分析(表3)表明,MDA含量与发病率、病情指数呈显著正相关,感病程度严重的黄柏树皮MDA的含量更高。
3 讨论与结论通过对四川省大邑县仰天窝药场和华山林场3个样地9个标准地黄柏膏药病发生规律的调查,树龄、坡向、坡度、树种组成与病害的关系非常密切。华山林场膏药病发生较为严重,可能原因是环境中温度较低,比较潮湿,有利于膏药病菌的繁殖扩展。不同树龄的林木对环境的适应能力、土壤肥力等均不同,从而对其长势和抗病能力会产生一系列的影响[17-18]。本研究中树龄与病害发生呈显著相关,与张茜等[19]对降香黄檀Dalbergia odorifera的研究不一致,结合刘兰玉[9]的报道分析原因可能是膏药病病菌是多年生担子菌,存活时间长,病斑累积显示病害加重;另一方面树龄越大,冠幅越大,光照减弱,为病原菌的传播提供了良好的环境。地形中以阴坡比阳坡样地的膏药病发生更为严重,阴坡郁闭阴凉,通风透光不良,排水不良,光合作用降低,导致黄柏自身抗病力变差,病害扩展迅速;坡度越大发病率和病情指数越低,与众多研究结论一致[9, 20-21]。树种组成与发病率和病情指数呈极显著负相关,说明黄柏与杜仲、厚朴混交有利于减轻病害的发生。而本研究中的3个样地郁闭度差异不显著,是否符合郁闭度越高病害发生越严重的结论[21],还需要扩大黄柏膏药病调查区域来论证,且该样地地形属于平坡,发病最重,这可能是由树种单一、树龄大、郁闭度高等因素综合决定,但具体哪一种因素起主要作用,还需进一步探究。综合来看,光照充足、湿度低、林分组成复杂有利于提高黄柏的抗病性,因此,在黄柏的生产中、尤其是病害发生严重的华山林场,应加强黄柏林的栽培管理,适时修剪改善透光条件,增加通风降低潮湿度,同时,在黄柏林中混栽其他树种以达到稳产的目的。
树皮组织含水量的多少是衡量树木抗病性的指标之一[22]。本试验采用相对肿胀度代表黄柏树皮含水量,膏药病会导致树皮含水量显著下降,影响树木的正常生理代谢,引发树木发育异常,甚至整株枯死的现象。
植物体是一个有着完善调控功能的系统,任何内外条件的变化都会引起植物体内蛋白质表达的变化。研究表明,在病原物及其代谢物的胁迫下[23-24],植物体内正常蛋白质合成受到抑制,但往往会有一种新蛋白产生或原有蛋白质含量明显增加。本研究测定的可溶性蛋白含量在病害发生的高峰期(7—8月)呈现急剧上升的趋势,可能是病原物的积累引发了黄柏抗性系统的反应,当高于一定水平后,组织的整体功能在短时间内遭到严重破坏,蛋白质合成受到阻遏,同时储藏蛋白质的水解加速,其含量迅速降低。但相关性分析结果并不显著,由于可溶性蛋白质的组成本身非常复杂,它对黄柏膏药病的作用方式及其调节功能亦不清楚,有待进一步研究。
植物体内存在膜保护系统,是由许多酶和还原型物质组成,其中SOD、POD、PAL等主要的抗氧化酶,可清除体内有害的活性氧,从而在逆境条件下保护植物膜系统[25-26]。本研究结果显示,3种酶活性与黄柏膏药病发生呈显著或极显著负相关关系,SOD在感病树皮中整个检测期内波动较大,结合Borsani等[27]的结果,可以证明膏药病菌和黄柏在相互识别过程中,病原物迫使寄主产生超过正常水平的O2-,寄主SOD功能受到显著影响。另外,有报道指出,抗性强的品种POD活性在一定范围内相对较低,超过这一范围则维持相对较高活性水平,能催化有毒物质的分解,其活性高低能反映植物受害的程度[28]。感病黄柏测试期内该指标显著下降,与感病程度呈极显著负相关,说明膏药病菌侵染并积累对黄柏防御酶系统破坏较大,受害程度增加。PAL是酚代谢的关键酶,可修复伤口,抑制病原物繁殖[29],大多数研究认为PAL活性与抗性显著正相关[30],本研究分析结果显示,感病黄柏树皮PAL酶活性有一定程度下降,反映了黄柏受害程度的增加,同时抗性减弱。MDA含量可以反映植物遭受逆境伤害的程度[28]。通过对树皮中MDA含量测定发现,MDA含量在8月迅速升高,与感病程度呈显著正相关,膏药病菌可能激活了黄柏活性氧系统,膜脂过氧化作用加剧,MDA积累。综上所述,膏药病对黄柏生理代谢影响显著,以上指标可作为黄柏抗性鉴定指标,但各生理变化之间的联系,如可溶性蛋白与黄柏体内抗性蛋白、病程相关蛋白和防御酶系合成有何关系,甚至各防御酶之间的相互关系,有待进一步探讨。
| [1] |
张冠英, 董瑞娟, 廉莲. 川黄柏、关黄柏的化学成分及药理活性研究进展[J]. 沈阳药科大学学报, 2012, 29(10): 812-821. (  0) 0) |
| [2] |
胡俊青, 胡晓. 黄柏化学成分和药理作用的现代研究[J]. 当代医学, 2009, 15(7): 139-141. (  0) 0) |
| [3] |
曹福祥. 黄柏、杜仲4种主要枝干病害的初步调查和鉴定[J]. 经济林研究, 1993, 11(S1): 333-335. (  0) 0) |
| [4] |
朱天辉, 陈第文, 曾保清, 等. 花椒膏药病的研究[J]. 四川农业大学学报, 1997, 15(1): 70-72, 127. (  0) 0) |
| [5] |
卢胜进. 果树膏药病综合防治技术[J]. 科学种养, 2013, 8(10): 32-33. DOI:10.3969/j.issn.1673-3339.2013.10.024 (  0) 0) |
| [6] |
LU C, GUO L, WEI J, et al. Two new species of Septobasidium (Septobasidiaceae) from Southern China
[J]. Mycotaxon, 2009, 109(1): 477-482. DOI:10.5248/109.477 (  0) 0) |
| [7] |
张东柱, 谢焕儒, 张瑞璋, 等. 台湾常见树木病害(树木膏药病)[M]. 台北: 台湾省林业实验所, 2000: 88-89.
(  0) 0) |
| [8] |
BIER J E. Relation of some bark factors to canker susceptibility[J]. Phytopathology, 1964, 54(4): 250-253. (  0) 0) |
| [9] |
刘兰玉. 板栗膏药病致病机理及病害控制研究[D]. 合肥: 安徽农业大学, 2007.
(  0) 0) |
| [10] |
唐永奉, 闫大琦, 杨建荣, 等. 5种药剂防治核桃膏药病药效试验[J]. 西部林业科学, 2014, 43(4): 128-131. (  0) 0) |
| [11] |
芦建国, 彭河忠. 鸢尾属植物的抗性研究进展[J]. 江西农业学报, 2012, 24(2): 48-51. (  0) 0) |
| [12] |
LI S J, ZHU T H. Biochemical response and induced resistance against anthracnose (Colletotrichum camelliae) of camellia (Camellia pitardii) by chitosan oligosaccharide application
[J]. Forest Pathol, 2013, 43(1): 67-76. (  0) 0) |
| [13] |
沈文飚, 徐朗莱, 叶茂炳, 等. 氮蓝四唑光化还原法测定超氧化物歧化酶活性的适宜条件[J]. 南京农业大学学报, 1996, 19(2): 101-102. (  0) 0) |
| [14] |
MOERSCHBACHER B M, NOLL U M, FLOTT B E. Lignin biosynthetic enzymes in stem rust infected,resistant and susceptible near-isogenic wheat lines[J]. Physiol Mol Plant P, 1988, 33(1): 33-46. DOI:10.1016/0885-5765(88)90041-0 (  0) 0) |
| [15] |
MANDAL S, MITRA A, MALLICK N. Time course study on accumulation of cell wall-bound phenolics and activities of defense enzymes in tomato roots in relation to Fusarium wilt
[J]. World J Microb Biot, 2007, 25(5): 795-802. (  0) 0) |
| [16] |
李姝江, 朱天辉, 黄艳娜, 等. 水杨酸诱导山茶抗灰斑病的作用及生理生化响应[J]. 林业科学, 2012, 48(2): 103-109. DOI:10.11707/j.1001-7488.20120215 (  0) 0) |
| [17] |
CAMP A E. Age structure and species composition changes resulting from altered disturbance regimes on the eastern slopes of the Cascades Range, Washington[J]. J Sustain Forest, 1999, 9(34): 39-67. (  0) 0) |
| [18] |
NORD L, CAO T A. Diameter distribution model for even-aged beech in Denmark[J]. Forest Ecol Manag, 2006, 231(13): 218-225. (  0) 0) |
| [19] |
张茜, 周国英, 董文统, 等. 降香黄檀人工林群落结构对叶部病害发生的影响[J]. 林业科学, 2015, 51(11): 121-127. (  0) 0) |
| [20] |
王柏泉, 艾训儒, 卢宗荣, 等. 鄂西南山区杜仲叶部病害发生规律的研究[J]. 中国森林病虫, 2006, 25(4): 4-6. (  0) 0) |
| [21] |
叶建仁, 廖太林. 松树枯梢病发生的立地条件及其主要诱因分析[J]. 林业科学, 2006, 42(9): 79-82. (  0) 0) |
| [22] |
刘红宇, 陈超燕, 刘晓莉, 等. 樟树黄化病与树皮电阻值、含水量关系的研究[J]. 安徽农业科学, 2006, 34(12): 2802-2805. DOI:10.3969/j.issn.0517-6611.2006.12.095 (  0) 0) |
| [23] |
LI S J, ZHU T H, ZHU H M Y, et al. Purification of protein AP-toxin from Arthrinium phaeospermum causing blight in Bambusa pervariabilis×Dendrocalamopsis grandis and its metabolic effects on four bamboo varieties
[J]. Phytopathology, 2013, 103(2): 135-145. DOI:10.1094/PHYTO-07-12-0164-R (  0) 0) |
| [24] |
ASHFAQ M, KHAN M A, JAVED N, et al. Effect of urdbean leaf crinkle virus infection on total soluble protein and antioxidant enzymes in blackgram plants[J]. Pak J Bot, 2010, 41(2): 447-454. (  0) 0) |
| [25] |
翁笑燕, 张木清, 阮妙鸿. 水分胁迫下钙对甘蔗幼苗抗氧化酶活性的影响[J]. 中国农学通报, 2007, 23(7): 273-279. (  0) 0) |
| [26] |
LI S J, ZHU T H. Purification of the toxin protein Pc from Arthrinium phaeospermum and its effect on the defence enzymes of Bambusa pervariabilis×Dendrocalamopsis grandis varieties
[J]. Forest Pathol, 2014, 44(2): 96-106. DOI:10.1111/efp.2014.44.issue-2 (  0) 0) |
| [27] |
BORSANI O, VALPUESTA V, BOTELLA M A. Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress in Arabidopsis seedlings
[J]. Plant Physiol, 2001, 126(3): 1024-1030. DOI:10.1104/pp.126.3.1024 (  0) 0) |
| [28] |
张永峰, 殷波. 混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J]. 草业学报, 2009, 18(1): 46-50. DOI:10.11686/cyxb20090107 (  0) 0) |
| [29] |
CAI K Z, GAO D, LUO S M, et al. Physiological and cytological mechanisms of silicon-induced resistance in rice against blast disease[J]. Physiol Plantarum, 2008, 134(2): 324-333. DOI:10.1111/ppl.2008.134.issue-2 (  0) 0) |
| [30] |
MANDAL S, MALICK N, MITRA A. Salicylic acid-induced resistance to Fusarium oxysporum f. sp. lycopersici in tomato
[J]. Plant Physiol Bioch, 2009, 47(7): 642-649. DOI:10.1016/j.plaphy.2009.03.001 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


