乳酸菌Lactobacillus spp.是一类能发酵碳水化合物产生乳酸的革兰阳性、无芽孢细菌的统称[1]。近年来,随着许多国家限制乃至禁止使用抗生素添加剂,乳酸菌作为一种公认的安全性较高、益生效果良好的益生菌,在饲料行业有着广阔的应用前景[2-3]。
产酸能力是乳酸菌的一个重要特性。近年来,产酸这一益生机制日益受到重视[4-5]。乳酸菌代谢产生的有机酸,如乳酸、乙酸、丙酸、柠檬酸和琥珀酸等,不仅能降低胃肠道pH,抑制、杀死肠道病原菌,调节肠道菌群平衡[6-7],同时还能提高胃肠道消化酶活性,促进矿物质吸收,缓解胃肠功能絮乱,降低腹泻发病率和死亡率[8-9],从而整体提高禽畜生长性能。此外,乳酸菌发酵产有机酸还有助于改善饲料产品口感和风味,提高饲料适口性以及防霉保质、延长饲料贮存期[10]。因此,在实际生产中,产酸能力强的乳酸菌具有更高的应用价值。
目前,在食品和保健品行业,乳酸菌的产酸能力已被广泛研究。然而,尽管大量研究表明乳酸菌产生的有机酸在饲料和养殖行业具有显著应用效果[11-12],但以产酸能力为指标筛选乳酸菌的研究鲜见报道。为此,本研究以产酸性能为主要指标,从酸性风味食品中筛选鉴定产酸性能优良的耐酸乳酸菌,并对其生长特性、耐受性以及抑制病原菌能力进行研究,以期为乳酸菌在饲料行业中的进一步应用提供优良菌种和技术支持。
1 材料与方法 1.1 材料 1.1.1 样品来源酸菜、酸豆角购自广州市先烈中路肉菜市场;梅菜由福建省上杭县古田镇农户腌制(1年陈)。
1.1.2 指示菌大肠埃希菌Escherichia coli ATCC 8739,金黄色葡萄球菌Staphylococcus aureus ATCC 6538,均保藏于广东省微生物菌种保藏中心。
1.1.3 培养基1) MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母粉4 g,磷酸氢二钾2 g,柠檬酸三铵2 g,乙酸钠5 g,葡萄糖20 g,吐温–80 5 mL,硫酸镁0.2 g,硫酸锰0.05 g,超纯水定容至1 L,调pH至7.2,分装试管后添加适量的石蜡,121℃条件下灭菌20 min;2) MRS琼脂培养基:配方同MRS液体培养基,添加琼脂粉15 g·L–1;3) 含碳酸钙的MRS琼脂培养基(CaCO3-MRS):MRS琼脂培养基中添加质量浓度为20 g·L–1的碳酸钙;4) NA液体培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,调pH至7.3,121 ℃条件下灭菌20 min。5) NA琼脂培养基:配方同NA液体培养基,添加琼脂粉15 g·L–1。
1.1.4 仪器与试剂仪器设备:高压蒸汽灭菌器HVE-50(Hirayama,日本);洁净工作台SW-CJ-2FD(苏净安泰,苏州);PHS-3C型pH计(雷磁,上海);梯度PCR仪GSX1(Eppendorf,德国);超纯水机RM-220(先河,湖州);离心机5424(Eppendorf,德国);电泳仪(六一,北京);超低温保存箱MDF-682(Panasonic,日本);生化培养箱LRH-250(浦东荣丰,上海);紫外可见分光光度计Ultrospec 6300 pro(GE Healthcare,英国);凝胶成像系统(BIO-RAD,美国);显微镜DM6(Leica,德国)。
主要试剂:2×Taq Master Mix即用型PCR预混液(Microanalysis,美国);细菌16S rRNA通用引物:上游引物(27F):5′-AGAGTTTGATCMTGGCTCAG-3′;下游引物(1492R):5′-TACGGYTACCTTGTTACGACTT-3′。引物由上海美吉生物医药科技有限公司合成;牛胆盐购自广东环凯微生物科技有限公司;乳酸、石蜡和过氧化氢等均为分析纯,购自广东广试试剂科技有限公司;其他常规试剂均为进口或国产分析纯产品。
1.2 方法 1.2.1 分离纯化乳酸菌取样品,加适量8.5 g·L–1的生理盐水研磨。将研磨液按倍比稀释法稀释至不同浓度,取10–6、10–7、10–8梯度的菌液涂布CaCO3-MRS平板,37 ℃厌氧培养48 h。挑取溶钙圈较大的菌落在MRS平板上划线分离,反复纯化。将纯化后的菌落进行革兰染色、镜检及H2O2接触酶试验,挑出无芽孢、接触酶阴性的革兰阳性菌株,置于φ为10%的甘油中,–80 ℃保存备用。
1.2.2 筛选耐酸乳酸菌用6 mol·L–1的盐酸分别调节MRS液体培养基pH至4.0、3.0和2.5。将分离纯化获得的乳酸菌进行活化并培养至对数生长期后,按φ为1%的接种量分别接种至pH为4.0、3.0和2.5的MRS液体培养基中,37 ℃厌氧培养24 h,以未接种的相应pH的培养基为空白对照,于600 nm下测各组菌液的光密度,选取耐酸性能较好的乳酸菌进行后续试验。
1.2.3 筛选耐胆盐乳酸菌取培养至对数生长期的耐酸乳酸菌新鲜菌液,按φ为1%的接种量分别转接至含0、1、2和3 g·L–1牛胆盐的MRS液体培养基,37 ℃厌氧条件下培养24 h,于600 nm下测各组菌液的光密度。
1.2.4 菌种鉴定形态学鉴定:将筛选获得的菌株涂布于MRS平板上,37 ℃厌氧条件下培养24 h 后,观察其菌落特征;取单菌落涂片,革兰染色,显微镜下观察其细胞形态。
16S rRNA基因分子鉴定:采用CTAB法[13]提取待鉴定菌株的基因组DNA,采用细菌16S rRNA基因通用引物27F和1492R进行PCR扩增,扩增体系及程序参见文献[14]。扩增产物送上海美吉生物医药科技有限公司测序。将测序结果提交Genbank进行Blast比对分析,并选取同属内近缘种的16S rRNA基因序列,采用MEGA6.0软件构建系统发育树。
1.2.5 测定产酸能力选取可在pH 3.0生长的菌株重新活化培养48 h,挑取单菌落分别接种至灭菌后pH为6.60的MRS液体培养基中,37 ℃厌氧条件下培养24 h,4 ℃条件下10 000 r·min–1离心10 min,用pH酸度计直接测定发酵上清液pH。同时,参照国标GB/T5413.34–2010[15]的方法测定滴定酸度,并以吉尔涅尔度(°T)表示乳酸菌发酵液的酸度,即每100 mL发酵液消耗1 mL浓度为0.1 mol·L–1的NaOH溶液相当于1 °T,每组滴定试验重复3个平行[16]。
1.2.6 测定抑菌性能以大肠埃希菌ATCC 8739和金黄色葡萄球菌ATCC 6538为指示菌,以NA培养基作为指示菌培养基,使用牛津杯打孔法进行抑菌试验。按φ为1%的接种量重新转接大肠埃希菌和金黄色葡萄球菌,28 ℃条件下180 r·min–1振荡培养17 h,使其菌体浓度约为107 cfu·mL–1。取2 mL上述大肠埃希菌或金黄色葡萄球菌菌液与200 mL经融化后保持在50 ℃左右的NA培养基混匀,在无菌平板上放置4个无菌牛津杯,用无菌移液管吸取20 mL覆盖平板。凝固后取出牛津杯,在孔中加入100 μL的乳酸菌发酵上清液,以调至相应pH的MRS空白培养基为对照,每组重复3个平行试验,37 ℃条件下培养20 h,测定抑菌圈直径。
1.2.7 绘制生长曲线及产酸曲线活化菌种,制备种子液,按φ为1%的接种量接种到MRS液体培养基中,37 ℃条件下培养。每间隔2 h取5 mL发酵液测D600 nm及pH,分别以D600 nm和pH为纵坐标,以时间为横坐标,绘制菌株生长曲线及产酸曲线。
1.2.8 耐酸、耐胆盐性能研究配制pH 为 2.0和2.5的MRS液体培养基以及pH 6.6且含3 g·L–1牛胆盐的MRS液体培养基。将已在37 ℃厌氧条件下培养20 h的待考察乳酸菌菌液,按φ为1%的接种量分别转接至pH 2.0、2.5或含3 g·L–1牛胆盐的MRS液体培养基中,37 ℃厌氧条件下培养3和6 h,取合适的稀释倍数进行涂布平板,每组重复3个平行试验,37 ℃条件下培养48 h后,选择菌落数30~300范围的平板进行菌落计数,并依据稀释倍数计算活菌数,cfu·mL–1。
2 结果与分析 2.1 乳酸菌的分离和筛选从酸菜、酸豆角及梅菜等样品中,共分离到81株溶钙圈较大、接触酶阴性、无芽孢的革兰阳性菌株,初步判断为乳酸菌。筛选发现,48株乳酸菌可在pH 4.0的MRS液体培养基中生长,10株乳酸菌能够在pH 3.0条件下生长,其中SC16、DJ8A、DJ9B和DJ10C菌株的耐酸能力相对较强,在pH 3.0条件下长势较好;所有菌株均无法在pH 2.5条件下生长。此外,对10株可在pH 3.0环境下生长的乳酸菌进行耐胆盐试验,结果如表1所示,除菌株SC15不能耐受质量浓度为1 g·L–1的牛胆盐外,其余9株乳酸菌均可在质量浓度为1 g·L–1的牛胆盐中生长,但均不能在质量浓度为2或3 g·L–1的牛胆盐中生长。上述结果表明,风味酸性食品获得的乳酸菌耐酸能力普遍较强,但对牛胆盐的耐受能力相对较差。
|
|
表 1 各乳酸菌在不同pH和牛胆盐质量浓度下的生长情况1) Table 1 The growth of Lactobacillus strains under different pH and bile salt concentrations |
对上述10株可在pH 3.0条件下生长的乳酸菌进行菌落形态及细胞形态观察。结果显示,菌株DJ3和SC3A的菌落形态为圆形,乳白色、不透明、凸起、有光泽、表面光滑湿润、直径0.5~1.5 mm;菌株DJ9B、DJ10C、SC15和SC16的菌落为圆形、灰白色、半透明、扁平、无光泽、表面光滑湿润、直径0.5~1.5 mm;菌株DJ8A、DJ8B、DJ9A和SC8的菌落为圆形、乳白色、不透明、扁平、有光泽、表面光滑湿润、直径2.0~3.0 mm。然而,虽然这10株乳酸菌有3种明显不同的菌落形态特征,但其细胞形态均没有明显差异,主要为短杆状,单个、成对或成链排列,无芽孢,革兰氏阳性,具体形态特征如图1所示。

|
图 1 部分乳酸菌的菌落形态和细胞形态图 Figure 1 The colony morphology and cell morphology of Lactobacillus strains a1、a2和a3分别为菌株DJ3、DJ9B和DJ8A的菌落形态图,b1、b2和b3分别为菌株DJ3、DJ9B和DJ8A的细胞形态图 |
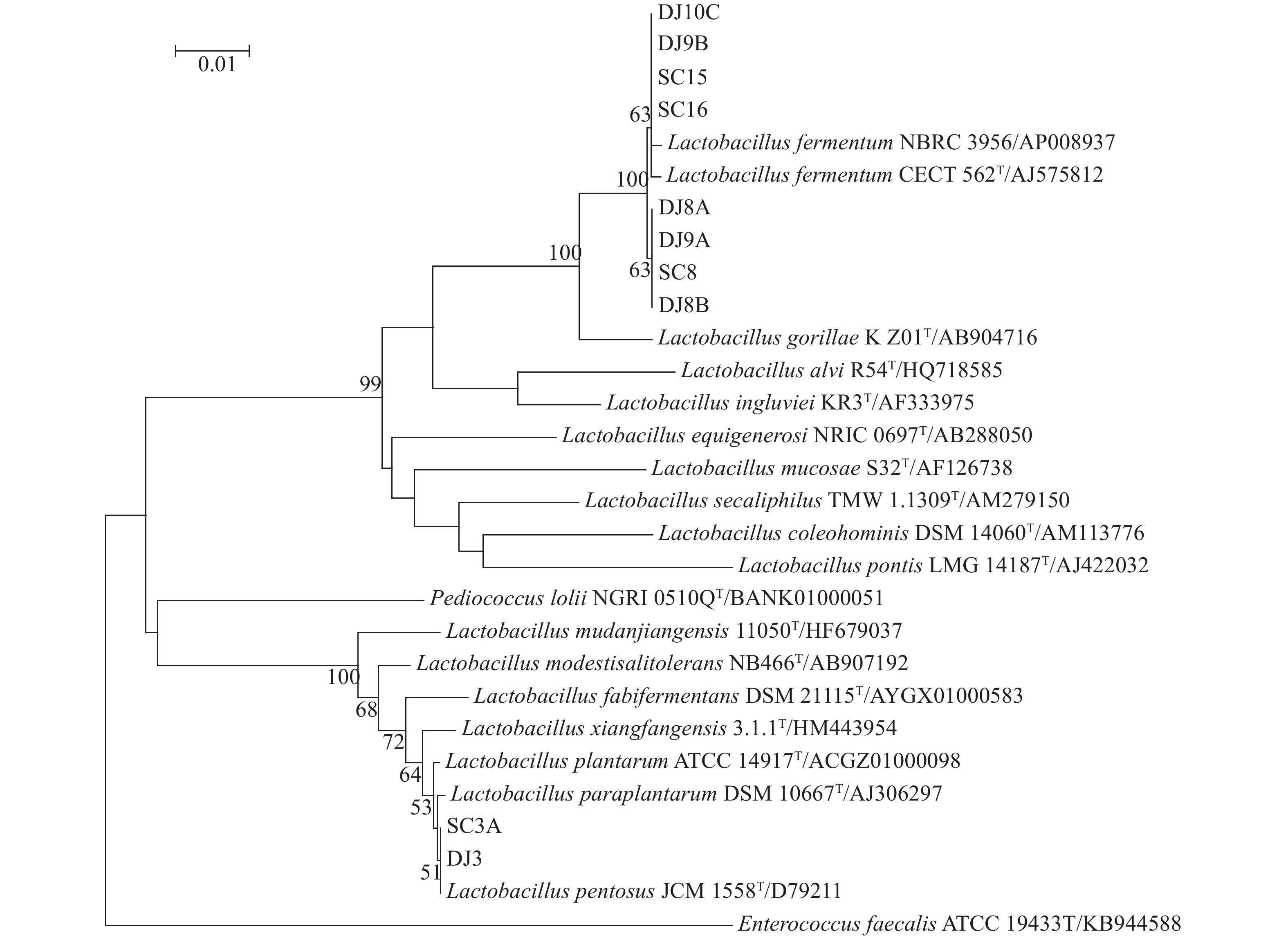
对这10株乳酸菌的16S rRNA基因序列进行分析、比对,选取同属内近缘种的16S rRNA基因序列,采用MEGA6.0软件分析,以Kimura-2模型计算遗传距离,以邻接法(Neighbor-Joining, NJ)构建系统发育树,Bootstrap自展1 000次检验进化树拓扑结构置信区间,结果如图2所示。
|
图 2 基于16S rRNA基因序列的乳酸菌系统进化树 Figure 2 Phylogenetic tree of Lactobacillus strains based on 16S rRNA gene sequences SC3A、DJ3、DJ8A、SC16、SC15、SC8、DJ10C、DJ9B、DJ9A和DJ8B这10株乳酸菌的16S rRNA基因序列GenBank登录号分别为 MF455206~MF455215 |
由图2可知,菌株SC3A和DJ3与Lactobacillus pentosus JCM 1558T的16S rRNA基因序列相似性达到100%,因此初步鉴定其为戊糖乳杆菌L. pentosus。而菌株SC15、SC16、DJ9B、DJ10C、SC8、DJ8A、DJ8B及DJ9A与L. fermentum CECT 562T和L. fermentumNBRC3956的16S rRNA基因序列相似性均达到99.65%以上,因此初步认定这8株乳酸菌为发酵乳杆菌L. fermentum。此外,菌株SC15、SC16、DJ9B及DJ10C之间的16S rRNA基因序列相似性为100%,而菌株SC8、DJ8A、DJ8B及DJ9A之间的16S rRNA基因序列相似性为100%,这与乳酸菌的形态学特征分类相符,说明上述8株发酵乳杆菌分别属于2个不同的种。
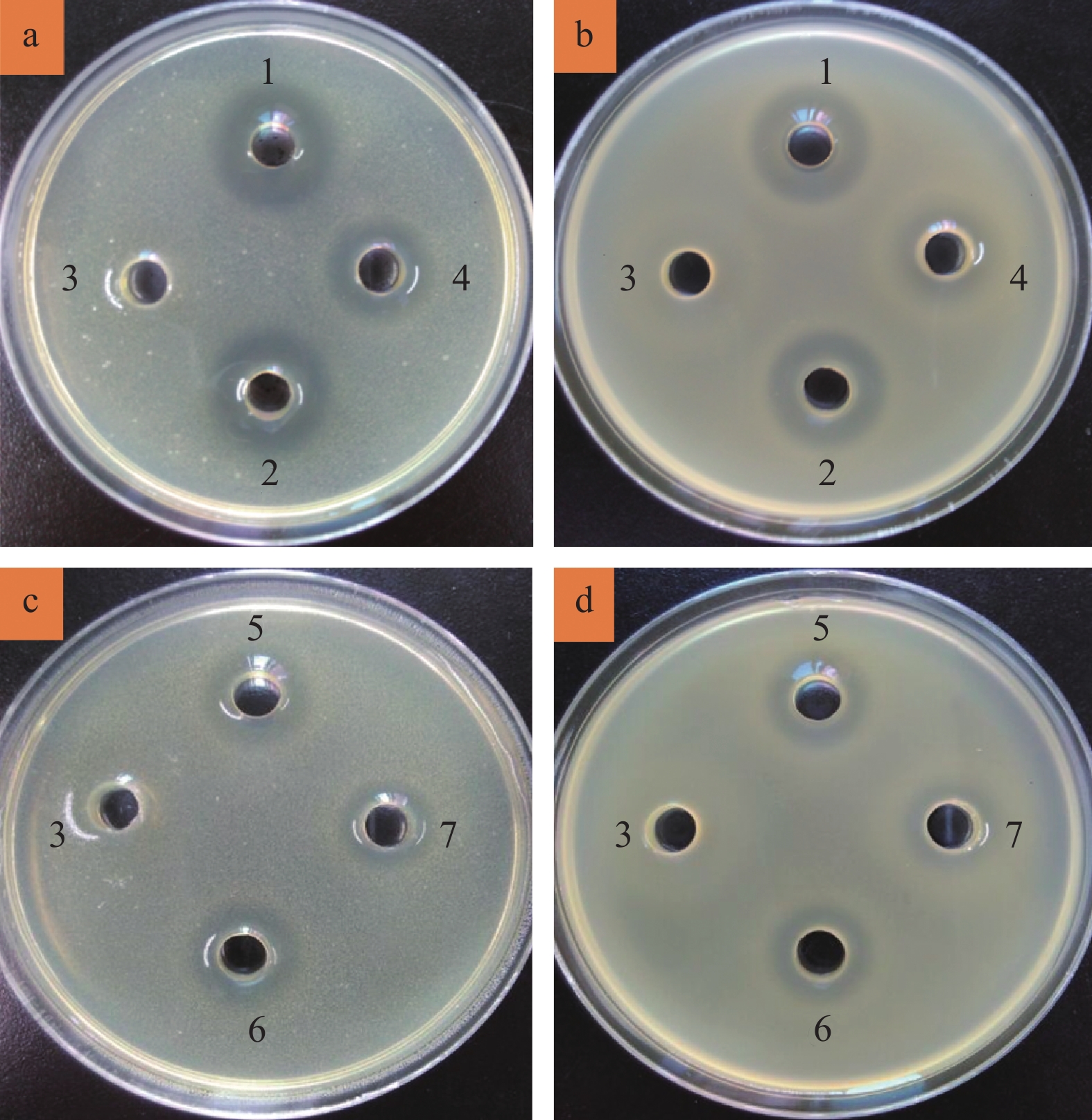
2.3 耐酸乳酸菌的产酸能力及抑菌作用考察对10株可在pH 3.0条件下生长的乳酸菌,进行产酸能力研究,并研究其对大肠埃希菌以及金黄色葡萄球菌的抑菌作用,结果如表2所示,菌液pH 与菌液酸度呈极显著负相关(两者的Pearson相关系数为0.929,P=0.000),戊糖乳杆菌DJ3和SC3A相对于其余8株发酵乳杆菌,菌液pH明显较低,酸度较高,说明其产酸能力较强,而其余8株发酵乳杆菌之间的产酸能力差距不大。此外,10株乳酸菌的发酵上清液对大肠埃希菌以及金黄色葡萄球菌均有明显抑菌效果,其中戊糖乳杆菌DJ3和SC3A 的抑菌作用明显优于其余8株发酵乳杆菌(图3)。另外,用乳酸调节MRS空白培养基至pH 3.72或4.32,其对大肠埃希菌及金黄色葡萄球菌也具有明显抑菌作用,但抑菌作用均不如相应pH的乳酸菌发酵上清液,而未接种的MRS培养基以及pH调至6.60的各乳酸菌发酵上清液对大肠埃希菌及金黄色葡萄球菌基本无抑菌作用(图3)。因此推测,一方面,乳酸对测试所用大肠埃希菌以及金黄色葡萄球菌具有明显的抑菌效果,另一方面,除乳酸外,上述乳酸菌还产生了其他抑菌物质,但这些抑菌物质在pH接近中性时,抑菌活性极弱,不足以形成较明显的抑菌圈。
|
|
表 2 各乳酸菌的产酸能力及抑菌作用1) Table 2 Acid-producing ability and antibacterial activity of Lactobacillus strains |
|
图 3 部分乳酸菌的发酵液对大肠埃希菌及金黄色葡萄球菌的抑菌效果 Figure 3 Inhibitory effect of the fermentation broth of Lactobacillus strains against Escherichia coli and Staphylococcus aureus a和c的指示菌为大肠埃希菌ATCC 8739,b和d的指示菌为金黄色葡萄球菌ATCC 6538;样品1、2、5和6分别为菌株DJ3、SC3A、DJ8A和DJ8B的发酵上清液,样品3为MRS培养基,样品4和7分别为用乳酸调pH至3.72和4.32的MRS培养基 |
根据表1和表2的分析测试结果,选取在pH 3.0条件下生长较好的发酵乳杆菌SC16、DJ8A、DJ9B、DJ10C及产酸能力较强的戊糖乳杆菌DJ3、SC3A进行生长曲线和产酸速率研究。如图4所示,戊糖乳杆菌DJ3和SC3A生长速度最快,发酵乳杆菌DJ9B次之,而发酵乳杆菌SC16、DJ10C及DJ8A最差。上述6株乳酸菌的生长趋势和产酸趋势存在对应关系:0~2 h为延滞期,菌体浓度没有明显增加,pH变化不大;2 h后进入对数生长期,菌体生长代谢旺盛,快速消耗碳源,产生大量有机酸,pH迅速下降;12 h左右达到生长稳定期,菌体浓度逐渐趋于稳定,pH也逐步趋于稳定,其中戊糖乳杆菌DJ3和SC3A菌液最终pH为3.7左右,而发酵乳杆菌菌液最终pH为4.3左右。

|
图 4 乳酸菌培养过程中菌液pH及D600 nm Figure 4 pH and D600 nm during the culture of Lactobacillus strains |
据“2.2”节的分析结果可知,菌株SC16和DJ10C与菌株DJ9B的形态学特征和16S rRNA基因序列基本一致,且其生长性能和产酸性能均明显不如DJ9B。结合表1和图4,选取生长性能和产酸性能较优的戊糖乳杆菌DJ3、SC3A以及耐酸性能相对较强的发酵乳杆菌DJ8A、DJ9B作为受试菌,进一步考察其对3 g·L–1牛胆盐质量浓度、pH 2.5以及pH 2.0的耐受性,结果如表3所示。
|
|
表 3 菌株DJ3、SC3A、DJ8A和DJ9B在不同培养条件下的存活能力1) Table 3 The viabilities of DJ3, SC3A, DJ8A and DJ9B strains under different culture conditions |
结果表明,戊糖乳杆菌DJ3和SC3A对pH 2.5的酸性环境具有较强的耐受性,在pH 2.5环境处理6 h,活菌数仍大于108 cfu·mL–1,但在pH 2.0或3 g·L–1牛胆盐浓度下耐受性极差,此条件下处理6 h,活菌数均小于100 cfu·mL–1,说明pH 2.0或含3 g·L–1牛胆盐的环境可能已超过了菌株SC3A及DJ3的生存耐受范围,导致其在此条件下耐受性极差。然而,与DJ3和SC3A相比,发酵乳杆菌DJ8A和DJ9B的耐酸和耐胆盐能力明显较强,其在pH 2.0或含3 g·L–1牛胆盐浓度的环境下处理3 h,活菌数仍可达106 cfu·mL–1,处理6 h,活菌数仍大于105 cfu·mL–1。
3 讨论与结论乳酸菌是动物肠道菌群的重要组成成分,具有改善胃肠道功能、提高动物免疫力、提高动物生产性能等益生作用。乳酸菌代谢产生的有机酸是重要的益生机制之一,近年来日益受到重视。
本研究从酸性风味食品中共分离到81株溶钙圈较大的乳酸菌。筛选发现,其中48株乳酸菌可在pH 4.0的MRS液体培养基中生长,10株乳酸菌能够在pH 3.0条件下生长。对这10株乳酸菌的产酸性能以及对大肠埃希菌和金黄色葡萄球菌的抑菌作用进行考察,结果表明10株乳酸菌发酵上清液对大肠埃希菌和金黄色葡萄球菌的均有明显抑菌作用,而且其产生的有机酸可能是主要抑菌成分。此外,研究发现,戊糖乳杆菌SC3A及DJ3产酸速度较快,发酵2 h后迅速产生大量有机酸,发酵12 h后pH趋于稳定,达到3.7左右,其产酸性能不但优于同批筛选获得的8株发酵乳杆菌,也普遍优于目前文献报道的常用产酸乳酸菌,如保加利亚乳杆菌、嗜热链球菌、植物乳杆菌及乳酸片球菌等[17-18]。这说明不同的乳酸菌产酸能力存在差异,戊糖乳杆菌的产酸能力值得深入研究和开发。
此外,由于动物体内胃液具有强酸性,pH一般维持在2.5~3.5之间[19],且十二指肠胆盐含量高,一般在0.3~3.0 g·L–1之间[20]。因此,在益生菌开发和使用过程中,筛选耐酸、耐胆盐的菌株同样具有重要意义,是益生菌充分发挥作用的前提。本研究在保证样品来源丰富度和菌种多样性前提下,选取生长性能和产酸性能较优的戊糖乳杆菌DJ3、SC3A以及耐酸性能相对较强的发酵乳杆菌DJ8A、DJ9B作为受试菌,进一步考察其对3 g·L–1牛胆盐质量浓度、pH 2.5以及pH 2.0的耐受性。结果表明,4株乳酸菌在pH 2.5条件下均具有良好的耐受性。其中,发酵乳杆菌DJ8A和DJ9B耐酸和耐胆盐能力相对较强,甚至能在一定程度上耐受pH 2.0及3 g·L–1牛胆盐质量的严苛条件。但是,戊糖乳杆菌SC3A和DJ3的生长速度、产酸能力以及拮抗病原菌的能力更强,具有良好的应用潜力。因此,如何通过菌株驯化、剂型保护等方法提高SC3A和DJ3对胃肠道环境的耐受性,值得深入研究。
据Stuart等[21]研究发现,用胆盐选择性驯化乳杆菌的胆盐耐受性是有效的,经过几代胆盐驯化后,得到的乳杆菌耐胆盐的能力比亲代乳杆菌强。由于本试验的样品来源于酸性风味食品,因此和以胃肠道或动物粪便作为筛选来源的研究报道相比,本试验所获得的乳酸菌产酸能力和耐酸能力相对较强,对胆盐耐受能力相对较弱,说明菌株的抗逆性能力可能与其特殊生存环境密切相关[22-25]。因此,本研究后续将对筛选获得的优良乳酸菌作进一步的胆盐驯化试验,以提高其整体性能。
近年来,乳酸菌类微生态制剂作为一种安全性较高的新型绿色功能性饲料添加剂,其产生和发展顺应了当前高新技术产业化和注重健康环保的主流,应用前景广阔。目前,虽然我国在乳酸菌制剂的研究和应用方面取得了一定的成绩,但还是比较薄弱,尤其是优良菌种资源方面,明显匮乏,严重阻碍了其在生产实践中的应用。为此,本研究筛选具有优良性能的乳酸菌并进行功能评价,对提高乳酸菌类产品的市场竞争力以及促进畜牧业的迅速健康发展都非常有意义。
| [1] |
BAO Q, LIU W, YU J, et al. Isolation and identification of cultivable lactic acid bacteria in traditional yak milk products of Gansu Province in China[J]. J Gen Appl Microbiol, 2012, 58(2): 95-105. DOI:10.2323/jgam.58.95 (  0) 0) |
| [2] |
李培培, 王建华, 张宝, 等. 饲用乳酸菌及其在养猪生产中的研究和应用[J]. 国外畜牧学(猪与禽), 2016, 36(10): 37-40. (  0) 0) |
| [3] |
SUKEGAWA S, IHARA Y, YUGE K, et al. Effects of oral administration of heat-killed Enterococcus faecium strain NHRD IHARA in post-weaning piglets
[J]. J Anim Sci, 2014, 85(4): 454. DOI:10.1111/asj.2014.85.issue-4 (  0) 0) |
| [4] |
AKANJI B T, ALAKE A B. Evaluation of organic acids, anti-Salmonella activities of lactic acid bacteria isolated from Nigerian grown salad vegetables
[J]. Br Biotechnol J, 2016, 11(1): 1-10. (  0) 0) |
| [5] |
MAKRAS L, LDE V. The in vitro inhibition of Gram-negative pathogenic bacteria by bifidobacteria is caused by the production of organic acids
[J]. Int Dairy J, 2006, 16(9): 1049-1057. DOI:10.1016/j.idairyj.2005.09.006 (  0) 0) |
| [6] |
PANIGRAHI P, BRAILEANU G T, CHEN H, et al. Probiotic bacteria change Escherichia coli-induced gene expression in cultured colonocytes: Implications in intestinal pathophysiology
[J]. World J Gastroentero, 2011, 13(47): 6370-6378. (  0) 0) |
| [7] |
陈星. 乳酸菌在动物生产中的应用研究现状[J]. 当代畜牧, 2014(33): 20-22. (  0) 0) |
| [8] |
FOOLADI A A I, FOROOSHAI M C, SAFFARIAN P, et al. Antimicrobial effects of four lactobacilli strains isolated from yoghurt against Escherichia coli O157:H7
[J]. J Food Safety, 2014, 34(2): 150-160. DOI:10.1111/jfs.2014.34.issue-2 (  0) 0) |
| [9] |
刘宇, 李阳, 刘通, 等. 乳酸菌益生特性及在猪生产中应用研究进展[J]. 动物医学进展, 2016, 37(6): 87-90. (  0) 0) |
| [10] |
YAHAYA M S, GOTO M, YIMITI W, et al. Evaluation of fermentation quality of a tropical and temperate forage crops ensiled with additives of fermented juice of epiphytic lactic acid bacteria[J]. Asian Austral J Anim, 2004, 17(7): 942-946. DOI:10.5713/ajas.2004.942 (  0) 0) |
| [11] |
马玉莲, 王爽, 张鹏宇, 等. 饲用有机酸的益生特性及其在猪生产中应用研究进展[J]. 猪业科学, 2016, 33(4): 40-42. (  0) 0) |
| [12] |
王巧丽, 季海峰, 韩向敏, 等. 饲用乳酸菌的主要代谢产物及其作用[J]. 饲料研究, 2012(10): 22-24. DOI:10.3969/j.issn.1002-2813.2012.10.008 (  0) 0) |
| [13] |
YANG Q, FRANCO C M, ZHANG W. Sponge-associated actinobacterial diversity: Validation of the methods of actinobacterial DNA extraction and optimization of 16S rRNA gene amplification[J]. Appl Microbiol Biot, 2015, 99(20): 8731-8740. DOI:10.1007/s00253-015-6875-8 (  0) 0) |
| [14] |
冯广达, 陈美标, 羊宋贞, 等. 用于PCR扩增的细菌DNA提取方法比较[J]. 华南农业大学学报, 2013, 34(3): 439-442. DOI:10.7671/j.issn.1001-411X.2013.03.031 (  0) 0) |
| [15] |
中华人民共和国卫生部.食品安全国家标准: 乳和乳制品酸度的测定: GB/T5413.34-2010[S].北京: 中国标准出版社, 2010.
(  0) 0) |
| [16] |
缑敬轩, 吕嘉枥, 张智维, 等. 泡菜中益生性乳酸菌的筛选和鉴定[J]. 中国酿造, 2008, 27(6): 22-24. (  0) 0) |
| [17] |
马春丽, 张兰威. 高产酸性能乳酸菌的筛选及产酸机理研究[J]. 食品工业科技, 2010, 31(1): 189-190. (  0) 0) |
| [18] |
张慧杰, 玉柱, 王林, 等. 青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J]. 草地学报, 2011, 19(1): 137-141. DOI:10.11733/j.issn.1007-0435.2011.01.024 (  0) 0) |
| [19] |
HOLZAPFEL W H, HABERER P, SNEL J, et al. Overview of gut flora and probiotics[J]. Int J Food Microbiol, 1998, 41(2): 85-101. DOI:10.1016/S0168-1605(98)00044-0 (  0) 0) |
| [20] |
吴祖芳, 洪松虎, 沈锡权, 等. 乳酸菌高抗氧化活性菌株的筛选及鉴定[J]. 中国食品学报, 2010, 10(1): 73-78. (  0) 0) |
| [21] |
STUART M R, CHOU L S, WEIMER B C. Influence of carbohydrate starvation and arginine on culturability and amino acid utilization of Lactococcus lactis subsp. lactis
[J]. Appl Environ Microb, 1999, 65(2): 665-673. (  0) 0) |
| [22] |
孙宏, 卢志超, 吴逸飞, 等. 猪源乳酸菌的筛选、体外益生效果评价及对小鼠肠道菌群的影响[J]. 中国畜牧杂志, 2016, 52(19): 66-70. (  0) 0) |
| [23] |
冯会贤, 梅星星, 蒋瑞瑞, 等. 禽用乳酸菌的筛选与功能鉴定[J]. 西北农林科技大学学报(自然科学版), 2016, 44(9): 35-41. (  0) 0) |
| [24] |
高擎燏, 李平华, 黄瑞华, 等. 猪源乳酸菌的抗逆性及益生性研究[J]. 畜牧与兽医, 2015, 47(10): 41-46. (  0) 0) |
| [25] |
曹珂, 林丽萍, 陈于陇, 等. 一株健康仔猪肠道乳酸菌的筛选鉴定与饲喂安全性的研究[J]. 江西农业大学学报, 2014, 36(6): 1325-1331. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


