2. 华南农业大学 实验动物中心,广东 广州 510642;
3. 深圳出入境检验检疫局 动植物检验检疫技术中心,广东 深圳 518045
2. Laboratory Animal Center, South China Agricultural University, Guangzhou 510642, China;
3. Inspection and Quarantine Center for Animals and Plants, Shenzhen Entry-exit Inspection and Quarantine Bureau, Shenzhen 518045, China
自朗洪武等[1]2001年报道我国存在由猪圆环病毒2型(Porcine circovirus type 2,PCV2)感染导致的断奶仔猪多系统衰竭综合症(Post-weaning multisystemic wasting syndrome,PMWS)以来,由PCV2感染引起的相关疾病在全国许多省市的猪场均有发生,且呈不断蔓延趋势[2-4],引起养猪业的广泛重视。PCV2主要导致猪只免疫系统受抑制[5],与多种病原菌混合感染引起严重病症[6],而且从临床症状很难做出准确诊断。受PCV2感染的细胞不呈现病变[7],获得的病毒培养物毒价较低,抗原制备成本较高。昆虫杆状病毒表达系统具有外源蛋白易纯化、产量较高和免疫原性较好等特点[8],在抗原诊断上取得了长足进展,得到国内外研究者的认同。
PCV2病毒基因组主要包括2个开放的阅读框架(ORF1和ORF2),其中ORF1编码病毒蛋白复制酶(Replicin protein,Rep)[9],ORF2编码病毒衣壳蛋白(Capsid protein,Cap)[10]。Cap是PCV2的主要结构蛋白,目前已成为检测PCV2特异性抗体比较理想的目标抗原[11-13]。本研究将含有PCV2-ORF2基因的重组杆状病毒接种于昆虫细胞进行真核表达,并将表达的纯化产物进行免疫小鼠对比试验,以研究重组蛋白*Cap的免疫原性,为进一步研究PCV2免疫学特性和亚单位疫苗研制奠定基础。
1 材料与方法 1.1 材料重组PCV2-ORF2基因的杆状病毒Bacmid-ORF2和质粒pcDNA3.1-ORF2(包含ORF2全阅读框)由国家生猪种业工程技术研究中心构建、鉴定并保存[14];High five昆虫细胞由中山大学生物防治国家重点实验室赠送;Sf9昆虫细胞购自Invitrogen公司。
DMEM细胞基础培养基(高糖型)购自GIBCO公司;Express Five®昆虫细胞无血清培养基、Grace’s培养基和L–谷氨酰胺购自Invitrogen公司;胎牛血清为中国医学科学院生物工程研究所产品。
BALB/c小鼠,SPF级,雄性,6周龄,购自中山大学实验动物中心。
Cellfectin®细胞转染剂、ProBondTM树脂色谱柱及相关试剂购自Invitrogen公司;预染蛋白Marker、HRP–羊抗IgG是晶美生物技术有限公司产品;咪唑为Sigma公司产品;尿素购自北京鼎国生物技术有限公司;去内毒素质粒大量抽提试剂盒购自广州美基生物科技有限公司;PCV2抗体检测ELISA试剂盒为北京世纪元亨公司产品。
1.2 重组杆状病毒的获得 1.2.1 Sf9昆虫细胞的转染和收获在每个35 mm(6孔板)的孔中加入9×105个Sf9细胞、含双抗的Grace’s培养基2 mL,27 ℃贴壁生长至少1~2 h,用无抗生素的培养基清洗细胞2次;在100 μL的无抗生素培养基中加入5 μL Bacmid-ORF2和5 μL 细胞转染剂,室温放置30 min,加入0.8 mL培养基,轻轻混匀,将脂质体–DNA的混合物加到细胞表面,27 ℃培养5 h;弃去转染混合物,加入2 mL含抗生素的Grace’s培养基,28 ℃培养72 h后收获第1代(P1代)种毒。
1.2.2 重组杆状病毒的扩增以P1代重组种毒接种能高效表达的High five细胞以制备高滴度的第2代(P2代)种毒。挑选处于对数生长期并且生长良好的High five细胞(约105 mL–1),吸弃培养基,加入P1代重组种毒20 μL与900 μL Express Five®培养基(含w为10%的L–谷氨酰胺)的混合液,覆盖住细胞,27 ℃静置1~2 h,每间隔20 min轻轻摇动培养瓶;弃掉上清液,加入2 mL含5%(φ)胎牛血清的Express Five®培养基(含w为10%的 L–谷氨酰胺),28 ℃培养48 h之后,收集培养上清液,分成小管于4 ℃保存,为P2代病毒液。
1.3 表达产物SDS-PAGE和Western-Blot分析按文献[15]的方法制胶,将细胞轻轻吹下,3 000 r·min–1离心10 min,取上清液加入200 μL 2×SDS-PAGE Loading Buffer,煮沸5 min,立即冷却;细胞沉淀用预冷的PBS缓冲液洗涤2次,加入200 μL 2×SDS-PAGE Loading Buffer,将沉淀打散后煮沸5 min,立即冷却,3 000 r·min–1离心10 min后取15 μL用于SDS-PAGE。
根据文献[15]的方法安装转移装置,将SDS-PAGE电泳的蛋白条带转移至硝酸纤维膜,用含 5% (w)脱脂奶粉的TBS(20 mmol·L–1 Tris-HCl,150 mmol·L–1 NaCl)缓冲液封闭,以猪PCV2阳性血清为一抗、HRP–羊抗猪IgG为二抗,DAB染色。
1.4 重组蛋白*Cap的大量表达昆虫细胞培养:当High five细胞铺满细胞瓶底时,倒去原液,加入新的Express Five®培养基(含φ为10%的胎牛血清,w为10%的L–谷氨酰胺,100 U·mL–1青霉素),按体积比1∶3分瓶传代,放入28 ℃培养箱中静止培养3~5 d。将3瓶长成单层的细胞转入1个大细胞瓶中生长,加入100 mL新的Express Five®培养液,再用大细胞瓶按体积比1∶3分瓶传代。
重组融合蛋白*Cap的大量表达:昆虫细胞分瓶后24 h,将φ为0.5%的P2代种毒液接种于High five昆虫细胞上,放入28 ℃培养箱中静止培养96 h,收集细胞悬液。连续接毒数次,收集所有细胞及悬液。
1.5 重组蛋白的纯化参照ProBondTM试剂盒说明书进行操作。将收集的细胞悬浮于细胞缓冲液中,通过18号针头,3 000 r·min–1离心15 min,收集细胞液上清,过柱,将洗脱液加入到纯化后的重组蛋白中洗脱,在缓冲液中4 ℃过夜。透析后,分装样品。
1.6 表达蛋白纯化效果检测SDS-PAGE电泳检测融合表达蛋白纯化效果。蛋白质质量浓度的测定:用紫外分光光度计测定波长在260和280 nm的吸光度(D),按下式计算纯化样品中的蛋白质质量浓度[ρ(蛋白质)]:
ρ(蛋白质)=1.45D280 nm–0.74D260 nm。
1.7 pcDNA3.1-ORF2的大量制备按照质粒大量抽提试剂盒(HiPure Plasmid EF Maxi Kit)说明书进行操作。细菌大量培养后,经过重悬、裂解和过滤菌液,将HiPure EF Maxi Column套在50 mL无菌收集管中,逐步转移混合液至柱子中洗脱,5 000 r·min–1离心10 min,倒弃滤液,加入0.8 mL Buffer TE至柱子膜中央,静置2 min,7 000 r·min–1离心3 min,再加入0.4 mL Buffer TE至柱子膜中央,7 000 r·min–1离心3 min,弃柱子,把质粒保存于–20 ℃。
1.8 动物免疫试验30只SPF级雄鼠随机平均分为3组,二次免疫在首次免疫后10 d进行,三次免疫在二次免疫后14 d进行。a组(pcDNA3.1-ORF2)在免疫前3 d分别在小鼠右后腿股四头肌注射0.5 mg·mL–1的盐酸普鲁卡因50 µL进行预处理,使局部组织变性后再生,以提高外源基因的表达,正式免疫时于小鼠相同部位注射质粒pcDNA3.1-ORF2,每次免疫每只小鼠注射100 µg。b组首次免疫用弗氏完全佐剂和*Cap制成油乳剂疫苗进行腹腔免疫,二次免疫和三次免疫使用弗氏不完全佐剂制成的油乳剂疫苗进行腹腔免疫,每次免疫每只小鼠注射100 µg。c组为PBS对照组,于小鼠的右后腿股四头肌注射PBS缓冲液,每次免疫每只小鼠注射100 µg。断尾采血在二次免疫后10 d和三次免疫后7 d进行。
1.9 免疫小鼠脾脏T淋巴细胞增殖试验三次免疫后第7天 ,每组随机取5只小鼠,无菌取脾,在DMEM营养液中剪碎,磨碎后200目筛过滤,将细胞悬液加于等量的淋巴细胞分层液上层,2 500 r·min–1离心15 min,吸白色淋巴细胞层至另一无菌离心管,用DMEM营养液洗涤2次,离心,用DMEM(含φ为10%的小牛血清、双抗100 IU·mL–1)将细胞数调到1×107 mL–1。在96孔板中每孔加入100 μL脾细胞液,同时加刀豆凝集素ConA至质量浓度为20 μg·mL–1,在37 ℃的CO2培养箱静置36 h;每孔加入10 μL MTT(5 mg·mL–1),置37 ℃的CO2培养箱静置3~4 h;每孔加入100 μL 10% (w) SDS–0.01 mol·L–1 HCl溶液,混匀,37 ℃的CO2培养箱静置2 h;在酶标仪上读取波长为570 nm时的吸光度(D)。对各组T细胞活化数据(D570 nm)进行统计学处理,用t检验比较各分组之间差异的显著性。
1.10 小鼠血清抗体检测试验将ELISA检测试剂盒中的二抗用HRP–羊抗鼠IgG替换,根据ELISA试剂盒使用说明书进行操作。
2 结果与分析 2.1 重组转染载体Bacmid-ORF2转染昆虫细胞重组转染载体转染昆虫细胞后,昆虫细胞逐渐发生改变,细胞变大变圆,细胞核变大,几乎充满细胞,产生明显的细胞病变,96 h后有些细胞溶解、破裂,溶液中出现细胞碎片(图1)。

|
图 1 重组转染载体Bacmid-ORF2转染昆虫细胞后的细胞病变 Figure 1 The cytopathic effect of insect cells transfected by recombinant transfection vector Bacmid-ORF2 |
ORF2阅读框编码的蛋白相对分子质量约为28 000,同时载体两端序列编码的短肽(重组蛋白的C'末端带有的V5抗原决定基和六聚组氨酸标记序列)相对分子质量约4 000,则理论上表达的目的蛋白相对分子质量应为32 000左右。重组病毒感染昆虫细胞以后,用SDS-PAGE方法分析表达的蛋白,比野生型对照组多出1条蛋白条带,分子量与融合蛋白基本一致(图2A)。电泳产物电转移至硝酸纤维膜,进行Western-blot分析。结果显示:硝酸纤维膜上有1条明显的棕色印迹出现,无非特异性条带出现,野生型杆状病毒转染的昆虫细胞表达产物则无颜色反应条带(图2B),说明表达产物抗原性良好。

|
图 2 重组蛋白的SDS-PAGE和Western-blot分析 Figure 2 SDS-PAGE and Western-blot analyses of recombinant protein Mr:标准分子量蛋白Marker;1、2:重组杆状病毒转染High five细胞收获的蛋白;3:野生型杆状病毒转染High five细胞收获的蛋白 |
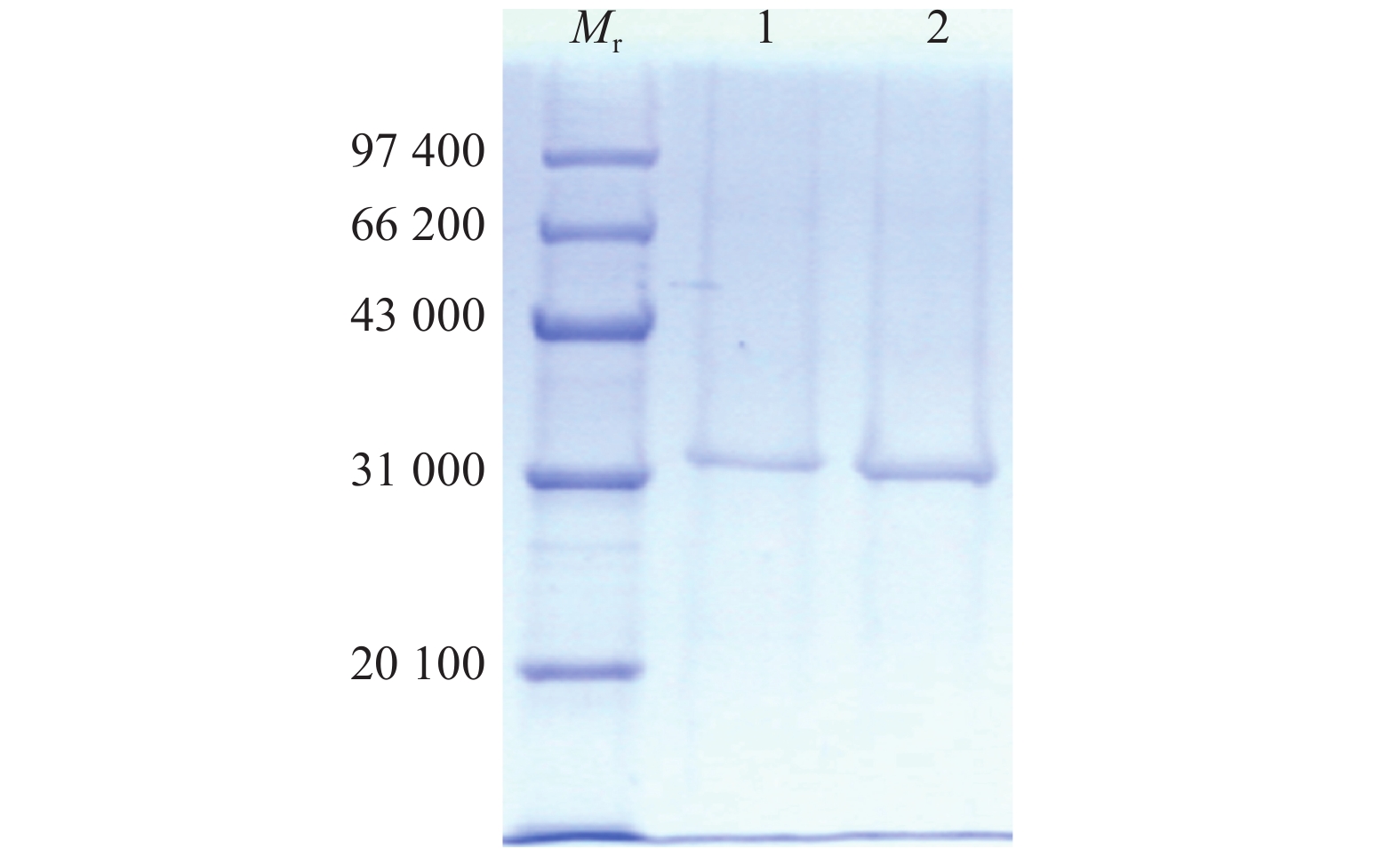
将收集到的纯化后的重组融合蛋白样品进行SDS-PAGE分析,考马斯亮蓝染色,结果表明,纯化后的蛋白只在相对分子质量32 000处有1条非常明显的蛋白条带(图3),说明重组蛋白已纯化。
|
图 3 重组融合蛋白纯化后的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of purified recombinant fusion protein Mr:标准分子量蛋白Marker;1、2:纯化后的重组蛋白 |
用紫外分光光度计测得该纯化蛋白在280和260 nm处吸光度并分别代入公式,得到蛋白质质量浓度为0.301 87 mg·mL–1。
2.5 免疫小鼠脾脏T淋巴细胞增殖试验结果在三次免疫后1周无菌取小鼠脾脏并分离脾淋巴细胞,以MTT法测定其细胞免疫水平,试验结果见表1。ConA能刺激试验组免疫鼠的T淋巴细胞增殖转化,试验组和对照组测定结果差异极显著(P<0.01),表明淋巴细胞增殖,且能够在病毒的细胞免疫中发挥一定作用,b组的效果极显著优于a组(P<0.01)。
|
|
表 2 免疫小鼠血清抗体测定结果1) Table 2 The serum antibody test results of immunized mice |
免疫小鼠分别在二次免疫后10 d和三次免疫后7 d断尾采血,分离血清。用ELISA检测试剂盒测定小鼠血清中的抗体,结果见表2。a组二次免疫后所测的D570 nm值与c组差别不大,但D570 nm值在三次免疫后有所增大。b组二次免疫后产生了特异性抗体,且抗体免疫水平在三次免疫后略有升高。t检验分析显示三次免疫后c组和a、b 2组差异极显著(P<0.01);重组质粒制作的基因疫苗能够产生一定的免疫效果。相比之下*Cap组能诱导小鼠产生特异性抗体,而pcDNA3.1-ORF2组抗体滴度较低,免疫效果不理想。
|
|
表 1 免疫小鼠脾脏T淋巴细胞增殖试验结果 Table 1 The spleen T lymphocyte proliferation test results of immunized mice |
本研究采用的是昆虫杆状病毒表达系统,在表达真核蛋白时,可以进行蛋白的翻译后修饰,使表达的产物更接近天然蛋白,其优越性远超过细菌表达体系。在使用该系统进行蛋白表达的时候,细胞系的选择很关键。本试验选用Sf9细胞进行病毒扩增,重组蛋白表达选用High five细胞。因为相比其他的昆虫细胞系,Sf9细胞病毒扩增的能力比较强,且容易转染,易于得到大量重组病毒子。High five细胞系是目前商业市场最好、表达量最高的细胞系,其表达量要比Sf9细胞高5~10倍,而且High five细胞系可以用无血清培养基培养,方便表达产物的纯化。2000年,第1个利用昆虫杆状病毒表达系统生产的疫苗面市,是表达猪瘟病毒E2蛋白的重组苗,随后2006年一款名为“CircoFLEX”表达PCV2-ORF2蛋白的商业化重组杆状病毒亚单位疫苗问世,至今已广泛应用[16]。2009 年,第1个利用昆虫杆状病毒表达系统生产的人用疫苗在美国上市[17],该疫苗以重组人乳头瘤状病毒(Human papillomavirus,HPV)16、18 型L1 蛋白为主要抗原。尽管该表达系统有着独特的优势,但也存在一些不足,如重组蛋白易降解等问题。昆虫杆状病毒表达系统本身就是一个裂解性的系统,在蛋白质产生的每个阶段都有蛋白酶的分泌,杆状病毒感染昆虫细胞后,细胞本身的应激反应也产生蛋白酶,并随细胞裂解释放出来,这些蛋白酶会造成重组蛋白的降解。同时采用的无血清培养基缺少血清蛋白质的保护,使蛋白质水解的问题更加严重[18],这或许是本试验重组蛋白表达量不高的原因。
本研究在已构建了成功表达PCV2外壳蛋白的重组昆虫杆状病毒的基础上,将PCV2重组Cap蛋白杆状病毒在High five昆虫细胞中表达。经SDS-PAGE电泳可观察到特异性表达条带,用PCV2阳性猪血清对ORF2基因重组杆状病毒表达蛋白进行Western-blot免疫检测分析,结果显示重组表达蛋白在变性条件下仍可被PCV2多克隆阳性血清所识别,印迹膜上接近蛋白相对分子质量部位呈现1条特异的显色条带,而野生型杆状病毒表达蛋白无此反应条带,表明所表达的重组蛋白*Cap是特异的,并且具有良好的抗原性。进一步用纯化的*Cap和质粒pcDNA3.1-ORF2分别免疫小鼠,发现*Cap不论是在细胞免疫水平还是体液免疫水平其免疫效果均优于pcDNA3.1-ORF2,表明其具有PCV2疫苗潜在应用价值。
| [1] |
郎洪武, 王力, 张广川, 等. 猪圆环病毒分离鉴定及猪断奶多系统衰弱综合征的诊断[J]. 中国兽医科技, 2001, 31(3): 3-4. (  0) 0) |
| [2] |
吴佳俊, 张硕, 刘颖昳, 等. 我国种猪主要垂直传播性疫病流行态势分析及控制策略探讨[J]. 中国动物检疫, 2017, 34(8): 14-16. (  0) 0) |
| [3] |
胡帅, 周庆安, 李军, 等. 2013—2014年广西省主要猪病毒性传染病流行病学调查[J]. 中国畜牧兽医, 2016, 43(6): 1618-1623. (  0) 0) |
| [4] |
曹东阳, 王小敏, 钱爱东, 等. 江苏省及周边地区猪圆环病毒Ⅱ型(PCV2)分子流行病学调查[J]. 江苏农业学报, 2016, 32(2): 390-398. (  0) 0) |
| [5] |
ELLIS J. Porcine circovirus: A historical perspective[J]. Vet Pathol, 2014, 51(2): 315-327. DOI:10.1177/0300985814521245 (  0) 0) |
| [6] |
GU J, XING G, LEI J, et al. Porcine circovirus type 2 and PCV2-systemic disease: A review[J]. Chin J Biotechnol, 2015, 31(6): 880-891. (  0) 0) |
| [7] |
TISCHER I, RASCH R, TOCHTERMANN G. Characterization of papovavirus and picornavirus-like particles in permanent pig kidney cell lines[J]. Zentralbl Bakteriol Orig A, 1974, 226(2): 153-167. (  0) 0) |
| [8] |
CHEN H, SHAFFER P L, HUANG X, et al. Rapid screening of membrane protein expression in transiently transfected insect cells[J]. Protein Expr Purif, 2013, 88(1): 134-142. DOI:10.1016/j.pep.2012.12.003 (  0) 0) |
| [9] |
SEGALÉS J, KEKARAINEN T, CORTEY M. The natural history of porcine circovirus type 2: From an inoffensive virus to a devastating swine disease?[J]. Vet Microbiol, 2013, 165(1/2): 13-20. (  0) 0) |
| [10] |
杨克礼, 时代, 段正赢, 等. 猪圆环病毒2型 Cap 基因的克隆与原核表达
[J]. 江西农业学报, 2017, 29(1): 96-101. (  0) 0) |
| [11] |
NAWAGITGUL P, MOROZOV I, BOLIN S R, et al. Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J]. J Gen Virol, 2000, 81(9): 2281-2287. DOI:10.1099/0022-1317-81-9-2281 (  0) 0) |
| [12] |
NAWAGITGUL P, HARMS P A, MOROZOV I, et al. Modified indirect pornine circovirus (PCV) type 2-based and recombinant capsid protein (ORF2)-based enzyme-linked immunosorbent assays for detection of antibodies to PCV[J]. Clin Diagn Lab Immunol, 2002, 9(1): 33-40. (  0) 0) |
| [13] |
宋月, 姜艳萍, 崔文, 等. 猪圆环病毒2型Cap蛋白在杆状病毒系统表达及鉴定[J]. 东北农业大学学报, 2012, 43(3): 36-41. (  0) 0) |
| [14] |
徐铮, 孙彦伟, 刘镇明, 等. 猪圆环病毒Ⅱ型ORF2基因的克隆及其杆状病毒表达载体的构建[J]. 黑龙江畜牧兽医, 2007(4): 67-69. (  0) 0) |
| [15] |
萨姆布鲁克 J, 拉塞尔D W. 分子克隆试验指南[M]. 黄培堂, 等, 译. 3版. 北京: 科学出版社, 2002.
(  0) 0) |
| [16] |
GEISLER C, JARVIS D L. Innovative use of a bacterial enzyme involved in sialic acid degradation to initiate sialic acid biosynthesis in glycoengineered insect cells[J]. Metab Eng, 2012, 14(6): 642-652. DOI:10.1016/j.ymben.2012.08.005 (  0) 0) |
| [17] |
SOKOLENKO S, GEORGE S, WAGNER A, et al. Co-expression vs. co-infection using baculovirus expression vectors in insect cell culture: Benefits and drawbacks[J]. Biotechnol Adv, 2012, 30(3): 766-781. DOI:10.1016/j.biotechadv.2012.01.009 (  0) 0) |
| [18] |
DA SILVA JUNIOR H C, DA SILVA E MOUTA JUNIOR S, DE MENDONÇA M C L, et al. Comparison of two eukaryotic system for the expression of VP6 protein of rotavirus specie A: Transient gene expression in HEK293-T cells and insect cell-baculovirus system[J]. Biotechnol Lett, 2012, 34(9): 1623-1627. DOI:10.1007/s10529-012-0946-z (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


