2. 成都农业科技职业学院,四川 成都 611130;
3. 西昌学院 动物科学学院,四川 西昌 615000
2. Chengdu Agricultural College, Chengdu 611130, China;
3. College of Animal Science and Technology, Xichang College, Xi chang 615000, China
大肠埃希菌属于革兰阴性菌,是人和动物体内的正常寄生菌,属于条件性致病菌。致病性大肠埃希菌可引起以初生幼犬为主的急性肠道疾病,临床症状主要表现为腹泻、败血症等;大肠埃希菌还能引起成年犬、猫的肾盂肾炎和尿道炎等[1]。随着人们生活质量的提高,饲养宠物的数量日益增多,抗菌药物的不合理使用也日益严重[2]。已有人类感染犬源多重耐药细菌的报道[3]。对犬源大肠埃希菌的耐药性进行长期监测,有助于防止宠物源大肠埃希菌耐药性的扩散,同时也可为临床中的宠物用药提供依据[4]。
细菌耐药性被认为是人类和动物健康的重要威胁,耐药基因能够通过可移动遗传元件(质粒、转座子等)在同种或不同种病原菌之间转移[5-7],其中整合子–基因盒系统在外源耐药基因的捕获、表达及细菌进化过程中具有重要作用,引起了科学家的广泛关注[7]。根据整合酶基因碱基序列的不同,整合子至少分为8类,与耐药性有关的主要是Ⅰ类、Ⅱ类和Ⅲ类整合子。资料表明,临床中耐药菌株主要以Ⅰ类整合子占比最高[8]。整合子主要通过特异性位点重组的方式捕获外源基因盒并使其表达,整合子可存在于质粒中或自身作为转座子的一部分参与转移进而传播耐药基因[9-10]。目前,3类整合子中发现与耐药性相关的基因盒多达80余种,这些基因盒编码的产物导致了细菌对临床中常用的药物产生了广泛的耐药性[11]。同一个整合子可变区携带的耐药基因盒数量不等,使宿主菌对药物产生了多重耐药性。携带有整合子的细菌比未携带整合子的细菌更趋向于表现出多重耐药性[12]。
本研究检测分离的30株腹泻犬源大肠埃希菌的耐药性及Ⅰ、Ⅱ、Ⅲ类整合子携带情况,分析分离株中整合子的携带情况及细菌的耐药表型,探究大肠埃希菌多重耐药株中整合子的分布情况,为宠物临床用药及犬源大肠埃希菌耐药性监测提供依据。
1 材料与方法 1.1 材料大肠埃希菌菌株为动物疫病与人类健康四川省重点实验室2016年于成都地区腹泻犬中分离保存的菌株;大肠埃希菌质控菌株(ATCC25922)购于中国兽医药品监察所。
2×Taq PCR MasterMix、DL2000 DNA Marker、大肠埃希菌DH5α、细菌基因组DNA提取试剂盒均购自天根生物试剂有限公司;pMD19-T载体购自宝生物工程(大连)有限公司。
试验共选择19种抗菌药物药敏纸片,均购于杭州天和微生物试剂有限公司。抗菌药物包括青霉素类:阿莫西林(Amoxicillin,AML)和氨苄西林(Ambicillin,AMP),每张药敏纸片含药量分别为20、10 μg;四环素类:四环素(Tetracycline,TET)和多西环素(Doxycycline,DOX),每张药敏纸片含药量均为30 μg;酰胺醇类:氯霉素(Chloramphenicol,CHL)和氟苯尼考(Florfenicol,FFC),每张药敏纸片含药量均为30 μg;磺胺类:复方新诺明(Sulfamethoxazole,SXT),每张药敏纸片含药量为23.75/1.75 μg;氨基糖苷类:链霉素(Streptomycin,STR)、庆大霉素(Gentamicin,GM)、卡那霉素(Kanamycin,Kan)、新霉素(Neomycin,NEO)和阿米卡星(Amikacin,AMK),每张药敏纸片含药量分别为10、10、30、30和30 μg;喹诺酮类:环丙沙星(Ciprofloxacin,CIP)、诺氟沙星(Norfloxacin,NOR)和氧氟沙星(Ofloxacin,OFX),药敏纸片每张纸片含药量分别为5、10和5 μg;头孢类:头孢唑啉(Cephazoline,CFZ)、头孢噻肟(Cefotaxime Sodium,CTX)和头孢曲松(Ceftriaxone,CRO),每张药敏纸片含药量分别为20、30和30 μg;单环β–内酰胺类:氨曲南(Aztreonam,AZM),每张药敏纸片含药量为30 μg。
1.2 方法 1.2.1 药敏试验根据美国临床和实验室标准协会(CLSI)推荐的纸片琼脂扩散法(Kirby-Bauer, K-B)[13]测定分离株对19种抗菌药物的抑菌圈直径,以大肠埃希菌ATCC25922的药敏结果为对照,依据CLSI标准进行判定。
1.2.2 DNA的提取大肠埃希菌DNA采用细菌基因组DNA提取试剂盒进行提取。
1.2.3 整合子–基因盒引物序列扩增3类整合子、Ⅰ型整合子可变区(基因盒)及sul1-qacEΔ1基因,引物序列见表1。引物由上海英俊技术生物有限公司合成。
|
|
表 1 整合子–基因盒引物序列 Table 1 Primers used for integron-gene cassettes application |
以大肠埃希菌的基因组DNA为模板扩增intI1、intI2、intI3基因。PCR反应体系:2×Taq PCR MasterMix 12.5 μL,2 μL模板DNA,上、下游引物(10 μmol·L–1)各1 μL,ddH2O 8.5 μL。循环条件:94 ℃预变性3 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 5 min。10 g·L–1的琼脂糖凝胶对PCR产物进行电泳初步验证。
所有Ⅰ型整合子阳性菌株均进行sul1-qacEΔ1基因的扩增。PCR反应体系:2×Taq PCR MasterMix 12.5 μL,2 μL模板DNA,上、下游引物(10 μmol·L–1)各1 μL,ddH2O 8.5 μL。循环条件:94 ℃预变性4 min;94 ℃ 60 s,60.5 ℃ 50 s,72 ℃ 80 s,共32个循环;72 ℃ 10 min。10 g·L–1的琼脂糖凝胶电泳对产物进行初步验证。
1.2.5 分离株中整合子–基因盒的扩增整合子可变区的PCR扩增采用25 μL反应体系:2×Taq PCR MasterMix 12.5 μL,2 μL模板DNA,上、下游引物(10 μmol·L–1)各1 μL,ddH2O 8.5 μL。循环条件:94 ℃预变性5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 2 min,共36个循环;72 ℃ 5 min。10 g·L–1的琼脂糖凝胶对整合子可变区的PCR产物进行电泳初步分析。
将PCR扩增出的不同整合子可变区片段经胶回收纯化后,连接pMD19-T载体并转化至大肠埃希菌DH5α感受态细胞中,由北京六合华大基因科技有限公司进行测序分析。测序结果与GenBank中相应序列进行比对(BLAST),分析菌株中基因盒的组合形式。
1.3 数据处理依据菌株中整合子检测结果,将分离株分为整合子携带阳性组和阴性组。采用SPSS软件中χ2检验对30株分离株的耐药率进行统计学分析。
2 结果与分析 2.1 30株犬源分离株的药敏试验结果药敏试验结果显示,30株大肠埃希菌对19种药物表现出不同程度的耐药性(表2)。对阿莫西林、氨苄西林、四环素和多西环素的耐药率分别为90.00%、83.33%、66.67%和63.33%,耐药性很高;而对头孢唑啉、头孢噻肟、阿米卡星、氨曲南等敏感性较高,敏感率大于80%;其他药物耐药率为3.33%~36.67%。从抗生素大类分析,耐药率高低依次为:青霉素类(83.33%~90.00%)>四环素类(63.33%~66.67%)>酰胺醇类(33.33%~36.67%)>磺胺类(30.00%)>氨基糖苷类(3.33%~23.33%)>喹诺酮类(3.33%~6.67%)>头孢类、单环β–内酰胺类(3.33%)。
|
|
表 2 30株大肠埃希菌对19种抗菌药物的药敏结果1) Table 2 Susceptility results of 30 Escherichia coli isolates against 19 antimicrobial agents |
30株大肠埃希菌中耐受1种抗生素的菌株有3株,占10%;耐受2种抗生素的菌株有6株,占20%;耐受3种及3种以上抗生素的菌株有21株,占70%。由表3可知,大肠埃希菌对19种抗菌药物共产生18种耐药谱,最多的耐药谱抗生素组合是AML/DOX/AMP/TET、AML/AMP、AML/DOX/CHL/FFC/AMP/TET和AML。
|
|
表 3 大肠埃希菌耐药菌株的耐药谱 Table 3 Resistance spectrum of Escherichia coli resistant strains |
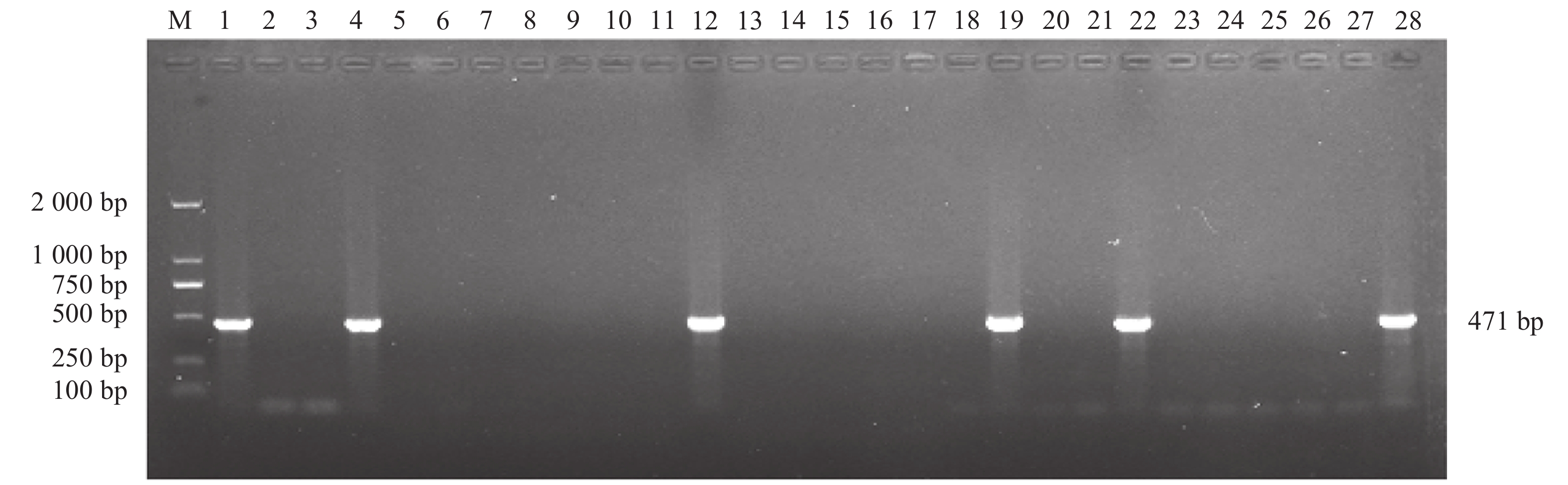
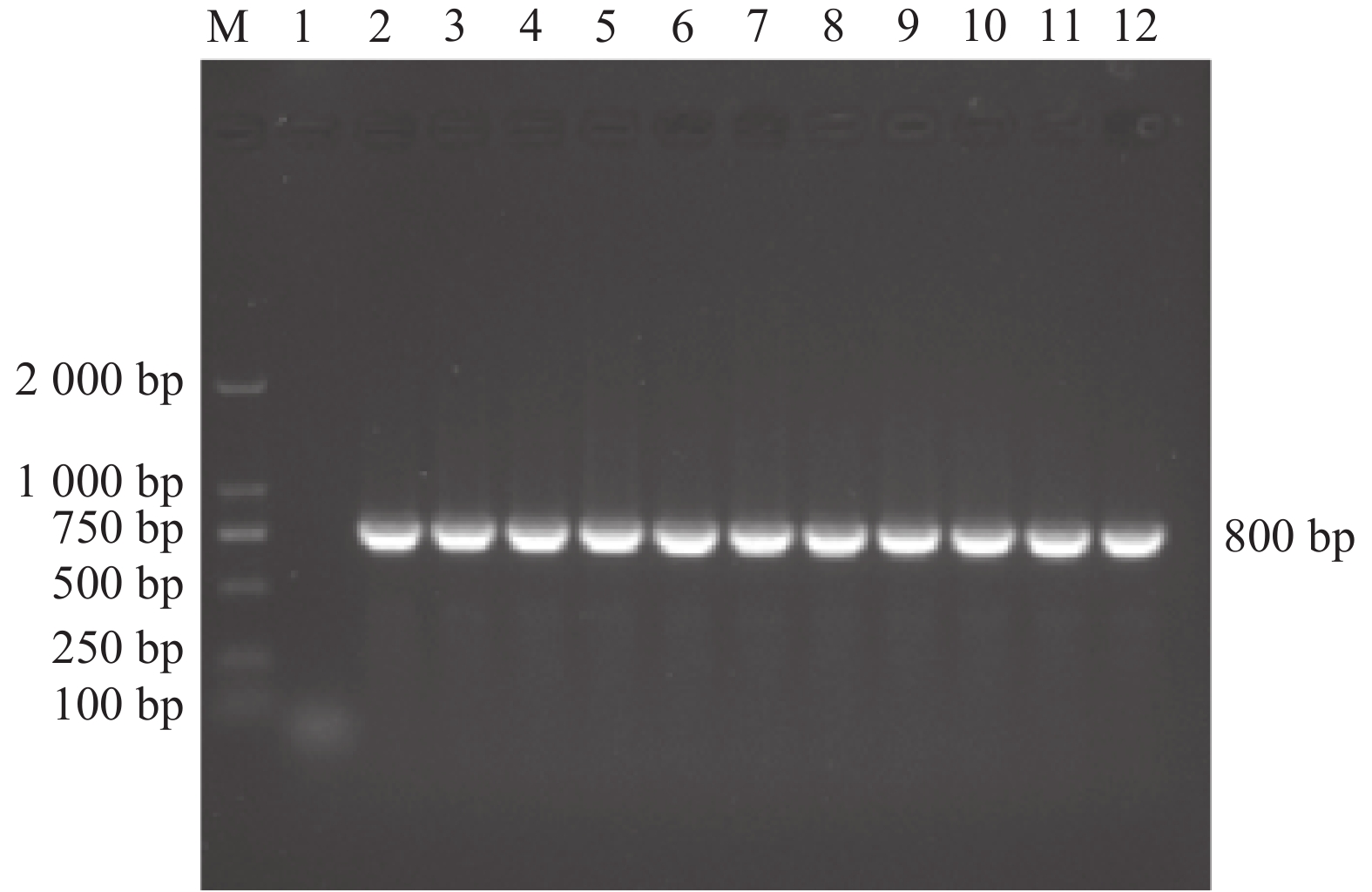
30株大肠埃希菌中共检出intI1(Ⅰ型整合子)阳性菌11株,菌株编号分别为2、8、9、11、14、18、21、27、31、34和40,检出率为37%,未检出intI2和intI3。部分大肠埃希菌intI1基因的扩增结果见图1。11株Ⅰ型整合子阳性菌株均进行sul1-qacEΔ1基因的扩增,结果(图2)显示,11株整合子阳性菌均携带sul1和qacEΔ1基因,检出率为100%。
|
图 1 Ⅰ类整合子PCR产物的电泳图 Figure 1 Agarose gel electrophoresis results for PCR products of IntI1 M:DL2000 DNA Marker;1:阳性对照;2:阴性对照;4、12、19、22和28表示部分intI1阳性株;3、5、6、7、8、9、10、11、13、14、15、16、17、18、20、21、23、24、25、26和27表示部分intI1阴性株 |
|
图 2 sul1-qacEΔ1基因PCR产物的电泳图 Figure 2 Agarose gel electrophoresis results for PCR products of sul1-qacEΔ1 gene M:DL2000 DNA Marker;1:阴性对照;2~12:sul1-qacEΔ1阳性株 |
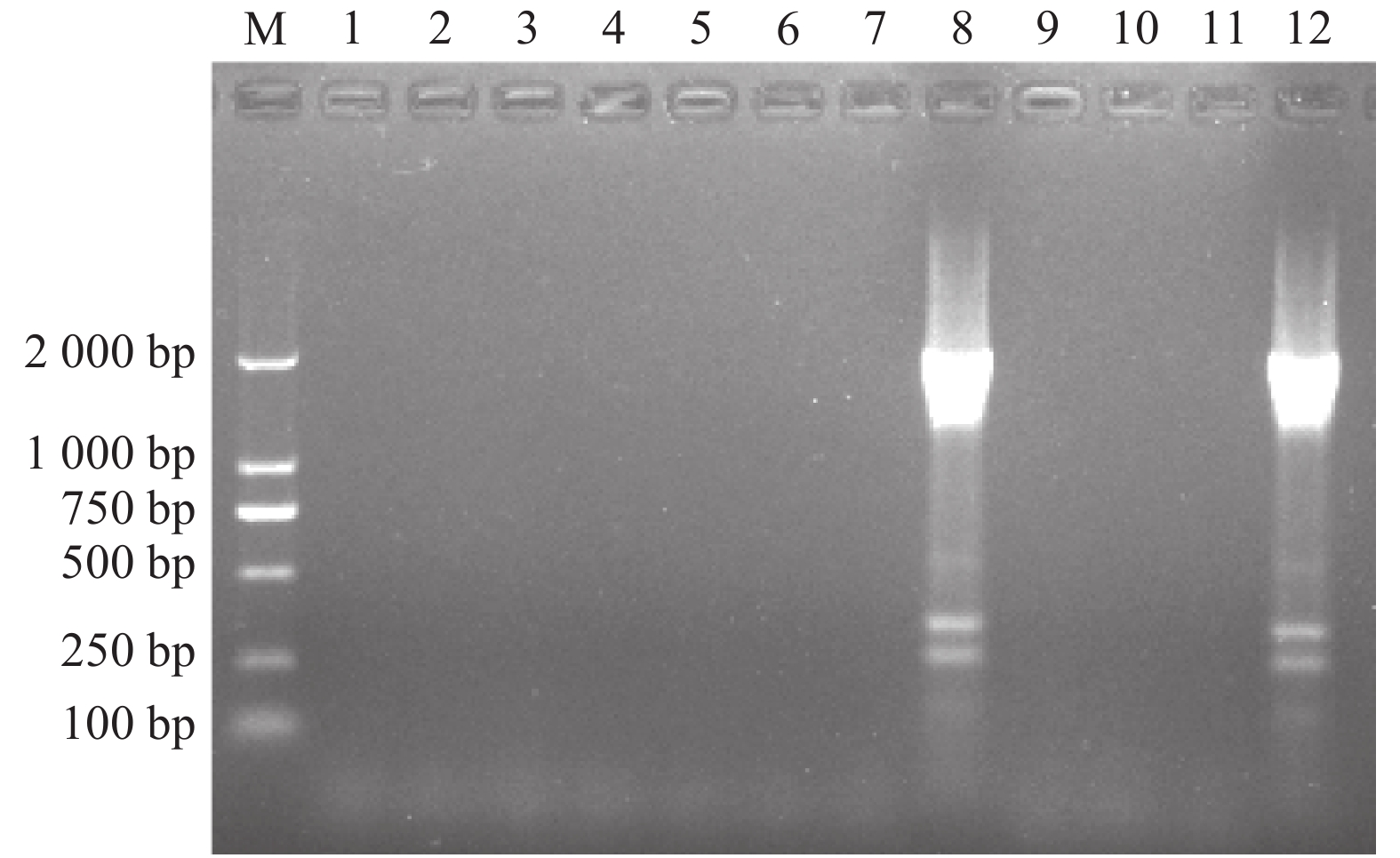
11株intI1阳性菌株进行Ⅰ型整合子可变区的扩增,发现9株菌株含有整合酶但未携带耐药基因盒,只有编号为21和40的2株菌株含有耐药基因盒,其PCR产物为1 879 bp(图3)。分别对2株菌株的耐药基因盒进行克隆,PCR鉴定后进行测序,与GenBank中相应序列进行比对分析,结果显示,此次PCR扩增可变区得到的类型均为:dfrA12+orfF+aadA2 [介导甲氧苄氨嘧啶(二氢叶酸还原酶)+假定蛋白+链霉素、大观霉素(氨基糖苷腺苷转移酶)],检出率为18.18%。
|
图 3 基因盒PCR产物电泳图 Figure 3 Agarose gel electrophoresis results for PCR products of gene cassettes M:DL2000 DNA Marker;1:阴性对照;8,12:基因盒阳性株;2、3、4、5、6、7、9、10、11:基因盒阴性株 |
11株Ⅰ型整合子阳性分离株中,6株菌表现为多重耐药(≥3种抗菌药物),多重耐药率为54.55%;19株Ⅰ型整合子阴性大肠埃希菌中,有14株菌表现为多重耐药,多重耐药率为73.68%。SPSS统计软件中的χ2检验结果显示,2组大肠埃希菌对阿莫西林、多西环素、链霉素、卡那霉素、诺氟沙星、环丙沙星的耐药率为整合子阳性菌株显著高于阴性菌株;对复方新诺明、氯霉素的耐药率为整合子阳性菌株极显著高于阴性菌株。
从表3的犬源大肠埃希菌耐药表型与整合子–基因盒的关系中可以得出:30株分离株中携带基因盒的菌株均为多重耐药菌,编号为21的菌株耐18种药物;编号为40的菌株耐12种药物;PCR扩增结果表明编号为21和40的菌株的基因盒携带情况均为dfrA12+orfF+aadA2,且携带Ⅰ型整合子;基因盒所介导的耐药性与分离株的耐药表型只有部分相关,即菌株不仅对基因盒介导的药物表现出抗性,而且对其他药物也表现出抗性;相反,某些菌株对一些药物表现出耐药性,但其相关的耐药基因盒检测呈阴性。
|
|
表 4 大肠埃希菌耐药性和基因盒的携带情况 Table 4 Drug resistance and the carrying gene cassettes of Escherichia coli |
30株犬源大肠埃希菌的药敏试验结果表明,分离株对19种抗菌药物表现出不同程度的耐药性,对氨苄西林、阿莫西林、四环素和多西环素表现出很高程度的耐药性,耐药率分别为90.00%、83.33%、66.67%和63.33%,高于其他检测结果[17-18],对阿米卡星、头孢曲松等其他药物耐药率低于或接近其他检测结果[17, 19-20]。以上结果表明,成都地区的犬源大肠埃希菌耐药性与其他地区存在一定的差异,这可能与菌株来源不同以及各地区的用药习惯、用药方式及用药种类不同等有关。因此,各地区应该根据动物病情以及药敏试验等,综合考虑轮换用药、交叉用药以及联合用药的方式,减少动物抗生素的滥用。
造成多重耐药菌流行的主要原因是整合子–基因盒介导的耐药基因可在同种或不同种病原菌间水平传递[21]。本试验对30株犬源大肠埃希菌进行3类整合子的检测发现,37%的菌株携带有Ⅰ型整合子,未检出Ⅱ型、Ⅲ型整合子,低于闫国栋[7]的64.10%和蒋月等[22]的76.00%,表明成都区域犬源大肠埃希菌中Ⅰ型整合子广泛流行。有文献表明,Ⅰ型整合子在食品动物源大肠埃希菌[23-24]和大熊猫等野生动物源菌株[25]中广泛分布。本次试验结果也表明,在犬源大肠埃希菌中Ⅰ型整合子也大量存在,为大肠埃希菌在不同动物间耐药基因的水平传播和交换提供了可能,应加强对动物源大肠埃希菌整合子的监测。11株Ⅰ型整合子阳性菌株均携带磺胺耐药基因(sul1)和季铵盐化合物耐药基因(qacEΔ1),检出率为100%,表明11株Ⅰ型整合子阳性菌株均为典型的Ⅰ类整合子。
对11株intI1阳性菌株进行耐药基因盒检测,其中9株菌未检出基因盒。出现这一现象的原因可能是,部分分离株中的整合子可变区携带基因盒的数量过多,片段大,超过了试验中rTaq酶的扩增范畴;本试验的部分分离株是未携带基因盒的空整合子菌株。剩余2株菌株携带基因盒的组合方式均为dfrA12+orfF+aadA2,主要介导甲氧苄啶耐药(dfrA12)和氨基糖苷类耐药(aadA2),这与报道[26]认为的Ⅰ型整合子在临床菌株中大多携带aadA、dfrA基因盒相一致,这从耐药基因水平验证了本试验的分离株的耐药性与氨基糖苷类药物有一定相关性。此外,本试验中基因盒介导的耐药性与分离株的耐药表型只有部分相关,即分离株不仅对基因盒所介导的药物具有耐药性,且对其他类药物也同样产生抗性;反之,某些菌株对部分药物检测出耐药性,但其并未携带耐药相关的基因盒。分析其原因可能是:本试验仅对分离株的整合子–基因盒进行了检测,而耐药表型是多种耐药机制综合表现的结果,如其他耐药基因的参与,细菌细胞膜的通透性发生改变以及外排泵的存在导致药物的外排效应等。本次试验中的分离株是否还有其他可移动遗传元件参与抗生素的耐药调控,需要进一步的研究。
综上所述,本次检测的腹泻犬大肠埃希菌对多种抗菌药物呈现出不同水平的耐药性,对青霉素类药物耐药性最高。Ⅰ型整合子已普遍存在于犬源大肠埃希菌中,其与大肠埃希菌耐药性密切相关。虽然整合子–基因盒不是导致大肠埃希菌产生耐药性的唯一原因,但其与多重耐药菌株的产生与散播密切相关。今后的研究中,应加强动物源大肠埃希菌整合子–基因盒的检测,为临床中控制大肠埃希菌的多重耐药菌株的形成和传播提供依据。
| [1] |
张美君, 廖晓萍, 王秀梅, 等. 宠物源大肠杆菌的血清型和毒力基因及耐药性调查[J]. 中国预防兽医学报, 2011, 33(8): 601-605. (  0) 0) |
| [2] |
朱恒乾, 廖晓萍, 陈朝喜, 等. 宠物源大肠杆菌质粒介导喹诺酮类耐药基因流行性检测[J]. 中国农业科学, 2010, 43(16): 3447-3454. DOI:10.3864/j.issn.0578-1752.2010.16.022 (  0) 0) |
| [3] |
JOHNSON J K, PERENCEVICH E N, LINCALIS D P, et al. Dog bite transmission of antibiotic-resistant bacteria to a human[J]. Infect Control Hosp Epidemiol, 2006, 27(7): 762-763. DOI:10.1086/505101 (  0) 0) |
| [4] |
师志海, 王文佳, 兰亚莉, 等. 宠物源性大肠杆菌耐药性调查[J]. 中国畜牧兽医, 2012, 39(7): 244-245. (  0) 0) |
| [5] |
VAN DEN BOGAARD A E, STOBBERINGH E E. Antibiotic usage in animals: Impact on bacterial resistance and public health[J]. Drugs, 1999, 58(4): 589-607. DOI:10.2165/00003495-199958040-00002 (  0) 0) |
| [6] |
HAMPTON T. Report reveals scope of US antibiotic resistance threat[J]. JAMA, 2013, 310(16): 1661-1663. DOI:10.1001/jama.2013.280695 (  0) 0) |
| [7] |
闫国栋. 不同源大肠杆菌耐药性及整合子–基因盒研究[D]. 成都: 四川农业大学, 2015.
(  0) 0) |
| [8] |
LABBATE M, CASE R J, STOKES H W. The integron/gene cassette system: An active player in bacterial adaptation[M]//MARIA G, JOHANN P G, LORRAINE D. Horizontal gene transfer: Genomes in flux. New Jersey: Humana Press, 2009: 103-125.
(  0) 0) |
| [9] |
CAMERON F H, GROOT OBBINK D J, ACKERMAN V P, et al. Nucleotide sequence of the AAD(2") aminoglycoside adenylyltransferase determinant aadB: Evolutionary relationship of this region with those surrounding aadA in R538-1 and dhfrII in R388
[J]. Nucleic Acids Res, 1986, 14(21): 8625-8635. DOI:10.1093/nar/14.21.8625 (  0) 0) |
| [10] |
MAZEL D, DYCHINCO B, WEBB V A, et al. Antibiotic resistance in the ECOR collection: Integrons and identification of a novel aad gene
[J]. Antimicrob Agents Ch, 2000, 44(6): 1568-1574. DOI:10.1128/AAC.44.6.1568-1574.2000 (  0) 0) |
| [11] |
MAZEL D. Integrons: Agents of bacterial evolution[J]. Nat Rev Microbiol, 2006, 4(8): 608-620. DOI:10.1038/nrmicro1462 (  0) 0) |
| [12] |
王海生, 扈瑞平, 高玉敏, 等. 牛源大肠杆菌Ⅰ类整合子分子特征及其与耐药性关系的研究[J]. 中国畜牧兽医, 2014, 41(9): 63-68. (  0) 0) |
| [13] |
WAYNE P A. Clinical and laboratory standards institute: Performance standards for antimicrobial susceptibility testing[S]. Wayne: Clinical and Laboratory Standards Institute, 2011.
(  0) 0) |
| [14] |
HOLMES A J, HOLLEY M P, MAHON A, et al. Recombination activity of a distinctive integron-gene cassette system associated with Pseudomonas stutzeri populations in soil
[J]. J Bacteriol, 2003, 185(3): 918-928. DOI:10.1128/JB.185.3.918-928.2003 (  0) 0) |
| [15] |
魏伟. 猪源产肠毒素大肠杆菌多重PCR检测方法的建立及整合子介导的耐药性分析[D]. 南昌: 江西农业大学, 2014.
(  0) 0) |
| [16] |
XU H, DAVIES J, MIAO V. Molecular characterization of class 3 integrons from Delftia spp.
[J]. J Bacteriol, 2007, 189(17): 6276-6283. DOI:10.1128/JB.00348-07 (  0) 0) |
| [17] |
赵相胜. 犬源大肠杆菌耐药性及分子流行病学初步研究[D]. 长春: 吉林农业大学, 2014.
(  0) 0) |
| [18] |
何柳, 孙艳, 雷涛, 等. 宠物源大肠杆菌耐药性调查[J]. 中国兽医杂志, 2009, 45(8): 28-30. (  0) 0) |
| [19] |
兰亚莉. 郑州市宠物源大肠杆菌生物被膜表型与耐药谱型分析[J]. 河南农业科学, 2016, 45(1): 135-137. (  0) 0) |
| [20] |
RAVI A, AVERSHINA E, LUDVIGSEN J, et al. Integrons in the intestinal microbiota as reservoirs for transmission of antibiotic resistance genes[J]. Pathogens, 2014, 3(2): 238-248. DOI:10.3390/pathogens3020238 (  0) 0) |
| [21] |
林居纯, 曹三杰, 张辉建, 等. 动物源大肠杆菌整合子携带氨基糖苷类耐药基因盒的研究[J]. 中国兽医学报, 2011, 31(11): 1587-1590. (  0) 0) |
| [22] |
蒋月, 盛鹏飞. 宠物源大肠杆菌耐药性与整合子关系的研究[J]. 畜牧与兽医, 2013, 45(8): 79-83. (  0) 0) |
| [23] |
邹立扣, 蒲妍君, 杨莉, 等. 四川省猪肉源大肠杆菌和沙门氏菌的分离与耐药性分析[J]. 食品科学, 2012, 33(13): 202-206. (  0) 0) |
| [24] |
林居纯, 舒刚, 张辉建, 等. 健康畜禽肠道大肠杆菌耐药性及整合子–基因盒检测[J]. 中国兽医学报, 2014, 34(1): 56-60. (  0) 0) |
| [25] |
闫国栋, 刘颂蕊, 侯蓉, 等. 大熊猫粪源大肠杆菌耐药性及整合子研究[J]. 四川动物, 2015, 34(4): 489-493. DOI:10.11984/j.issn.1000-7083.2015.04.002 (  0) 0) |
| [26] |
LEILA S, YOLANDA S, CAEMEN T, et al. Escherichia coli of poultry food origin as reservoir of sulphonamide resistance genes and integrons
[J]. Int J Food Microbiol, 2011, 144(3): 497-502. DOI:10.1016/j.ijfoodmicro.2010.11.008 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


