2. 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530005
2. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530005, China
水稻Oryza sativa L. 是人类最重要的粮食作物之一,杂交水稻的推广极大地提高了水稻单产,为我国粮食安全提供了强有力的保障。但是杂交稻尤其是两系杂交稻在种子生产过程中,光温敏核雄性不育系在低温条件下育性容易恢复,导致杂交种亲本混淆和杂交种纯度下降。例如‘培矮64S’在1989、2001和2002年夏季的低温条件下,出现了严重的育性恢复,致使其组配的F1杂交种出现了较大比率的假杂交种[1]。如何在低温条件下确保不育系和杂交种的纯度一直以来是困惑育种学家们的一个难题。为了解决这一问题,人们尝试使用了不同的方法,例如人工除杂技术和紫叶标记技术。比较而言,人工除杂技术有明显的缺陷,使用该技术进行人工筛选去除假不育系,不仅成本高周期长,而且许多性状受栽培技术及环境因素的影响而不易辨别,影响筛选效果。而紫叶标记技术具有明显的优势,导入了隐性紫叶性状的不育系在苗期表现紫色,如果繁种时该隐性紫叶不育系与其他正常绿叶的水稻串粉结实,其杂交种表现为绿色,那么在苗期的制种田里就能轻易剔除掉混杂的不育系,保证不育系纯度。为此,育种学家们将紫叶标记技术与不育系的选育相结合,先后育出‘中紫S’、‘明紫–2S’、‘明紫–3S’、‘99Hll4紫S’、‘紫IIA’和‘先红A’[2-7]等一批具有较高应用价值的紫叶不育系,极大减少了杂交稻因种子纯度下降而造成的损失。
水稻的紫色性状与花青素含量的累积相关。花青素是一种黄酮类植物色素,它的合成既受结构基因编码蛋白的调控,也受调节因子,如MYB(v-Myb avian myeloblastosis viral oncogene homolog)家族的bHLH(Helix-helix-turn-helix)蛋白等的控制[8]。花青素的转运与积累可能受GST(Glutathione S-transferase)和MATE(Multidrug and toxin efflux)蛋白家族基因等的调控[9-10]。截至2018年3月,通过图位克隆已克隆出OsC1和Plw2个水稻紫叶性状基因,其中,OsC1位于第6号染色体上编码1个MYB类转录因子,Plw位于第4号染色体上,由OsB1和OsB2共同组成,编码1个bHLH转录因子[11-12],这些基因的克隆促进了对水稻花青素分子调控机制的理解。但是,水稻紫叶性状受合成基因、调节基因和转运基因等多个基因控制。因此,深入挖掘水稻紫叶新基因,对增进对水稻花青素分子调控机制的理解并促进其在水稻遗传改良中的应用具有重要意义。
本研究从紫叶籼稻品种‘Z3474’与绿叶粳稻品种‘日本晴’的杂交后代中选育得到紫叶纯系材料pl41,并对其进行表型分析、遗传分析和基因初步定位研究,以期为pl41的图位克隆、花青素分子调控路径解析和pl41在水稻遗传改良中的应用奠定坚实基础。
1 材料与方法 1.1 材料水稻紫叶材料pl41是从紫叶籼稻品种‘Z3474’与绿叶粳稻品种‘日本晴’的杂交后代中筛选得到的1份紫叶性状稳定遗传的材料。pl41与‘日本晴’杂交后代F1及分离群体F2用于紫叶性状的遗传分析和基因初步定位研究。
1.2 田间种植和性状调查田间试验分别于2015和2016年在广西大学农学院试验田进行,分早晚2季:早季3月1日播种,4月7日移栽;晚季7月21日播种,8月9日移栽。株行距15 cm×25 cm,单株种植,每行10株,常规水肥管理。苗期、抽穗期和灌浆期分别观察pl41、‘日本晴’和F1植株的叶色,并统计分析F2群体中紫叶和绿叶单株的分离情况,挑选F2群体中紫叶单株进行目标基因定位研究。
1.3 叶绿素及花青素含量测定在苗期、抽穗期和灌浆期分别取pl41和‘日本晴’的倒2叶进行叶绿素a、叶绿素b、总叶绿素、类胡萝卜素和花青素含量的测定,每个时期每个亲本分别重复3次。
叶绿素含量测定:样品表面用蒸馏水冲洗,并用吸水纸吸干表面水分,将叶片剪成直径为1~3 mm的碎片,混匀后称取碎片0.05 g,放入25 mL棕色试剂瓶中,重复3次。用V(丙酮)∶V(乙醇)=1∶1的混合液定容至25 mL,室温下置于摇床上振荡24 h,使碎片与试剂充分接触。以V(丙酮)∶V(乙醇)=1∶1的混合液为空白对照,使用INESA L5S紫外可见分光光度计测定浸提液在波长470、645和663 nm下的吸光度(D)。
按照以下公式分别计算叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量:
w(叶绿素a)=(12.7D663 nm–2.69D645 nm)V/(1 000m),
w(叶绿素b)=(22.9D645 nm–4.68D663 nm)V/(1 000m),
w(总叶绿素)=(20.2D645 nm+8.02D663 nm)V/(1 000m),
w(类胡萝卜素)=4.7D470 nm–0.27w总。
式中,V为提取液总体积(25 mL);m为样品质量(0.05 g)。
花青素含量测定:样品表面用蒸馏水冲洗,并用吸水纸吸干表面水分,将叶片剪成直径为1~3 mm的碎片,混匀后称取碎片0.1 g,放入10 mL离心管中,重复3次。加入0.1 mol·L–1盐酸溶液,定容至10 mL。室温下置于摇床上振荡4 h,使碎片与试剂充分接触。以0.1 mol·L–1的盐酸溶液为空白对照,使用INESA L5S紫外可见分光光度计在530 nm下测定浸提液的吸光度。假设吸光度D530 nm=0.1时的花青素浓度为1个单位,用以比较花青素的相对含量,计算公式为:
花青素的相对含量=10D530 nm。
1.4 统计分析方法采用SPSS11.0和Excel软件对试验数据进行统计分析,差异显著性分析采用t检验法。
1.5 DNA提取、PCR体系及电泳参照Monna等[13]的方法提取叶片基因组DNA。用于基因定位的PCR扩增体系为10 μL:DNA模板1 μL、上下游引物各0.4 μL、PCR Mix 5 μL和ddH2O 3.2 μL。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,33个循环;72 ℃ 5 min。扩增产物经70 g·L–1的聚丙烯酰胺凝胶电泳检测。用于候选基因测序的PCR扩增体系为40 μL,包括DNA模板4 μL、上下游引物各1.6 μL、2×EasyPfu PCR SuperMix 20 μL、ddH2O 12.8 μL。扩增程序:94 ℃ 5 min;94 ℃ 30 s、56 ℃ 35 s、72 ℃ 1 min,30个循环;72 ℃ 10 min。扩增产物经20 g·L–1的琼脂糖凝胶电泳检测,目标条带回收后由深圳华大基因公司测序。PCR Mix和EasyPfu PCR SuperMix均购自全式金生物技术公司。
1.6 多态性分子标记的开发基因连锁分析及定位的分子标记包括STS和SSR标记,其中SSR标记引物序列来自数据库http://www.gramene.org,STS标记基于粳稻品种‘日本晴’和籼稻品种‘9311’的序列差异,在差异序列两端开发设计引物,SSR和STS标记引物均由深圳华大基因公司合成。
1.7 候选基因的预测分析利用RAP-DB(http://rapdb.dna.affrc.go.jp)和GRAMENE(http://ensembl.gramene.org)水稻基因组注释信息,对定位区间内的所有基因进行预测,结合候选基因编码区序列的测序比对,分析候选基因。
2 结果与分析 2.1 pl41植株表型特征pl41株型与‘日本晴’无明显差异,但植株颜色有明显差别。在苗期,pl41叶鞘、叶尖和叶缘处呈现紫色,颜色较浅(图1A);从苗期开始,植株紫色逐渐变深,抽穗期地上部分组织呈现较深的紫色(图1B)。‘日本晴’植株在各个时期均表现为绿色(图1A、1B)。pl41叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量在苗期显著高于‘日本晴’,在抽穗期显著低于‘日本晴’,在灌浆期无显著差异;pl41花青素含量在苗期、抽穗期和灌浆期均极显著高于‘日本晴’(表1)。花青素含量与叶绿素a、叶绿素b和总叶绿素含量的相关系数分别为–0.936、–0.958和–0.941,均达极显著负相关(P<0.01)。在抽穗期,pl41叶绿素a、叶绿素b和总叶绿素含量均低于苗期,花青素含量高于苗期;在灌浆期,pl41叶绿素a、叶绿素b和总叶绿素含量高于抽穗期,花青素含量低于抽穗期(表1)。

|
图 1 ‘日本晴’和pl41植株的表型分析 Figure 1 Phenotypic analyses of ‘Nipponbare’ and pl41 |
|
|
表 1 pl41和‘日本晴’在3个不同发育时期叶绿素、类胡萝卜素及花青素含量比较1) Table 1 Comparisons of chlorophyll, carotenoid and anthocyanin contents between pl41 and ‘Nipponbare’ at three different developmental stages |
为了明确pl41紫叶性状的遗传基础,本研究对pl41与‘日本晴’杂交后代F1及分离群体F2的紫叶性状进行了遗传分析。结果表明,F1代植株均表现为绿叶,F2代植株叶片颜色呈现明显的紫色和绿色分离,绿叶和紫叶单株数分别为254和79株,符合3∶1的分离比(χ2=0.26,P>0.05),表明pl41紫叶性状受1对隐性主效核基因控制。
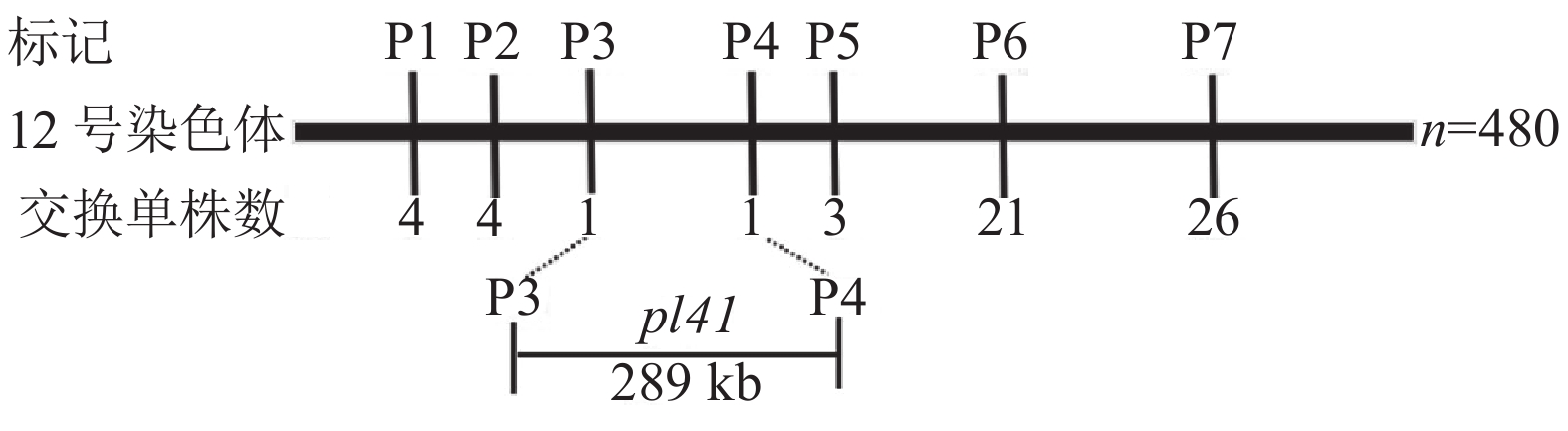
2.3 pl41的初步定位为了分离控制pl41紫叶性状的目标基因pl41,我们在F2代分离群体中选取了480株紫叶单株用于pl41的初步定位研究。利用127对在pl41和‘日本晴’之间存在多态性的STS和SSR分子标记引物对480株紫叶单株进行连锁分析,结果表明目标基因pl41与第12号染色体上的分子标记引物P1、P2、P3、P4、P5、P6、P7(表2)的序列存在不同程度的连锁,并且被初步定位于P3和P4之间289 kb的范围内(图2)。在此定位区间内,存在53个注释的预测基因,这些基因编码的蛋白详见表3。其中,有5个基因可能与花青素的合成与转运相关:1个GST蛋白编码基因(编号25)、1个MYB类转录因子蛋白编码基因(编号44)和3个MATE转运蛋白编码基因(编号49、52、53)。对pl41这5个基因的编码区序列进行测序,并分别与‘日本晴’序列比对,发现这5个基因的编码区序列与‘日本晴’无差异。
|
|
表 3 定位区间内的基因注释 Table 3 Gene annotation in the preliminary mapped region |
|
图 2 水稻紫叶基因pl41在第12号染色体上的初步定位 Figure 2 Preliminary mapping of rice purple leaf gene pl41 on chromosome 12 |
|
|
表 2 pl41初步定位所用引物 Table 2 Primers used in preliminary mapping of pl41 |
水稻紫色性状为明显的标记性状,在不育系和杂交稻种子纯度的鉴定上具有重要的应用价值,其性状表现与花青素的合成、转运和累积相关。花青素分布的多样性使得水稻紫色性状表现多样化,例如有些水稻品种在叶鞘和茎基部表现紫色,而有些水稻品种只在叶缘、柱头和稃尖等部位呈现紫色。本研究鉴定出来的pl41植株大部分组织均表现紫色,带紫色性状的植株与绿色植株区别明显,而且紫色性状稳定,不易受季节和环境因素影响,由此可见,pl41具有较大的应用潜力。
目前,虽然关于水稻紫色性状已有较深入研究,但已报道的紫色性状基因多为显性基因,例如OsC1和PSH1(t)[11, 14]。由于显性基因无法区分纯合子和杂合子,使得无法剔除掉混杂的不育系和假杂种,所以这类基因一般不能应用于生产实践。因此,挖掘隐性紫色性状基因,对于促进其在生产实践上的成功应用具有重要意义。本研究鉴定的pl41为隐性基因,定位于第12号染色体短臂289 kb范围内,在目前报道的水稻紫叶基因中没有1个基因位于该区域,这表明pl41可能是1个新的隐性紫叶基因。在该定位区间内发现有5个基因可能与花青素的合成与转运相关,包括1个MYB类转录因子蛋白编码基因、1个GST蛋白编码基因和3个MATE蛋白编码基因。在植物中,MYB类转录因子蛋白调控花青素结构基因的时空表达和花青素的组织分布[8],水稻第6号染色体上的1个MYB类转录因子蛋白编码基因OsC1被发现与叶鞘花青素的累积相关[11];GST和MATE蛋白家族基因被发现可能参与花青素向液泡的转运,例如拟南芥的TT19基因[15]、玉米的Bronze-2基因[9]和拟南芥的TT12基因[16],就已被证明与花青素的累积相关。通过测序比对分析,发现这5个基因的编码区序列在pl41与‘日本晴’之间无差异,表明它们可能不是pl41紫叶性状的候选基因,但也不能完全排除这种可能,因为导致表型变异的因素除了基因编码区序列差异以外,基因启动子和增强子区序列的差异也能导致表型变异。因此,下一步拟检测这5个基因在启动子和增强子区的序列差异和转录水平上的表达差异,预测可能的候选基因。同时也配制了pl41的大分离群体,以期通过精细定位为pl41最终的图位克隆奠定基础。
研究表明,叶色标记一般全生育期表达,在影响不育系本身农艺性状的同时,对繁种和制种产量也有一定负效应。本研究发现,pl41花青素的累积与叶绿素含量的变化呈显著负相关,这表明pl41可能对农艺性状尤其是水稻产量性状有一定的影响。由于近等基因系的遗传背景基本一致,可以最大限度降低遗传背景对目标基因的影响,因此它是准确分析目标基因对产量性状影响的理想材料。为了更准确地分析pl41对水稻产量性状的影响、更详细地评估pl41的应用潜力,目前正在构建pl41的近等基因系,拟利用pl41的近等基因系来分析pl41对农艺性状的影响。这些工作将为阐明pl41对水稻产量性状的影响和评价pl41的应用潜力奠定坚实的基础。
| [1] |
WU D, SHU Q, XIA Y. In vitro mutagenesis induced novel thermo/photoperiod-sensitive genic male sterile indica rice with green-revertible xanthan leaf color marker
[J]. Euphytica, 2002, 123(2): 195-202. DOI:10.1023/A:1014924418395 (  0) 0) |
| [2] |
曹立勇, 钱前, 朱旭东, 等. 紫色标记籼型光–温敏核不育系中紫S的选育及其配组的杂种优势[J]. 作物学报, 1999, 25(l): 44-49. (  0) 0) |
| [3] |
杨腾帮, 许旭明, 张受刚. 具有隐性紫叶标记性状的籼型光敏核不育系明紫02S的选育[J]. 福建农业科技, 2005(l): 3-5. (  0) 0) |
| [4] |
杨腾帮, 许旭明, 张受刚, 等. 隐性紫叶光温敏核不育水稻明紫03S的选育[J]. 福建农业科技, 2005(5): 54-56. (  0) 0) |
| [5] |
余显权, 吴平理, 赵福胜, 等. 隐性紫叶水稻的改良及其应用探讨[J]. 贵州农业科学, 2003, 31(3): 3-6. (  0) 0) |
| [6] |
向关伦, 黄宗洪, 杨占烈, 等. 水稻不育系紫IIA的选育[J]. 种子, 2007, 26(1): 93-95. (  0) 0) |
| [7] |
邓国富, 梁世荣, 周萌, 等. 水稻紫红叶标记不育系先红A的选育及应用[J]. 中国稻米, 2008(5): 26-28. (  0) 0) |
| [8] |
XIE D Y, SHARMA S B, WRIGHT E, et al. Metabolic engineering of proanthocyanidins through co-expression of anthocyanidin reductase and the PAP1 MYB transcription factor[J]. Plant J, 2006, 45(6): 895-907. DOI:10.1111/tpj.2006.45.issue-6 (  0) 0) |
| [9] |
MARRS K A, ALFENITO M R, LLOYD A M, et al. A glutathione S-transferase involved in vacuolar transfer encoded by the maize gene Bronze-2
[J]. Nature, 1995, 375(6530): 397-400. DOI:10.1038/375397a0 (  0) 0) |
| [10] |
GOODMAN C D, CASATI P, WALBOT V. A multidrug resistance-associated protein involved in anthocyanin transport in Zea mays
[J]. Plant Cell, 2004, 16(7): 1812-1826. DOI:10.1105/tpc.022574 (  0) 0) |
| [11] |
SAITOH K, ONISHI K, MIKAMI I, et al. Allelic diversification at the C (OsC1) locus of wild and cultivated rice: Nucleotide changes associated with phenotypes
[J]. Genetics, 2004, 168(2): 997-1007. DOI:10.1534/genetics.103.018390 (  0) 0) |
| [12] |
SAKAMOTO W, OHMORI T, KAGEYAMA K, et al. The purple leaf (pl) locus of rice: plw allele has a complex organization and includes two genes encoding basic helix-loop-helix proteins involved in anthocyanin biosynthesis
[J]. Plant Cell Physiol, 2001, 42(9): 982-991. DOI:10.1093/pcp/pce128 (  0) 0) |
| [13] |
MONNA L, LIN H, KOJIMA S, et al. Genetic dissection of a genomic region for a quantitative trait locus, Hd3, into two loci, Hd3a and Hd3b, controlling heading date in rice
[J]. Theor Appl Genet, 2002, 104(5): 772-778. DOI:10.1007/s00122-001-0813-0 (  0) 0) |
| [14] |
WANG W Y, DING H F, LI G X, et al. Delimitation of the PSH1(t) gene for rice purple leaf sheath to a 23.5 kb DNA fragment
[J]. Genome, 2009, 52: 268-274. DOI:10.1139/G08-121 (  0) 0) |
| [15] |
KITAMURA S, SHIKAZONO N, TANAKA A. TRANSPARENT TESTA 19 is involved in the accumulation of both anthocyanins and proanthocyanidins in Arabidopsis
[J]. Plant J, 2004, 37(1): 104-114. DOI:10.1046/j.1365-313X.2003.01943.x (  0) 0) |
| [16] |
DEBEAUJON I, PEETERS A J M, LÉON-KLOOSTERZIEL K M, et al. The TRANSPARENT TESTA12 gene of Arabidopsis encodes a multidrug secondary transporter-like protein required for flavonoid sequestration in vacuoles of the seed coat endothelium
[J]. Plant Cell, 2001, 13: 853-871. DOI:10.1105/tpc.13.4.853 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


