2. 广西农业科学院 蔬菜研究所,广西 南宁 530007;
3. 广西农业科学院 生物技术研究所,广西 南宁 530007
2. Vegetable Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China;
3. Biotechnology Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China
冬瓜Benincasa hispida (Thunb.) Cogn.四倍体新种质的研发,既可丰富冬瓜种质资源,又可为选育高产、高抗、品质优良品种提供中间材料或商品品种。目前蔬菜四倍体材料的获得最常用的方法是化学诱变,秋水仙素是应用最广泛的化学诱变剂之一[1-4],但因其是一种神经性毒剂,能导致不育,对人、畜及环境存在较大的安全隐患[5],且易产生嵌合体,使多倍体诱导率降低,倍性遗传稳定性差[6-7]。为克服秋水仙素在多倍体诱导方面的负面影响,寻找更好的多倍体诱变剂,近年来研究发现硝基苯胺类除草剂Oryzalin(中文名称包括胺磺灵、氨磺灵、安磺灵和氨磺乐灵等)能够抑制纺锤体的形成和细胞分裂中期的有丝分裂,对植物微管蛋白亲和力显著高于秋水仙素,容易形成微管蛋白—Oryzalin复合体,同时Oryzalin也干扰细胞器中Ca2+运输系统,导致微管解聚合[8],因而Oryzalin在植物多倍体诱导中具有同秋水仙素相同的加倍效果[9]。应用Oryzalin作为四倍体的诱变剂已在大蒜[1]、西瓜[10-12]、黄瓜[13]、姜[14]、甜瓜[15]、南瓜[16]、安祖花[3]、百香果[17]等多种作物上有诸多研究报道。前人研究认为Oryzalin的用量与药害均比秋水仙素低很多[18],且诱导率高,对人、畜和环境较安全[3, 17],因此Oryzalin被认为是四倍体诱变的新型药剂[19],且开始逐渐替代秋水仙素进行四倍体材料的诱变[9, 13]。在冬瓜多倍体新种质的创制方面,国内外仅见谢大森等[20]利用不同浓度秋水仙素滴苗处理成功获得四倍体冬瓜材料。在四倍体黑皮冬瓜适合的诱变剂、诱变剂适宜的浓度及处理时间段等方法组合研究方面鲜见报道。另外,目前染色体计数法是最直接、最准确的鉴定植物倍性的方法,但该法需要较为熟练的细胞学操作技术,试验步骤较为复杂,在大通量、多样品情况下检测耗时长,仅适合少量样品的检测。因此,寻找高效的诱变方法组合及探索更为快捷、大通量、准确的鉴定四倍体的方法和技术显得尤为重要。本试验以二倍体黑皮冬瓜自交系幼苗为试验材料,使用秋水仙素和Oryzalin作为诱变剂,比较在常温下使用2种不同浓度的诱变剂在不同时间段“剥滴”处理幼苗生长点,通过综合比较其诱变成功率,筛选出最适宜的药剂、浓度及时间段组合,同时也摸索出简单、易操作、大通量、快速、准确的倍性鉴定方法集成,为黑皮冬瓜四倍体的诱变提供理论和技术依据。
1 材料与方法 1.1 试验材料二倍体黑皮冬瓜自交系6-2×(2n=2x=24)来源于广西农业科学院现代农业科技示范园,自交30代。秋水仙素和Oryzalin(Sigma)购于上海玉博生物科技有限公司。
1.2 诱变处理试验在广西农业科学院现代农业科技示范园蔬菜大棚、广西农业科学院经济作物研究所国家木薯改良分中心实验室进行。于2012年11月26日进行种子浸种、磕种、催芽处理,2012年11月29日播种于50 孔育苗穴盘,当幼苗2 片子叶展平、真叶微露心时,分别用1、2和4 g·L–1的秋水仙素以及20、40和60 μmol·L–1 的Oryzalin在06:00—07:00、12:00—13:00、17:00—18:00共3个时间段“剥滴”处理幼苗生长点,以清水为对照,每苗每天1滴(约0.005 mL),连续处理7 d,每处理约30株,重复3次。从处理开始到处理结束后3 d共计10 d内用50%遮光率的黑色遮阳网全天覆盖(阴雨天不做遮光处理)。待2~3片真叶平展时选苗移栽于试验大棚,田间管理按常规进行。
1.3 形态学鉴定苗期变异株的认定与管理:移栽前,选取生长点丛生,叶片皱缩,叶表面隆起、密被茸毛,叶色浓绿,叶缘变钝明显者定义为变异株,并移栽于大棚,拔除未变异的植株。
抽蔓期形态鉴定:抽蔓期选留叶形、叶面积、叶色与原二倍体存在明显差异的植株,拔除未发生变异的植株。
1.4 抽蔓期细胞学鉴定参照施先锋等[21]的方法。随机统计10个保卫细胞内叶绿体数目和20个视野的气孔保卫细胞数目并拍照,重复3次。田间选留单位面积气孔保卫细胞大小及保卫细胞内的叶绿体数目与原二倍体存在显著差异的植株,拔除未发生变异的植株。
1.5 流式细胞术倍性鉴定参照田新民等[22]的方法。田间选留经过流式细胞术鉴定为四倍体的变异株,严格套袋单株自交留种,其余植株全部拔除。
1.6 根尖染色体数目倍性鉴定参照张永兵等[23]的方法。
1.7 数据统计与分析数据采用Excel2003进行统计,用SPSS18.0软件进行Duncan’s方差显著性分析和独立样本t检验。
2 结果与分析 2.1 秋水仙素和Oryzalin不同处理组合对四倍体黑皮冬瓜的诱变效果由表1可知,用秋水仙素在3个时间段内处理冬瓜幼苗,随秋水仙素处理浓度升高,幼苗的变异率均呈现先升高后下降的趋势,田间观察到用4 g·L–1的秋水仙素处理存在明显的药害引起的死苗现象,这是秋水仙素浓度过高导致变异率下降的主要原因。而用3种不同浓度的Oryzalin在3个时间段内处理冬瓜幼苗,随Oryzalin浓度的升高,幼苗的变异率均呈现逐渐升高的趋势,且未出现死苗情况,但在前期预备试验中发现,当Oryzalin的浓度高于80 μmol·L–1时即出现死苗情况。这说明不同药剂的处理浓度是关键,高浓度的秋水仙素和Oryzalin处理都会对幼苗产生一定的药害。
用不同浓度的秋水仙素和Oryzalin在3个不同时间段内处理冬瓜幼苗,四倍体诱变成功率整体水平均表现为上午(06:00—07:00)>下午(17:00—18:00)>中午(12:00—13:00),说明不同时间段处理诱变效果存在较大差异。
用不同浓度的秋水仙素和Oryzalin在3个时间段内处理幼苗,四倍体的诱变成功率总体水平均以秋水仙素处理的略高于Oryzalin处理,且各冬瓜幼苗生长点均受到一定程度的抑制(图1),说明秋水仙素和Oryzalin都具有使染色体加倍的功能,同时也具有延缓植株生长的作用,但以2 g·L–1秋水仙素在上午(06:00—07:00)处理幼苗生长点这个组合诱变的成功率为最高,达到了32.18%,用不同浓度的Oryzalin在不同的时间段处理也有一定的诱变效果,但总体诱变率不高,说明诱变的效果可能与诱变使用的药剂及浓度、处理的材料、处理的时间段及诱变的环境条件等相关。
|
|
表 1 秋水仙素和Oryzalin不同处理组合对二倍体冬瓜的诱变效果1) Table 1 Induction effect on diploid Benincasa hispida by different treatments of colchicine and Oryzalin |

|
图 1 苗期变异株生长点丛生形态特征 Figure 1 The morphology characteristics of clustering growth points in mutated seedlings |
用不同浓度的秋水仙素和Oryzalin在不同时间段“剥滴”处理幼苗生长点后,在苗期、抽蔓期变异株的外部形态特征均与普通二倍体表现出较大差异。变异株在苗期主要表现为:生长点丛生,叶片皱缩,叶表面隆起、密被茸毛,叶色浓绿,叶缘变钝明显(图1、图2)。在抽蔓期,变异株的叶色深绿,相同节位叶片的叶面积明显变大,叶片叶缘变钝、叶掌基部叶面基本重叠、浅缺刻(图3)。

|
图 2 苗期叶片形态特征 Figure 2 The morphology characteristics of leaves in seedlings |

|
图 3 抽蔓期相同节位叶片形态 Figure 3 The morphology characteristic of leaves at vine growth stage |
由图4和表2可知,相对原二倍体植株而言,变异株叶片中单个气孔保卫细胞体积增大,保卫细胞的纵径和横径分别比原二倍体增加46.9%和33.47%,差异达极显著水平(P<0.01);变异株中叶片气孔保卫细胞密度比原二倍体减少40%,呈极显著差异;变异株中叶片单个气孔保卫细胞内的叶绿体数量明显增加,原二倍体中的叶绿体数目平均为8.1个,而变异株中叶绿体数目为14.6个,差异达极显著水平。
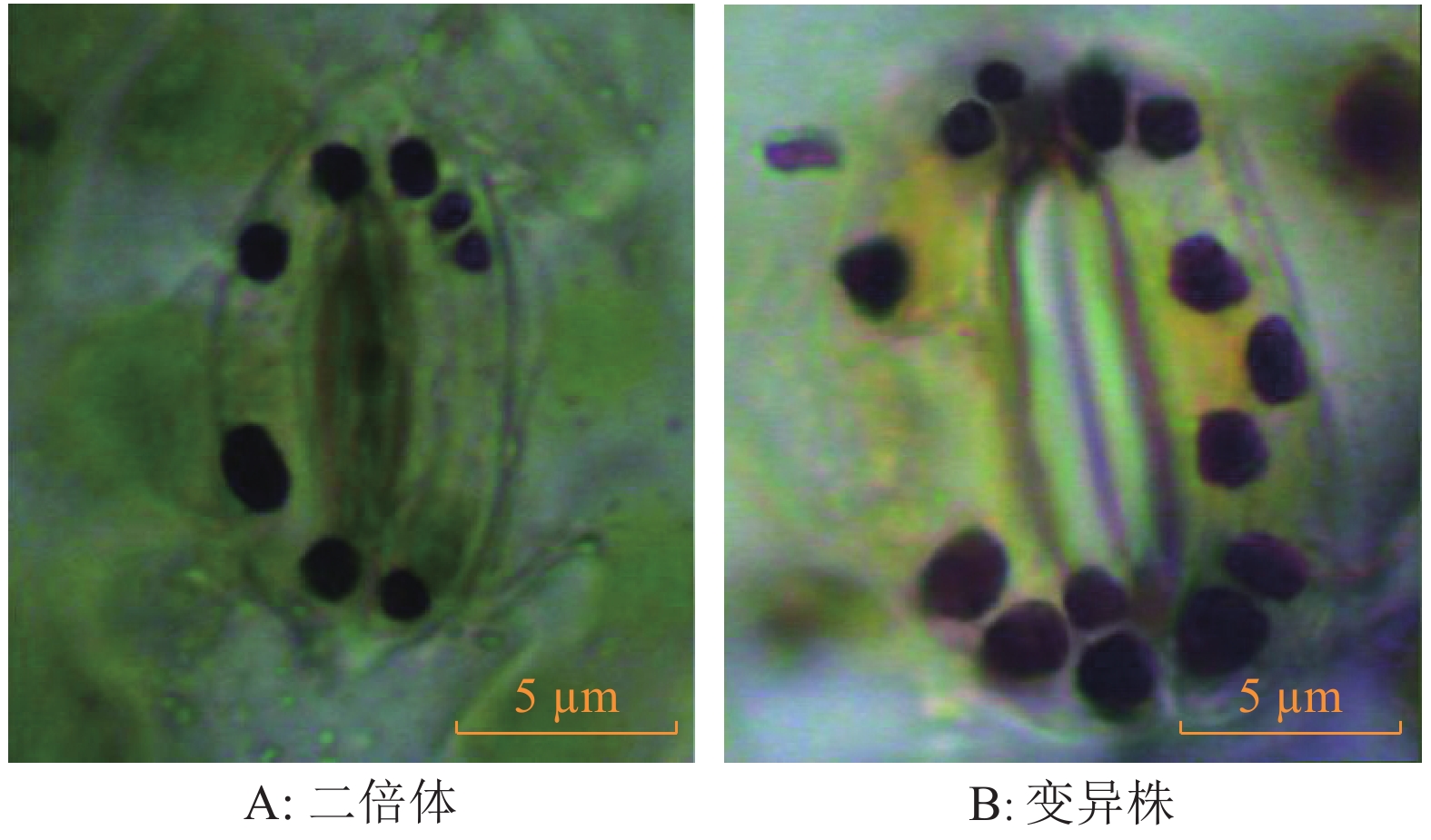
|
图 4 叶片表皮上气孔保卫细胞中的叶绿体 Figure 4 Chloroplast in stomata guard cell on leaf epidermis |
|
|
表 2 抽蔓期变异株与正常株气孔保卫细胞大小、密度及叶绿体数比较1) Table 2 The comparison on size, density and number of chloroplast of stomata guard cell between normal and mutated plants at vine growth stage |
利用流式细胞仪测定变异株幼嫩叶片细胞核内DNA含量,根据其DNA相对含量的峰值图可推断变异株的倍性水平。对于已知的原二倍体对照,其DNA相对含量约为100时出现峰值(图5A);四倍体的DNA相对含量约为200时出现峰值(图5B);三倍体的DNA相对含量约为150时出现峰值(图5C);二倍体、四倍体的混倍体DNA相对含量约为100和200时出现峰值(图5D);四倍体、八倍体的混倍体DNA相对含量约为200和400时出现峰值(图5E)。说明利用秋水仙素和Oryzalin处理均能产生一定数量的嵌合体或非整倍体,前期的形态学鉴定和细胞学鉴定只能是间接地辅助鉴定变异株的倍性水平的手段,其准确性还有待进一步的验证。
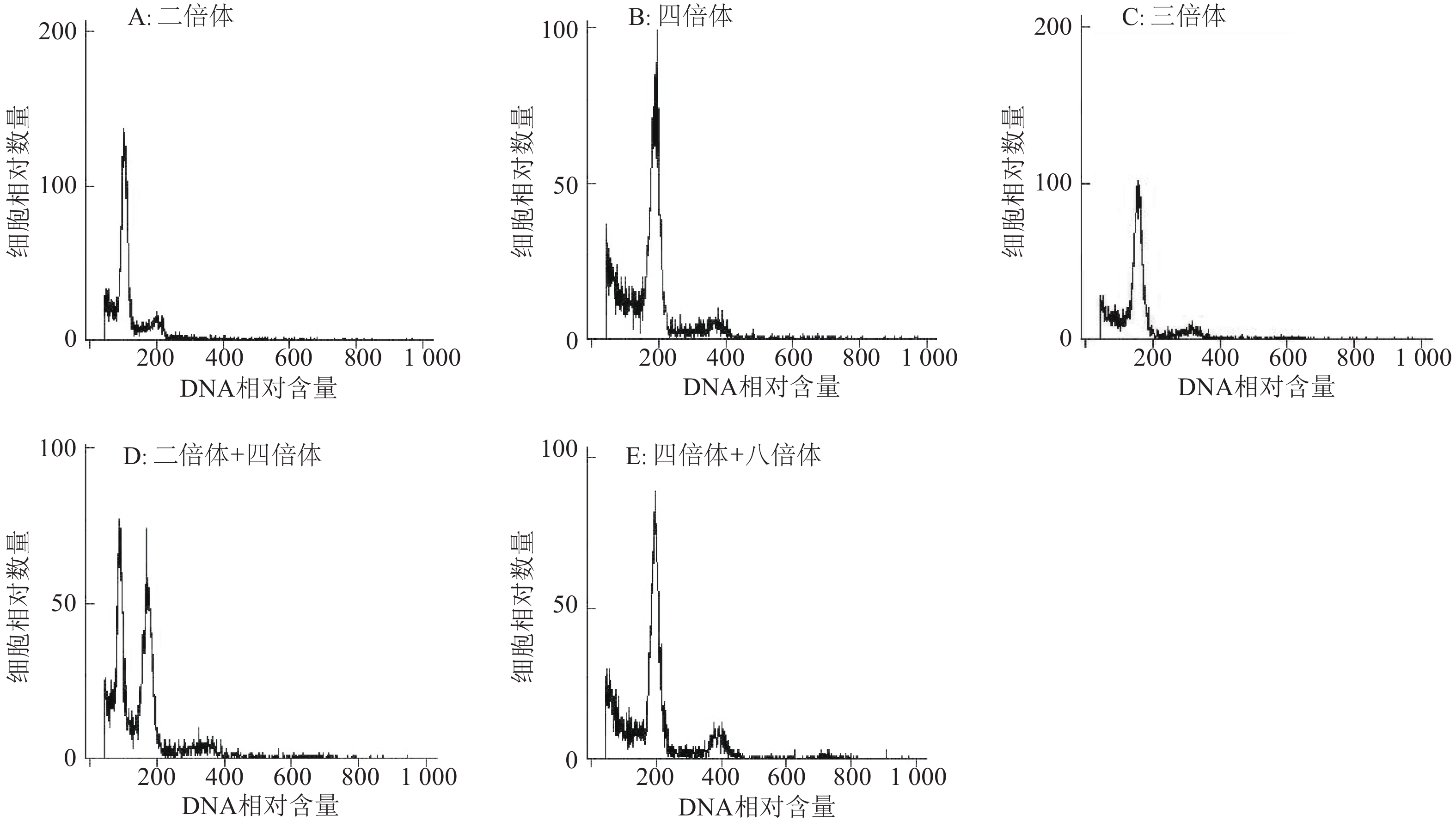
|
图 5 流式细胞仪测定细胞核DNA含量峰值分布图 Figure 5 Peak distribution of nuclear DNA content by flow cytometry 细胞核总数为5 000,变异系数<5% |
根据根尖细胞染色体镜检结果(图6),普通二倍体黑皮冬瓜根尖细胞染色体数2n=2x=24(图6A),而选留经过前期形态学、细胞学及流式细胞术检测集成组合鉴定为四倍体的黑皮冬瓜变异株进行严格的套袋自交留种,对所得种子随机抽样进行根尖细胞染色体压片,统计其染色体数为2n=4x=48(图6B),比二倍体染色体数增加一倍,表明经过诱变处理成功获得了四倍体,同时也说明集合前期筛选鉴定倍性的结果与根尖细胞染色体计数鉴定结果一致,集成形态学、细胞学及流式细胞术组合鉴定的结果可信。
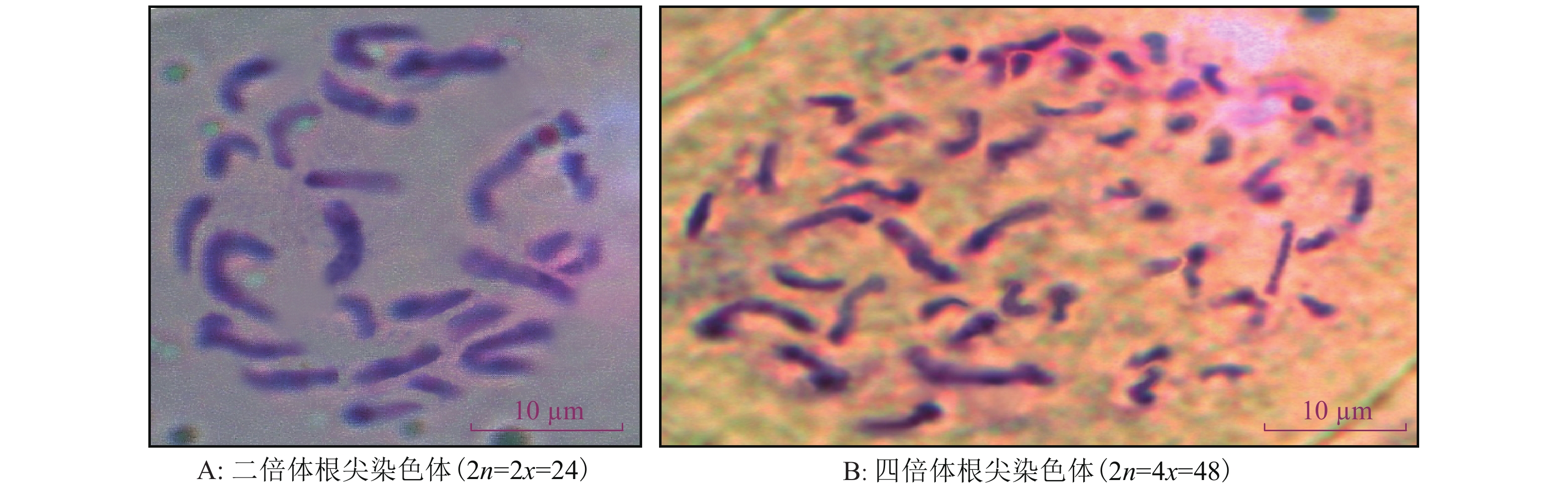
|
图 6 冬瓜根尖细胞染色体 Figure 6 Choromosomes in root tip cells of Benincasa hispida |
诱变处理的关键是既要获得高的诱变率,又要有高的成活率。化学诱变影响染色体加倍的相关因素有:处理药剂种类、浓度、处理方法、处理材料、处理时间长短、处理的时间段及处理时的温度等,其中,以药剂种类、浓度、时间(时间长短、处理时间段)及温度最为关键[24]。本试验中不同浓度秋水仙素在各时间段的诱变成功率总体水平高于Oryzalin处理,且以2 g·L–1的秋水仙素处理诱导率最高,达32.18%,说明秋水仙素适合作为黑皮冬瓜材料的诱变剂。
梁倩倩等[25]的研究指出,用秋水仙素进行滴苗处理西瓜幼苗,温度越低,幼苗成活率及诱导率越高,且在一天的不同时间段处理上,诱变效果为下午(17:00—18:00)>早上(08:00—09:00)>中午(12:00—13:00)。徐道娜等[26]在西瓜多倍体诱导上也采用滴苗处理的同时进行低温处理,诱变率最高可达42%。综合前人研究表明,滴苗处理时的温度是关键,一天中以中午温度最高,早、晚次之,这也较好地解释了中午时间段处理的诱变率最低的原因。另有研究表明,秋水仙素的水解速度受温度影响,在低温条件下能保持其稳定性,保证秋水仙素与材料发生作用,但当温度增高时,可显著促进秋水仙素的作用和反应速度,促进植物体内染色体数目加倍,但也加深组织药害[25, 27]。Oryzalin和温度的互作性可能也与秋水仙素类似,这也导致了2种药剂在中午时间段处理诱变率最低。本试验中,利用不同浓度的秋水仙素和Oryzalin在3个时间段处理的诱变率均表现为早上(06:00—07:00)>下午(17:00—18:00)>中午(12:00—13:00),这与前人结果部分一致,其中的差异可能与诱变的作物种类、环境条件等有关。
另外,在预备试验时发现在晴天进行滴苗处理后未使用遮阳网覆盖,会引起绝大部分幼苗产生药害而死亡,且使用药剂的浓度越高,死亡率越高。而在正式试验时,通过采用处理时及处理后3 d总计10 d内用50%遮光率的黑色遮阳网全程覆盖的方法(阴雨天不覆盖),死苗情况明显减少。这可能与高温和强光会加快2种药剂秋水仙素和Oryzalin的挥发与作用,从而引发药害导致死苗有关。在诱变过程中使用遮阳网覆盖处理来减少药害和死苗的现象还鲜见报道,引起该现象的原因还有待进一步的试验研究。
3.2 倍性鉴定方法在多倍体诱导过程中,及时、准确地筛选出变异株可极大地缩短育种周期,减少工作量。特别是在大批量诱导多倍体的情况下,及早淘汰非变异植株,可减少后期的管理成本和时间,是提高多倍体育种效率的重要手段。由于变异株在生长早期与普通二倍体存在显著形态变化,通过早期的形态鉴定可减少后期工作量,但只能作为一种辅助检测手段,还需要借助其他的判断方法才能准确进行倍性鉴定。如李立志等[28]对秋水仙素诱变处理的西瓜植株进行形态学鉴定,四倍体的准确率为91.3%。
谭素英[29]研究指出,用叶片保卫细胞内叶绿体数来鉴定西瓜倍性的方法可行,简便易操作,准确性也较高。施先锋等[21]研究指出,不同倍性西瓜其染色体数目与叶片气孔保卫细胞中的叶绿体数呈正相关,用气孔保卫细胞内叶绿体数目预测倍性的准确率可达90.2%。刘文革等[30]的研究指出,二倍体、三倍体和四倍体西瓜的叶片保卫细胞中的叶绿体数目比例约为2∶3∶4,与倍性一致,可以通过单位叶面积上细胞数目和细胞大小来对西瓜倍性进行早期鉴定。因此,针对大批量的样品,可以先通过气孔特征这一细胞学因素对变异株进行早期的筛选,再通过流式细胞术或者染色体压片确定植株的倍性[31]。
染色体计数鉴定法是最直接、准确的倍性鉴定方法,但需要熟练的细胞学操作技术,试验步骤较繁琐,且良好的染色体制片受到多种因素影响,要获得清晰的中期染色体制片难度较大,前期摸索时间长[9, 23]。
流式细胞术鉴定法,是大批量试验中鉴定倍性最快捷有效的方法,准备好的样品在3~5 min内即可以得出鉴定结果,且根据DNA的峰值图能很好地区分诱变产生的嵌合体(混倍体)、非整倍体及多倍体的倍性,但需要有相关的设备[14, 31]及专业人士,因此对于大批量的样品检测而言,检测费用相对较高。
由于多倍体植株在外部形态特征上与普通二倍体有显著变化,在早期可凭肉眼进行初步筛选。本试验就利用该方法,在诱变后、移栽前,根据苗期外部形态对诱变株进行了第1次的筛选、淘汰,在抽蔓期根据叶片形态进行第2次筛选,在抽蔓期利用气孔特征和叶绿体数目进行了第3次筛选。经过前3次的初筛,淘汰了大部分非变异株,极大地减少了第4次利用流式细胞术鉴定的成本,同时也减少了后期田间管理成本(如:套袋授粉的人工、水、肥投入及病虫害防治成本等)。之后,对套袋自交获得的种子抽样进行根尖染色体计数法鉴定,其结果与前期集成鉴定方法结果一致。表明利用前期的植株形态学鉴定、细胞学鉴定结合流式细胞术集成鉴定方法能省时、准确、高效地对大批量的诱变株进行鉴定,且前期鉴定不会对植株造成伤害或影响后续的生产。这种集成组合鉴定方法具有以下特点:1)能有效弥补染色体计数法需要熟练的细胞学操作技术、在大通量和多样品情况下检测耗时长的缺点;2)节省了直接用流式细胞术鉴定的检测成本;3)解决了有部分四倍体植株不能正常坐果、结籽而造成后期无法鉴定的问题;4)有效减少了四倍体种子的消耗等。王康等[32]也利用细胞学鉴定(气孔特征)和流式细胞术鉴定相结合的方法对二甲戊灵诱变的薄皮甜瓜进行倍性鉴定,表明2种鉴定方法相结合可快速、准确确定变异株倍性。
3.3 诱变产生嵌合体或非整倍体孔素萍等[1]研究表明,利用Oryzalin、秋水仙素、二甲戊乐灵作为大蒜四倍体的诱变剂,在低浓度或者短时间高浓度处理组合下均有嵌合体出现,而在高浓度长时间处理下则未有嵌合体出现。邵冰洁等[31]的研究也指出,利用秋水仙素诱导黑果枸杞和宁夏枸杞时均有二倍体和四倍体的嵌合体存在。在本试验中,通过流式细胞术检测发现,经秋水仙素和Oryzalin滴苗处理的变异株,均有嵌合体及三倍体的植株,不过利用秋水仙素处理出现的嵌合体的类型及数量较用Oryzalin处理的多,用秋水仙素处理产生的嵌合体有二倍体和四倍体及四倍体和八倍体2种嵌合体存在,而Oryzalin处理产生的嵌合体只发现有二倍体和四倍体的嵌合体,这可能是由秋水仙素使用的浓度高、药害比Oryzalin强引起的。
3.4 变异株的逆转在本试验的田间观察中,发现变异株在苗期、抽蔓前期,其茎叶形态可能表现出四倍体的表型特征,但经过一段时间的生长后,又会恢复为二倍体的表型特征。这种情况也可以从抽蔓期细胞学鉴定及流式细胞术分析结果中观察到,虽然气孔特征鉴定为变异株,但通过流式细胞术鉴定后表明变异株存在嵌合体的情况。这主要是由于在诱变后的早期冬瓜植株内分生能力细胞加倍不足,表现为二倍体细胞分裂速度快于四倍体,在植物外部形态上呈现出四倍体细胞占优势,之后随着植株的生长发育,二倍体细胞分裂速度逐渐加快,表现为二倍体细胞生长占优势,所以最后仍会恢复为二倍体的表型特征[7]。在实际生产中,针对这种情况可通过及时去除二倍体的枝蔓,来促进四倍体枝蔓的快速生长,才能获得较高的诱变成功率,但这需要较为丰富的田间形态识别经验[25, 28]。
3.5 诱变材料的选择在前期预备试验中发现,不同基因型的冬瓜材料的诱变率有明显不同。在预备试验中采用了3种不同基因型的黑皮冬瓜材料进行诱变处理,除了6-2×诱变获得四倍体外,其余的7-2×和13-2×均未成功诱变获得四倍体。说明诱导效果可能与作物的基因类型相关,这与葛志东等[33]、赵胜杰等[11]和刘泽发等[16]的研究结论一致。
| [1] |
孔素萍, 段乃彬, 刘冰江, 等. 不同诱变剂对大蒜四倍体诱导的影响[J]. 核农学报, 2016, 30(6): 1067-1073. DOI:10.11869/j.issn.100-8551.2016.06.1067 (  0) 0) |
| [2] |
王红娟, 杨岚, 李雅婷, 等. 茅苍术同源四倍体离体诱导与鉴定[J]. 核农学报, 2015, 29(6): 1030-1036. DOI:10.11869/j.issn.100-8551.2015.06.1030 (  0) 0) |
| [3] |
储丽红, 彭佳佳, 王钊, 等. 氨磺灵、氟乐灵和秋水仙素诱导安祖花多倍体的研究[J]. 园艺学报, 2014, 41(11): 2275-2280. (  0) 0) |
| [4] |
王友平, 朱金英, 徐光东, 等. 西瓜多倍体研究应用进展[J]. 长江蔬菜, 2010(20): 8-12. (  0) 0) |
| [5] |
MOREJOHN L C, BUREAU T E, MOLE-BAJER J, et al. Oryzalin, a dinitroaniline herbicide, binds to plant tubulin and inhibits microtubule polymerization in vitro
[J]. Planta, 1987, 172(2): 252-264. DOI:10.1007/BF00394595 (  0) 0) |
| [6] |
董飞, 陈运起, 刘世琦, 等. 秋水仙素诱导大葱多倍体的研究[J]. 园艺学报, 2011, 38(12): 2381-2386. (  0) 0) |
| [7] |
乔永刚, 马璐琳, 赵晓明, 等. 秋水仙素诱导党参四倍体[J]. 核农学报, 2009, 23(4): 566-571. (  0) 0) |
| [8] |
赵璘, 刘文革, 郭金丽, 等. 除草剂在植物离体染色体加倍上的应用[J]. 长江蔬菜, 2008(1): 30-33. (  0) 0) |
| [9] |
阎志红, 刘文革, 赵胜杰, 等. 利用二硝基苯胺类除草剂离体诱导西瓜四倍体[J]. 园艺学报, 2008, 35(11): 1621-1626. DOI:10.3321/j.issn:0513-353X.2008.11.010 (  0) 0) |
| [10] |
ZHANG N, ZENG H X, SHI X F, et al. Selection of tetraploid of a yellow flesh mini-watermelon using oryzalin[J]. Adv Mater Res, 2014, 838/839/840/841: 2449-2454. (  0) 0) |
| [11] |
赵胜杰, 刘文革, 阎志红, 等. 秋水仙素和胺磺灵除草剂诱导小型西瓜四倍体研究[J]. 长江蔬菜, 2010(8): 12-13.
(  0) 0) |
| [12] |
赵依杰, 张小红, 吴宇芬, 等. 除草剂Oryzalin诱变西瓜四倍体及倍性鉴定[J]. 云南农业大学学报, 2011, 26(4): 515-518. (  0) 0) |
| [13] |
韩毅科, 杜胜利, 张桂华, 等. 利用抗微管除草剂胺磺灵诱导黄瓜四倍体[J]. 华北农学报, 2006, 21(4): 27-30. (  0) 0) |
| [14] |
SAKHANOKHO H F, RAJASEKARAN K, KELLEY R Y, et al. Induced polyploidy in diploid ornamental ginger (Hedychium muluense R. M. Simth) using colchicine and oryzalin
[J]. Hortscience, 2009, 44(7): 1809-1814. (  0) 0) |
| [15] |
WANG K, HE L C, YAN H L, et al. Induction of tetraploidity with antimicrotubule agents in oriental melon (Cucumis melo var. makuwa)
[J]. Isr J Plant Sci, 2015, 62(3): 198-207. DOI:10.1080/07929978.2015.1067411 (  0) 0) |
| [16] |
刘泽发, 闵子杨, 孙小武, 等. 印度南瓜四倍体诱变及其特性研究[J]. 华北农学报, 2015, 30(5): 125-129. DOI:10.7668/hbnxb.2015.05.021 (  0) 0) |
| [17] |
REGO M M, REGO E R, BRUCKNER C H, et al. In vitro induction of autotetraploids from diploid yellow passion fruit mediated by colchicine and oryzalin
[J]. Plant Cell Tiss Org, 2011, 107(3): 451-459. DOI:10.1007/s11240-011-9995-6 (  0) 0) |
| [18] |
LEHRER J M, BRAND M K, LUBELL J D. Induction of tetraploidy in meristematically active seeds of Japanese barberry (Berberis thunbergii var. atropurpurea) through exposure to colchicine and oryzalin
[J]. Sci Hortic, 2008, 119(1): 67-71. DOI:10.1016/j.scienta.2008.07.003 (  0) 0) |
| [19] |
王惠林, 张慧林, 周志成. ORYZALIN 不同处理方法对西瓜四倍体诱变效果的影响[J]. 新疆农业大学学报, 2008, 31(6): 21-25. (  0) 0) |
| [20] |
谢大森, 张钢, 彭庆务, 等. 秋水仙素诱导冬瓜多倍体的初步研究[J]. 热带作物学报, 2011, 32(11): 2094-2098. DOI:10.3969/j.issn.1000-2561.2011.11.018 (  0) 0) |
| [21] |
施先锋, 彭金光, 汪李平. 用西瓜叶片气孔保卫细胞叶绿体数鉴定西瓜染色体倍性[J]. 湖南农业大学学报(自然科学版), 2009, 35(6): 640-642. (  0) 0) |
| [22] |
田新民, 周香艳, 弓娜, 等. 流式细胞术在植物学研究中的应用: 检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27. (  0) 0) |
| [23] |
张永兵, 陈劲枫, 伊鸿平, 等. 甜瓜有丝分裂染色体制片技术及核型分析[J]. 西北植物学报, 2005, 25(9): 1735-1739. (  0) 0) |
| [24] |
全国无子西瓜科研协作组. 无子西瓜栽培与育种[M]. 北京: 中国农业出版社, 2001: 46-48.
(  0) 0) |
| [25] |
梁倩倩, 张显, 顾桂兰. 温度和处理时间段对西瓜四倍体诱导的影响及其倍性鉴定[J]. 西北农业学报, 2009, 18(4): 301-305. (  0) 0) |
| [26] |
徐道娜, 薛志强, 李世栋, 等. 西瓜幼苗多倍体诱导方法研究[J]. 安徽农业科学, 2007, 35(28): 8847-8849. DOI:10.3969/j.issn.0517-6611.2007.28.046 (  0) 0) |
| [27] |
彭尽晖, 张良波, 彭晓英. 秋水仙素在植物倍性育种中的应用进展[J]. 湖南农业科技, 2004, 31(5): 22-25. (  0) 0) |
| [28] |
李立志, 何毅, 卢焜光. 黄皮西瓜化学诱变及四倍体利用研究初报[J]. 中国蔬菜, 2002(3): 8-11. (  0) 0) |
| [29] |
谭素英. 西瓜不同倍体叶保卫细胞中的叶绿体数观察[J]. 果树科学, 1985(4): 34-36. (  0) 0) |
| [30] |
刘文革, 阎志红, 饶小莉. 不同倍性西瓜的叶表皮微形态特征比较[J]. 果树学报, 2005, 22(1): 31-34. (  0) 0) |
| [31] |
邵冰洁, 万思琦, 刘江淼, 等. 黑果枸杞和宁夏枸杞的多倍体诱导和鉴定[J/OL]. 分子植物育种, (2017-10-25)[2018-01-15]. http://kns.cnki.net/kcms/detail/46.1068.S.20171025.1644.008.html.
(  0) 0) |
| [32] |
王康, 何林池, 魏小云, 等. 利用二甲戊乐灵创制薄皮甜瓜同源四倍体[J]. 西北农业学报, 2015, 24(4): 114-119. DOI:10.7606/j.issn.1004-1389.2015.04.019 (  0) 0) |
| [33] |
葛志东, 李海真, 王惠林, 等. 氟乐灵诱导西葫芦染色体加倍研究[J]. 中国农学通报, 2009, 25(8): 215-218. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


