人参Panax ginseng是吉林省重要的人工栽培药用植物之一,人参皂苷是其主要药效成分[1],有达玛烷型原人参二醇型皂苷(Protopanaxadiol, PPD)、原人参三醇型皂苷(Protopanaxatriol, PPT)和齐墩果烷型人参皂苷(Oleanane type saponins,OTS)。研究表明人参叶中皂苷含量显著高于根[2-3],并且价格低廉,有广阔的开发前景。近年来,人参皂苷生物合成途径已逐渐明晰[4-7],其中调控人参皂苷合成的关键酶3–羟基–3–甲基戊二酰CoA还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, HMGR)是植物中的MVA途径中的第1个限速酶,影响3–异戊二烯焦磷酸 (Isopentenyl pyrophosphate, IPP) 和二甲基烯丙基焦磷酸(Dimethylallyl pyrophosphate, DMAPP)的产量;法尼基焦磷酸合成酶(Famesyl pryophosphate synthase, FPS)可催化IPP和牻牛儿基焦磷酸(Geranyl pyrophosphate, GPP)生成法尼基焦磷酸(Farnesyl pyrophosphate, FPP);鲨烯合成酶(Squalene synthase, SS)将FPP催化合成鲨烯;鲨烯环氧酶(Squalene epoxidase, SE)催化鲨烯形成2,3–氧化鲨烯;达玛烷二醇合成酶(Dammarenediol synthase, DS)、β–香树素合成酶(β-amyrin synthase, β-AS)分别催化2,3–氧化鲨烯形成达玛烷型、齐墩果烷型人参皂苷的前体,最终经细胞色素P450(Cytoehrome P450, CYP450)、糖基转移酶(Glycosyl transferase, GT)进行碳环修饰、糖基化修饰,以超基因家族的形式存在于植物中,从而可以形成复杂多样的单体人参皂苷,目前已经得到功能验证的有CYP716A47、CYP716A52v2、CYP716A53v3、CYP93E1等基因。但相关研究多集中于关键酶基因的发掘、功能验证等工作方面,对于植物内在基因与外部环境的响应机制研究还较少。
吉林省长白山地区独特的自然地理环境形成了人参药材的道地产区,而人参皂苷的合成受生长所在的环境和体内关键酶基因的共同调控[8-9]。然而对于人参叶中人参皂苷的研究多集中于药物化学、药理学研究,人参叶中皂苷的生物合成受内在基因与外部环境的调控机制还不明确。因而本研究以人参叶为试验材料,对不同生长时期叶中8种单体人参皂苷(Rg1、Re、Rf、Rb1、Rb2、Rb3、Rc和Rd)含量以及调控人参皂苷合成的7个关键酶基因(HMGR、FPS、SS、SE、DS、β-AS和CYP716A47)表达量进行测定和分析,结合人参样地的生态因子综合分析关键酶基因表达量与人参皂苷含量的关系,以明确人参皂苷生物合成的生理生态机制,揭示生态因子和遗传因素与药材质量的关系,为实现对药材质量的调控提供理论依据。
1 材料与方法 1.1 材料4年生人参于2016年5月30日、6月12日、6月22日、7月3日、7月13日、7月24日、8月5日、8月18日、8月31日、9月13日和9月29日取自吉林省抚松县松江河林业局板石河林场人参产业技术研究与示范抚松基地(42°N,127°E),田间取样采用5点取样法,每次随机采集固定田垄的人参10株,经吉林农业大学杨利民教授鉴定为人参。将人参叶片轻轻摘下,每次采集约50枚小叶片,将新鲜叶片置于冰盒中保鲜带回实验室,清洗干净并用吸水纸吸去水分。将每次采集的小叶片随机选择10枚分装于冻存管,液氮对样品进行快速冷冻后贮存于–80 ℃超低温冰箱以用于后续人参皂苷合成关键酶基因表达量测定。将剩余清洗干净的约40枚人参小叶片置于烘箱中低温烘干至恒质量,用粉碎机磨成细粉,过40目筛后用于人参皂苷含量测定。
主要试剂:多糖多酚植物总RNA提取试剂盒、BioTeke super RT Kit cDNA合成试剂盒购于长春百金,SYBR® Premix Ex TaqTM荧光染料等购于长春海灵科贸,甲醇、乙腈(色谱纯,Fisher Scientific),甲醇(萃取剂)及其他试剂均为国产分析纯。
主要仪器:美国HOBO®小型气象站;美国Aligent荧光定量PCR仪Mx3000P;美国Agilent高效液相色谱仪1260;美国Thermo核酸/蛋白定量仪NanoDrop 2000;美国Thermo微量离心机Heraeus Fresco 21;上海之信仪器有限公司智能超声波清洗器DL-820E;日本SANYO超低温冰箱MDF-382E。
1.2 样地气象数据采集使用HOBO®小型气象站于采样地进行24 h监测,收集样地温度、降雨量、光合有效辐射、土壤水势、相对湿度等数据。
1.3 关键酶基因表达量测定 1.3.1 总RNA提取及cDNA合成每次取人参叶组织样品约50~100 mg在液氮中研磨成粉,按照长春百金公司的总RNA提取试剂盒的说明书提取总RNA,采用NanoDrop 2000检测仪测定RNA质量浓度。采用BioTeke super RT Kit cDNA试剂盒将总RNA逆转录合成cDNA,于–20 ℃条件下保存备用。
1.3.2 引物设计与合成荧光定量PCR特异引物由上海生工生物工程有限公司合成,其序列见表1。
|
|
表 1 荧光定量PCR引物 Table 1 Primers of quantitative fluorescent PCR |
反应体系:灭菌水7.5 μL,SYBR® Premix Ex TaqTM 10 μL,引物各0.5 μL,50×ROX Reference Dye II 0.5 μL,cDNA模板1 μL,总计20 μL。反应程序:94 ℃预变性30 s;4 ℃变性5 s,55 ℃退火30 s,72 ℃延伸20 s,循环45次。以人参亲环蛋白基因(Cyclophilin)为内参[10],不同生长时期人参叶片样品重复反应3次。
1.3.4 相对表达量的测定以5月30日人参叶片中的表达量作为对照,根据表1中各基因的引物序列,按“1.3.3”的反应条件分别对人参HMGR、FPS、SS、SE、DS、β-AS、CYP716A47基因进行RT-PCR扩增,用MxPro软件收集数据,采用2–ΔΔCt法分析结果[11]。
1.4 单体人参皂苷含量测定 1.4.1 色谱条件依利特Hypersil ODS2 (250 mm×4.6 mm,5 μm)色谱柱,流动相为水–乙腈溶液,梯度洗脱条件:乙腈溶液体积分数(进间)为19%~22%(0~24.0 min),22%~26%(24.0~26.0 min),26%~32%(26.0~30.0 min),2%~34%(30.0~50.0 min),34%~80%(50.0~50.1 min),80%(50.1~65.0 min)。流速1.0 mL·min–1,检测波长203 nm,柱温25 ℃。测定8种单体皂苷的峰面积,并通过线性方程计算其含量[12]。
1.4.2 样品单体皂苷含量测定精密称取不同生长时期的人参叶样品1.000 g,加入30 mL甲醇,超声提取30 min,提取3次后合并滤液。使用旋转蒸发仪50 ℃条件下挥干甲醇,用甲醇溶解并定容至10 mL,经0.22 μm微孔滤膜过滤后取供试样品20 μL按照“1.4.1”的条件进样检测。每个样品重复进样3次。
1.5 数据处理人参采样地收集到的气象数据用Excel软件处理;人参皂苷合成关键酶基因表达量数据、人参皂苷含量数据和气象数据采用SPSS 19.0进行处理,采用Duncan’s新复极差法进行多重比较检验数据的显著性差异,用Pearson法分析生态因子与人参皂苷含量及其关键酶基因表达的相关系数;采用DPS 7.05计算生态因子与人参皂苷含量及其关键酶基因表达之间的灰色关联度。
2 结果与分析 2.1 总RNA提取结果提取不同时期人参叶组织的总RNA,进行质量浓度和纯度检测,不同时期人参叶组织总RNA的检测结果如表2所示。表2的结果表明,总RNA的质量浓度和纯度均较高,可用于下一步试验。
|
|
表 2 不同生长时期人参叶总RNA的检测结果 Table 2 The detection of total RNA from Panax ginseng leaves at different growth time |
用实时荧光定量PCR的方法检测了人参叶片不同生长时期HMGR、FPS、SS、SE、DS、β-AS、CYP716A47基因的表达量,结果如图1所示。人参HMGR、FPS、DS、β-AS、CYP716A47基因在叶中的表达有相似的变化趋势,7月13日—9月29日是人参HMGR、FPS、DS、β-AS、CYP716A47基因表达的活跃时期,而此时也是人参生长处于绿果期到果后参根生长期,是人参皂苷积累的重要时期;人参SS基因在展叶期(5月30日)和绿果期(7月13—24日)均有较高的表达,但其余生长时期表达并不活跃;人参SE基因表达较为活跃的时期是展叶期(5月30日)、绿果期(7月13日)和枯萎期(9月29日),其他生长时期有较低水平的表达;7个人参皂苷合成关键酶基因在6月12日—7月3日表达量均处于极低的水平,在6月22日7个基因的表达量急剧下调,甚至不表达,此时人参处于生殖生长的开花期,相关关键酶基因的表达下调可能导致了人参皂苷合成减少。对人参叶中7个关键酶基因在不同生长时期表达量进行相关性分析,结果见表3,多个关键酶基因之间多表现出了显著相关性(P<0.05),说明人参皂苷合成关键酶基因在叶中的表达有协同增减的趋势,它们共同调控了人参叶片中皂苷的合成与积累,造成不同生长时期叶片中的人参皂苷含量差异。
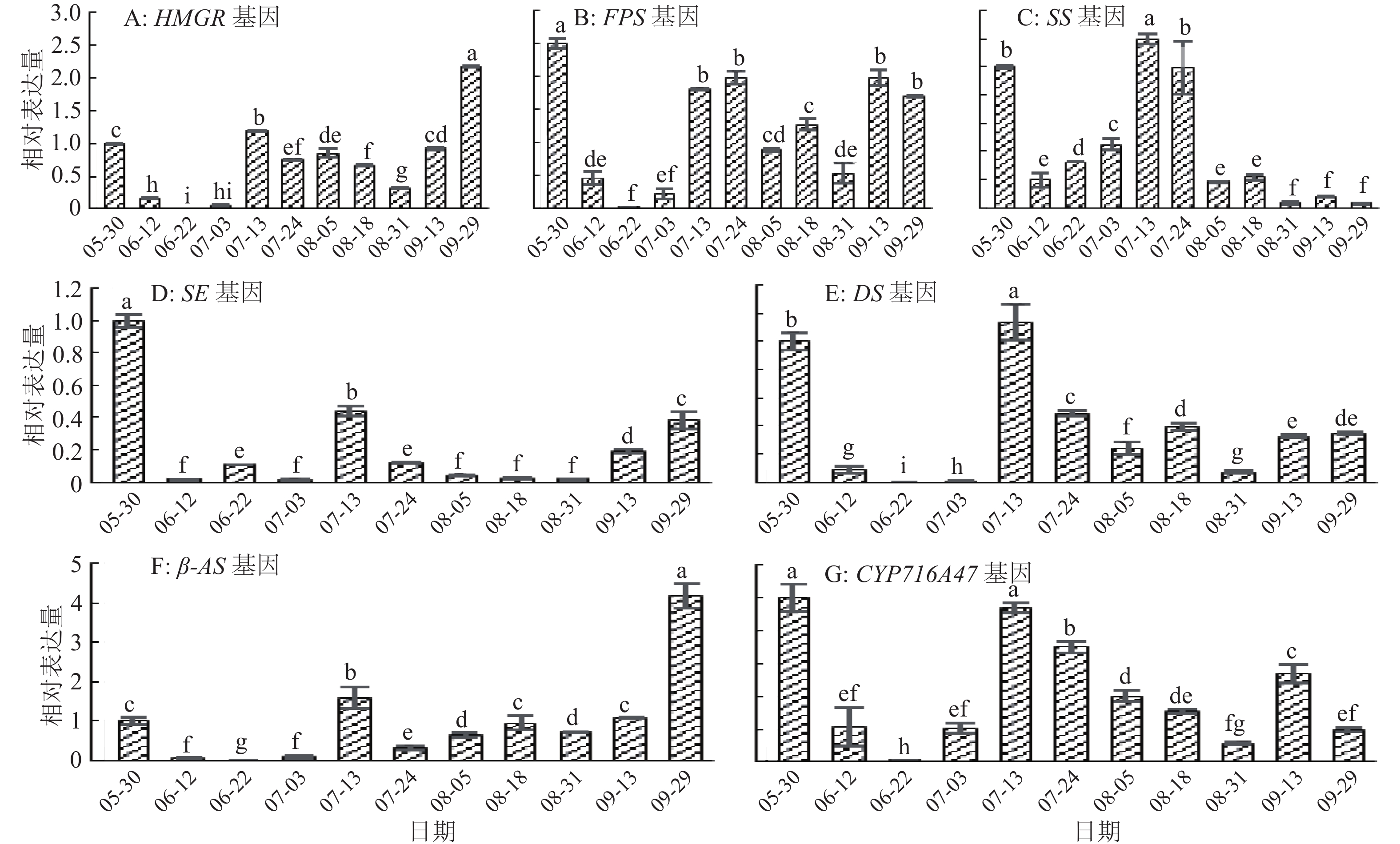
|
图 1 不同生长时期人参叶片中的关键酶基因荧光定量PCR表达分析(n=3) Figure 1 Expression analysis of key enzyme genes in Panax ginseng leaves at different growth times by quantitative fluorescent PCR 各图中,柱子上方凡是具有一个相同小写字母者表示差异不显著(P>0.05, n=3, Duncan’s法) |
|
|
表 3 人参叶片中基因表达的相关性1) Table 3 Correlation expression among different genes in Panax ginseng leaves |
4年生人参叶中8种单体人参皂苷含量变化如图2所示,人参叶中单体皂苷平均含量高低顺序为Re>Rg1、Rd>Rb1>Rb2、Rf、Rc、Rb3,不同生长时期各个单体皂苷变化趋势并不相同,存在明显差异。PPT型人参皂苷Re、Rg1含量随着生长时期的变化呈逐渐增加的趋势,Rf含量在各个生长时期变化不大,三者在果后参根生长期(8月31日—9月13日)达到最大值,分别为60.30、39.38和9.65 mg·g−1。PPD型人参皂苷(Rd、Rb1、Rb3、Rc、Rb2)有相似的变化趋势,它们在人参果期(7月3日—7月24日)含量有所降低,然后逐渐增加,在果后参根生长期达到最大值35.81、27.08、15.98、14.42和12.22 mg·g−1。不同生长时期中PPT型人参皂苷与PPD型人参皂苷在叶中的比例约等于1∶1,9月20日枯萎期PPD型人参皂苷突然急剧降低,但是PPT型人参皂苷的含量并未发生巨大波动,枯萎期人参样地霜害严重,环境最低温度达–4.82 ℃,环境的急剧变化可能直接影响了叶中PPD型人参皂苷含量,但对PPT型人参皂苷影响不大。对不同生长时期叶中8种单体皂苷含量进行相关性分析,结果见表4,PPT型人参皂苷(Rg1、Re、Rf)之间极显著相关(P<0.01),而他们与PPD型人参皂苷之间的相关性较弱,同时PPD型人参皂苷(Rd、Rb1、Rb3、Rc、Rb2)之间多达到极显著相关水平(P<0.01)。相关性分析结果表明,人参叶中不同构型的人参皂苷的合成与积累存在不同规律,相似构型的人参皂苷存在协同增减的趋势。
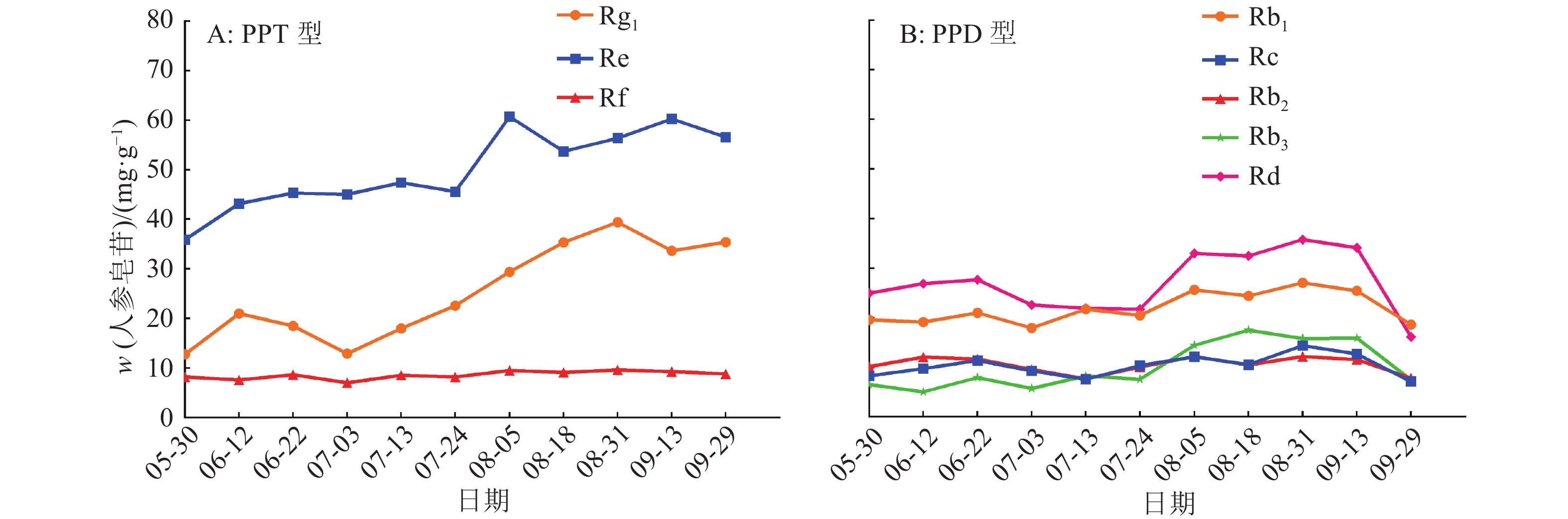
|
图 2 不同生长时期人参叶片中人参皂苷含量(n=3) Figure 2 The contents of ginsenosides in Panax ginseng leaves at different growth times (n=3) |
|
|
表 4 不同人参皂苷含量间的相关性1) Table 4 Correlation of the contents of different ginsenosides |
采样地人参生长各个时期生态因子数据整理后如表5所示。人参采样地5月30日—9月29日最低温度为–4.82 ℃,最高温度达32.76 ℃;各个生长期日均光合有效辐射范围为292.58~525.30 μmol·m–2·s–1;生长期总降雨量为459.905 mm,空气相对湿度64.93%~86.92%,土壤水势(–0.290 ~ –0.101)较高,样地整体水分充足,适宜人参生长。
|
|
表 5 采样地各生长时期生态因子 Table 5 Ecological factors of the sample plot at different growth time |
生态因子与人参皂苷含量的相关性分析结果见表6,人参叶中皂苷的形成受多种生态因子影响,其中温度、光合有效辐射、土壤水势对人参皂苷的合成有抑制作用,而降雨和空气相对湿度可促进人参皂苷的合成。温度与人参皂苷Rg1、Rb3含量呈极显著负相关(P<0.01),温度与人参皂苷Re、Rf、Rb1、Rd含量呈显著负相关(P<0.05),说明过高的温度显著抑制了叶片中人参皂苷的合成,适当的降低温度是提高叶片中皂苷含量的有效手段之一。光合有效辐射与人参皂苷Rg1含量显著负相关(P<0.05),人参是喜阴植物,过高的光照强度会抑制体内代谢,因而皂苷含量降低。土壤水势的变化影响植物对水分的吸收,因而对叶片中皂苷含量影响巨大,土壤水势与人参皂苷Rg1、Re、Rf、Rb3含量极显著负相关(P<0.01),土壤水势与人参皂苷Rb1含量显著负相关(P<0.05),说明参地土壤水分过高制约了人参皂苷的合成。降雨对叶片中人参皂苷含量有促进作用,但未达到显著水平。空气相对湿度对人参叶片有直接作用,可促进人参叶片中皂苷的合成,空气相对湿度与人参皂苷Rg1、Re、Rf、Rb1、Rb3的含量显著正相关(P<0.05),说明可适当提高环境中相对湿度以利于人参皂苷的合成。
人参皂苷的合成受多种关键酶基因调控,如表7所示,HMGR基因的表达与人参皂苷Rb2含量显著负相关(P<0.05);SS基因的表达与人参皂苷Rg1、Re含量呈显著负相关(P<0.05);β-AS基因的表达与人参皂苷Rc含量显著负相关(P<0.05),与Rb2的含量极显著负相关(P<0.01)。但人参皂苷合成某1个关键酶基因的表达可能仅作用于人参皂苷合成途径中的某1个位点,由于人参皂苷合成途径中有多个调控位点,某1个关键酶基因与最终的人参皂苷合成之间还有多个步骤,因此并非所有基因均与皂苷含量的相关性达到显著水平。
|
|
表 6 生态因子与叶中人参皂苷含量的相关性1) Table 6 Correlation between ecological factors and ginsenoside contents in leaves |
|
|
表 7 基因表达量与叶中人参皂苷含量的相关性1) Table 7 Correlation between gene expression and ginsenoside contents in leaves |
表8、表9分析了生态因子、关键酶基因表达与人参皂苷灰色关联度。相对湿度与人参皂苷Re、Rf、Rb1、Rb2、Rd灰色关联度均高于其他生态因子,为0.727 9~0.871 1,说明相对湿度对叶中人参皂苷的积累起主导作用,是影响叶中人参皂苷含量的主导生态因子;土壤水势也是影响叶中人参皂苷含量的重要生态因子,土壤水势对人参皂苷Rg1和Rb3含量的影响高于其他生态因子,灰色关联度分别为0.826 3和0.677 4;温度、光合有效辐射是影响叶中人参皂苷含量的次要生态因子,它们与人参皂苷含量的灰色关联值也均处于较高水平。
叶中关键酶基因中与人参皂苷含量关联值较高的是HMGR、FPS、β-AS、CYP716A47,关联值为0.379 0~0.518 9,明显小于生态因子与人参皂苷含量的关联值,说明生态因子是影响人参皂苷合成的主导因子,而关键酶基因的表达则是调控人参皂苷体内流向,人参皂苷含量的高低受外部环境影响高于内在遗传因素。
|
|
表 8 生态因子与叶中人参皂苷含量的灰色关联度 Table 8 Grey correlation degrees between ecological factors and ginsenoside contents in leaves |
|
|
表 9 基因表达量与叶中人参皂苷含量的灰色关联度 Table 9 Grey correlation degrees between genes expression and ginsenoside contents in leaves |
药材质量的形成受外部环境的影响,外部环境的变化导致药材内在遗传因素调控药效成分的生物合成对环境因子的响应呈现出多样性,内在遗传因素与外部环境因素共同决定了药材质量的形成[13]。本研究发现温度对叶片中多种人参皂苷(Rg1、Re、Rf、Rb1、Rb3、Rd)的积累有显著的抑制作用,这与谢彩香等[14]和贾光林等[15]的研究一致,说明在一定温度范围内,叶片中人参皂苷的含量随着温度升高而降低,适当低温利于人参皂苷积累;光照对人参生长的影响作用不同,20%透光棚下人参根中皂苷含量最高,而15%透光棚下叶片中皂苷含量最高[16],人参叶片对光照的反应敏感,过高的光合有效辐射可能损伤叶片,因而造成人参皂苷的减少;土壤中水分含量的高低是影响药材质量形成的重要因子,适度的干旱胁迫可以提高药材中有效成分的含量[17],包京姗等[18]发现土壤相对含水量为60%~80%时有利于人参生长,而本研究中人参样地土壤水势较高(–0.290 ~ –0.101),显著影响了叶片中人参皂苷含量,适当进行人工调控,降低水分可对人参皂苷的合成有积极作用;空气湿度可适当缓解土壤的干旱限制,利于植物叶片生长以及生命活动的进行[19],本研究中空气湿度对人参叶片有直接作用,该样地空气相对湿度在0.649~0.869,适宜人参生长,对叶片中人参皂苷含量的积累起到了显著作用。
随着分子生物学的深入发展,人们对于药材质量的形成也着眼于内在遗传因素的影响。Kim等[20]发现在连续2~3 d的黑暗条件下HMGR基因活性提高,推测HMGR影响人参皂苷合成可能需要黑暗的条件;Park等[21]将积雪草的FPS基因导入到人参不定根中并过量表达,结果人参皂苷含量比对照组有显著提高;蒋世翠等[22]在人参愈伤组织中导入了SS基因干扰表达载体,转化后SS基因表达量明显降低,人参皂苷含量也有所变化;Han等[23]在转基因人参根中沉默PgSQE1基因,发现人参皂苷含量降低;Han等[24]通过RNAi技术使DS基因沉默,发现人参根中皂苷产量显著降低。对人参皂苷合成关键酶基因多集中于报道单一基因功能,或者不同组织部位的基因表达差异[25],并未对人参组织在不同生长时期生长发育的基因表达变化进行研究,而本研究对多基因与环境因子和人参皂苷关系进行了研究,发现在人参叶片中HMGR基因的表达与Rb2含量显著负相关;SS基因与Rg1、Re含量显著负相关;β-AS基因与Rc、Rb2含量显著负相关。
人参样地环境复杂多变,在人参整个生长过程中也受到多种因素的影响,某一个单一基因与人参皂苷含量的相关性就很难达到显著程度,因此本研究中多数关键酶基因与人参皂苷含量的相关性并未达到显著水平,可能有多种原因:1)人参皂苷最终的合成是受多步反应催化的,多种酶参与了人参皂苷的合成,而某一个关键酶基因的表达仅作用于一个位点,对最终人参皂苷的合成促进作用有限;2)由于同源基因的存在,每一步反应可能有多个同源基因的表达所影响,本文中所研究的基因表达没达到显著水平,可能存在其他未被发现的同源基因的共同作用;3)从某一关键酶基因的表达到某一种酶的合成,还需要多步反应催化,可能关键酶基因表达高,但由于生命活动的变化,植物体合成关键酶的量有限,所以最终与人参皂苷含量相关性不显著;4)研究发现植物次生代谢产物的合成往往是多个基因家族形成的复杂调控网络所调控产生,在数量庞大的基因家族群中单一基因的作用较小,而我们对于药用植物次生代谢的基因认识还较少,关键基因发掘的数量不够,因此对于阐明其分子机制还需要深入研究;5)由于药材药效成分形成的相关分子生物学研究进展有限,本研究仅从转录水平入手,今后还应从翻译水平、翻译后酶(蛋白)催化水平进一步揭示药材质量形成的分子生态机制。
对生态因子、关键酶基因表达与人参皂苷含量的灰色关联度进行计算,生态因子(温度、光和有效辐射、土壤水势、相对湿度)与人参皂苷灰色关联度在0.552 6~0.871 1之间,说明各个生态因子与叶中人参皂苷积累有密切联系,而关键酶基因表达与人参皂苷灰色关联度在0.309 8~0.518 9之间,生态因子是叶片中有效成分积累的主导外部因素,其作用具有整体性,影响着人参的整个生命活动,而某一关键酶基因所影响的节点有限,内在遗传因素决定了人参皂苷前体物质的最终流向,但最终产物的多少还受外部生态因子的调控。
目前对于人参中人参皂苷形成与积累的规律研究的不足,制约了对人参药材质量的调控,从分子生态学的角度阐明影响人参皂苷形成的主导生态因子与内在遗传因素,对实现药材质量“安全、有效、稳定、可控”的目标有重要意义。
| [1] |
黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166. (  0) 0) |
| [2] |
逄世峰, 李亚丽, 许世泉, 等. 人参不同部位人参皂苷类成分研究[J]. 人参研究, 2015, 27(1): 5-8. (  0) 0) |
| [3] |
张兰兰, 高文远, 宋兆辉, 等. 不同年份林下山参叶中皂苷类成分含量变化研究[J]. 中国中药杂志, 2012, 37(17): 2530-2533. (  0) 0) |
| [4] |
ZHAO C L, CUI X M, CHEN Y P, et al. Key enzymes of triterpenoid saponin biosynthesis and the induction of their activities and gene expressions in plants[J]. Nat Prod Commun, 2010, 5(7): 1147-1158. (  0) 0) |
| [5] |
HAN J Y, KIM H J, KWON Y S, et al. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-II during ginsenoside biosynthesis in Panax ginseng
[J]. Plant Cell Physiol, 2011, 52(12): 2062-2073. DOI:10.1093/pcp/pcr150 (  0) 0) |
| [6] |
SAWAI S, SAITO K. Triterpenoid biosynthesis and engineering in plants[J]. Front Plant Sci, 2011. DOI:10.3389/fpls.2011.00025 (  0) 0) |
| [7] |
林彦萍, 张美萍, 王康宇, 等. 人参皂苷生物合成研究进展[J]. 中国中药杂志, 2016, 41(23): 4292-4302. (  0) 0) |
| [8] |
杨利民. 中药资源生态学及其科学问题[J]. 吉林农业大学学报, 2008, 30(4): 506-510. (  0) 0) |
| [9] |
焦晓林, 高微微. 环境因子对药用植物三萜皂苷合成影响的研究进展[J]. 中草药, 2011, 42(2): 398-402. (  0) 0) |
| [10] |
LIU J, WANG Q, SUN M, et al. Selection of reference genes for quantitative real-time PCR normalization in Panax ginseng at different stages of growth and in different organs
[J]. PLoS One, 2014, 9(11): e112177. DOI:10.1371/journal.pone.0112177 (  0) 0) |
| [11] |
杨怡姝, 孙晓娜, 王小利, 等. 实时荧光定量PCR技术的操作实践[J]. 实验室研究与探索, 2011, 30(7): 15-19. (  0) 0) |
| [12] |
林红梅, 张永刚, 李岳桦, 等. 不同产地人参中8种人参单体皂苷含量比较[J]. 特产研究, 2013, 35(4): 63-66. (  0) 0) |
| [13] |
杨利民, 张永刚, 林红梅, 等. 中药材质量形成理论与控制技术研究进展[J]. 吉林农业大学学报, 2012, 34(2): 119-124. (  0) 0) |
| [14] |
谢彩香, 索风梅, 贾光林, 等. 人参皂苷与生态因子的相关性[J]. 生态学报, 2011, 31(24): 7551-7563. (  0) 0) |
| [15] |
贾光林, 黄林芳, 索风梅, 等. 人参药材中人参皂苷与生态因子的相关性及人参生态区划[J]. 植物生态学报, 2012, 36(4): 302-312. (  0) 0) |
| [16] |
张治安, 徐克章, 任跃英, 等. 光照条件对参株碳水化合物和人参皂甙含量的影响[J]. 吉林农业大学学报, 1994, 16(3): 15-17. (  0) 0) |
| [17] |
王红星, 乔传英, 古红梅. 影响植物次生代谢产物形成的因素[J]. 安徽农业科学, 2007, 35(35): 11376-11377. DOI:10.3969/j.issn.0517-6611.2007.35.021 (  0) 0) |
| [18] |
包京姗, 王秀全, 金晶茹, 等. 不同土壤及其含水量对人参生长的影响[J]. 吉林农业大学学报, 2009, 31(6): 725-728. (  0) 0) |
| [19] |
YU Q, WANG T. Simulation of the physiological responses of C3 plant leaves to environmental factors by a model which combines stomatal conductance, photosynthesis and transpiration[J]. Acta Bot Sin, 1998, 40(8): 740-750. (  0) 0) |
| [20] |
KIM Y J, LEE O R, OH J Y, et al. Functional analysis of 3-hydroxy-3-methylglutaryl coenzyme a reductase encoding genes in triterpene saponin-producing ginseng[J]. Plant Physiol, 2014, 165(1): 373-387. DOI:10.1104/pp.113.222596 (  0) 0) |
| [21] |
PARK H W, KIM O T, HYUN D W, et al. Overexpression of farnesyl diphosphate synthase by introducing CaFPS gene in Panax ginseng C. A. Mey
[J]. Korea Journal of Medicinal Crop Science, 2013, 21(1): 32-38. DOI:10.7783/KJMCS.2013.21.1.32 (  0) 0) |
| [22] |
蒋世翠, 张明哲, 王义, 等. 人参SQS基因的干扰载体构建及转化人参愈伤组织
[J]. 吉林大学学报(理学版), 2011, 49(6): 1136-1140. (  0) 0) |
| [23] |
HAN J Y, IN J G, KWON Y S, et al. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panax ginseng
[J]. Phytochemistry, 2010, 71(1): 36-46. DOI:10.1016/j.phytochem.2009.09.031 (  0) 0) |
| [24] |
HAN J Y, KWON Y S, YANG D C, et al. Expression and RNA interference-induced silencing of the dammarenediol synthase gene in Panax ginseng
[J]. Plant Cell Physiol, 2006, 47(12): 1653-1662. DOI:10.1093/pcp/pcl032 (  0) 0) |
| [25] |
刘娟, 纪瑞锋, 陈同, 等. 人参皂苷生物合成基因组织表达特性的研究[J]. 中国中药杂志, 2017, 42(13): 2453-2459. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


