拟除虫菊酯类农药是一类高效、广谱、低毒的仿生杀虫剂,通过触杀和胃毒作用,可有效防治农业、公共卫生、城市绿化中多种害虫、害螨等,在全球范围内广泛使用[1]。氯原子和3–苯氧基苄基取代天然除虫菊素的部分侧链,显著改进了菊酯类农药的光稳定性,使高效低毒的拟除虫菊酯类农药在农业生产中迅速推广[2],目前该类农药已商业化的品种约为70多种,产量占据了全球杀虫剂市场的30%左右[3]。然而,化学结构的改造极大提高了该类农药的生物毒性[4]。拟除虫菊酯类农药作用于昆虫神经系统,因此,哺乳动物神经传导系统的钠离子通道也成为菊酯类农药的潜在作用位点[5]。研究表明,拟除虫菊酯类农药对非靶标哺乳动物的中枢神经和外周神经表现出较高的神经毒性[6-8],逐渐成为人类健康及生态系统安全的潜在威胁,因此,如何消除拟除虫菊酯类农药在环境中的残留污染是保障农业安全生产的迫切问题[9-10]。
微生物群落的多样性及丰富性促进了土壤有机质的分解和养分的转化,微生物可快速响应土壤环境中的农药蓄积压力,并激发其特有的生物解毒机制[11]。研究表明,经筛选、驯化后,微生物可有效代谢环境中残留的农药,具有操作简单、高效、低成本、无二次污染等优点[12-13]。然而,在田间应用中,因菌株的直接投放导致菌群存活率低、生长繁殖慢、易受原生菌群及环境因素影响等问题,大幅削弱了农药降解菌的生物修复效果,从而阻碍了降解微生物在田间农药残留污染修复中的大规模推广和应用。本研究利用前期筛选的高效氯氰菊酯(Beta-cypermethrin,β-CP)降解菌株枯草芽孢杆菌Bacillus subtilis BSF01,通过助剂成分筛选及比例优化,制备活性高、持效性好、能够在田间广泛运用的降解菌剂,为今后该降解菌的产业化生产和应用提供重要基础,同时,为治理农田环境中的拟除虫菊酯类农药的残留污染提供参考。
1 材料与方法 1.1 材料供试菌株枯草芽孢杆菌BSF01是由华南农业大学昆虫毒理研究室从广西农药厂废水活性污泥中筛选、分离与鉴定。现保存于该实验室及中国典型培养物保藏中心,菌种保藏号为CCTCCAB2014103。根据文献方法,制备种子液培养基[3],计数培养基[3]及发酵培养基[14]。
质量分数为95%的β-CP原药由江苏扬农股份化工有限公司提供。色谱级有机溶剂购自瑞典Oceanpak公司;其余试剂均为国产分析纯。
准确称取一定质量的原药,加入丙酮振荡使其充分溶解,并定容至100 mL,配制为1 000 mg·L–1的农药母液,经0.22 μm有机滤膜过滤后避光低温保存于棕色瓶中。
1.2 菌粉的制备在50 mL种子液培养基中按1%的体积分数添加活化菌液,置于200 r·min–1、35 ℃摇床中培养24 h后,制得菌株BSF01的活化种子液。扩大培养时,将发酵罐蒸汽灭菌之后装入发酵培养基15 L,继续蒸汽灭菌30 min,待发酵液温度下降至40 ℃后,按1%的体积分数(150 mL)接种活化种子液至发酵罐中,调节pH为7.0±0.2,加入适量灭菌消泡剂,于350 r·min–1、35 ℃条件下发酵培养16 h。在发酵后期,每隔1 h从发酵罐中取样制片,结晶紫染色后将其置于光学显微镜下观察枯草芽孢杆菌形态,待视野中芽孢生成率大于99%且芽孢形态均一时结束发酵,将发酵液分装后,以4 ℃、3 600 r·min–1离心30 min,弃上清液,按沉淀质量的3%添加载体填料高岭土用于喷制菌粉。喷雾干燥制备菌粉时,将进样泵的转速设置为14~16 r·min–1,喷雾干燥机进风温度195 ℃,出风温度90 ℃,雾化器转速250~260 r·min–1,每次进行喷雾干燥前先清洁干燥器内壁及管道,进样前开引风机热机0.5 h,喷雾干燥完成后开引风机降温,待温度低于50 ℃时,收集喷雾塔中的菌粉,称质量,测定芽孢含量,密封保存。
1.3 菌剂助剂的筛选 1.3.1 润湿剂的筛选以洗衣粉、十二烷基磺酸钠(Sodium dodecyl sulfonate, SDS)及十二烷基苯磺酸钠(Sodium dodecyl benzene sulfonate, SDBS)为待测润湿剂,使菌粉中各润湿剂的质量分数分别为3%、5%和7%,每个处理3个重复,并设置未添加润湿剂的空白对照。经过微型粉碎机粉碎后收集混合物,参照《农药可湿性粉剂润湿性测定方法(GB/T 5451—2001)》[15],测定不同润湿剂混合物的润湿时间。同时,将混合物常温条件贮存7 d后用稀释涂布平板法计算混合物中枯草芽孢杆菌的芽孢含量。
1.3.2 分散剂的筛选以阿拉伯树胶、聚乙烯醇(Polyvinyl alcohol, PVA)及PEG-8000为待测分散剂,使菌粉中各分散剂的质量分数分别为3%、5%和7%,每个处理3个重复,并设置未添加分散剂的空白对照。经过微型粉碎机粉碎后收集混合物,参照《农药可湿性粉剂润湿性测定方法(GB/T 5451—2001)》[15],测定不同分散剂混合物的悬浮率。同时,将混合物常温条件贮存7 d后用稀释涂布平板法计算混合物中枯草芽孢杆菌的芽孢含量。
1.3.3 稳定剂的筛选以磷酸钾、碳酸钙、磷酸氢二钾及羧甲基纤维素钠为待测稳定剂,添加质量分数为4%,每个处理3个重复,并设置未添加稳定剂的空白对照。将配置好的混合物置于50 ℃电热鼓风干燥箱中,每隔7 d取样测定不同处理条件下混合物的芽孢含量。
1.3.4 紫外保护剂的筛选向待测混合粉剂中分别加入质量分数为0.5%和1.0%的抗坏血酸(VC)或糊精为紫外照射保护剂,并将菌剂稀释涂布于平板中,置于15 W紫外灯下,照射距离为40 cm,照射0.5、1.0、1.5、2.0、2.5、4.0、6.0、8.0和10.0 h后,将平板置于35 ℃接种培养箱培养18.0 h,记录芽孢杆菌的菌落数量。
1.4 菌剂质量检测BSF01菌剂的质量检测参照《农用微生物菌剂(GB 20287—2006)》标准[16]。将1 g菌粉添加至装有10~20颗玻璃珠及100 mL无菌水的三角瓶中,置于35 ℃、150 r·min–1摇床中震荡培养30 min后,将菌液进行梯度稀释,取稀释菌液100 mL均匀涂布于培养基平板,并置于35 ℃培养箱中培养15~18 h,记录平板菌落数,计算菌粉芽孢含量。
在初始质量浓度为50 mg·L–1的β-CP培养液中,分别添加稀释了100、1 000和2 000倍的BSF01菌剂,每个处理设置3个重复,记录各处理芽孢含量,并以未添加菌剂的β-CP培养液为空白对照,处理1、3、5和7 d后,通过高效液相色谱法(High performance liquid chromatography, HPLC)分析检测β-CP的质量浓度,并计算降解率。
1.5 β-CP的HPLC分析检测分别配制0.1、0.5、1.0、2.0和5.0 mg·L–1的工作标准液,经HPLC测定[3],β-CP的标准曲线符合方程y=153.78+7.263 8x,相关性好(R2=0.999 9),满足液相色谱分析要求。土壤样品取自华南农业大学教学农场,过筛处理后,土壤空白样品中分别添加β-CP标准溶液至0.1、0.5和1.0 mg·kg–1,每个处理设5个重复,以不添加β-CP标准溶液作为空白对照,混匀静置30 min后进行提取和净化[17-18],通过HPLC测定,其回收率为82.5%~105.2%,相对标准偏差为3.8%~6.1%,方法准确可信,满足农药残留检测要求。
1.6 菌剂对高效氯氰菊酯的降解试验从华南农业大学教学实习农场取回菜地用土(未经烘烤、灭菌),用于室内模拟试验。按喷雾量0.075 L·m–2喷施36 mg·L–1 β-CP悬浮剂。48 h后,将制备菌剂兑水稀释100、1 000和2 000倍,按0.075 L·m–2用量喷雾,以喷施等量清水为空白对照,每个处理设3个重复。菌剂施用2 h后检测土壤中β-CP的原始沉积量,5 d后按“5点取样法”分析检测β-CP残留量,并计算降解率和相对降解率。
| ${\text{降解率}}=(1-w_{\rm T}/{w_0}) \times 100 {\text{%}}\,\, ,$ |
式中,wT为处理5 d后的残留量,w0为原始沉积量。
| ${\text{相对降解率}}=(1-w_{\rm T}/{w_{\rm {CK}}}) \times 100 {\text{%}}\,\, ,$ |
式中,wT和wCK分别为菌剂和空白对照处理5 d后土壤中β-CP残留量。
2 结果与分析 2.1 润湿剂的筛选加入润湿剂之后,复合菌粉的润湿时间明显缩短(表1)。以SDS为润湿剂的菌粉润湿时间最短,当添加质量分数为3%、5%和7%时,润湿时间分别为11.2、9.6和9.0 s;以洗衣粉为润湿剂的润湿时间次之,在添加质量分数为5%和7%时,用时分别为10.4和10.6 s;以SDBS为润湿剂时,耗时较长,与对照组相当,需要30.0 s以上。比较各润湿剂处理菌粉的芽孢含量,以SDBS为润湿剂时芽孢含量最高,其中,添加质量分数为5%的SDBS后,菌剂芽孢含量达到4.8×1013 cfu·g–1,与洗衣粉或SDS处理组均存在显著差异(P<0.05)。由于芽孢含量是衡量菌剂质量的重要指标,且其润湿时间(31.2 s)足以满足实际运用需要,因此,选择质量分数为5%的SDBS作为BSF01菌剂的润湿剂。
|
|
表 1 添加不同种类及质量分数润湿剂后BSF01菌剂的润湿时间和芽孢含量1) Table 1 The wetting time and spore intensity of strain BSF01 agent with different types and contents of wetting agents |
以阿拉伯树胶为分散剂的菌剂悬浮率最高(表2),当添加质量分数为7%时,悬浮率可高达77%;以PEG-8000或PVA为分散剂,菌剂悬浮率均低于60%,与阿拉伯树胶存在显著差异。同时,以阿拉伯树胶为分散剂的菌剂芽孢含量最高,当其添加质量分数为3%、5%和7%时,芽孢含量分别达到9.7×1012、10.0×1012和8.0×1012 cfu·g–1,因此综合考虑以不同分散剂处理的菌剂悬浮率及芽孢含量,选择以质量分数为7%的阿拉伯树胶为BSF01菌剂的分散剂。
|
|
表 2 添加不同种类及质量分数分散剂后BSF01菌剂的悬浮率和芽孢含量1) Table 2 The suspending rate and spore intensity of strain BSF01 agent with different types and contents of dispersants |
从图1中可以看出,在加入不同稳定剂后,各处理芽孢含量均随着时间延长而减少,最终趋于稳定。其中,以碳酸钙,磷酸氢二钾和羧甲基纤维素钠为稳定剂的菌粉复合物芽孢含量与对照组差异不大。当磷酸钾作为稳定剂时,芽孢含量明显高于其他处理,混合处理28 d后,芽孢含量达6.0×1012 cfu·g–1,因此,在菌粉中添加质量分数为4%的磷酸钾作为稳定剂。
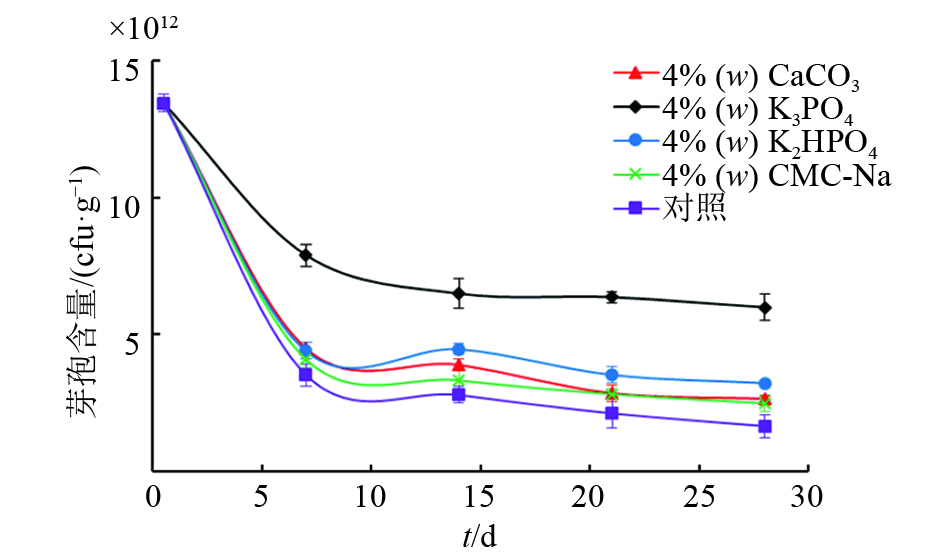
|
图 1 添加不同稳定剂后BSF01菌剂的芽孢含量 Figure 1 The spore intensity of strain BSF01 agent with different stabilizers |
由图2可知,紫外照射2 h内,各处理中芽孢含量普遍上升后下降,推测紫外辐射能激发枯草芽孢杆菌BSF01的紫外抗性。继续进行辐照10 h,各处理中芽孢含量均缓慢下降,其中,以质量分数为1.0%的糊精为紫外保护剂的菌剂芽孢含量高达30.5×1011 cfu·g–1,显著高于其他处理组。因此,选择以质量分数为1.0%的糊精为BSF01菌剂的紫外保护剂。

|
图 2 添加不同紫外保护剂后BSF01菌剂的芽孢含量 Figure 2 The spore intensity of strain BSF01 agent with different UV protectants |
通过配方筛选,确定了BSF01菌剂配方以及各组分质量分数:以30%菌粉为主体,添加5%SDBS为润湿剂,7%阿拉伯树胶粉为分散剂,4%磷酸钾为稳定剂及1%糊精为紫外保护剂,并加入载体高岭土补足100%。根据《农用微生物菌剂(GB 20287—2006)》检测标准,检测了BSF01菌剂的主要质量指标,结果表明,菌剂芽孢含量为6.50×1011 cfu·g–1,含水量(w)≤0.6%,细度≥99%,润湿时间为32.0 s,悬浮率达到78.0%,各项指标均符合国家标准。将BSF01菌剂稀释100、1 000及2 000倍后,芽孢含量为1.0×106~1.0×1010 cfu·g–1,将稀释菌剂投入初始质量浓度为50 mg·L–1的β-CP溶液中,培养处理后7 d后,各处理中β-CP残留均大幅降低(图3),其中,以100及1 000倍菌剂稀释液处理5 d后,β-CP的残留质量浓度不足5 mg·L–1,降解率达到90%以上,说明该菌剂对β-CP残留表现出显著的消解效果。
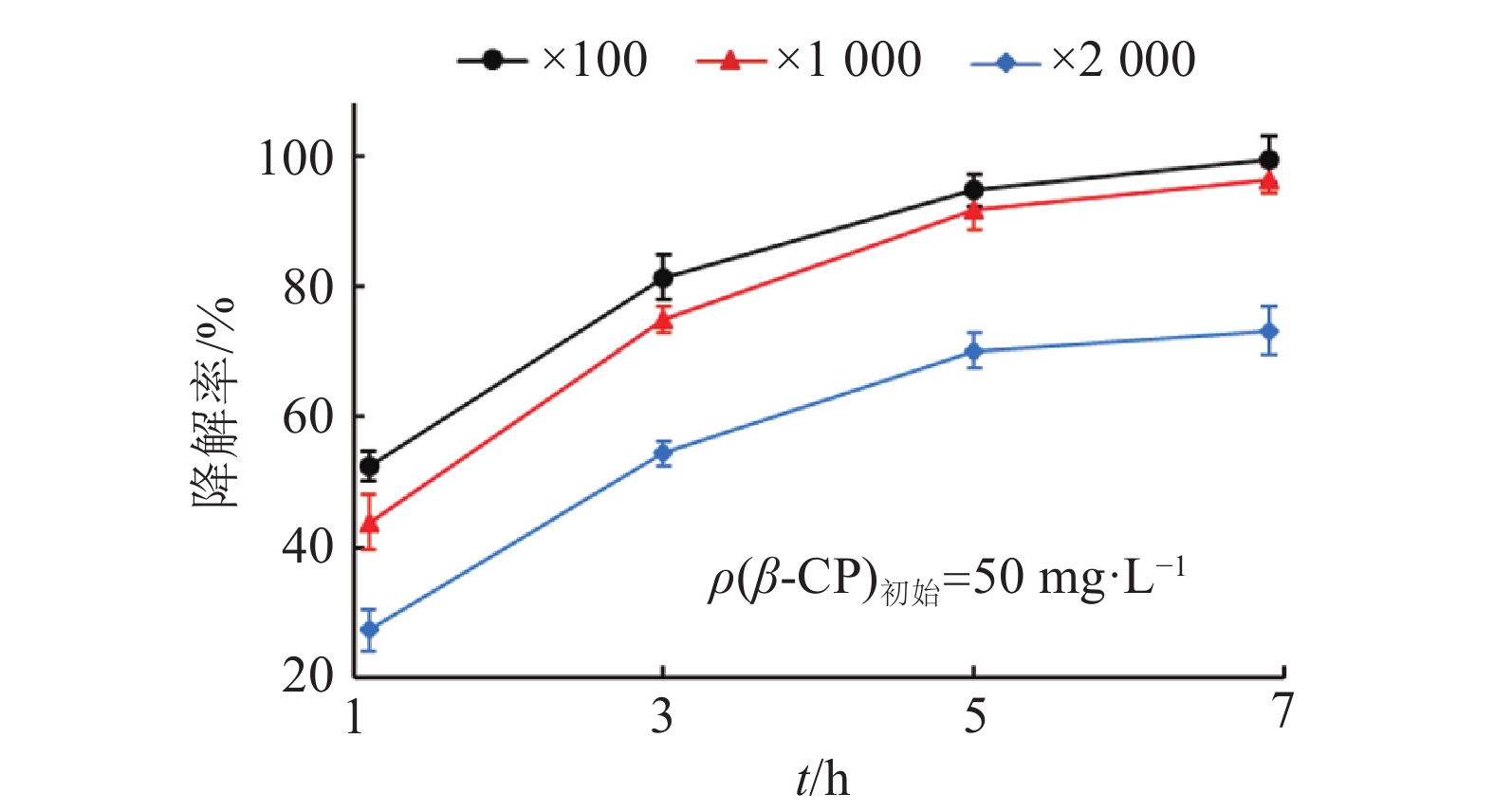
|
图 3 不同稀释倍数的BSF01菌剂对β-CP的降解效果 Figure 3 The degradation of β-CP by strain BSF01 agent with different dilution |
在室内模拟条件下,将36 mg·kg–1 β-CP施用土壤2 d后,喷施BSF01菌剂100、1 000和2 000倍稀释液,经HPLC分析,各处理中β-CP原始沉积量分别为5.71、6.13和8.71 mg·kg–1。5 d后取样检测,土壤中β-CP残留量分别为0.03、0.11和0.21 mg·kg–1,降解率达到99.47%、98.37%和97.70%,降解效果显著(图4)。相较于5 d后空白对照的残留量(0.24 mg·kg–1),各稀释菌剂处理间差异明显,相对降解率分别为87.50%、58.33%和16.67%,表明该菌剂对土壤中β-CP具有快速、高效的降解效果,且降解能力与菌剂的使用剂量相关,具有进一步优化应用潜力。
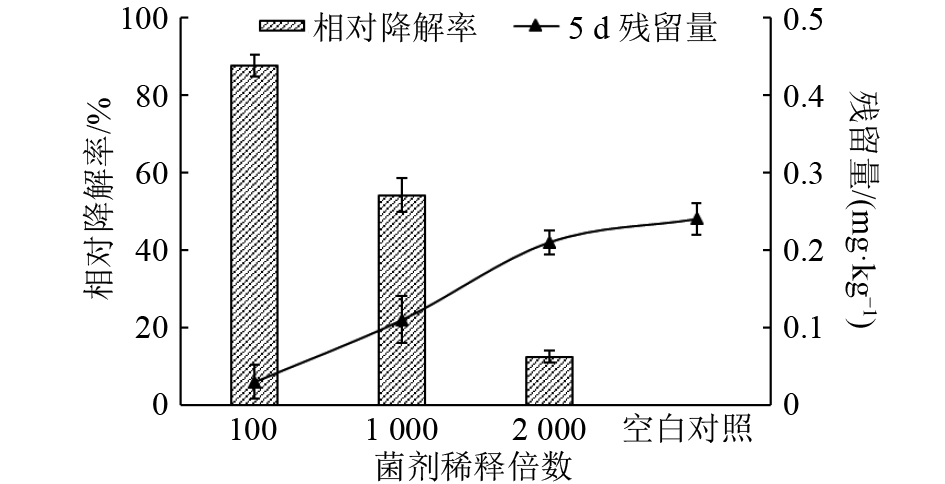
|
图 4 BSF01菌剂对土壤β-CP残留的降解效果 Figure 4 The degradation of β-CP residue in soil by strain BSF01 agent |
随着有机氯、有机磷等高毒农药的禁用,高效低毒广谱的拟除虫菊酯类农药在农业生产中得以广泛使用。然而,一味追求产量及防效的传统耕作理念使得不规范、不科学、不合理施用农药的现象普遍存在,导致了日益严重的农药残留污染问题,对作物生长安全、农产品安全、生态环境安全造成了极大威胁,已成为科研工作者亟待解决的具有重要经济和社会意义的重大问题。利用微生物对外源污染物的代谢作用,有效降低或消除环境中农药残留污染已成为现代农业科学的研究热点[19]。微生物制剂中的助剂性质决定着菌剂的各项初始理化性质[17, 20-21],因此,本研究通过单因素试验法,对β-CP降解菌剂的助剂成分进行筛选及优化,确保制剂有效成分的生物活性,得到了枯草芽孢杆菌BSF01菌剂的最佳配方以及各组分质量分数:以30% BSF01菌粉为主体,添加5%SDBS,7%阿拉伯树胶,4%磷酸钾,1%糊精,并添加高岭土补足100%。经检验,该配方制备的菌剂芽孢含量为6.50×1011 cfu·g–1,含水量(w)≤0.6%,细度≥99%,润湿时间为32.0 s,悬浮率达到78.0%,各项指标均符合国家标准。
降解菌剂对环境中农药残留蓄积污染的修复是微生物制剂研发的最终目标[18, 22]。本研究通过室内模拟试验,将BSF01菌剂投入受β-CP残留污染的土壤中,可在短期内有效降低β-CP残留水平,初步验证了该菌剂的田间适用性。值得注意的是,实际田间环境中存在多种可能影响菌剂降解效果的因素,今后需明确各因素的潜在影响,并通过优化配方、改良施用方式等途径,保障BSF01菌剂的实际运用效果。另外,供试降解菌剂对β-CP残留的降解效果,主要与该菌剂的稀释倍数相关。试验中,当菌剂稀释倍数为100倍时,可迅速降低土壤中β-CP残留含量,相对降解率达到87.50%,高于该菌剂的1 000倍及2 000倍稀释液。因此,今后仍需深入研究降解效率与稀释倍数之间的关系,并从残留污染水平及使用方式等方面指导该菌剂的实践使用。本研究结果表明,β-CP降解菌株BSF01菌剂制备方法简便、性质稳定、实践应用效果良好,具有产业化运用的前景,值得进一步研究开发。然而,本研究仅测定了供试菌剂对β-CP的降解效果,对于其他菊酯类农药残留污染的降解效果仍有待进一步深入研究。
| [1] |
KOLACZINSKI J H, CURTIS C F. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: A review of the debate[J]. Food Chem Toxicol, 2004, 42(5): 697-706. DOI:10.1016/j.fct.2003.12.008 (  0) 0) |
| [2] |
CASIDA J E. Pyrethrum flowers and pyrethroid insecticides[J]. Environ Health Persp, 1980, 34: 189-202. DOI:10.1289/ehp.8034189 (  0) 0) |
| [3] |
XIAO Y, CHEN S, GAO Y, et al. Isolation of a novel beta-cypermethrin degrading strain Bacillus subtilis BSF01 and its biodegradation pathway
[J]. Appl Microbiol Biot, 2015, 99(6): 2849-2859. DOI:10.1007/s00253-014-6164-y (  0) 0) |
| [4] |
FIELD L M, EMYR DAVIES T G, O’REILLY A O, et al. Voltage-gated sodium channels as targets for pyrethroid insecticides[J]. Eur Biophys J, 2017, 46(7): 675-679. DOI:10.1007/s00249-016-1195-1 (  0) 0) |
| [5] |
HANSEN M R H, J RS E, LANDER F, et al. Neurological deficits after long-term pyrethroid exposure[J]. Environ Health Insights, 2017. DOI:10.1177/1178630217700628 (  0) 0) |
| [6] |
JOHNSTONE A F M, STRICKLAND J D, CROFTON K M, et al. Effects of an environmentally relevant mixture of pyrethroid insecticides on spontaneous activity in primary cortical networks on microelectrode arrays[J]. Neurotoxicology, 2017, 60: 234-239. DOI:10.1016/j.neuro.2016.05.005 (  0) 0) |
| [7] |
CORCELLAS C, ELJARRAT E, BARCEL D. First report of pyrethroid bioaccumulation in wild river fish: A case study in Iberian river basins (Spain)[J]. Environ Int, 2015, 75: 110-116. DOI:10.1016/j.envint.2014.11.007 (  0) 0) |
| [8] |
MUGGELBERG L L, HUFF HARTZ K E, NUTILE S A, et al. Do pyrethroid-resistant Hyalella azteca have greater bioaccumulation potential compared to non-resistant populations? Implications for bioaccumulation in fish
[J]. Environ Pollut, 2017, 220(Pt A): 375-382. (  0) 0) |
| [9] |
HUGHES M F, ROSS D G, STARR J M, et al. Environmentally relevant pyrethroid mixtures: A study on the correlation of blood and brain concentrations of a mixture of pyrethroid insecticides to motor activity in the rat[J]. Toxicology, 2016, 359/360: 19-28. DOI:10.1016/j.tox.2016.06.013 (  0) 0) |
| [10] |
AZNAR-ALEMANY Ò, ELJARRAT E, BARCEL D. Effect of pyrethroid treatment against sea lice in salmon farming regarding consumers’ health[J]. Food Chem Toxicol, 2017, 105: 347-354. DOI:10.1016/j.fct.2017.04.036 (  0) 0) |
| [11] |
CYCOŃ M, PIOTROWSKA-SEGET Z. Pyrethroid-degrading microorganisms and their potential for the bioremediation of contaminated soils: A review[J]. Front Microbiol, 2016. DOI:10.3389/fmicb.2016.01463 (  0) 0) |
| [12] |
TRAN N H, URASE T, NGO H H, et al. Insight into metabolic and cometabolic activities of autotrophic and heterotrophic microorganisms in the biodegradation of emerging trace organic contaminants[J]. Bioresource Technol, 2013, 146(10): 721-731. (  0) 0) |
| [13] |
CYCOŃ M, MROZIK A, PIOTROWSKA-SEGET Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil: A review[J]. Chemosphere, 2017, 172: 52-71. DOI:10.1016/j.chemosphere.2016.12.129 (  0) 0) |
| [14] |
XIAO Z J, LIU P H, QIN J Y, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J]. Appl Microbiol Biot, 2007, 74(1): 61-68. DOI:10.1007/s00253-006-0646-5 (  0) 0) |
| [15] |
中华人民共和国国家质量监督检验检疫总局. 农药可湿性粉剂润湿性测定方法: GB/T 5451—2001[S]. 北京: 中国标准出版社, 2001.
(  0) 0) |
| [16] |
中华人民共和国国家质量监督检验检疫总局. 农用微生物菌剂: GB 20287—2006[S]. 北京: 中国标准出版社, 2006.
(  0) 0) |
| [17] |
LIU J, HUANG W, HAN H, et al. Characterization of cell-free extracts from fenpropathrin-degrading strain Bacillus cereus ZH-3 and its potential for bioremediation of pyrethroid-contaminated soils
[J]. Sci Total Environ, 2015, 523: 50-58. DOI:10.1016/j.scitotenv.2015.03.124 (  0) 0) |
| [18] |
CHEN S, CHANG C, DENG Y, et al. Fenpropathrin biodegradation pathway in Bacillus sp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils
[J]. J Agr Food Chem, 2014, 62(10): 2147-2157. DOI:10.1021/jf404908j (  0) 0) |
| [19] |
FERNANDEZ-FONTAINA E, PINHO I, CARBALLA M, et al. Biodegradation kinetic constants and sorption coefficients of micropollutants in membrane bioreactors[J]. Biodegradation, 2013, 24(2): 165-177. DOI:10.1007/s10532-012-9568-3 (  0) 0) |
| [20] |
DUAN H, KOE L C C, YAN R, et al. Biological treatment of H2S using pellet activated carbon as a carrier of microorganisms in a biofilter
[J]. Water Res, 2006, 40(14): 2629-2636. DOI:10.1016/j.watres.2006.05.021 (  0) 0) |
| [21] |
ZHU S M, DENG Y L, RUAN Y J, et al. Biological denitrification using poly(butylene succinate) as carbon source and biofilm carrier for recirculating aquaculture system effluent treatment[J]. Bioresource Technol, 2015, 192: 603-610. DOI:10.1016/j.biortech.2015.06.021 (  0) 0) |
| [22] |
WEN D, ZHANG J, XIONG R, et al. Bioaugmentation with a pyridine-degrading bacterium in a membrane bioreactor treating pharmaceutical wastewater[J]. J Environ Sci, 2013, 25(11): 2265-2271. DOI:10.1016/S1001-0742(12)60278-2 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


