相对于弱毒活疫苗,灭活疫苗安全性更好,但很难诱导细胞免疫反应。研究证明,使用免疫增强剂能够有效提升灭活疫苗的细胞免疫指标从而提高疫苗的保护效果[1]。免疫增强剂是一类单独或与抗原配合使用,通过提升机体免疫系统对抗原或免疫原的免疫应答反应或改变免疫应答类型,从而增强动物机体免疫应答的物质。自1925年法国免疫学家拉蒙(Gaston Ramon)发现在疫苗中加入某些物质可以特异性地增强机体的免疫应答反应以来,医学和兽医学界对免疫增强剂开展了不同程度的研究,兽用疫苗中一部分免疫增强剂如猪支原体疫苗佐剂Amphigen®等已经商品化[2]。细胞因子作为一种重要的免疫调节因子,在机体免疫网络中发挥着重要的传递信号的作用,可以作为疫苗免疫效果的评价指标之一[3]。
盐酸左旋咪唑(Levamisole hydrochloride,LH)作为驱虫剂使用,具有免疫调节功能,是一种使用范围较广的免疫增强剂[4-5]。刀豆素(Concanavalin A,ConA)具有广谱抗病毒作用,对细菌性疾病也有治疗作用[6-7]。胞壁酰二肽(Muramyl dipeptide,MDP)具有很强的佐剂活性,能增强体液免疫和细胞免疫,提高疫苗、菌苗、病毒亚单位及寄生虫苗的保护力[8-9]。因此,本研究以这3种免疫增强剂为材料进行免疫效果的对比。
本试验以猪伪狂犬灭活疫苗为例,在小鼠模型上进行免疫效果评估,为后续筛选复合免疫增强剂及进行猪体试验提供参考。
1 材料与方法 1.1 试验动物18~22 g 4周龄雌性昆明小鼠,购于南方医科大学实验动物中心。
1.2 试验材料猪伪狂犬病毒(Psuedorabies virus,PRV)强毒株QY株[10]为华南农业大学兽医学院传染病教研室保存,病毒效价为108.5TCID50·mL–1;LH、ConA和MDP分别购自广州昂科生物科技有限公司、天行健生物科技有限公司和湖北拓楚慷元医药化工有限公司。
1.3 试剂和试剂盒DMEM高糖细胞培养液、w为0.25%的细胞胰酶消化液、胎牛血清和PRV的ELISA抗体检测试剂盒均购自武汉科前生物股份有限公司;小鼠白介素2(IL-2)、白介素4(IL-4)和干扰素γ(IFN-γ)的ELISA检测试剂盒均购自欣博盛生物科技有限公司;HRP标记羊抗鼠二抗购自bioWORLD公司;白油、SPAN–80、硬脂酸铝、吐温–80和其他常用试剂均为国产分析纯。
1.4 免疫增强剂剂量确定在预备试验中,每种药物设计低、中、高剂量进行小鼠的免疫增强试验(表1),筛选出各免疫增强剂作为灭活疫苗免疫增强剂的最佳应用剂量,分别为:LH 7.5 mg·mL–1、ConA 25.0 mg·mL–1、MDP 150.0 mg·mL–1。
|
|
表 1 3种免疫增强剂剂量设计 Table 1 Dose designs of three immunopotentiators |
灭活疫苗制备参照裴春生等[11]的方法,具体制备步骤为:将增强剂混入含灭活PRV病毒的水相,然后与油相乳化,使免疫增强剂的最终剂量为设计剂量,制成相应的灭活疫苗。其中水相灭活后抗原剂量为63.94 ng·L–1。
1.6 小鼠分组与免疫将25只SPF级雌性昆明小鼠随机分成5组,每组5只,设对照组、白油组和免疫增强剂组。3种免疫增强剂各成1组,即LH低剂量组、ConA低剂量组和MDP高剂量组。
免疫程序:白油组和免疫增强剂组在每只小鼠腿部肌肉注射100 μL相应的灭活疫苗,对照组在相同部位注射100 μL PBS缓冲液,14 d后二次免疫。各组小鼠分别于首次免疫后14 d,二次免疫后7、14 d断尾采血,用ELISA试剂盒检测血清中各细胞因子(IL-2、IL-4和IFN-γ)含量变化和PRV特异性抗体水平。二次免疫后14 d攻毒,每只小鼠腹腔注射100 μL 105 LD50PRV强毒株,观察小鼠生活状态,记录死亡时间并计算攻毒保护率。
1.7 小鼠血清细胞因子含量与PRV抗体水平检测 1.7.1 小鼠血清IL-2 、IL-4及IFN-γ含量测定密封的孔板恢复室温后,解封;设置空白孔、标准孔和样品孔,空白孔加100 μL标准品和标本通用稀释液,标准孔加相应的标准品,样品孔加20 μL样品和 80 μL稀释液,用封板胶纸将反应孔封住,37 ℃温箱孵育 90 min,然后用洗涤液洗板5次,拍干;空白孔加100 μL生物素化抗体稀释液,标准孔和样品孔加100 μL生物素化抗体工作液,用新封板胶纸将反应孔封住,37 ℃温箱孵育60 min,用洗涤液洗板5次,拍干;空白孔加100 μL酶结合物稀释液,标准孔和样品孔加100 μL酶结合物工作液,用新封板胶纸封住反应孔,37 ℃温箱避光孵育30 min,用洗涤液洗板5次,拍干;提前打开酶标仪电源,仪器预热,并设置检测程序,每孔加100 μL显色底物(TMB),37 ℃温箱避光孵育15 min,每孔加100 μL终止液,混匀后立即测量孔板的D450 nm值。
1.7.2 小鼠血清PRV抗体水平检测将PRV的ELISA抗体检测试剂盒中的二抗换成HRP–羊抗鼠IgG来测定小鼠血清中的PRV抗体,经试验,二抗最适稀释度为1︰8 000,同时将原有AB液显色更换为TMB显色,测D450 nm值。具体检测步骤如下:按照需求数量拆抗原包被板,稀释好的待检血清样品和对照血清各取100 μL加入抗原包被板孔中,待检样品设1孔,阴性、阳性对照各设2孔,轻轻震荡孔板,使孔中样品混匀,置于37 ℃温箱温育45 min;弃孔中液体,每孔加300 μL洗涤液,静置3 min后弃洗涤液,在吸水纸上拍干,共计洗涤5次;每孔加稀释度为 1︰8 000的HRP–羊抗鼠IgG 100 μL,置37 ℃温箱温育30 min;弃孔中液体,每孔加300 μL洗涤液,静置3 min后弃洗涤液,在吸水纸上拍干,共计洗涤 5 次;每孔加显色液(TMB) 100 μL,混匀后在37 ℃温箱避光显色10 min;每孔加50 μL终止液,10 min内测定D450 nm值。因二抗更换,检测结果为抗体滴度,用D450 nm值表示。
1.8 数据分析数据均以平均值±标准差表示,用SPSS 17.0软件进行统计分析比较。处理间差异显著性分析采用t检验法,以P<0.01或P<0.05为有显著差异。
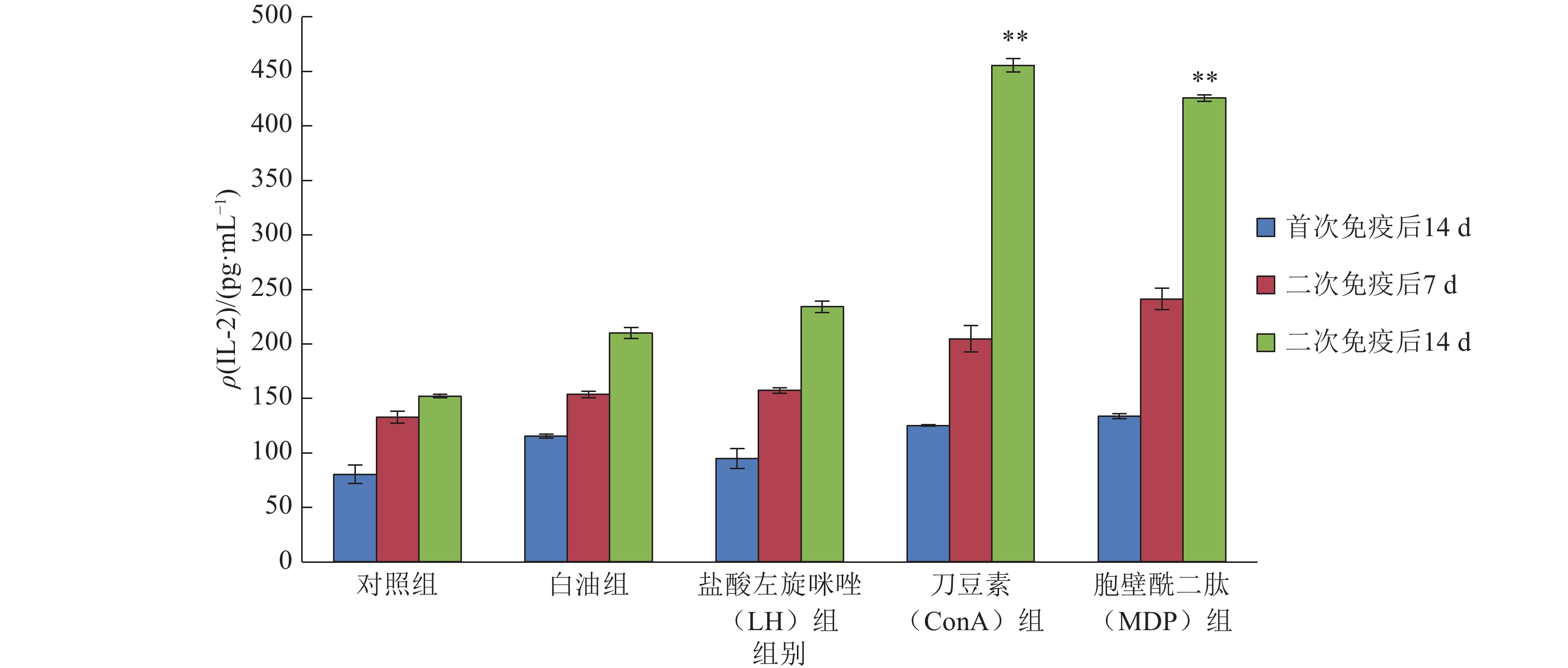
2 结果与分析 2.1 小鼠血清IL-2含量从图1可看出,各组小鼠血清中IL-2含量均随时间推移而增加。以二次免疫后14 d做比较,相对于对照组,白油组和免疫增强剂组对小鼠血清中IL-2含量提升效果明显;相对于白油组,ConA组和MDP组对小鼠血清中IL-2含量提升效果极显著(P<0.01),其中,ConA组小鼠血清IL-2含量为455.58 pg·mL–1,MDP组IL-2含量为425.41 pg·mL–1,LH组对IL-2含量的提升效果不明显。
|
图 1 小鼠血清中IL-2含量 Figure 1 The content of IL-2 in mouse serum 相同颜色柱子上“**”表示与白油组相比,差异达到0.01的显著水平(t检验) |
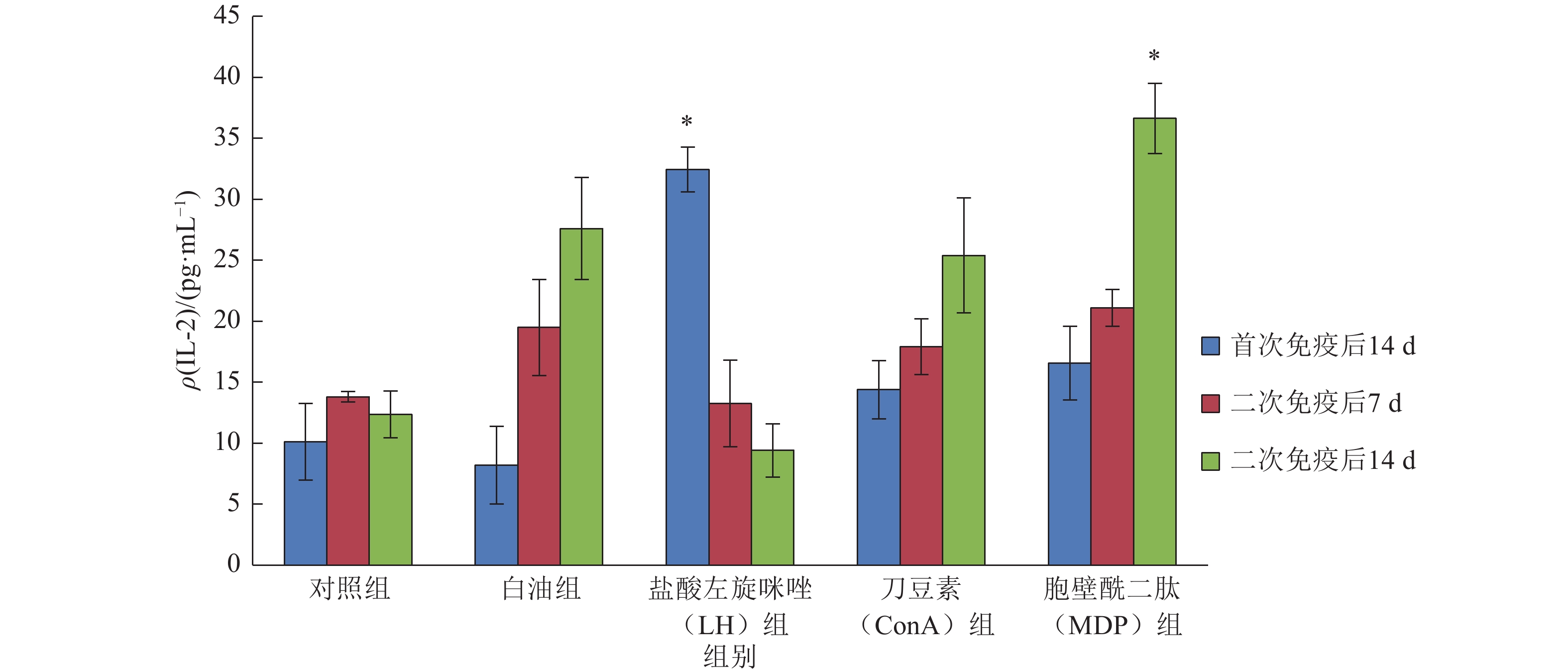
从图2可看出,白油组和免疫增强剂组对小鼠血清中IL-4含量均有提升效果。LH组在首次免疫后14 d提升效果最佳, 相比其他组差异显著(P<0.05),IL-4含量为32.43 pg·mL–1,二次免疫后14 d恢复到正常水平。白油组、ConA组和MDP组的提升效果在二次免疫后14 d较好,且MDP组效果最优,相对于白油组有显著提升(P<0.05),IL-4含量为36.63 pg·mL–1。
|
图 2 小鼠血清中IL-4含量 Figure 2 The content of IL-4 in mouse serum 相同颜色柱子上“*”表示与白油组相比,差异达到0.05的显著水平(t检验) |
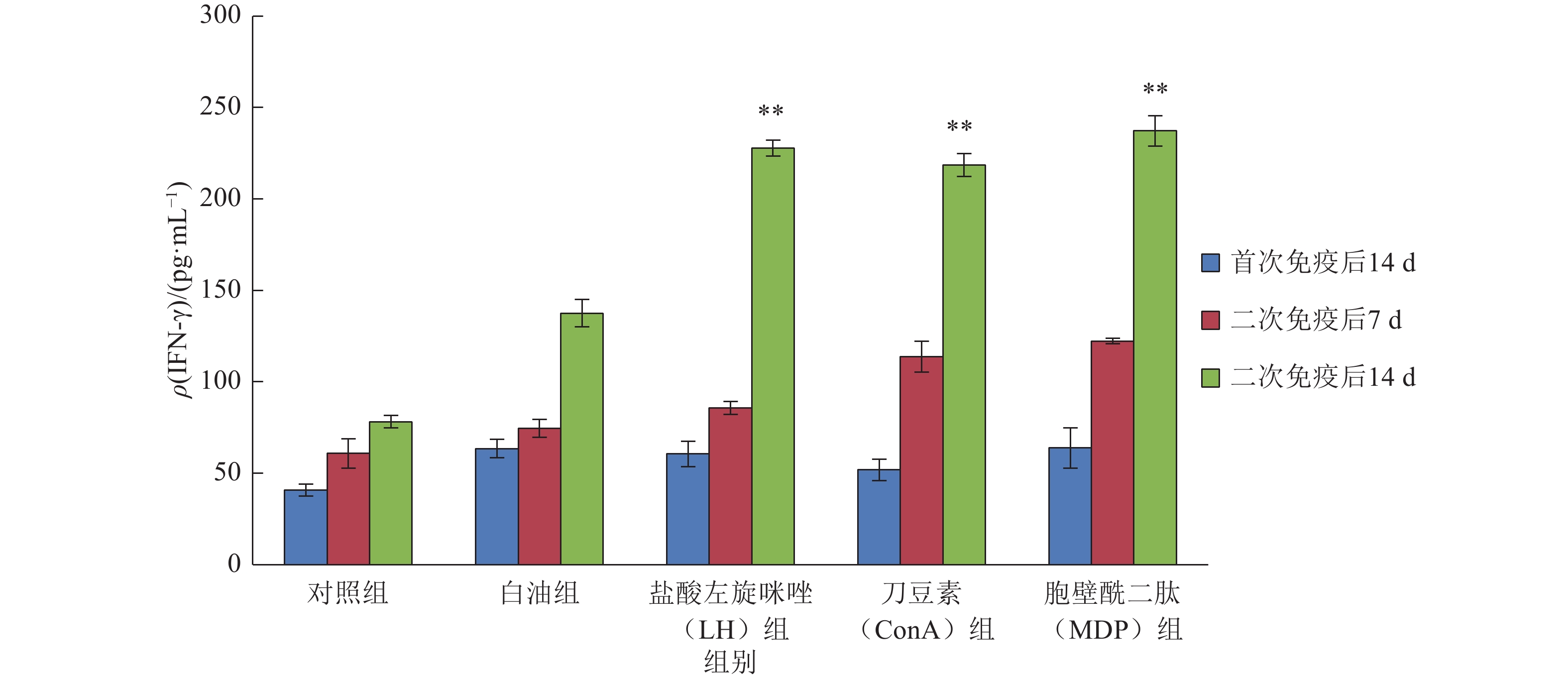
从图3可看出,各组小鼠血清中IFN-γ含量随时间呈递增趋势,二次免疫后14 d,白油组和免疫增强剂组提升效果明显。相对于白油组,免疫增强剂组提升效果极显著(P<0.01),含量分别为LH组227.88 pg·mL–1、ConA组218.42 pg·mL–1、MDP组237.16 pg·mL–1,免疫增强剂组组间提升效果差异不明显。
|
图 3 小鼠血清中IFN-γ含量 Figure 3 The content of IFN-γ in mouse serum 相同颜色柱子上“**”表示与白油组相比,差异达到0.01的显著水平(t检验) |
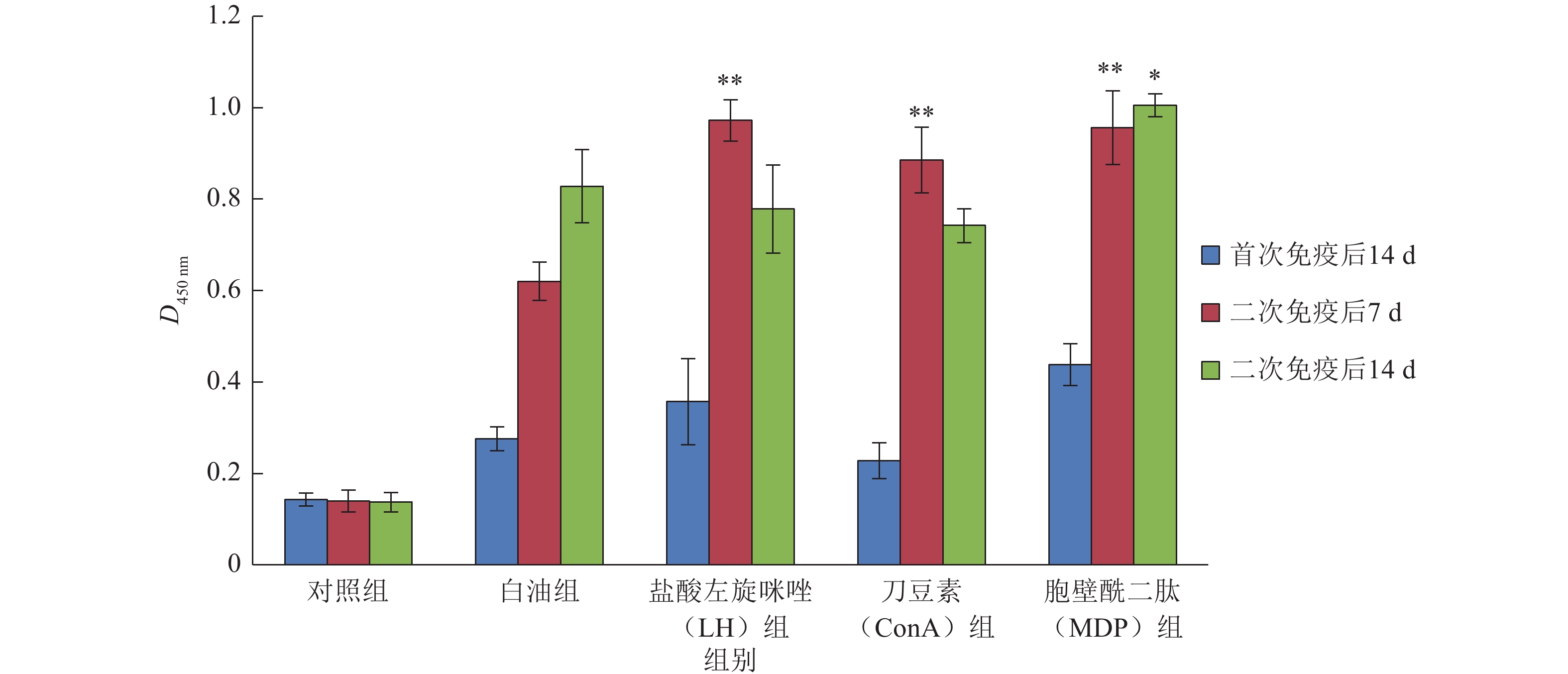
从图4可看出,相对于对照组,白油组和免疫增强剂组抗体水平均有明显提高,且免疫增强剂组效果较优。二次免疫后7 d,免疫增强剂组抗体水平较白油组提升极显著(P<0.01),LH和MDP组效果优于ConA组,此时各组D450 nm值分别为LH组0.972、ConA组0.885、MDP组0.956。二次免疫后14 d,白油组和MDP组抗体含量达较高水平,LH组和ConA组抗体水平较二次免疫后7 d有所下降且低于白油组,此时所有组别中,MDP组对抗体含量提升效果最好,D450 nm值为1.005,较白油组提升效果显著(P<0.05)。
|
图 4 小鼠血清中猪伪狂犬病毒抗体含量 Figure 4 The content of pseudorabies virus antibody in mouse serum 相同颜色柱子上“*”、“**”分别表示与白油组相比,差异达到0.05、0.01的显著水平(t检验) |
试验过程中以小鼠是否出现奇痒、废食以及被毛糙乱等症状判定发病与否。
从表2可看出,攻毒后,对照组、白油组和ConA组小鼠全部发病,LH组和MDP组发病率较低。对照组小鼠死亡速度最快,72 h内全部死亡。相对于免疫增强剂组,白油组小鼠死亡速度稍快,120 h内全部死亡。LH组和ConA组最终存活率一致,但ConA组发病率高于LH组。MDP组效果最好,发病率最低,小鼠死亡速度最慢,存活率最高。
|
|
表 2 添加了免疫增强剂的猪伪狂犬灭活疫苗的攻毒保护率 Table 2 The attack protective rates of pseudorabies virus inactivated vaccines containing immunopotentiators |
本研究在猪伪狂犬灭活疫苗中加入所选的3种免疫增强剂,使用文中所述剂量均有较好的免疫增强效果。免疫增强剂组在提升抗体水平的速度和质量上明显优于白油组,说明所选免疫增强剂与猪伪狂犬灭活疫苗联用后可以刺激机体产生更强的体液免疫应答,使机体产生更多的特异性抗体。除此之外,相对于白油组,小鼠血清中IL-2、IL-4、IFN-γ和PRV抗体含量明显升高,说明所选免疫增强剂与疫苗联用能增强机体的细胞免疫应答,IFN-γ等细胞因子含量的提高使CD4+/CD8+ T细胞数量增多,从而增强机体抗病毒感染的能力[12]。
机体Th1细胞主要分泌IL-2、IL-12、IL-15、IL-18、TNF-α和IFN-γ等细胞因子,具有激活巨噬细胞并增强吞噬病原微生物的能力。Th2细胞主要分泌IL-4、IL-5、IL-6、IL-10及IL-13等细胞因子,具有促进嗜酸性粒细胞激活和分化的能力。Th1和Th2细胞分泌的细胞因子在体内具交互抑制作用。Thl分泌的IFN-γ等细胞因子可促进Thl型细胞的增殖分化,却抑制Th2型细胞的分化;Th2细胞分泌的IL-4也会抑制Thl型细胞的生成[13]。本研究LH组首次免疫后14 d小鼠血清中IL-4含量明显高于ConA组和MDP组,而IL-2含量提升速度较慢;ConA组和MDP组小鼠血清中IL-4含量提升速度较慢,而IL-2含量提升速度较快,这可能与Th1和Th2细胞分泌的细胞因子的相互调节有关[3]。
攻毒保护率可以最直观地评价免疫增强剂和疫苗的免疫效果。本研究3种免疫增强剂均能在一定程度上提高疫苗的攻毒保护率,其中MDP组效果最优,显著降低发病率和死亡率,这可能与免疫增强剂组小鼠相应细胞因子及抗体水平的提升相关。LH组和ConA组攻毒保护效果较差,可能与后期特异性抗体水平下降有关,推测LH和ConA可能会影响油乳疫苗的稳定性,从而导致疫苗抗体水平下降较快,其中机理有待探讨。
总体来说,所选3种免疫增强剂在各自最佳使用剂量与猪伪狂犬灭活疫苗联用的效果明显优于常规免疫,其中MDP的免疫增强效果最好,且本试验使用剂量在小鼠上未出现相关毒副作用,证明3种免疫增强剂具有应用前景。本研究为后续复合免疫增强剂筛选打下了基础。
| [1] |
AKIRA S, TAKEDA K, KAISHO T. Toll-like receptors: Critical proteins linking innate and acquired immunity[J]. Nat Immunol, 2001, 2(8): 675-680. DOI:10.1038/90609 (  0) 0) |
| [2] |
KRISTENSEN C S, ANDREASEN M, ERSBØLL A K, et al. Antibody response in sows and piglets following vaccination against Mycoplasma hyopneumoniae, toxigenic Pasteurella multocida, and Actinobacillus pleuropneumoniae
[J]. Can J Vet Res, 2004, 68(1): 66-70. (  0) 0) |
| [3] |
FISCHER T, BÜTTNER M, RZIHA H J. T helper 1-type cytokine transcription in peripheral blood mononuclear cells of pseudorabies virus (Suid herpesvirus 1)-primed swine indicates efficient immunization
[J]. Immunology, 2000, 101(3): 378-387. DOI:10.1046/j.1365-2567.2000.00124.x (  0) 0) |
| [4] |
李向东, 王莹, 苏培, 等. 盐酸左旋咪唑栓免疫调节作用的临床观察[J]. 天津药学, 2000, 12(2): 44-45. (  0) 0) |
| [5] |
牛华星, 李淑花, 张传津, 等. 盐酸左旋咪唑–维生素E可溶性粉对鸡免疫功能增强作用研究[J]. 山东畜牧兽医, 2009, 30(8): 3-5. (  0) 0) |
| [6] |
陈华良. 一种动物复合免疫增强剂的研制[D]. 广州: 华南农业大学, 2016.
(  0) 0) |
| [7] |
翁梅悦, 银少华, 欧盛绘, 等. 猪场常见重要病毒性疫病临床诊断与防控概要[J]. 畜牧兽医, 2017, 326(2): 90-92. (  0) 0) |
| [8] |
YOO Y C, YOSHIMATSU K, KOIKE Y, et al. Adjuvant activity of muramyl dipeptide derivatives to enhance immunogenicity of a hantavirus-inactivated vaccine[J]. Vaccine, 1998, 16(2/3): 216-224. (  0) 0) |
| [9] |
田世昭. 分枝杆菌的佐剂活性与菌株[J]. 国外医学 (生物制品学分册), 1982(1): 23. (  0) 0) |
| [10] |
陈华良, 王和兴, 李小鹏, 等. 广东地区猪伪狂犬病流行病学调查与gE、TK基因遗传进化分析
[J]. 广东畜牧兽医科技, 2016, 41(2): 5-9. (  0) 0) |
| [11] |
裴春生, 何玉友, 李群, 等. 油乳剂疫苗中硬脂酸铝含量与油相水相比例关系研究[J]. 中国兽药杂志, 2005, 39(2): 21-23. (  0) 0) |
| [12] |
TANG Y, LU J, WU P, et al. Inactivated vaccine with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens[J]. Vet Microbiol, 2014, 172(1/2): 120-128. (  0) 0) |
| [13] |
司兴奎, 郭鑫, 杨汉春. 猪圆环病毒2型感染后猪外周血淋巴细胞IL-2、IL-4、IL-10、IL-12p40、IFN-γ和TNF-α mRNA转录的变化[J]. 畜牧兽医学报, 2009, 40(1): 78-82. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


