2. 四川农业大学 动物科技学院,四川 温江 611130
2. College of Animal Science and Technology, Sichuan Agricultural University, Wenjiang 611130, China
鲁氏耶尔森氏菌Yersinia ruckeri属于肠杆菌科Enterobacteriaceae耶尔森氏菌属Yersinia,是鲑鳟鱼类的重要病原菌,其感染引起鲑鳟鱼的肠炎红嘴病(Enteric redmouth,ERM),主要病变特点为体表(尤其是嘴、鳍、泄殖孔)及内脏器官充血、出血等[1]。此外,该细菌还可感染鲢Hypophthalmichthys molitrix、鳙Aristichthys nobilis[2]、金鱼Carassius auratus、鲟鱼Acipenser sturio[3]、鲤鱼Cyprinus carpio、斑点叉尾鮰Ietalurus punetaus[4]等鱼类,引起败血症[5]。自1952年在美国首次从发病的虹鳟Oncorhynchus mykiss中分离到鲁氏耶尔森氏菌以来[6],相继在德国、法国、英国等欧洲各国,以及澳大利亚、中国均有所发现[7],其地理分布逐渐扩大,危害的鱼类种类也不断增多,给水产养殖造成了较为严重的威胁。
鲟鱼(Sturgeon)是地球上最古老的鱼种之一[8],因其具有极高的营养价值而成为一种重要的经济鱼类。我国自1992年引进该品种,现已推广到除西藏以外所有省市,至2015年,我国鲟鱼养殖产量已达90 828 t,成为全球最大的养鲟国家。但随着养殖集约化程度提高,养殖水体的内、外源污染加重,各种疾病频发,如维氏气单胞菌Aeromonas veronii[9]、嗜水气单胞菌Aeromonas hydrophila[10]、海豚链球菌Streptococcus iniae[11]等细菌性疾病时有报道,给我国鲟鱼养殖业造成严重损失。2016年4月四川省邛崃市某鲟鱼养殖场暴发一种以口腔周围出血,肛门红肿、外突和内脏器官不同程度出血为临床特征的传染病,死亡率达40%,发病水温16~20 ℃,发病鱼体质量100 g左右。本研究对病鱼进行病原菌镜检、分离、纯化及鉴定,同时进行了药敏试验、人工感染试验及病理损伤观察,旨在为该病的诊断与防治提供依据与参考。
1 材料与方法 1.1 试验动物与试剂发病杂交鲟Acipenser schrencki ♀×A. baeri♂采自四川省邛崃市某养殖场,体质量(102.7±8.5) g,健康杂交鲟体质量(124.5±10.3) g,购于彭州市某养殖场。
LB浸液培养基(北京欣经科生物技术有限公司)、细菌DNA提取试剂盒、DNA Marker和蛋白酶K[天根生化科技(北京)有限公司]、药敏试纸及细菌生化微量鉴定管(杭州微生物试剂有限公司)。
1.2 病原菌镜检与分离纯化取10尾濒死杂交鲟的鳃丝、消化道内含物、体表附着物等于载玻片上,进行寄生虫压片镜检;取肝、脾、肾等组织于载玻片上涂片,革兰氏染色后油镜检查细菌;无菌条件下,从病鱼肝、脾、肾取样划线接种于LB平板,28 ℃条件下恒温培养24~48 h,挑取形态大小一致的单个优势菌落在LB平板上,再次划线培养,获得纯培养菌株,观察菌落与细菌形态特征,–80 ℃条件下保存备用。
1.3 人工感染试验分离菌在LB平板上28 ℃条件下培养24 h,无菌生理盐水洗下菌苔,麦氏比浊法调节菌悬液浓度为2.8×105、2.8×106、2.8×107和2.8×108 cfu·mL–1,健康杂交鲟实验室暂养7 d后,每尾腹腔注射0.3 mL菌液,每组10尾,对照组注射等量生理盐水。接种后观察鱼的临床症状及死亡情况,连续观察14 d,并对死亡鱼及时剖检,且再次分离鉴定致病菌。
1.4 分离菌理化特性及药敏试验无菌挑取上述纯培养菌液于微量生化反应管,28 ℃条件下培养24 h,各种理化指标参照文献[12]进行测定。药敏试验采用标准Kriby-Bauer纸片扩散法,参照NCCLS抗微生物药物敏感性试验执行标准[13]进行。
1.5 分离菌gyrB基因与16S rRNA基因PCR扩增与测序分析将纯化菌株接种至LB肉汤中,28 ℃条件下培养24 h,使用细菌DNA提取试剂盒提取分离菌株的DNA作为模板,分别进行gyrB基因和16S rRNA基因的PCR扩增。gyrB基因扩增引物(F:5′-GAAGTCATCATGACCGTTCTGCA(TC)GC(TCAG)GG(TCAG)GG(TCAG)AA(AG)TT(TC)GA-3′;R:5′-AGCAGGGTACGGATGTGCGAGCC(AG) TC(TCAG)AC(AG)TC(TCAG)GC(AG)TC(TCAG)GTCAT-3′)[14],预期扩增片段大小约为1 200 bp;16S rRNA基因扩增引物(F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-TACGGCTACCTTGTTACGAC-3′)[15],预期扩增片段大小约为1 500 bp。PCR反应体系:PCR Master Mix(2x)12.5 μL、10 μmol·L–1的上下游引物各1 μL,2 μL模板DNA,加ddH2O至25 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min 45 s,共30个循环;最后,72 ℃延伸5 min。PCR扩增产物经10 g·L–1的琼脂糖凝胶电泳检测。PCR产物经DNA纯化试剂盒纯化后,送成都擎科梓熙生物技术有限公司测序。
1.6 组织病理学观察取患病鱼心、肝、脾、肾、鳃、肠和肌肉等组织,用体积分数为10%的中性甲醛溶液固定,石蜡包埋,常规切片,苏木精–伊红染色(HE染色),中性树胶封片,光学显微镜下观察并照相记录。
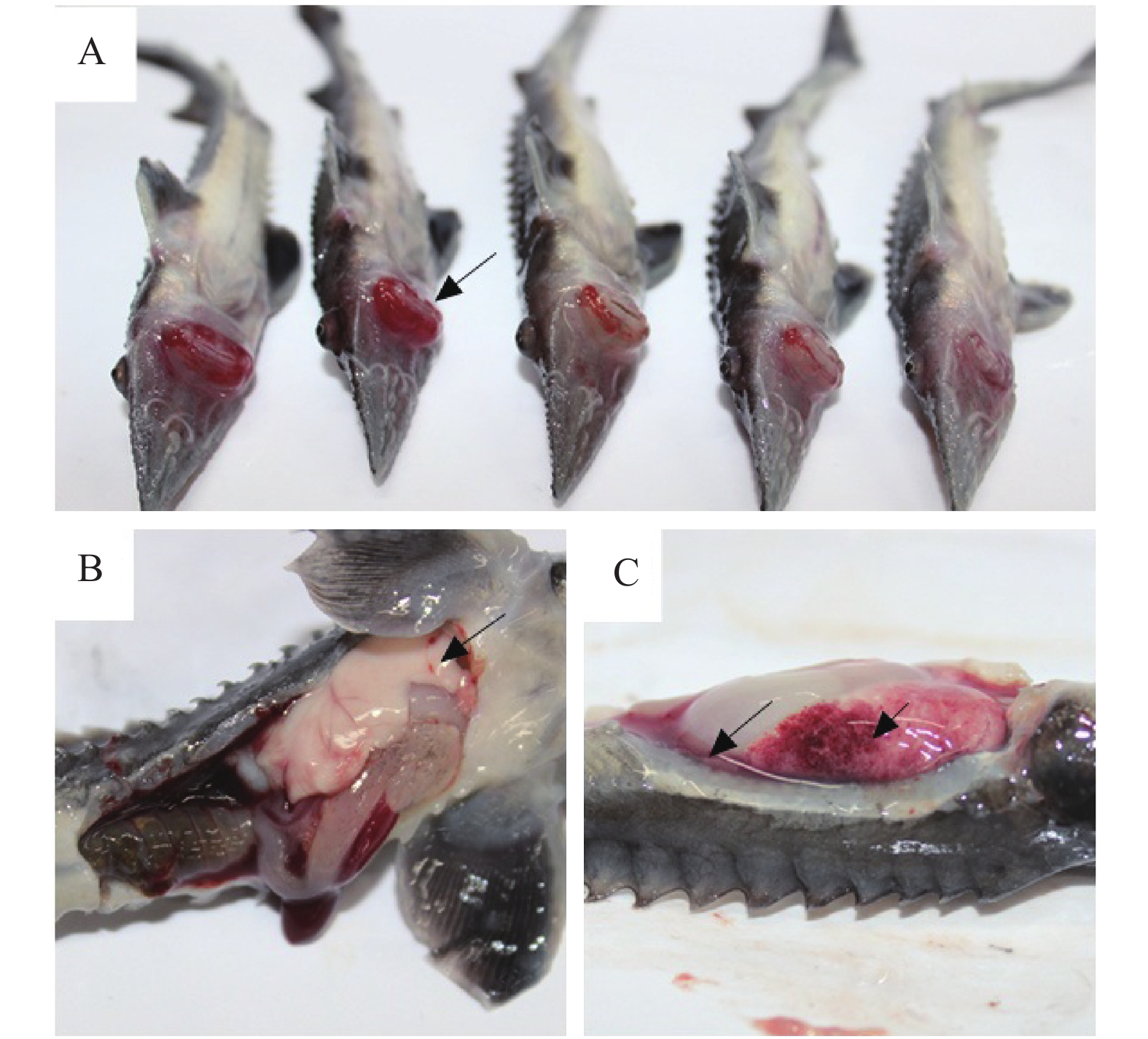
2 结果与分析 2.1 临床症状与剖检病鱼临床症状表现为体色变暗,食欲下降或丧失,嘴部红肿、出血(图1A),肛门红肿,外突;剖检见肝肿大,色白质脆,表面斑点状出血;肠壁变薄(图1B),肠腔内没有食物,充满大量淡黄色黏液;肾、脾肿大;鳃肿胀,黏液分泌增多,甚至发生坏死;部分病鱼腹腔内见一定量淡黄色腹水(图1C)。
|
图 1 患病杂交鲟鱼的临床特征 Figure 1 Clinical signs of diseased hybrid sturgeon A:嘴部出血;B:肝脏色白质脆,肠壁变薄;C:肝脏肿大,弥散性出血,腹水 |
鳃与内脏压片镜检未观察到寄生虫;内脏器官涂片,革兰氏染色镜检见组织内有单个或成对排列的革兰阴性短杆菌。无菌条件下从肝、肾、脾取样,划线接种于LB平板,28 ℃条件下培养24 h,获得表面光滑、隆起、边缘整齐、直径约为2 mm的乳白色圆形小菌落的优势菌(图2A),革兰氏染色后光学显微镜下观察分离菌为G–短杆菌,单个排列(图2B)。

|
图 2 纯化后的分离菌(A)及菌株YC160412的革兰染色形态(B) Figure 2 Purified bacteria (A) and gram staining micrograph (B) of strain YC160412 |
分离菌腹腔注射感染健康杂交鲟,攻毒12 h后,试验鱼安静,反应迟钝;2.8×108 cfu·mL–1浓度组在24 h后开始出现死亡,2.8×107、2.8×106与2.8×105 cfu·mL–1浓度组相继在32 h后开始死亡;发病鱼的临床表现和病理变化与自然发病鱼相似,感染5 d后各试验组鱼未再发生死亡;而对照组无任何异常,各组的死亡情况见表1。采用寇氏法得出分离菌对杂交鲟的半数致死量(LD50)为5.3×106 cfu·尾–1。从人工感染发病死亡的鱼体内再次分离细菌,获得与分离株形态、生化特性一致的细菌。
|
|
表 1 菌株YC160412人工感染杂交鲟的试验结果 Table 1 Experimental results of hybrid sturgeon artificially infected by strain YC160412 |
常规理化分析表明,分离菌株YC160412为革兰氏染色阴性,最适生长温度为22~28 ℃,最适pH为7.0,氧化酶反应阴性,氧化发酵阳性,具有运动性,其他生化特性见表2。
|
|
表 2 菌株YC160412与鲁氏耶尔森氏菌的理化特性比较1) Table 2 Comparisons of physicochemical characteristics of strain YC160412 with Yersinia ruckeri |
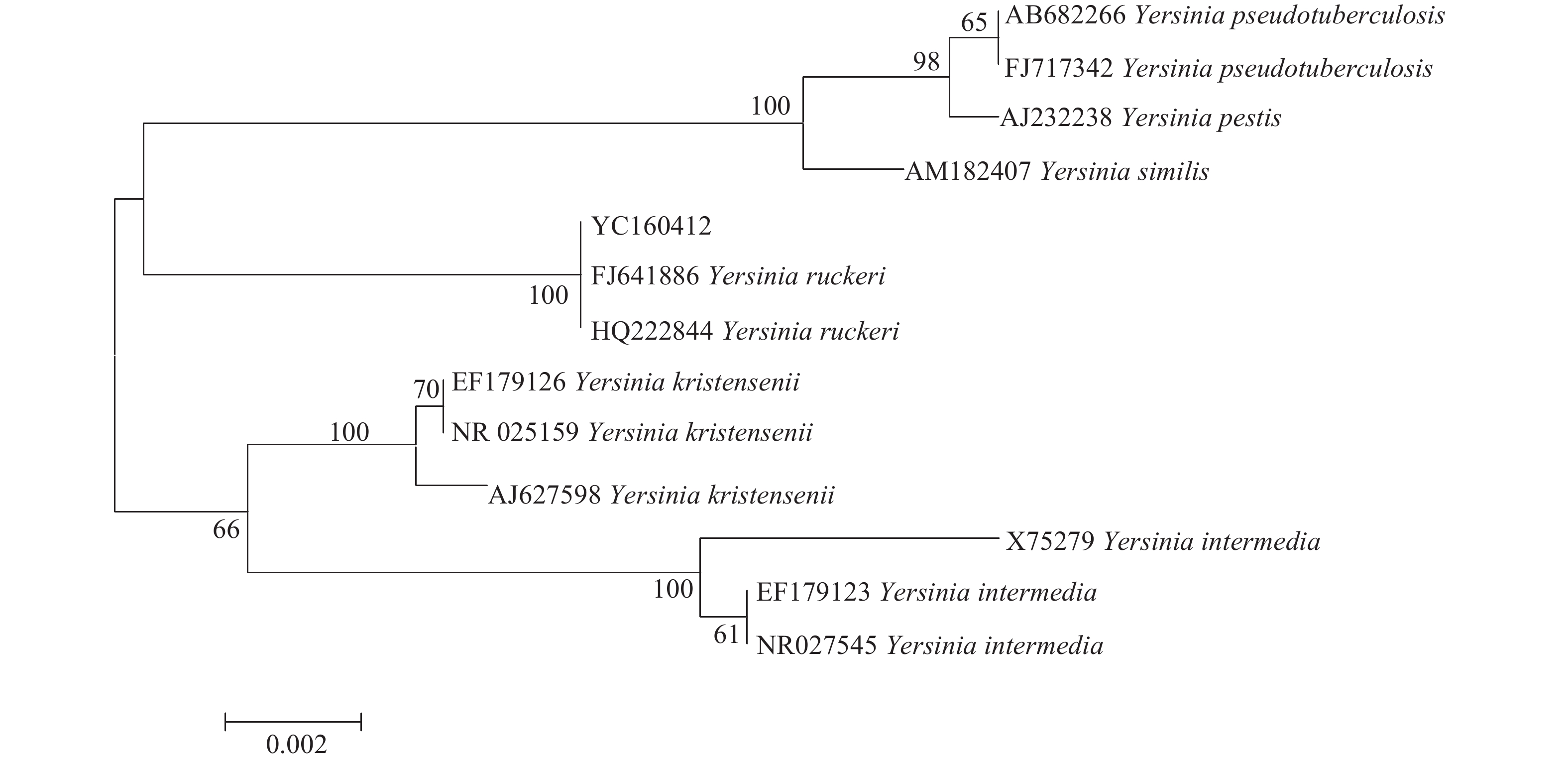
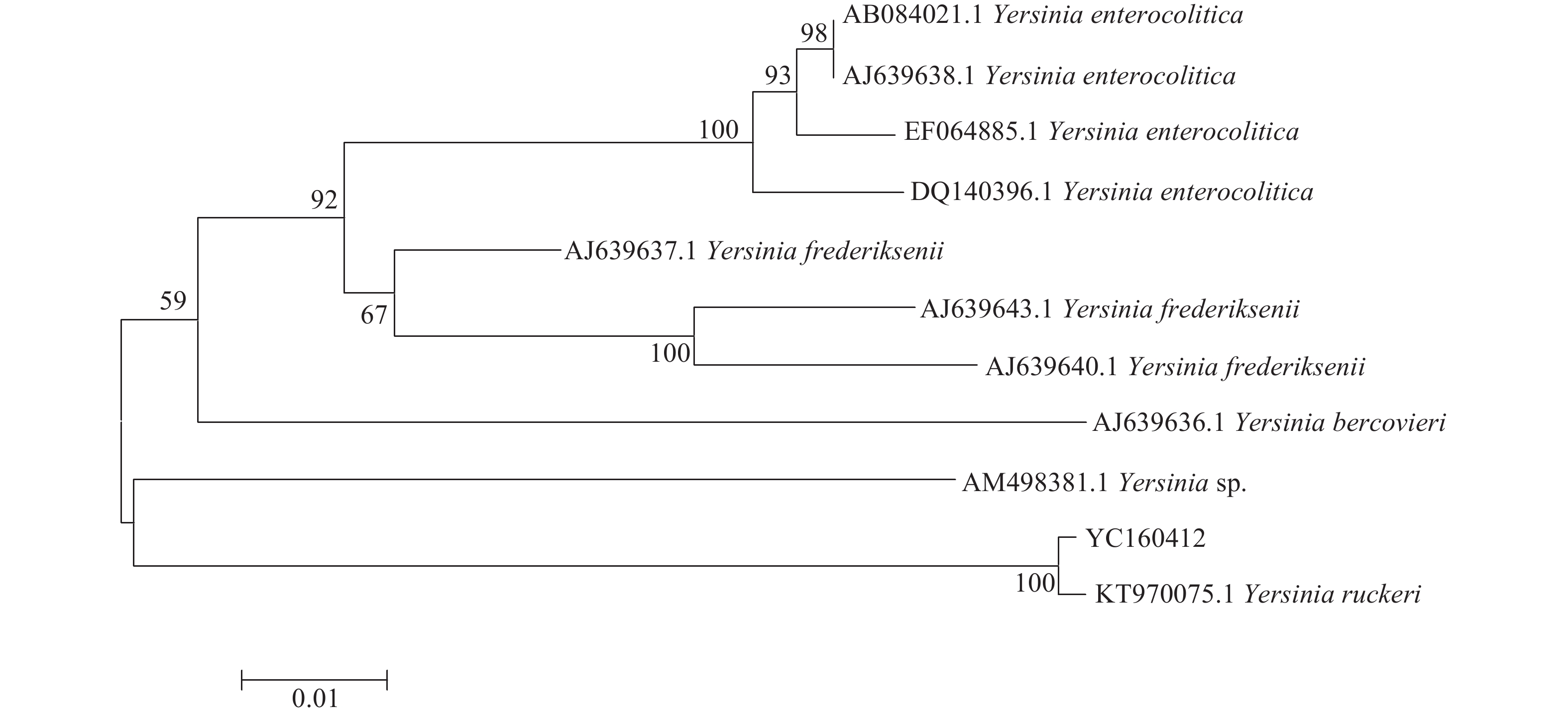
以分离菌株的DNA为模板,分别扩增的gyrB和16S rRNA基因条带均与预期相符,测序结果在GenBank(gyrB基因的序列登录号为MG017541,16S rRNA基因的序列登录号为KY848832)进行Blast分析,结果显示序列与Y. ruckeri的gyrB和16S rRNA基因相似性最高,分别为99.0%和99.8%。进一步利用MEGA 5.02软件对分离菌株的16S rRNA和gyrB基因序列构建系统发育树(图3,图4),在系统发育树上分离株YC160412与Y. ruckeri均聚为同一个分支。
|
图 3 基于菌株YC160412及耶尔森氏菌属相关菌株16S rRNA基因序列构建的系统发育树 Figure 3 Phylogenetic tree of strain YC160412 and related species of Yersiniagenus based on 16S rRNA sequence |
|
图 4 基于菌株YC160412及耶尔森氏菌属相关菌株gyrB基因序列构建的系统发育树 Figure 4 Phylogenetic tree of strain YC160412 and related species of Yersinia genus based on gyrB gene sequence |
对菌株YC160412进行23种抗生素药物的敏感性试验,结果显示,该分离株对头孢噻肟、头孢唑啉、氨苄西林、氧氟沙星、大观霉素和氟苯尼考等抗生素高度敏感,对阿莫西林、林可霉素、克林霉素、红霉素、青霉素等耐药,对四环素和新霉素表现为中度敏感,具体见表3。
|
|
表 3 菌株YC160412抗生素药敏试验结果 Table 3 Antibiotic susceptibility test results of strain YC160412 |
通过解剖及光学显微镜对患病鱼的心、肝、脾、肾、鳃、肠和肌肉等组织切片进行观察,结果发现:病鱼心外膜与心包膜水肿增厚,心包腔内大量淋巴细胞浸润(图5A);心肌纤维颗粒变性或空泡变性,甚至发生断裂、溶解,其间有少量淋巴细胞浸润(图5B);肝血窦淤血,肝细胞肿胀,出现广泛性空泡变性(图5C),严重的发生坏死,并在肝组织内见杆状的细菌团块(图5D);脾髓窦淤血、出血,淋巴细胞坏死,数量明显减少,巨噬细胞、中性白细胞浸润,网状内皮细胞增生(图5E),并在一些坏死区可见细菌团块(图5F);肾小管发生颗粒变性、坏死,肾小球毛细血管扩张,充血,肾小囊内可见大量染成淡红色的渗出物,肾间造血组织细胞坏死,细胞核裂解,中性粒细胞、嗜酸性粒细胞与巨噬细胞等炎症细胞浸润(图5G),同时在一些坏死区域可见细菌团块(图5H);肠绒毛上皮变性、坏死,脱落的上皮细胞与黏液充滞肠腔内,固有膜与黏膜下层淋巴细胞、中性粒细胞与巨噬细胞等炎症细胞浸润(图5I)。

|
图 5 感染鲁氏耶尔森氏菌杂交鲟的病理组织学损伤 Figure 5 Pathohistological lesions of hybrid sturgeon infected by Yersinia ruckeri A:心包腔内大量淋巴细胞浸润;B:心肌断裂、溶解,淋巴细胞浸润;C:肝细胞空泡变性;D:肝中的细菌团块;E:脾髓窦淤血,淋巴细胞坏死;F:脾中的细菌团块;G:肾小球内大量渗出物,肾间造血组织坏死,炎症细胞浸润;H:肾中的细菌团块;I:肠绒毛上皮变性、坏死脱落 |
自1952年首次从发病虹鳟中分离Y.ruckeri以来,其感染所致的“肠炎红嘴病”一直被认为是危害鲑鳟鱼类养殖的疾病,但也相继有鲢[2]、金鱼、施氏鲟Acipenser schrenckii[16]、鲤和斑点叉尾鮰[4]等鱼类感染引起败血症的报道[5],表明其感染的宿主范围在逐步扩大。本研究从发生肠炎与口唇红肿的杂交鲟体内分离到1株革兰阴性细菌,经人工感染试验证实了其病原性,根据分离细菌的形态学特征和生理生化特性初步确定为Y.ruckeri;基于其16S rRNA和gyrB基因序列的系统发育分析表明,其与Y.ruckeri进化关系密切,相似性达到99%以上,结合形态学和理化特征鉴定该菌为Y.ruckeri。杂交鲟在感染Y.ruckeri后表现出了虹鳟、斑点叉尾鮰等相似的临床表现,即肠炎与口唇充血、出血而发红,由此可见,该临床特征可作为临床上初步诊断该病的重要依据。但本研究也发现,有部分感染杂交鲟未出现明显的临床病变、死亡,因此,临床上对该病的确切诊断还需要借助于PCR与Elisa等特异性更强的方法。
本研究中,鲟鱼感染Y.ruckeri后主要表现为全身性多组织器官坏死、变性、出血等败血症,与Y.ruckeri感染其他宿主所引起的临床症状不尽相同,该菌感染虹鳟时表现为心脏充血、出血,细胞肿胀;肝脂肪变性,血窦消失;肾小管无明显病变,肾小球系膜细胞增生,淋巴细胞显著减少,单核细胞增生[17]。但本研究发现,杂交鲟感染Y. ruckeri后,其肝脏、肾脏的损伤尤其明显,肝血窦淤血,细胞肿胀,出现广泛性空泡变性,甚至发生坏死;肾小管发生颗粒变性、坏死,肾小囊内有大量渗出液,肾间造血组织坏死,大量炎症细胞浸润,出现这种差异的原因可能与感染宿主的种属差异以及与病原的互作效应不同有关。另外,本研究发现在染病鲟的肝、脾和肾组织中存在大量细菌团块,表明这些器官可能是Y.ruckeri感染鲟的主要亲嗜器官。
药敏试验结果表明,该菌对头孢噻肟、头孢唑啉、氨苄西林、氧氟沙星、大观霉素和氟苯尼考等抗生素敏感,对阿莫西林、林可霉素、克林霉素、红霉素等耐药,且实际处理中采用敏感药物氟苯尼考内服较为有效地控制了疫情。分离菌的药物敏感性与杨移斌等[18]及王荻等[19]报道从西伯利亚鲟分离到Y.ruckeri对丁胺卡那、庆大霉素、氟苯尼考敏感,对克林霉素耐药具有相似性;但与范方玲等[20]报道从斑点叉尾鮰分离到的Y.ruckeri对环丙沙星、卡那霉素等药物敏感特性存在差异。由此可见,来源于不同动物源或区域的同种细菌,在药物敏感性上可能存在差异。因此,为避免药物滥用,在鱼类细菌性疾病的治疗中应根据药敏试验结果选择敏感抗菌药物,本试验结果可为指导养殖生产中杂交鲟鲁氏耶尔森氏菌病的有效治疗及安全用药提供一定的参考。
| [1] |
TOBBACK E, DECOSTERE A, HERMANS K, et al. Yersinia ruckeri infections in salmonid fish
[J]. J Fish Dis, 2007, 30(5): 257. DOI:10.1111/jfd.2007.30.issue-5 (  0) 0) |
| [2] |
徐伯亥, 殷战, 陈燕燊, 等. 鲢、鳙鱼一种新的传染病: Yersinia ruckeri, 一种新的鲢、鳙鱼病原菌
[J]. 科学通报, 1991, 36(8): 620. (  0) 0) |
| [3] |
李绍戊, 王荻, 冯娟, 等. 养殖鲟鱼出血症病原鲁氏耶尔森菌的分离鉴定和致病性研究[J]. 海洋与湖沼, 2014, 45(3): 561-567. DOI:10.11693/hyhz20130121001 (  0) 0) |
| [4] |
DANLEY M L, GOODWIN A E, KILLIAN H S. Epizootics in farm-raised channel catfish, Ictalurus punctatus (Rafinesque), caused by the enteric redmouth bacterium Yersinia ruckeri
[J]. J Fish Dis, 1999, 22(6): 451-456. DOI:10.1046/j.1365-2761.1999.00196.x (  0) 0) |
| [5] |
ISPIR U, GOKHAN H B, OZCAN M, et al. Immune response of rainbow trout (Oncorhynchus mykiss) to selected antigens of Yersinia ruckeri
[J]. Acta Vet Brno, 2009, 78(1): 145-150. DOI:10.2754/avb200978010145 (  0) 0) |
| [6] |
ROSS A J, RUCKER R R, EWING W H. Description of a bacterium associated with redmouth disease of rainbow trout (Salmo gairdneri)
[J]. Can J Microbiol, 1966, 12(4): 763-770. DOI:10.1139/m66-103 (  0) 0) |
| [7] |
张晓君. 鲁氏耶尔森氏菌及鱼类相应感染症[J]. 河北科技师范学院学报, 2004, 18(3): 77-80. (  0) 0) |
| [8] |
RUBAN G I. Species structure, contemporary distribution and status of the Siberian sturgeon, Acipenser baerii
[J]. Environ Biol Fish, 1997, 48: 221-230. DOI:10.1023/A:1007372932444 (  0) 0) |
| [9] |
马志宏, 杨慧, 李铁梁, 等. 西伯利亚鲟(Acipenser baerii)致病性维氏气单胞菌的分离鉴定
[J]. 微生物学报, 2009, 49(10): 1289-1294. DOI:10.3321/j.issn:0001-6209.2009.10.017 (  0) 0) |
| [10] |
杨治国. 鲟鱼嗜水气单胞菌的分离鉴定[J]. 淡水渔业, 2001, 31(5): 40-41. (  0) 0) |
| [11] |
DENG M L, YU Z H, GENG Y, et al. Outbreaks of streptococcosis associated with Streptococcus iniae in Siberian sturgeon (Acipenser baerii) in China
[J]. Aquac Res, 2017, 48(3): 909-919. DOI:10.1111/are.2017.48.issue-3 (  0) 0) |
| [12] |
ETAL E J H. Bergey’s manual of determinative bacteriology [M]. 9th ed. Philadelphia, Lippincott: Williams & Wilkins, 1994: 520-521.
(  0) 0) |
| [13] |
WIKLER M A. Performance standards for antimicrobial susceptibility testing: Eighteenth informational supplement[M]. Pennsylvania: Clinical and Laboratory Standards Institute, 2006.
(  0) 0) |
| [14] |
YAMAMOTO S, HARAYAMA S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains
[J]. Appl Environ Microbiol, 1995, 61(3): 1104-1109. (  0) 0) |
| [15] |
JENSEN S, BERGH O, ENGER O, et al. Use of PCR-RFLP for genotyping 16S rRNA and characterizing bacteria cultured from halibut fry[J]. Can J Microbiol, 2002, 48(5): 379-386. DOI:10.1139/w02-033 (  0) 0) |
| [16] |
孟彦, 肖汉兵, 张林, 等. 施氏鲟出血性败血症病原菌的分离和鉴定[J]. 华中农业大学学报, 2007, 26(6): 822-826. (  0) 0) |
| [17] |
AVCI H, BİRİNCİOĞLU S S. Pathological findings in rinbow trout (Oncorhynchus mykiss Walbaum, 1792) experimentally infected with Yersinia ruckeri
[J]. Turk J Vet Anim Sci, 2005, 29(6): 1321-1328. (  0) 0) |
| [18] |
杨移斌, 夏永涛, 郑卫东, 等. 鲟源鲁氏耶尔森氏菌的分离鉴定及药敏特性研究[J]. 水生生物学报, 2013, 37(2): 393-398. DOI:10.7541/2013.33 (  0) 0) |
| [19] |
王荻, 李绍戊, 冯娟, 等. 氟苯尼考在感染鲁氏耶尔森氏菌的西伯利亚鲟体内的药效学[J]. 水产学杂志, 2012, 25(2): 11-14. (  0) 0) |
| [20] |
范方玲, 汪开毓, 耿毅, 等. 斑点叉尾(Ictalunes punctatus)源鲁氏耶尔森氏菌的分离鉴定及系统发育分析
[J]. 海洋与湖沼, 2010, 41(6): 862-868. DOI:10.11693/hyhz201006010010 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


