2. 四川农业大学 动物科技学院,四川 成都 611130
2. College of Animal Science and Technology, Sichuan Agricultural University, Chengdu 611130, China
锦鲤疱疹病毒病(Koi herpesvirus disease,KHVD)是由锦鲤疱疹病毒(Cyprinid herpesvirus 3, CyHV-3)感染引起鲤鱼Cyprinus carpio、锦鲤Cryprinus carpiod以及普通变种鳃坏死、间质性肾炎的一种高致病性、高传染性、高死亡率的疾病。该病发病率高、流行范围广,致死率高达80%~100%[1-2]。自1998年以来,KHVD时常在世界范围内的许多鲤鱼和锦鲤养殖场发生[3],死亡率极高,该病的暴发给鲤鱼和锦鲤养殖业造成了严重的经济损失[4-8]。因此,KHVD是世界动物卫生组织必须申报的疾病,是中国农业部规定的Ⅱ类动物疫病,是全世界进出口必检的病原。
KHVD多发于春秋季节,导致KHVD发病和严重程度的主要环境因素是水体温度[9-10]。水温在23~28 ℃时KHVD易暴发流行[11-12]。先前报道CyHV-3的体外增殖温度范围是15~25 ℃,当温度低于10 ℃或大于30 ℃时,病毒不复制,不能造成疾病暴发[13-14]。2014年4月,吉林省白山地区报道了1例冰下低温条件下暴发的KHVD,造成了鲤鱼的大量死亡,发病时的水温为–2~5 ℃[15]。因此,CyHV-3是否能够在低温条件下复制和具有致病性还需要进一步的研究。本研究选用CyHV-3-EGFP病毒株为研究对象,从病毒在培养基中的热稳定性、温度对病毒的体外培养和体内致病性的影响共3个方面开展研究,旨在为CyHV-3的致病机制研究和防控提供依据。
1 材料与方法 1.1 细胞、病毒和试验动物普通鲤鱼脑细胞(Common carp brain cell,CCB)系由深圳出入境检验检疫局刘荭研究员馈赠;CCB细胞用含体积分数为10%FBS的MEM培养基培养,置于25 ℃、CO2体积分数为5%的恒温培养箱中;CyHV-3-EGFP病毒株由比利时列日大学Alain Vanderplasschen教授提供;健康鲤鱼(体长10~15 cm)60条,购自四川省成都市某鲤鱼养殖场;细胞培养板,购自上海索宝生物科技有限公司。
1.2 主要试剂MEM和DMEM培养基、胎牛血清购自Sigma公司;鼠抗CyHV-3单抗2F12 WD1000由比利时列日大学Alain Vanderplasschen教授提供;荧光二抗Alexa 488标记山羊抗小鼠IgG(H+L)购自Santa Cruz公司。
1.3 病毒滴度的测定采用间接免疫荧光染色法测定CyHV-3病毒滴度[16]。以无血清培养基将待测的CyHV-3病毒液从10–2梯度稀释到10–6。取对数生长期CCB细胞,胰酶消化、计数,铺24孔板,每孔250 μL(含4×105个细胞)。每个病毒梯度设3个重复,每孔滴加250 μL待测病毒样品。25 ℃、CO2体积分数为5%的培养箱培养5 d。培养后的CCB细胞置于丙酮–乙醇(体积比50∶50)固定液中–20 ℃固定10 min,加入一抗(2F12 WD1000,1∶1 000稀释)置于25 ℃孵育45 min后,使用含体积分数为10%FBS的PBS缓冲液洗涤3次,每次5 min,加入荧光二抗(Alexa Fluor 488标记山羊抗小鼠IgG,1∶1 000稀释) 25 ℃孵育30 min,使用含体积分数为10%FBS的PBS缓冲液洗涤3次,每次5 min后,加入适量含体积分数为10%FBS的PBS缓冲液,荧光显微镜下直接计数每孔中荧光细胞数。以每孔荧光细胞数30~300个为最佳。测得病毒滴度以每毫升的绿色荧光形成单位(PFU·mL–1)表示,每个荧光细胞对应1个绿色荧光形成单位。依公式计算病毒滴度:病毒滴度=绿色荧光细胞数/(微孔×病毒量×稀释倍数)。
1.4 病毒热稳定性的测定为研究CyHV-3在培养基中的热稳定性,分别将病毒液置于4、10、15、20、25、30、40和50 ℃条件下1 h。将处理后的病毒样品进行10倍梯度稀释,接种至对数生长期的单层CCB细胞中,使用12孔细胞培养板,每孔加0.2 mL病毒液,25 ℃条件下于无FBS的DMEM培养液中攻毒2 h,去除上清,添加2 mL含体积分数为10%FBS的DMEM培养液中,置于25 ℃、CO2体积分数为5%的恒温培养箱中,培养5 d后采用间接免疫荧光蛋白法进行病毒滴度计数。为了进一步研究温度对病毒稳定性的影响,在30~40 ℃之间分别设置了6个温度梯度(30、32、34、36、38、40 ℃),重复以上试验步骤,计算病毒滴度。
1.5 温度对CyHV-3体外增殖的影响 1.5.1 感染温度对CyHV-3体外增殖的影响取100 μL CyHV-3-EGFP病毒液,加入200 μL无血清DMEM培养液,混匀,静置15 min后加入1.7 mL无血清的DMEM培养液,所有病毒液感染对数生长期的CCB细胞后,将平板置于4、15、25、30和37 ℃条件下感染2 h,去掉上清液,添加新的DMEM液,于25 ℃、CO2体积分数为5%的培养箱中继续培养5 d,利用荧光显微镜观察,研究感染温度对CyHV-3体外增殖的影响。
1.5.2 孵育温度对CyHV-3体外增殖的影响将CyHV-3-EGFP病毒在15、25和30 ℃条件下分别感染CCB细胞2 h后,再将这3组不同感染温度的CCB细胞分别置于15、25和30 ℃的恒温培养箱中培养5 d,利用荧光显微镜观察,研究孵育温度对CyHV-3体外增殖的影响。
1.6 温度对CyHV-3致病性的影响皮肤是CyHV-3感染的主要途径,人工动物感染试验采用浸泡法。健康鲤鱼经过2周环境适应后随机分成4组,每组15尾。处理组共设3个温度梯度,分别为15、25和30 ℃,采用400 PFU·mL–1的病毒悬液浸泡2 h攻毒;对照组温度为25 ℃,没有加入病毒悬液浸泡,而加入等量的DMEM培养液。攻毒后每天观察2次,记录临床症状、死亡时间和数量,连续观察6周。
2 结果与分析 2.1 CyHV-3热稳定性研究为研究CyHV-3在培养基中的热稳定性,分别将病毒液置于不同温度下1 h后,通过间接免疫荧光法测定病毒滴度。通过计算绿色荧光形成单位(PFU)可知,在4、10、15、20、25和30 ℃条件下1 h后,病毒的滴度都超过105 PFU·mL–1,说明CyHV-3在30 ℃条件下的热稳定性良好。但是当培养温度为40 ℃时,病毒滴度明显降低,仅为10 PFU·mL–1(图1A)。
为了进一步研究温度对CyHV-3稳定性的影响,在30 ℃至40 ℃之间设置了6个温度梯度(30、32、34、36、38和40 ℃)。经过计算PFU可知,温度低于36 ℃时,病毒滴度都超过了105 PFU·mL–1,但是呈现递减趋势。温度高于36 ℃时病毒滴度明显减少,38和40 ℃时的滴度分别为103.37、101.30 PFU·mL–1,病毒滴度大幅度的降低(图1B)。试验结果说明CyHV-3在4~36 ℃时具有很好的热稳定性,温度高于36 ℃时病毒活力降低,温度高于50 ℃时病毒活力完全丧失(图1)。
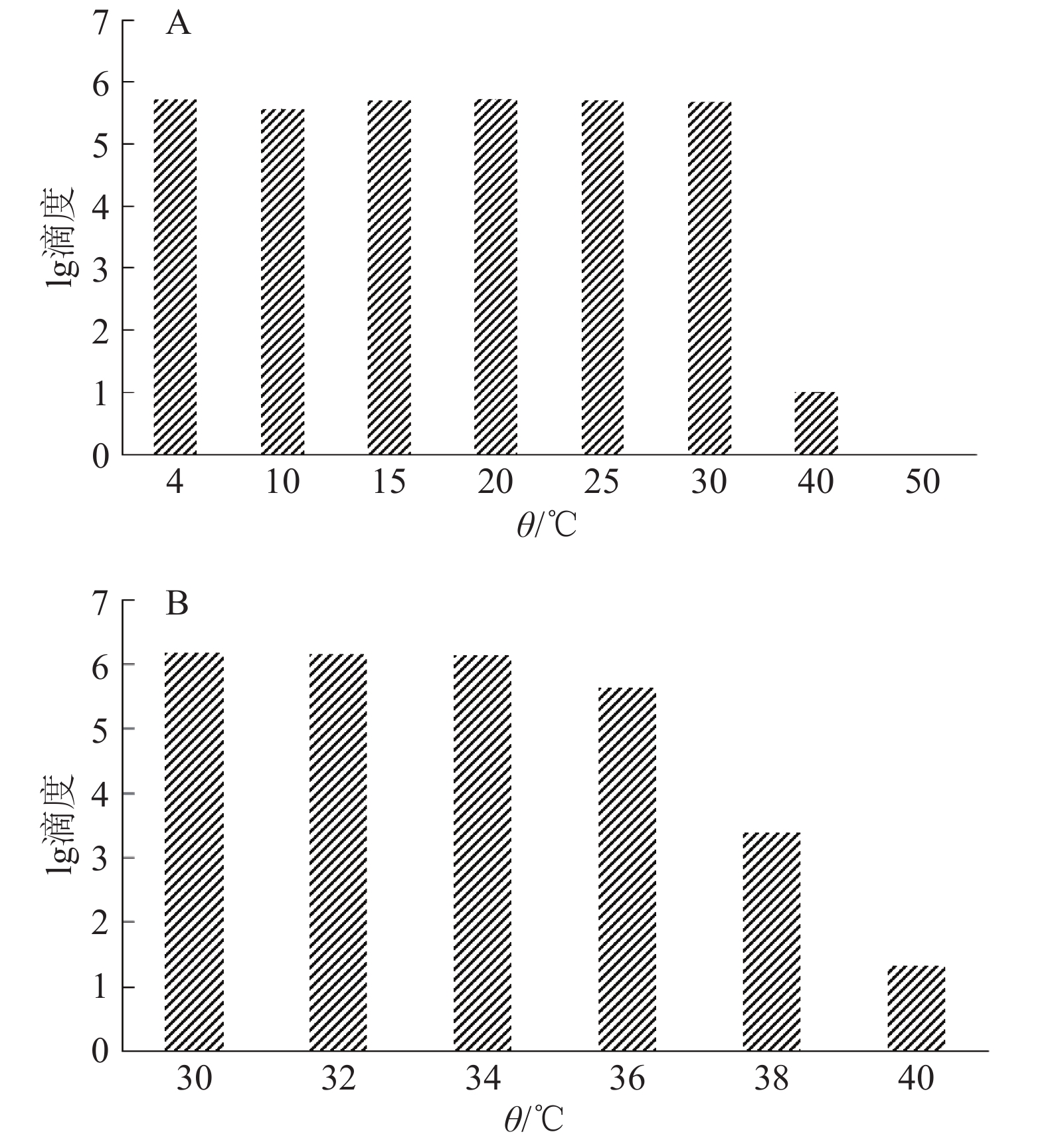
|
图 1 不同温度下CyHV-3病毒液的病毒滴度 Figure 1 Viral titers of CyHV-3 viral fluid under different temperature |
CyHV-3病毒分别在4、15、25、30和37 ℃条件下感染对数生长期的CCB细胞2 h后,置于25 ℃恒温培养箱中继续培养5 d,荧光显微镜观察结果显示,在这5个不同感染温度中,CyHV-3-EGFP对CCB细胞都具有感染力,能大量增殖。因此,4~37 ℃范围内的感染温度对病毒活力无影响(图2)。
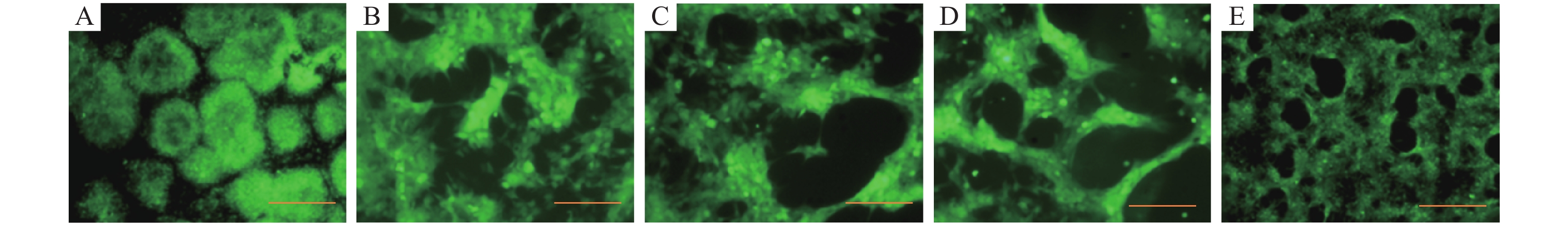
|
图 2 不同感染温度下CyHV-3体外增殖的荧光显微镜观察结果 Figure 2 Observation of CyHV-3 proliferation in vitro under different temperature using fluorescence microscope A:4 ℃,B:15 ℃,C:25 ℃,D:30 ℃,E:37 ℃;标尺=200 μm |
CyHV-3分别在15、25、30 ℃温度下感染2 h后,分别置于15、25、30 ℃恒温培养箱中继续孵育5 d,荧光显微镜观察显示,孵育温度为15和25 ℃时,3个感染温度下的CCB细胞中都出现病毒的大量增殖。其中感染温度为15 ℃,孵育温度为25 ℃时,病毒增殖量最多。当孵育温度为30 ℃时,3个感染温度下的CCB细胞中病毒的增殖量都很少,感染温度为30 ℃时,病毒没有增殖(图3)。
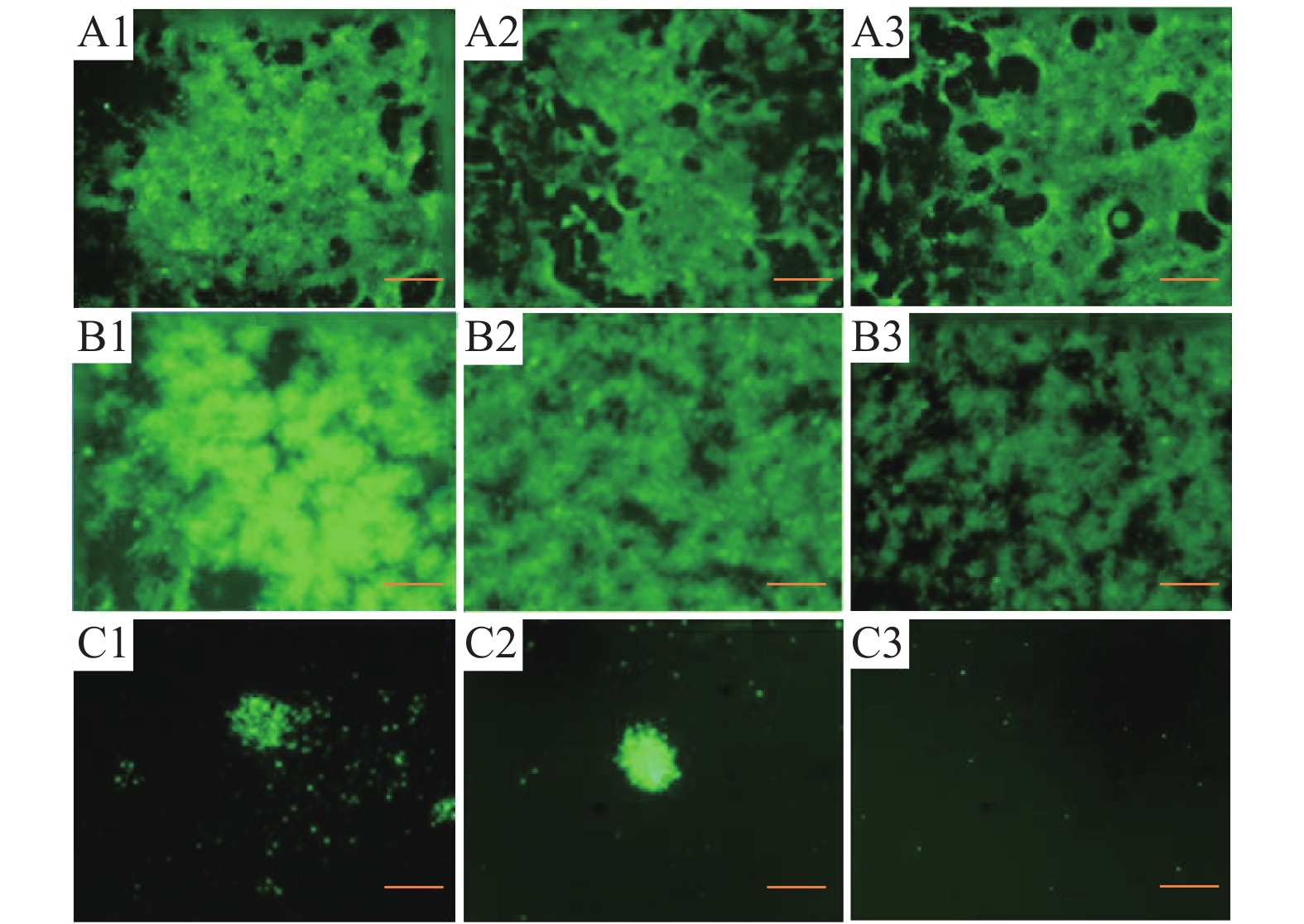
|
图 3 不同感染和孵育温度下CyHV-3体外培养的荧光显微镜观察结果 Figure 3 Observation of CyHV-3 culture in vitro under different infection and incubation temperatures using fluorescence microscope A1、A2和A3的感染温度分别为15、25和30 ℃,孵育温度为15 ℃;B1、B2和B3的感染温度分别为15、25和30 ℃,孵育温度为25 ℃;C1、C2和C3的感染温度分别为15、25和30 ℃,孵育温度为30 ℃;标尺=200 μm |
通过浸泡法进行人工感染动物试验,在15、25和30 ℃温度条件下饲养,观察鲤鱼的死亡情况。通过40 d的观察,15 ℃饲养条件下,攻毒9 d后鲤鱼开始表现出临床症状,14 d开始有鲤鱼死亡,累积死亡4尾,死亡率为26.67%;25 ℃饲养条件下,攻毒4 d后出现临床症状,7 d后鲤鱼开始死亡,累积死亡11尾,死亡率为73.33%。30 ℃条件下,在攻毒4 d后部分鱼表现轻微临床症状,几天后症状消失,没有发生死亡;对照组饲养温度为25 ℃,没有临床症状,死亡率为0 (图4)。因此,温度能够影响CyHV-3的致病力,温度为15 ℃时病毒存在致病性,但是致病力比25 ℃时减弱;温度为30 ℃时,CyHV-3的致病力降低至消失(图4)。
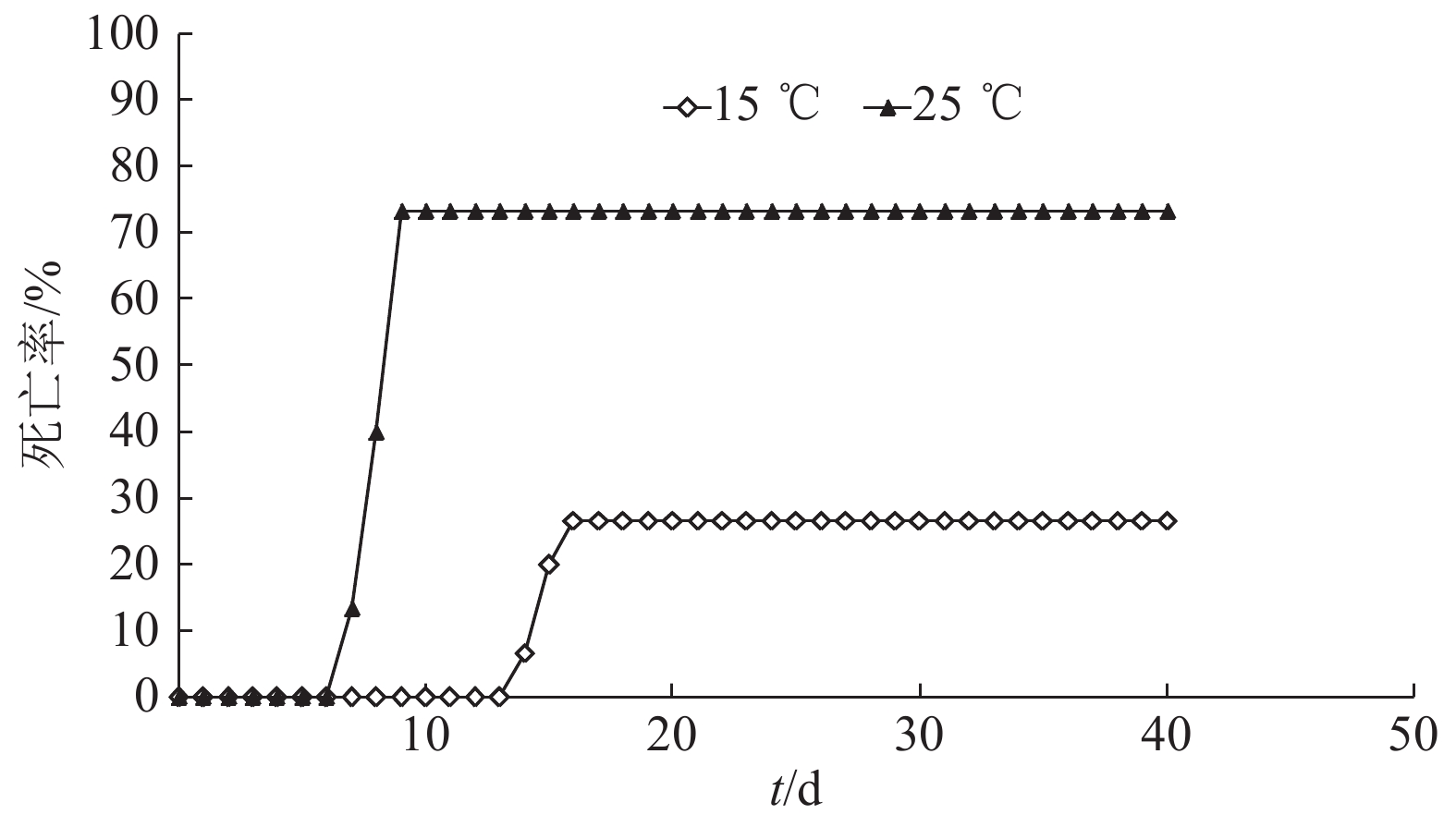
|
图 4 温度对CyHV-3致病性的影响 Figure 4 Effect of temperature on CyHV-3 pathogenicity 30 ℃条件下和对照组的死亡率在整个试验期均为0 |
自然条件下的水体温度是水生动物疾病暴发的一个重要诱因,也是影响病毒在水体存活的重要因素。鱼类是变温动物,免疫反应等生理机能直接受环境温度的影响,所以小范围的温度变化会改变鱼的代谢和生理机能,鱼类免疫反应和病原复制都与水温有关[17-18]。同时,水温的变化还会影响病原与宿主之间的平衡,从而改变疾病的发生率及分布。病毒性疾病具有严格的发病温度,对温度范围要求非常高,发病高峰在水温25 ℃左右,水温突然升到35 ℃,并维持24 h,很多病症就会消失;水温突然降到15 ℃,并维持24 h,很多病毒病症状也会消失,死亡率大幅减少。
锦鲤疱疹病毒CyHV-3自1997年首次被报道至今,虽然只有近20年的时间,却已经在全球多个国家传播及流行,遍布亚洲、欧洲及北美,非洲也偶有报道,几乎每年都有国家暴发该疾病,给鲤鱼及锦鲤养殖业造成巨大的经济损失。CyHV-3对温度有很强的依赖性,多发于春秋季节,适宜的温度为18~28 ℃范围之间,CyHV-3的潜伏期为14 d,在限制存活的温度下,CyHV-3能处于一种潜伏状态在鱼体内持续存活,当鱼转入到适合其生长的温度时CyHV-3会再次恢复活力[19-20]。Ronen等[21]将健康的鱼苗和患病的成鱼在适合病毒复制的温度(22~24 ℃)下共同饲养3~5 d,然后通过提高温度(约30 ℃)的方法抑制病毒复制,饲养25~30 d,保护率可达60%。近年来,CyHV-3有低温下发病的趋势[22]。2014年4月,吉林省白山地区报道了一例冰下低温条件下暴发的KHVD,造成了鲤鱼的大量死亡,发病时的水温为 –2~5 ℃。
为了证实温度对CyHV-3体外培养和致病性的影响,本研究设计试验检测CyHV-3在18 ℃以下或者28 ℃以上的温度条件下的稳定性、体外增殖能力以及致病性。通过试验数据得知CyHV-3在15 ℃条件下也具备很强的增殖能力和感染力,能对鲤鱼造成感染并致死。并且在4~36 ℃范围内都有很好的热稳定性,能保持病毒的毒力,一旦温度达到合适的范围,就会恢复感染力,侵袭宿主,但是高温条件会对CyHV-3产生抑制。本试验研究了温度对CyHV-3体外培养和致病性的影响,证实了CyHV-3能够在低温增殖并且具有致病性,解释了近年来KHVD的流行及暴发不再受限于春秋季节的现象。此外,CyHV-3为了适应低温而感染宿主,自身结构功能是否发生改变还需要验证。通过研究温度对CyHV-3体外增殖和致病力的影响,对控制KHVD的暴发和治疗提供新的思路。
致谢:感谢深圳出入境检验检疫局刘荭研究员提供CCB细胞,感谢比利时列日大学Alain Vanderplasschen教授提供病毒株。
| [1] |
RAKUS K, OUYANG P, BOUTIER M, et al. Cyprinid herpesvirus 3: An interesting virus for applied and fundamental research[J]. Vet Res, 2013, 44(1): 85. DOI:10.1186/1297-9716-44-85 (  0) 0) |
| [2] |
ANTYNCHOWICZ J, REICHERT M, MATRAS M, et al. Epidemiology, pathogenicity and molecular biology of koi herpesvirus isolated in Poland[J]. B Vet I Pulawy, 2005, 49(4): 367-373. (  0) 0) |
| [3] |
HEDRICK R P, GILAD O, YUN S, et al. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp[J]. J Aquat Anim Health, 2000, 12(1): 44-57. DOI:10.1577/1548-8667(2000)012<0044:AHAWMM>2.0.CO;2 (  0) 0) |
| [4] |
TU C, WENG M C, SHIAU J R, et al. Detection of koi herpesvirus in koi Cyprinus carpio in Taiwan
[J]. Fish Patho, 2009, 39(2): 109-110. (  0) 0) |
| [5] |
SANO M, ITO T, KURITA J, et al. First detection of koi herpesvirus in cultured common carp Cyprinus carpio in Japan
[J]. Fish Patho, 2004, 39(39): 165-167. (  0) 0) |
| [6] |
刘荭, 史秀杰, 高隆英, 等. 进口锦鲤暴发病病原的nested-PCR鉴定[J]. 华中农业大学学报, 2002, 21(5): 414-418. (  0) 0) |
| [7] |
朱霞, 李新伟, 王好, 等. 一株锦鲤疱疹病毒的分离与鉴定[J]. 中国预防兽医学报, 2011, 33(5): 340-343. (  0) 0) |
| [8] |
李莹莹, 王庆, 曾伟伟, 等. 锦鲤疱疹病毒GZ1301株的分离与鉴定[J]. 水产学报, 2014, 38(8): 1159-1166. (  0) 0) |
| [9] |
HARAMOTO E, KITAJIMA M, KATAYAMA H, et al. Detection of koi herpesvirus DNA in river water in Japan[J]. J Fish Dis, 2007, 30(1): 59-61. (  0) 0) |
| [10] |
MINAMOTO T, HONJO M N, UCHII K, et al. Detection of Cyprinid herpesvirus 3 DNA in river water during and after an outbreak[J]. Vet Microbiol, 2009, 135(3/4): 261-266. (  0) 0) |
| [11] |
MINAMOTO T, HONJO M N, YAMANAKA H, et al. Nationwide Cyprinid herpesvirus 3 contamination in natural rivers of Japan[J]. Res Vet Sci, 2012, 93(1): 508-514. DOI:10.1016/j.rvsc.2011.06.004 (  0) 0) |
| [12] |
MINAMOTO T, HONJO M N, KAWABATA Z. Seasonal distribution of Cyprinid herpesvirus 3 in lake Biwa, Japan[J]. Appl Environ Microb, 2009, 75(21): 6900-6904. DOI:10.1128/AEM.01411-09 (  0) 0) |
| [13] |
PIKARSKY E, RONEN A, ABRAMOWITZ J, et al. Pathogenesis of acute viral disease induced in fish by carp interstitial nephritis and gill necrosis virus[J]. J Virol, 2004, 78(17): 9544-9551. DOI:10.1128/JVI.78.17.9544-9551.2004 (  0) 0) |
| [14] |
郑树城, 王庆, 李莹莹, 等. 鲤疱疹病毒3型研究进展[J]. 病毒学报, 2016(1): 108-120. (  0) 0) |
| [15] |
邢程, 王好, 周井祥等. 一例冰下低温爆发的锦鲤疱疹病毒病的鉴定[J]. 水产学杂志, 2014(1): 46-49. (  0) 0) |
| [16] |
COSTES B, RAJ V S, MICHEL B, et al. The major portal of entry of koi herpesvirus in Cyprinus carpio is the skin
[J]. J Virol, 2009, 83(7): 2819-2830. DOI:10.1128/JVI.02305-08 (  0) 0) |
| [17] |
张奇亚. 水生低等脊椎动物病毒生态学研究[J]. 病毒学报, 2001, 17(3): 277-281. (  0) 0) |
| [18] |
温周瑞. 气候变化对鱼类病毒病和细菌病的影响[J]. 当代水产, 2013(8): 76-77. (  0) 0) |
| [19] |
RAKUS K L, IRNAZAROW I, ADAMEK M, et al. Gene expression analysis of common carp (Cyprinus carpio L.) lines during Cyprinid herpesvirus 3 infection yields insights into differential immune responses
[J]. Dev Comp Immunol, 2012, 37(1): 65-76. (  0) 0) |
| [20] |
罗丹, 梁利国, 谢骏, 等. 鲤疱疹病毒Ⅰ、Ⅱ、Ⅲ型研究进展[J]. 水生态学杂志, 2014, 35(3): 94-100. (  0) 0) |
| [21] |
RONEN A, PERELBERG A, ABRAMOWITZ J, et al. Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio
[J]. Vaccine, 2003, 21(32): 4677. DOI:10.1016/S0264-410X(03)00523-1 (  0) 0) |
| [22] |
高立容, 于慧, 周井祥, 等. 白山市鸭绿江网箱养鲤冰下爆发锦鲤疱疹病毒病的鉴定[J]. 水产养殖, 2017, 38(4): 7-11. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


