食品安全一直备受人们的广泛关注。微生物等通过污染肉制品、蔬菜和水果等感染人体,从而引发胃肠道疾病,常见的胃肠道疾病致病菌有沙门菌和大肠埃希菌等。这些致病菌不仅可以粘附于蔬果表面,还可能进入到蔬果内部。朱育菁等[1]从龙眼中分离出1株大肠埃希菌菌株和3株鼠伤寒沙门氏菌菌株。这些果蔬内部的致病菌难以通过表面清洗的方法清除,一旦食入很可能引发胃肠道疾病。同时内生菌的潜在威胁不限于此,携带抗菌药物耐药基因的内生细菌进入到胃肠道,很可能诱发肠道细菌产生耐药性。本文对市售小番茄内生细菌进行了分离鉴定,采用PCR法检测其中氯霉素类、四环素类、磺胺类和喹诺酮类等几种养殖场常用抗菌药物耐药基因的残留情况,并设计GFP标记–大肠埃希菌和构建种植模型对小番茄内生菌中耐药基因的转移进行了初步探讨。
1 材料与方法 1.1 材料 1.1.1 培养基与仪器麦康凯琼脂、BS琼脂、XLD琼脂等培养基及相关试剂购自青岛海博生物技术有限公司;次氯酸钠和无水乙醇购自北京普博欣公司;rTaqDNA聚合酶、DL1000 DNA Marker和dNTP Mixture等试剂购自TaKaRa宝成生物工程有限公司;基质辅助激光解吸电离飞行时间质谱仪(Matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)为岛津公司Performance ID Plus型;PCR扩增仪为Fisher公司ZHWY–200H型。
1.1.2 工程菌采用大肠埃希菌BL21 (DE3)感受态细胞,含绿色荧光蛋白(Green fluorescent protein,GFP)基因片段的ET28a-EGFP质粒作为载体,构建目标工程菌,经诱导剂诱导可产生绿色荧光。质粒由淼灵质粒平台提供。
1.2 方法 1.2.1 市售小番茄样品采集2016年8月至12月从广州市9个农贸市场和水果店共采集61批小番茄果实样品,每批约1 kg。
1.2.2 人工种植模型建立与采样种植小番茄植株,于结果期在外源添加菌液。分别设置对照组、表面喷洒组及根系组,每组3次重复,组间交叉间隔10 m,防止交叉污染。根系组采用专用加菌器于土壤下环根加菌;表面喷洒组采用与根系组等量的菌液喷雾接种于植株果实和叶片等部位;对照组在根系施加等量的纯水。每个处理组每棵植株每3天施加1次1×106 cfu·mL–1 GFP标记–大肠埃希菌菌液,每次100 mL,共施加9次,对照组用等量的纯水代替。在试验处理完成后第15、21和27天采样,分别采集果实、叶片及根系。
1.2.3 样品处理采集的果实、叶片和根系样品分别用自来水清洗表面污垢后,置于流动自来水中冲洗1 min,并用无菌超纯水冲洗3遍,放于无菌平皿中备用。在超净工作台内将番茄样品置于φ为75%的乙醇溶液浸泡1 min、φ为5%的次氯酸钠溶液浸泡3 min、无菌超纯水浸泡2 min。消毒好的番茄样品在无菌条件下自然风干,按以下步骤检查消毒是否彻底。
1) 于麦康凯平板及LB平板中做平板印迹检查:将消毒后的样品整个表面在平板上轻轻按压后,将平板置于37 ℃恒温培养箱培养48 h,若无菌生长则为消毒彻底;
2) 将消毒后的样品浸泡在LB肉汤中轻微震荡10 s后取出,再将肉汤置于37 ℃条件下 ,120 r·min–1震荡培养48 h,若肉汤清澈,无菌生长,则为消毒彻底;
3) 取消毒后最后一次无菌超纯水冲洗液200 μL,涂布于LB培养基上,再将培养基置于37 ℃ 恒温培养箱培养48 h,若无菌生长则为消毒彻底。
4) 采摘6颗对照组番茄果实,室温浸泡于与根系组、表面喷洒组相同浓度的GFP标记–大肠埃希菌菌液中24 h,再按照“1.2.3”中消毒步骤消毒后,按照上述1)、2)、3)步骤检查,若无菌生长,证明上述消毒方法可完全去除表面残留的GFP标记–大肠埃希菌。
1.2.4 内生菌的分离鉴定取消毒后的小番茄果实、叶片和根系样品各2 g分别置于5 mL EP管中,置于冰上,使用电动研磨器充分研磨样品,每管加3 mL LB肉汤,在37 ℃条件下120 r·min–1震荡培养24 h后涂布于麦康凯琼脂平板,分别挑取培养基中表观不同的单个菌落于麦康凯培养基上培养,直至无杂菌生成,纯化,将纯化后的细菌保存。使用MALDI-TOF-MS法对纯化后的细菌进行鉴定,将待测菌液与基质分别点在点样板上,溶剂挥发后形成共结晶,在激光照射下基质吸收能量,样品解吸,基质与样品之间发生电荷转移使样品分子电离。根据到达检测器飞行时间的不同,通过测定离子质荷比(m/z)与离子飞行时间的正比关系测量离子分子量,通过专业软件分析,确定特异性指纹图谱,进而鉴定待测细菌[2]。
1.2.5 基因检测PCR反应体系总体积为25 μL,反应程序为95 ℃预加热5 min;95 ℃变性30 s,退火温度如表1所示,时间为45 s,72 ℃延伸1 min,35个循环;72 ℃充分延伸10 min。氯霉素类、四环素类、磺胺类、喹诺酮类药物耐药基因及GFP基因片段的引物如表1所示。市售样品检测表1中的耐药基因,种植模型采集的样品在检测GFP基因片段的同时使用ERIC-PCR及AvaI质粒酶切法分别鉴别内生菌与BL21大肠埃希菌的相似性及内生菌质粒同工程菌质粒是否相同。
|
|
表 1 耐药基因和GFP基因片段的引物类型及序列 Table 1 Primer types and sequences of antibiotic resistant genes and GFP gene fragment |
广州市9个采样点采集的小番茄果实样品中共分离出52株内生细菌菌株,经MALDI-TOF-MS鉴定后,分别属于肠杆菌属Enterobacter、泛菌属Pantoea、克雷伯菌属Klebsiella、阪崎肠杆菌属Cronobacter和伯克霍尔德菌属Burkholderia。肠杆菌属、克雷伯菌属、泛菌属、阪崎肠杆菌属和伯克霍尔德菌属各分离出18、17、8、8和1株内生菌菌株,所占比例分别为34.6%、32.7%、15.4%、15.4%和1.9%。其中3个采样点的小番茄果实样品均检测出各类耐药基因,且均存在较高的内生菌菌株分离率。
52株已鉴定的内生菌菌株中各耐药基因的总阳性率如下:磺胺类药物耐药基因sul1、sul2和sul3总阳性率分别为19.23%、34.61%和0;氯霉素类药物耐药基因cmlA总阳性率为9.62%;四环素类药物耐药基因tetM和tetA总阳性率均为7.69%和7.69%;喹诺酮类药物耐药基因qnrS、qnrB、oqxA、oqxB和qepA总阳性率分别为1.92%、0、57.69%、92.31%和7.69%。从整体耐药基因阳性率结果发现,oqxA和oqxB基因的检出率较其他耐药基因高,提示小番茄内生菌中oqxA和oqxB基因较为流行。
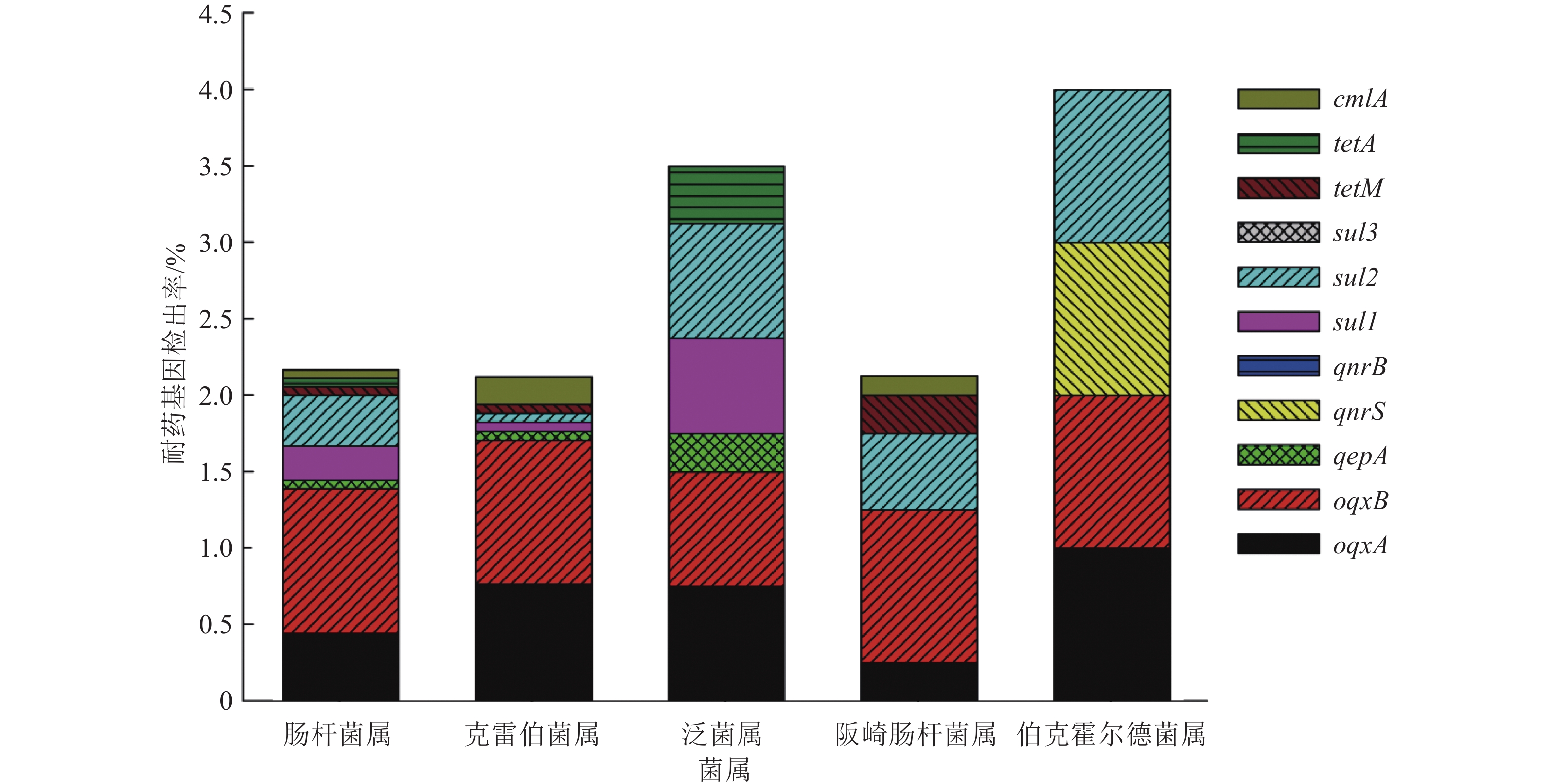
对52株已鉴定的内生菌菌株进行各菌属不同耐药基因阳性率的分析,结果如图1所示。肠杆菌属主要含有耐药基因sul1、sul2、oqxA和oqxB,阳性率分别为22.22%、33.33%、44.44%和94.44%;克雷伯菌属主要含有耐药基因cmlA、oqxA和oqxB,阳性率分别为17.65%、76.47%和94.12%;泛菌属主要含有耐药基因sul1、sul2、tetA、oqxA、oqxB和qepA,阳性率分别为62.50%、75.00%、37.50%、75.00%、75.00%和25.00%;阪崎肠杆菌属主要含有耐药基因sul2、cmlA、tetM、oqxA和oqxB,阳性率分别为50.00%、12.50%、25.00%、25.00%和100%;伯克霍尔德菌属同时检出sul2、qnrS、oqxA和oqxB 4种耐药基因,阳性率均为100%。oqxA和oqxB耐药基因在分离菌株中分布较广,在多个菌属中同时出现,如在克雷伯菌属同时出现的阳性率为76.47%(13/17),在泛菌属同时出现的阳性率为75.00%(6/8),在肠杆菌属同时出现的阳性率也高达44.44%(8/18)。
|
图 1 耐药基因在各个菌属中的分布及检出率 Figure 1 The distributions and detection rates of antibiotic resistant genes in each positively detected genus |
试验样品表面消毒结果如下:1)表面印迹检查无菌;2)消毒后的番茄样品浸泡在肉汤中轻微震荡10 s取出,将肉汤置于37 ℃条件下120 r·min–1震荡培养48 h,无菌;3)取消毒后最后一次超纯水冲洗液,涂布于LB培养基在37 ℃条件下120 r·min–1震荡培养48 h,无菌;4) 6颗对照组小番茄分别浸泡于相同浓度的GFP标记–大肠埃希菌菌液1 d后分离的内生菌中未检测到GFP基因片段。
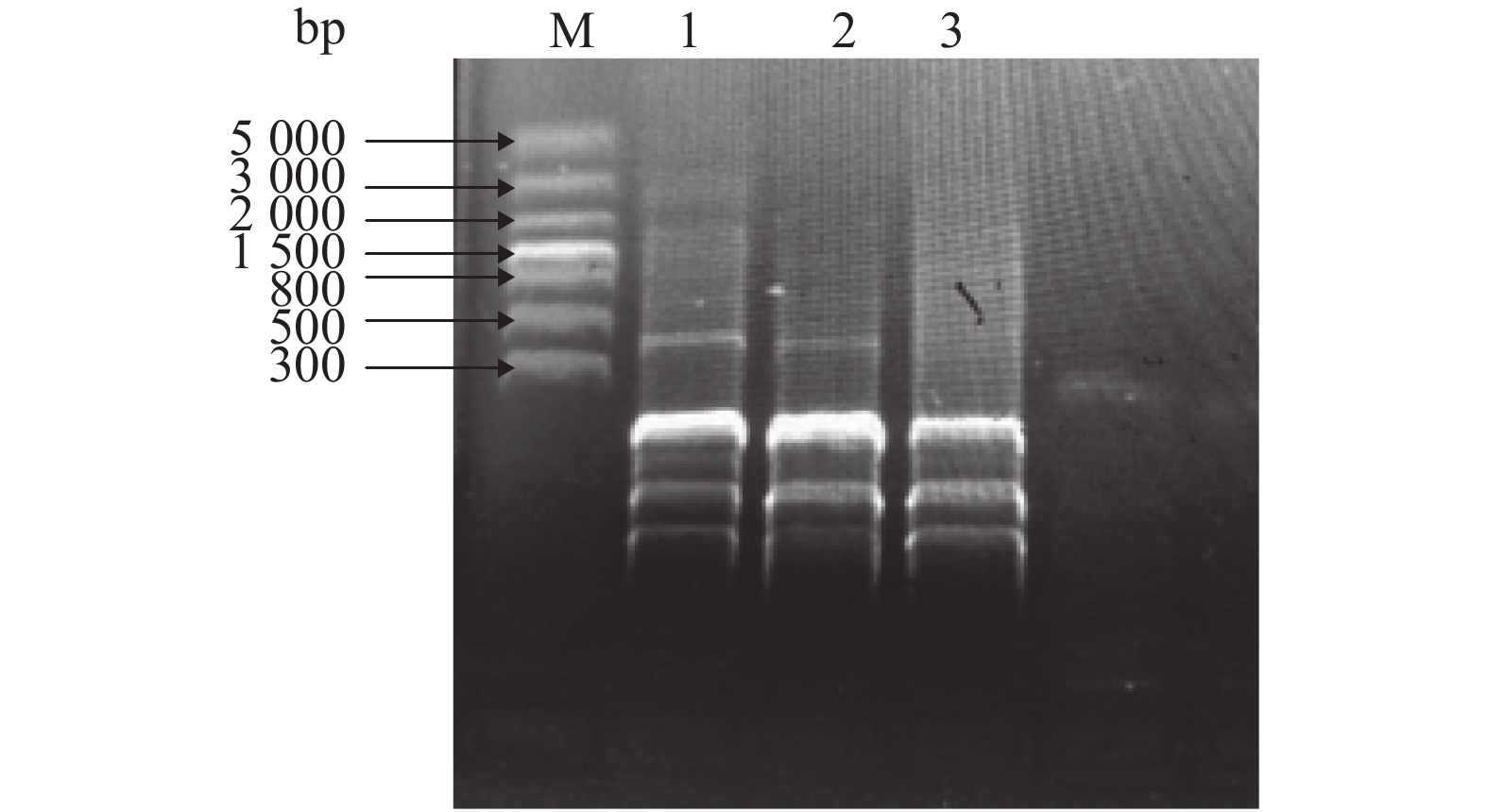
样品中内生菌GFP基因片段PCR检测结果见表2。在施加菌液后的第15天,仅在根系样品中分离到含GFP基因片段的内生菌;第21天,叶片和根系样品中均分离到含GFP基因片段的内生菌;第27天,表面喷洒组与根系组的果实样品中均分离到了含GFP基因片段的内生菌。ERIC-PCR显示果实中的阳性菌与BL21大肠埃希菌具相似性,如图2所示。AvaI质粒酶切法获得1 500和5 000 bp 2种条带,与原GFP质粒相同,为同一种质粒。因此果实内阳性菌极有可能与GFP标记的BL21大肠埃希菌为同一种菌。
|
|
表 2 小番茄内生菌GFP基因片段的PCR检测结果1) Table 2 PCR detection results of GFP gene fragment of endophytic bacteria in cherry tomato |
|
图 2 ERIC-PCR结果 Figure 2 Results of ERIC-PCR M:5 000 bp DNA Marker;1:BL21大肠埃希菌;2、3:果实中含GFP标记的阳性菌 |
本试验采用麦康凯平板进行分离鉴定,主要分离革兰阴性肠杆菌科内生菌,经MALDI-TOF-MS鉴定,分离到的52株内生菌菌株分别属于肠杆菌属、泛菌属、克雷伯菌属、阪崎肠杆菌属和伯克霍尔德菌属,这些菌属均属于常见的植物内生菌。李金霞等[11]从西沙野生尼诺果内同样分离出了泛菌属和伯克霍尔德菌属细菌。值得注意的是本试验喹诺酮类耐药基因 oqxA和oqxB在各菌属中的总阳性率分别达57.69%和92.31%。杨铜等[12]发现2004—2011年间动物源大肠埃希菌的oqxAB基因阳性率存在明显上升趋势,2010—2011年猪中分离的大肠埃希菌oqxAB基因阳性率最高,接近60%。近年来,肺炎克雷伯菌中oqxAB基因的阳性率处于较高水平,李瑞华等[13]分别在72株大肠埃希菌和49株肺炎克雷伯菌中检测oqxAB基因的阳性率,发现大肠埃希菌中仅为9.7%,肺炎克雷伯菌中为69.4%,Yuan等[14]临床分离的肺炎克雷伯菌中oqxAB的阳性率为100%。本试验虽然未确定oqxA和oqxB的耐药基因含量,但过量食用含有该基因的小番茄果实极有可能带来风险。
植物内生菌是指在其生活史的某一阶段生活在健康植物的各种组织内,但没有引起植物组织发生明显病害症状的真菌或细菌。内生菌的产生有3种假说[15]:1)通过植物种子传递;2)通过降解植物细胞纤维素,破坏细胞壁,进入植物体内;3)根际菌通过植物侧根的裂缝进入植物。本试验模型采用GFP标记排除了从种子进入的可能,通过4种方法的验证,证明样品表面消毒结果可信。第27天表面喷洒组果实样品中分离到的含GFP基因片段的内生菌很可能是通过破损的植物组织进入植物内部,根系处理组分离到的含GFP基因片段的内生菌可能是通过根系微生物的内生化作用,从根系进入植株内部,再定殖于果实中。蔡学清等[16]用GFP基因标记的内生细菌菌株BS-2-gfp和TB2-gfp喷雾接种于荔枝叶片、花和幼果,发现2种内生细菌均能在荔枝叶片、花和幼果上定殖,并在各组织内繁殖和在花和幼果间传导,与本文结果相似。ERIC-PCR和质粒酶切试验结果显示,人工种植模型果实样品中的阳性菌与GFP标记的BL21大肠埃希菌为同一种菌。结合上述试验结果,揭示了GFP标记的BL21大肠埃希菌从根系进入植株再转移到果实内部的潜在可能性。
耐药基因的传播以质粒介导传播最为广泛,尤其是喹诺酮类耐药基因,采样调查发现市售番茄果实受喹诺酮类耐药基因污染严重,故设计以GFP基因片段标记质粒的大肠埃希菌模拟实际生产生活中质粒携带耐药基因的人畜共患菌,探究其是否能通过植物内生化等作用进入可生食性果实中。试验结果表明,携带GFP标记的大肠埃希菌可通过根系进入植株,在植株不同部位定殖,生食携带耐药基因的果蔬对人类健康有潜在的威胁作用。
本文通过对广州市9个市场采集的小番茄分离其内生菌,检测磺胺类、四环素类、氯霉素类和喹诺酮类等药物耐药基因,发现小番茄内生菌中喹诺酮类耐药基因oqxA和oqxB的检出率高;建立GFP标记–大肠埃希菌小番茄人工种植模型研究耐药基因的转移,表明GFP标记–大肠埃希菌可通过某种途径转移到小番茄内,揭示耐药基因有可能通过施肥等方式进入到农作物、果蔬等植物内,通过食物链影响人类健康。
| [1] |
朱育菁, 王秋红, 陈璐, 等. 龙眼内生菌的分离与脂肪酸鉴定[J]. 亚热带植物科学, 2008, 37(4): 22-25. (  0) 0) |
| [2] |
陈信忠, 龚艳清, 郭书林. MALDI-TOF-MS在病原微生物鉴定中的研究进展[J]. 生物技术通报, 2012(6): 43-48. (  0) 0) |
| [3] |
LI J, SHAO B, SHEN J, et al. Occurrence of chloramphenicol-resistance genes as environmental pollutants from swine feedlots[J]. Environ Sci Technol, 2013, 47(6): 2892-2897. DOI:10.1021/es304616c (  0) 0) |
| [4] |
YOU Y, HILPERT M, WARD M J. Detection of a common and persistent tet(L)-carrying plasmid in chicken-waste-impacted farm soil
[J]. Appl Environ Microbiol, 2012, 78(9): 3203-3213. DOI:10.1128/AEM.07763-11 (  0) 0) |
| [5] |
NG L K, MARTIN I, ALFA M, et al. Multiplex PCR for the detection of tetracycline resistant genes[J]. Mol Cell Probes, 2001, 15(4): 209-215. DOI:10.1006/mcpr.2001.0363 (  0) 0) |
| [6] |
HE T, SHEN J, SCHWARZ S, et al. Characterization of a genomic island in Stenotrophomonas maltophilia that carries a novel floR gene variant
[J]. J Antimicrob Chemother, 2015, 70(4): 1031-1036. (  0) 0) |
| [7] |
PEI R, KIM S C, CARLSON K H, et al. Effect of river landscape on the sediment concentrations of antibiotics and corresponding antibiotic resistance genes (ARG)[J]. Water Res, 2006, 40(12): 2427-2435. DOI:10.1016/j.watres.2006.04.017 (  0) 0) |
| [8] |
CATTOIR V, WEILL F X, POIREL L, et al. Prevalence of qnr genes in Salmonella in France
[J]. J Antimicrob Chemother, 2007, 59(4): 751-754. DOI:10.1093/jac/dkl547 (  0) 0) |
| [9] |
KIM H B, WANG M, PARK C H, et al. oqxAB encoding a multidrug efflux pump in human clinical isolates of Enterobacteriaceae
[J]. Antimicrob Agents Chemother, 2009, 53(8): 3582-3584. DOI:10.1128/AAC.01574-08 (  0) 0) |
| [10] |
XIA L N, LI L, WU C M, et al. A survey of plasmid-mediated fluoroquinolone resistance genes from Escherichia coli isolates and their dissemination in Shandong, China
[J]. Foodborne Pathog Dis, 2010, 7(2): 207-215. DOI:10.1089/fpd.2009.0378 (  0) 0) |
| [11] |
李金霞, 曹艳花, 白飞荣, 等. 西沙野生诺尼果内生菌的分离与鉴定[J]. 食品与发酵工业, 2014, 40(3): 68-75. (  0) 0) |
| [12] |
杨铜, 刘健华. 不同来源大肠埃希菌中质粒介导的喹诺酮类耐药基因的流行性调查[C]//中国药理学会第十一届全国化疗药理学术研讨会论文集. 北京: 《中国学术期刊(光盘版)》电子杂志社, 2012: 290-293.
(  0) 0) |
| [13] |
李瑞华, 刘亮, 聂大平, 等. oqxAB基因在大肠埃希菌和肺炎克雷伯菌中的流行及传播
[J]. 中国感染与化疗杂志, 2013, 13(6): 456-459. (  0) 0) |
| [14] |
YUAN J, XU X, GUO Q, et al. Prevalence of the oqxAB gene complex in Klebsiella pneumoniae and Escherichia coli clinical isolates
[J]. J Antimicrob Chemother, 2012, 67(7): 1655-1659. DOI:10.1093/jac/dks086 (  0) 0) |
| [15] |
徐亚军. 植物内生菌资源多样性研究进展[J]. 广东农业科学, 2011(24): 149-152. DOI:10.3969/j.issn.1004-874X.2011.24.049 (  0) 0) |
| [16] |
蔡学清, 陈炜, 林娜, 等. 内生细菌在荔枝体内的定殖及其防病保鲜功能[J]. 应用生态学报, 2011, 22(8): 2140-2146. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


