2. 华南农业大学 花卉研究中心,广东 广州 510642
2. Guangzhou Flower Research Center, South China Agricutural University, Guangzhou 510642, China
白姜花Hedychium coronarium是姜科Zingiberaceae姜花属Hedychium多年生草本植物,具有独特的花型和浓郁的香气,是良好的切花材料和园林应用植物[1]。花香是影响花卉观赏价值的主要因素之一,对植物本身而言,花香可作为信号物质来吸引授粉者以及趋避病原菌和食草昆虫对花器官的危害,从而提高作物的产量和品质[2]。因此研究花卉香气成分以及花香物质释放的调控都具有重要的意义。
乙烯是一种植物激素,其在种子萌发[3]、开花[4]、叶片衰老[5]和果实成熟[6]等生理过程中发挥着重要的作用,其与花香物质释放调控的关系也十分密切。在矮牵牛中,乙烯能调控矮牵牛的特征香气苯甲酸甲酯的释放[7],也有试验证明乙烯会导致矮牵牛中苯甲酸甲酯的合成相关基因BSMT、BPBT和PAL等的表达下降[8]。而对于香豌豆[9]和桂花[10],乙烯处理会使罗勒烯和芳樟醇的挥发量下降。1–甲基环丙烯(1-methylcyclopropene,1-MCP)是一种乙烯拮抗剂,它能与乙烯受体不可逆结合,使植物感受不到乙烯信号。1-MCP能抑制植物香气物质的释放,例如,1-MCP处理会抑制梨[11]、苹果[12]和猕猴桃[13]香气物质的释放。
范燕萍等[14]的前期研究已经测得白姜花主要香气成分为L–沉香醇、1, 8–桉油醇、罗勒烯和月桂烯等。本试验通过用乙烯和1-MCP处理白姜花,随后用GC-MS分析了不同处理对挥发性花香物质释放的影响;通过荧光定量PCR试验,分析不同处理后花香相关基因的表达情况。本试验初步探索了乙烯与白姜花香气物质释放的关系,并且进一步探索了乙烯信号转录因子HcEIL1-1和HcEIL1-2的表达规律,推测其在白姜花香气物质合成释放中发挥着调节作用。为深入研究乙烯与白姜花香气物质合成释放的关系以及白姜花分子育种奠定了基础。
1 材料与方法 1.1 试验材料白姜花购于广州市岭南花卉市场。
1.2 试验处理乙烯处理:将露白期的白姜花瓶插在清水中,放置在透明密闭容器中,容器中放置小瓶1 mol·L–1的NaOH溶液,向NaOH溶液中滴入乙烯利从而释放出乙烯,使得终体积分数为10 μL·L–1。迅速密封容器。每个处理设3个重复。
1-MCP处理:将露白期的白姜花瓶插在清水中,放置在透明密闭容器中,容器中放置小瓶1 mol·L–1的NaOH溶液,在容器底部放置适量1-MCP粉剂,使得释放1-MCP的体积分数为4 μL·L–1,迅速密封容器。每个处理设3个重复。
空白对照组:将露白期的白姜花瓶插在清水中,放置在透明密闭容器中,容器中放置小瓶1 mol·L–1的NaOH溶液,并密封容器。每个处理设3个重复。
将以上3组容器放置在人工气候箱中,温度26 ℃,光照强度为300 μmol·m–2·s–1,湿度60%~70%,培养8 h,用于后续试验。
1.3 顶空萃取–固相微萃取(SPEM)乙烯和1-MCP处理8 h后,花朵处于盛花期,取白姜花(3朵)放置在玻璃瓶内,加入2 μL葵酸乙酯(葵酸乙酯与乙醇的体积比为1∶1 000)内标后,立即将瓶口用锡箔纸封口,并用透明胶密封15 min。SPEM(涂层材料DVB/CARonPDMS,涂层厚度50/30 μm)针头使用GC-MS仪器高温预先洗涤,然后透过锡箔纸伸进容器内置于花朵上方约2~3 cm处,顶空萃取15 min;随后,将SPEM针头插入GC-MS进行分析。每个重复进行3次平行试验。
1.4 GC-MS分析气体分析采用的色谱柱为安捷伦DB-5MS系列122-5532型(30 m;I.D:0.25 mm;Film:0.25 μm)色谱柱。GC-MS型号为安捷伦5975c,运行程序如下:不分流,进样口温度为250 ℃,100 ℃保持2 min,以10 ℃·min–1速度上升到170 ℃,保持2 min,然后以5 ℃·min–1速度升到250 ℃,最后280 ℃保持5 min。质谱检测器条件为:扫描时间0.5 s,间隔0.5 s,扫描范围为m/z 35~500,电压1 kV。所得到的离子图用NIST 08数据库进行定性及定量分析。
1.5 总RNA的提取和cDNA的合成以超低温冰箱保存的姜花样品作为提取RNA的材料。采用Trizol法按照Trizol (TaKaRa)的说明书提取白姜花总RNA。用TaKaRa公司的PrimeScript RT试剂盒反转录cDNA后作为模板,具体操作步骤参照说明书。
1.6 引物设计和RT-qPCR利用Primer Premier 5.0软件设计实时荧光定量PCR(RT-qPCR)引物(表1)。引物合成由上海生工生物公司完成。以各样品的cDNA为模板,在荧光定量PCR仪上进行RT-qPCR反应。每个样品设3个重复,以ddH2O为阴性对照,以GAPDH为内参基因。反应程序如下:94 ℃,30 s;94 ℃,15 s,55 ℃,30 s,72 ℃,30 min,40个循环;94 ℃,15 s;72 ℃,30 s,0.4 ℃·s–1融解曲线分析。反应结束后确认扩增曲线和融解曲线,用2–△△Ct法,进行数据分析并计算。
|
|
表 1 荧光定量PCR引物 Table 1 Fluorescent quantitative PCR primers |
各挥发性香气组分的相对含量采用内标法进行定量。计算公式为:各组分香气物质的相对含量=各组分峰面积×内标质量/[内标峰面积×花的质量×(集气时间+萃取时间)]。将得到的各组分香气物质相对含量的数据分别去除一个最大值和一个最小值,然后求算术平均值;各组数据的误差评估通过计算标准偏差衡量。通过单因素方差分析进行差异性分析。
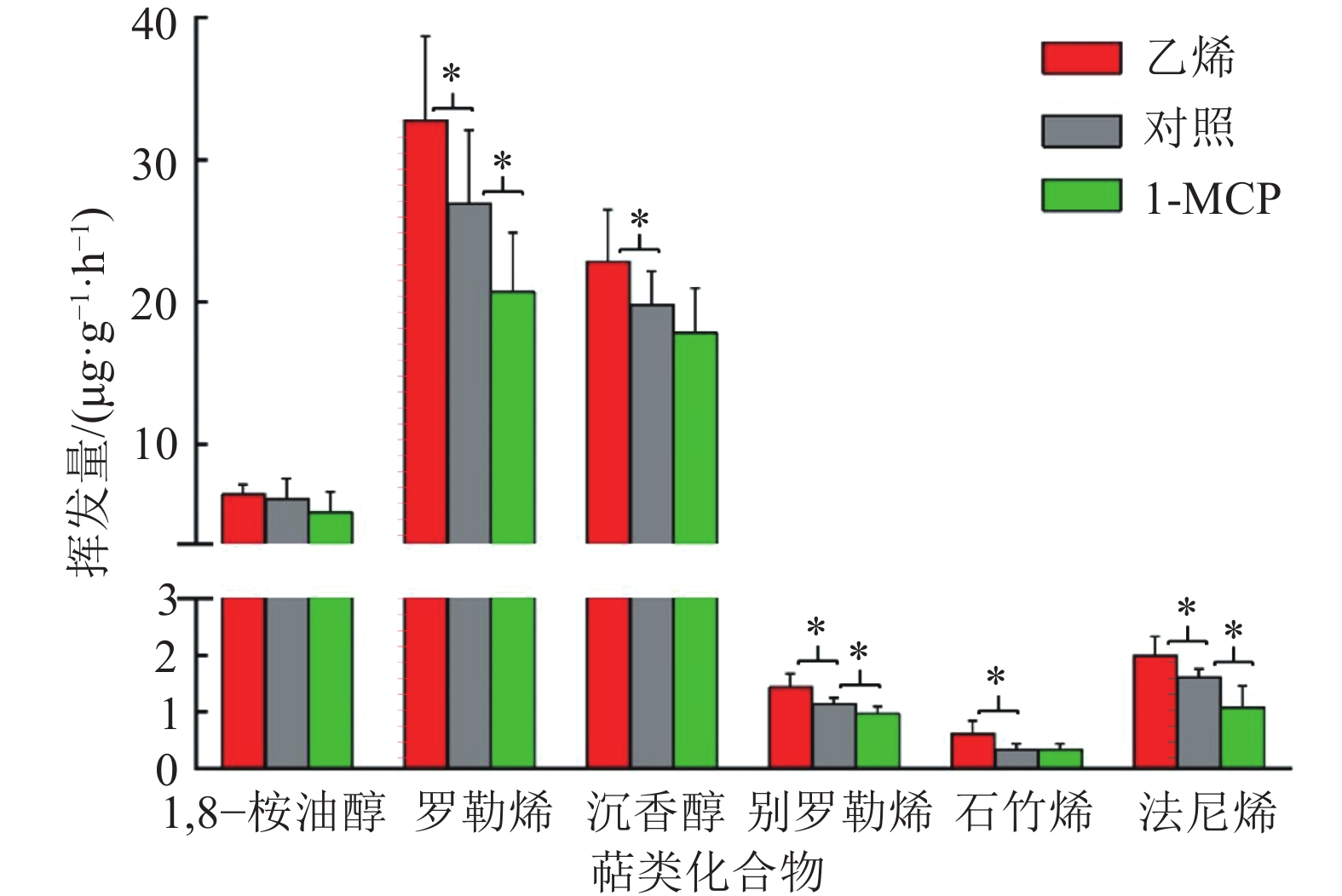
2 结果与分析 2.1 乙烯和1-MCP处理对白姜花花香物质挥发量的影响如图1所示,乙烯处理显著提高了罗勒烯、沉香醇、别罗勒烯、石竹烯和法尼烯的挥发量,分别上升了23%、19%、27%、52%和31%,而1,8–桉油醇的挥发量无明显变化。1-MCP处理显著降低了罗勒烯、别罗勒烯和法尼烯的挥发量,分别下降了19%、13%和30%,沉香醇下降了12%但未达到显著差异,其余香气物质变化不明显。以上结果表明,外源激素乙烯处理能诱导白姜花萜类香气物质挥发量上升,而乙烯抑制剂1-MCP处理会使白姜花萜类香气物质的挥发量下降。
|
图 1 乙烯和1-MCP处理对白姜花挥发性萜类香气物质的影响 Figure 1 Effects of ethylene and 1-MCP treatments on volatile terpene components of Hedychium coronarium “*”表示与对照差异达到0.05的显著水平(单因素方差分析) |
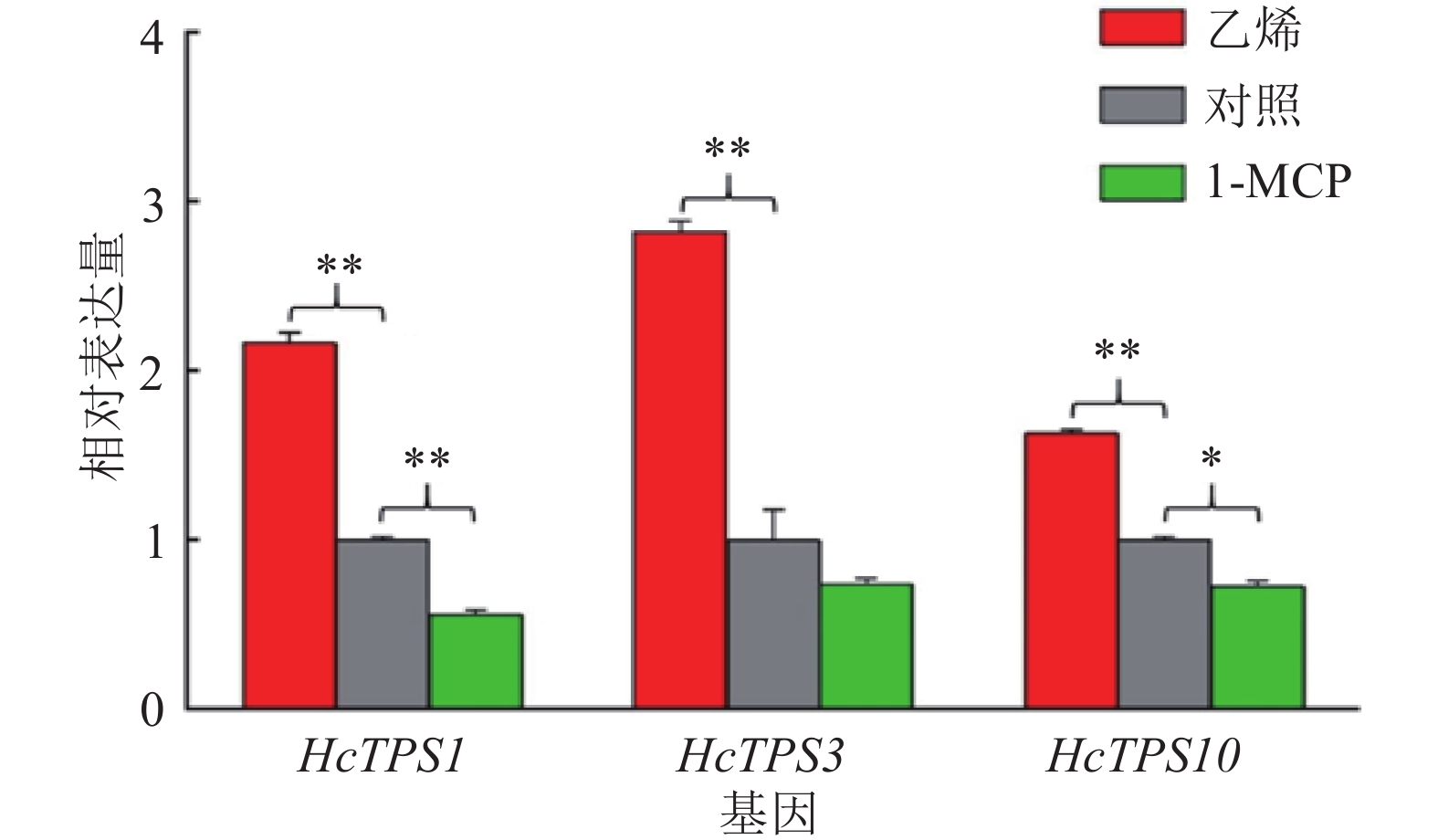
如图2所示,与花香密切相关的萜类合成酶基因HcTPS1、HcTPS3和HcTPS10,出现与花香释放规律相似的表达模式。乙烯处理极显著提高了HcTPS1、HcTPS3和HcTPS10的表达量,分别升高了116%、182%和63%;而1-MCP处理降低了HcTPS1、HcTPS3和HcTPS10的表达量,其中HcTPS1的表达量下降了45%,且达到了极显著差异,HcTPS3的表达量下降了30%,但未达到显著性差异,HcTPS10的表达量下降了30%,且达到了显著性差异。综合前文发现,在乙烯和1-MCP处理后,萜类花香物质合成相关酶基因的表达均与萜类花香物质释放规律相一致,说明乙烯确实调控了白姜花相关花香功能基因的表达。
|
图 2 乙烯和1-MCP处理对白姜花萜类合成酶相关基因表达的影响 Figure 2 Effects of ethylene and 1-MCP treatments on the expressions of terpene synthase related genes in Hedychium coronarium “*”和“**”分别表示与对照差异达到0.05和0.01的显著水平(单因素方差分析) |
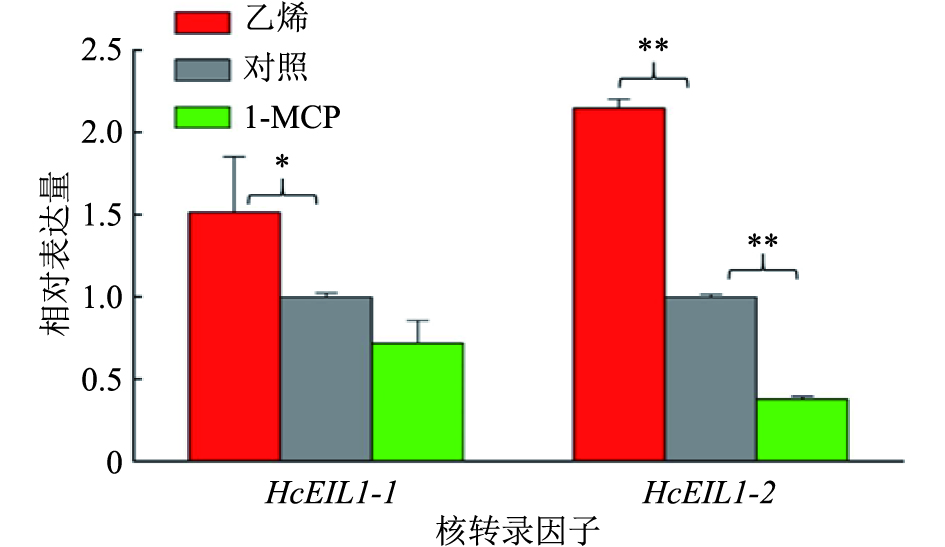
如图3所示,白姜花乙烯信号途径中的核转录因子HcEIL1-1和HcEIL1-2的表达与花香释放规律相似。乙烯处理提升了HcEIL1-1和HcEIL1-2的表达量,其中HcEIL1-1的表达量上升了51%且达到了显著性差异,HcEIL1-2的表达量上升了114%且达到了极显著性差异;而1-MCP处理降低了HcEIL1-1和HcEIL1-2的表达量,其中HcEIL1-1的表达量下降了30%,但未达到显著性差异,HcEIL1-2的表达量下降了60%,且达到了极显著性差异。结合前文比较,HcEIL1-1和HcEIL1-2基因的表达跟外源乙烯处理和1-MCP处理后的花香物质释放规律相一致,也和不同处理后的花香功能基因表达趋于一致。说明HcEIL1-1和HcEIL1-2这2个转录因子可能参与调节了花香物质的释放,并且可能直接或间接地调控了花香功能基因的表达。
|
图 3 乙烯和1-MCP处理对HcEIL1-1和HcEIL1-2表达的影响 Figure 3 Effects of ethylene and 1-MCP treatments on the expressions of HcEIL1-1 and HcEIL1-2 “*”和“**”分别表示与对照差异达到0.05和0.01的显著水平(单因素方差分析) |
植物花香物质的释放是一个非常复杂的过程,除了受各种环境因素的影响,植物激素和其他生长调节剂的作用也非常关键。乙烯作为一种植物激素,不仅在调控植物生长、发育和衰老等方面发挥着重要作用,也对花香物质的释放起着不可或缺的调节作用。本研究选取具有浓郁香气的白姜花为试验材料,其主要香气成分为萜类化合物,本研究观测了乙烯处理以及乙烯抑制剂1-MCP处理对白姜花花香物质释放的影响。试验发现,与对照组相比,乙烯处理可以使白姜花萜类化合物的挥发量上升,例如罗勒烯和法尼烯分别上升了23%和31%;而1-MCP处理使白姜花萜类化合物的挥发量下降,例如罗勒烯和法尼烯分别下降了19%和30%。该结果与其他科研人员的研究结果不同,乙烯处理香豌豆[9]和桂花[10]使得罗勒烯等萜类化合物挥发量下降,而香石竹[17]和月季[18]中用乙烯处理不会对花香物质的释放造成明显影响,说明不同花卉种类对乙烯的反应有差异,在不同物种之间,乙烯对花香物质释放的调控作用是不同的。
荧光定量PCR试验结果表明,乙烯处理后,相关萜类花香合成酶基因的表达量会上升,例如HcTPS3的表达量上升了182%;而1-MCP处理后,相关萜类花香合成酶基因的表达量会下降,例如HcTPS10下降了30%,这些结果说明乙烯可以调控相关花香功能基因的表达。与测气结果对比发现,萜类花香物质的释放与其合成功能基因的表达是一致的,说明乙烯处理能提高萜类花香合成酶基因表达,从而提高白姜花萜类花香物质的释放。
自从EIN3/EIL1基因被发现以来,人们对模式植物拟南芥中的EIN3/EIL1家族基因进行了系统深入的研究,发现大部分乙烯相关的生物学过程都跟转录因子EIN3/EIL1有关[19-20]。而EIN3/EIL1是乙烯信号转导途径中重要的核转录因子,其参与乙烯信号转导[21]、种子萌发[22]、调节乙烯与其他信号的交叉对话[23]、盐胁迫响应[24]等生物学过程。而在本次试验中,我们发现白姜花乙烯信号途径中的HcEIL1-1和HcEIL1-2的表达情况与罗勒烯等花香物质释放规律相同,根据已报道的文献,EIN3/EIL1是乙烯信号途径中的关键转录因子,所以推测HcEIL1-1和HcEIL1-2是乙烯调控白姜花香气物质释放的一个关键节点。因此在以后的试验中可以侧重于研究核转录因子HcEIL1-1和HcEIL1-2是如何调节花香功能基因的表达,或者探索这2个核转录因子是怎样沟通其他通路共同调节花香物质的释放。
花香被誉为花卉的灵魂,是花卉的主要观赏性状之一,而我们试验发现乙烯能提升白姜花特征香气的释放,所以在实际应用中可以用乙烯处理白姜花使香气更加浓郁,从而提高白姜花的观赏价值和经济价值。本研究初步探讨了相关萜类花香合成酶基因和乙烯信号途径关键核转录因子HcEIL-1和HcEIL1-2的表达规律,为进一步研究白姜花花香调控机制以及白姜花分子育种奠定了一定的基础,也为其他香型花卉香气物质释放的调节提供了一定的参考价值。
| [1] |
李瑞红, 范燕萍. 白姜花不同开花时期的香味组分及其变化[J]. 植物生理学通讯, 2007, 43(1): 176-180. (  0) 0) |
| [2] |
岳跃冲, 范燕萍. 植物萜类合成酶及其代谢调控的研究进展[J]. 园艺学报, 2011, 38(2): 379-388. (  0) 0) |
| [3] |
ARC E, SECHET J, CORBINEAU F, et al. ABA crosstalk with ethylene and nitric oxide in seed dormancy and germination[J]. Front Plant Sci, 2013, 4: 63. DOI:10.3389/fpls.2013.00063 (  0) 0) |
| [4] |
WANG Q, ZHANG W, YIN Z, et al. Rice CONSTITUTIVE TRIPLE-RESPONSE2 is involved in the ethylene-receptor signalling and regulation of various aspects of rice growth and development[J]. J Exp Bot, 2013, 64(16): 4863-4875. DOI:10.1093/jxb/ert272 (  0) 0) |
| [5] |
IQBAL N, KHAN N A, FERRANTE A, et al. Ethylene role in plant growth, development and senescence: Interaction with other phytohormones[J]. Front Plant Sci, 2017, 8: 475. DOI:10.3389/fpls.2017.00475 (  0) 0) |
| [6] |
BARRY C S, GIOVANNONI J J. Ethylene and fruit ripening[J]. J Plant Growth Regul, 2007, 26(2): 143-159. DOI:10.1007/s00344-007-9002-y (  0) 0) |
| [7] |
NEGRE F, KISH C M, BOATRIGHT J, et al. Regulation of methylbenzoate emission after pollination in snapdragon and petunia flowers[J]. Plant Cell, 2003, 15(12): 2992-3006. DOI:10.1105/tpc.016766 (  0) 0) |
| [8] |
UNDERWOOD B A, TIEMAN D M, SHIBUYA K, et al. Ethylene-regulated floral volatile synthesis in Petunia corollas
[J]. Plant Physiol, 2005, 138(1): 255-266. DOI:10.1104/pp.104.051144 (  0) 0) |
| [9] |
SEXTON R, STOPFORD A P, MOODIE W T, et al. Aroma production from cut sweet pea flowers (Lathyrusodoratus): The role of ethylene
[J]. Physiol Plantarum, 2005, 124(3): 381-389. DOI:10.1111/ppl.2005.124.issue-3 (  0) 0) |
| [10] |
邹晶晶. 乙烯对桂花花色花香成分的影响[C]//张启翔. 中国观赏园艺研究进展2017. 成都: 中国林业出版社, 2017: 458-462.
(  0) 0) |
| [11] |
LI G, JIA H, LI J, et al. Effects of 1-MCP on volatile production and transcription of ester biosynthesis related genes under cold storage in ‘Ruanerli’ pear fruit (Pyrusussuriensis Maxim.)
[J]. Postharvest Biol Tec, 2016, 111: 168-174. DOI:10.1016/j.postharvbio.2015.08.011 (  0) 0) |
| [12] |
王宝春, 颉敏华, 王学喜, 等. 1-MCP处理对冷藏期间花牛苹果香气成分和果实品质的影响[J]. 食品工业科技, 2017, 38(7): 331-339. (  0) 0) |
| [13] |
马婷, 任亚梅, 张艳宜, 等. 1-MCP处理对‘亚特’猕猴桃果实香气的影响[J]. 食品科学, 2016, 37(2): 276-281. (  0) 0) |
| [14] |
范燕萍, 余让才, 黄蕴, 等. 姜花挥发性成分的固相微萃取: 气相色谱质谱分析[J]. 园艺学报, 2003, 30(4): 475-475. (  0) 0) |
| [15] |
刘洋. 百合COP1和SPA对光的响应及在花香形成中的作用[D].广州: 华南农业大学, 2016.
(  0) 0) |
| [16] |
CHEN H, XUE L, CHINTAMANANI S, et al. ETHYLENE INSENSITIVE3 and ETHYLENE INSENSITIVE3-LIKE1 repress SALICYLIC ACID INDUCTION DEFICIENT2 expression to negatively regulate plant innate immunity in Arabidopsis
[J]. Plant Cell, 2009, 21(8): 2527-2540. DOI:10.1105/tpc.108.065193 (  0) 0) |
| [17] |
SCHADE F, LEGGE R L, THOMPSON J E. Fragrance volatiles of developing and senescing carnation flowers[J]. Phytochemistry, 2001, 56(7): 703-710. DOI:10.1016/S0031-9422(00)00483-0 (  0) 0) |
| [18] |
BORDA A M, CLARK D G, HUBER D J, et al. Effects of ethylene on volatile emission and fragrance in cut roses: The relationship between fragrance and vase life[J]. Postharvest Biol Tec, 2011, 59(3): 245-252. DOI:10.1016/j.postharvbio.2010.09.008 (  0) 0) |
| [19] |
CHANG KN, SHAN Z, WEIRAUCH M T, et al. Temporal transcriptional response to ethylene gas drives growth hormone cross-regulation in Arabidopsis
[J]. Elife, 2013, 2(11): 1-20. (  0) 0) |
| [20] |
WAWRZYNSKA A, SIRKO A. EIN3 interferes with the sulfur deficiency signaling in Arabidopsis thaliana through direct interaction with the SLIM1 transcription factor
[J]. Plant Sci, 2016, 253: 50-57. DOI:10.1016/j.plantsci.2016.09.002 (  0) 0) |
| [21] |
MBEGUIE-A-MBEGUIE D, HUBERT O, FILS-LYCAON B, et al. EIN3-like gene expression during fruit ripening of Cavendish banana (Musa acuminata cv. Grande naine)
[J]. Physiol Plantarum, 2008, 133(2): 435-448. DOI:10.1111/j.1399-3054.2008.01083.x (  0) 0) |
| [22] |
LI X, PAN Y, CHANG B, et al. NO promotes seed germination and seedling growth under high salt may depend on EIN3 protein in Arabidopsis
[J]. Front Plant Sci, 2016, 6: 1203. DOI:10.3389/fpls.2015.01203 (  0) 0) |
| [23] |
ZHU Z, AN F, FENG Y, et al. Derepression of ethylene-stabilized transcription factors (EIN3/EIL1) mediates jasmonate and ethylene signaling synergy in Arabidopsis
[J]. P Natl Acad Sci USA, 2011, 108(30): 12539-12544. DOI:10.1073/pnas.1103959108 (  0) 0) |
| [24] |
PENG J, LI Z, WEN X, et al. Salt-induced stabilization of EIN3/EIL1 confers salinity tolerance by deterring ROS accumulation in Arabidopsis
[J]. PLoS Genet, 2014, 10(10): e1004664. DOI:10.1371/journal.pgen.1004664 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


