2. 吉林农业大学 中药材学院 吉林 长春 130118;
3. 吉林大学 生命科学学院 吉林 长春 130012
2. Chinese Medicinal College, Jilin Agricultural University, Changchun 130118, China;
3. College of Life Sciences, Jilin University, Changchun 130012, China
炎症是一种十分常见的病理过程[1],组织对损伤因子所发生的防御反应均被视为炎症。当外界病原微生物或化学物质入侵机体时,机体产生自发反应来维持自身稳态, 许多致炎因子通过内源性化学因子的作用造成炎症并导致多种疾病的发生。脂多糖(Lipopolysaccharides,LPS)来源于革兰阴性菌细胞外壁[2-3],当机体被细菌感染或受到外界刺激时,LPS会结合到Toll样受体(Toll-like receptor, TLR)上,促使免疫细胞分泌大量肿瘤坏死因子、白介素因子等炎症因子,导致机体全身性炎症反应。如今被广泛使用的甾体抗炎药和非甾体抗炎药虽然对骨关节炎、类风湿性关节炎、多种发热和各种疼痛症状有缓解作用,但对胃肠道、肾脏及其他一些器官均存在副作用。寻找一种高效且副作用小的抗炎药是目前亟待解决的问题之一。虾青素(Astaxanthin,AST),一种类胡萝卜素,广泛存在于生物界,具有抗肿瘤、增强免疫力等生理功能,炎症通常是自由基导致的氧化损伤所致,虾青素较强的抗氧化特性有助于抑制自由基,减少其对关节的氧化损害[4]。本试验拟建立IPEC-J2细胞和转染IPEC-J2细胞炎症模型来研究虾青素对炎症的反应,为虾青素在疾病预防和炎症治疗方面的应用提供理论基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂虾青素、LPS、MTT溶液(美国Sigma公司);DMEM basic、胎牛血清、Trypsin-EDTA(美国Thermo Fisher Scientific公司);Penicillin-Streptomycin(美国HyClone公司);DMSO(北京Solarbio公司);RNA Lyzol(上海ExCell Bio公司);First-Strand cDNA Synthesis Kit(美国GeneCopoeia公司);SYBR Premix Ex Taq酶(日本TaKaRa公司);引物(上海生工生物) ELISA试剂盒(上海朗顿生物)。
1.1.2 主要仪器二氧化碳恒温细胞培养箱(德国Binder公司);倒置相差显微镜及全自动显微摄像装置(日本Olympus公司);Thermo酶标仪(上海赛默飞世尔仪器);高速冷冻离心机(德国Sigma公司);荧光定量PCR仪(美国Bio-Rad公司)。
1.2 方法 1.2.1 细胞培养及分组仔猪空肠上皮细胞系(IPEC-J2)和MyD88稳定转染IPEC-J2第5代细胞系(转染IPEC-J2)保存于吉林农业大学细胞生物学实验室。将按照常规方法复苏的细胞放入含体积分数为10%的胎牛血清和双抗的DMEM培养基中,置于37 ℃、CO2体积分数为5%的恒温培养箱内培养,待细胞生长至铺满培养瓶但不重叠前用胰酶消化传代。根据不同的试验目的,分别将细胞移入6孔细胞板或96孔细胞板中继续培养,试验分为4组:对照组、虾青素组(AST组)、脂多糖组(LPS组)、虾青素预保护组(AST+LPS组)。
1.2.2 MTT法检测虾青素对IPEC-J2细胞和转染IPEC-J2细胞活力的影响细胞以1×105 mL–1接种至96孔培养板中,100 μL·孔–1,置于37 ℃、CO2体积分数为5%的恒温培养箱内培养12 h后,加入虾青素,设置虾青素浓度梯度为0、10、50、100、150、200 μmol·L–1,每个梯度10 个重复,分别处理1、3、6 h后弃上清液,加入100 μL 1 mg·mL–1的MTT溶液,培养1 h后弃掉MTT溶液,每孔加100 μL的DMSO,振荡器平行摇动5 min,酶标仪490 nm波长下测其光密度,以细胞活力最高为选取标准,选取处理IPEC-J2细胞和转染IPEC-J2细胞的最佳虾青素处理浓度和处理时间。
1.2.3 MTT法检测脂多糖对IPEC-J2细胞和转染IPEC-J2细胞活力的影响参照“1.2.2”的步骤培养细胞12 h后,加入LPS,设置6个LPS质量浓度梯度:0、10、50、80、100、200 ng·mL–1,每个梯度10 个重复,分别处理3、6、12 h后弃上清液,然后参照“1.2.2”用MTT法确定处理IPEC-J2细胞和转染IPEC-J2细胞的最佳LPS处理浓度和处理时间。
1.2.4 实时荧光定量PCR检测虾青素对脂多糖刺激细胞炎症因子表达的影响细胞以2×106 mL–1接到6孔细胞板中,2 mL·孔–1,置于37 ℃、CO2体积分数为5%的恒温培养箱内培养12 h后,根据不同分组对细胞进行相应处理。参照RNA Lyzol说明书提取RNA后检测RNA质量浓度,使其D260 nm/D280 nm在1.8~2.0之间;根据cDNA说明书将RNA转录为cDNA;实时荧光定量PCR采用20 μL反应体系:SYBR Premix 10 μL、上下游引物各1 μL、cDNA模板2 μL、ddH2O 6 μL。扩增条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环;65 ℃ 5 s,95 ℃ 5 s。自动采集荧光,每次试验均设置GADPH基因作为内参,用 2–ΔΔCt法计算炎性因子的相对表达量,引物序列[5]见表1。
|
|
表 1 荧光定量PCR引物序列表 Table 1 Fluorescence quantitative PCR primer sequences |
用PBS缓冲液稀释预处理好的细胞,调整细胞至1×106 mL–1。反复冻融破碎细胞使其释放胞内成分,2 000~3 000 r·min–1离心20 min后仔细收集上清液。参照ELISA试剂盒说明书操作,根据细胞浓度和D450 nm绘制标准曲线,算出回归方程。
1.3 数据分析所有数据在Excel中初步归纳整理后,用SPSS19.0统计软件进行单因素方差分析,采用Duncan’s法对不同处理组进行多重比较,采用t检验分析IPEC-J2细胞和转染IPEC-J2细胞的差异。
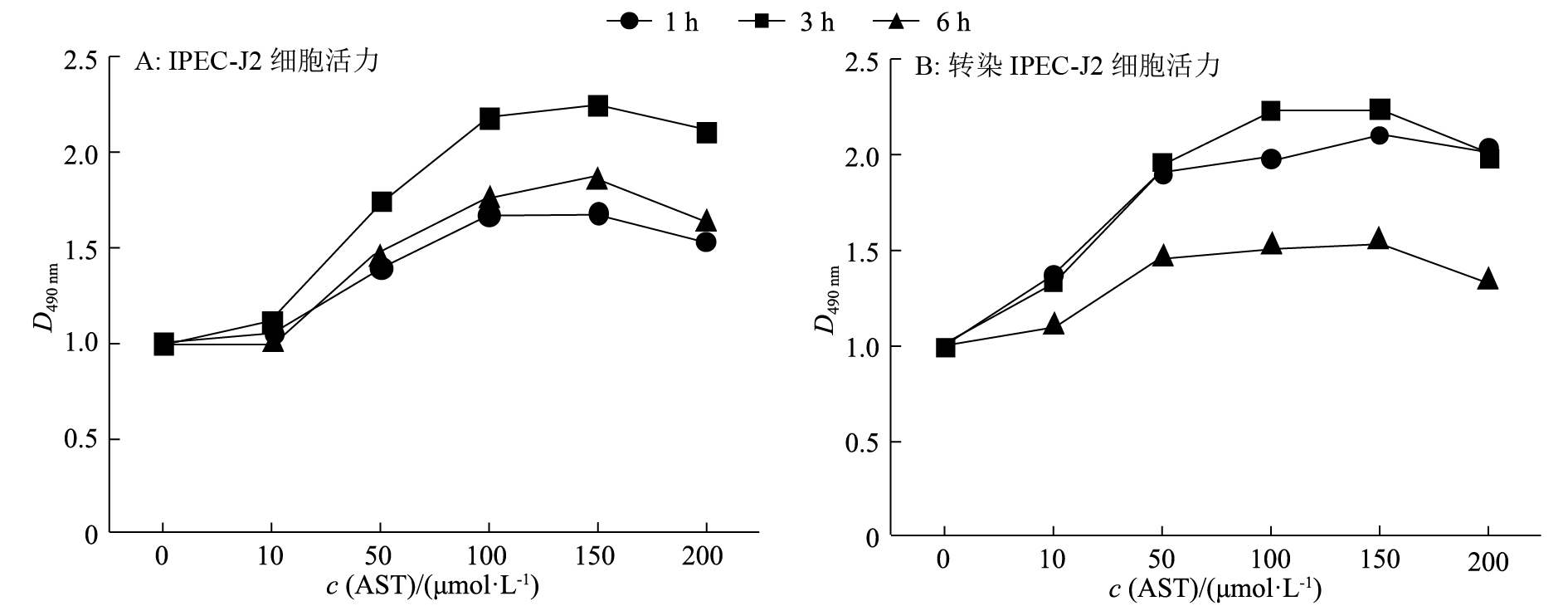
2 结果与分析 2.1 虾青素对IPEC-J2细胞和转染IPEC-J2细胞活力的影响用不同浓度的虾青素(0、10、50、100、150、200 μmol·L–1)分别处理IPEC-J2细胞和转染IPEC-J2细胞1 、3 和6 h。由图1A可知,随着虾青素浓度的升高,IPEC-J2细胞活力呈先升后降的趋势,当处理3 h且虾青素浓度为150 μmol·L–1时,IPEC-J2细胞活力达到峰值,显著高于其他组(P<0.05)。由图1B可知,当虾青素处理3 h、浓度达100和150 μmol·L–1时,转染IPEC-J2细胞活力均显著高于其他组,为了与IPEC-J2细胞处理条件相一致,所以后续试验采用150 μmol·L–1的虾青素。
|
图 1 虾青素处理对IPEC-J2细胞和转染IPEC-J2细胞活力的影响 Figure 1 Effects of astaxanthin treatment on vitalities of IPEC-J2 cells and transfected IPEC-J2 cells |
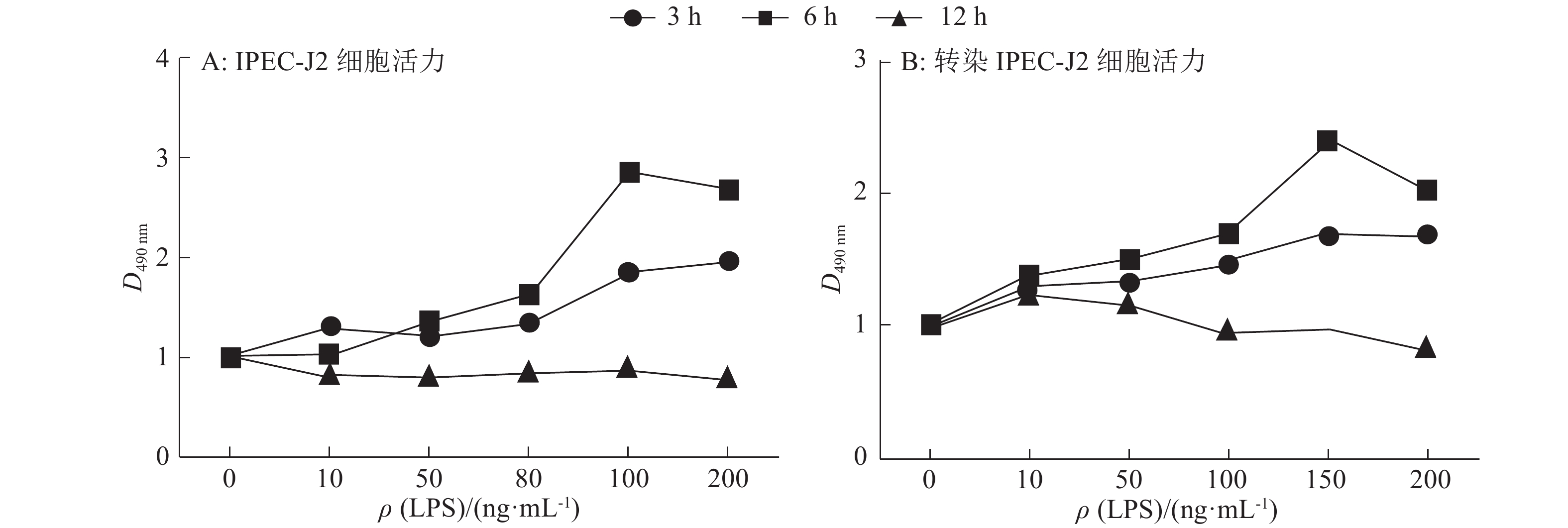
用不同质量浓度的LPS(0、10、50、80、100、200 ng·mL–1)分别处理IPEC-J2细胞和转染IPEC-J2细胞3 、6 和12 h。如图2所示,当用100 ng·mL–1LPS处理6 h时,IPEC-J2细胞和转染IPEC-J2细胞活力均达到峰值,显著高于其他组。
|
图 3 虾青素对脂多糖刺激细胞炎症因子表达的影响 Figure 3 Effects of astaxanthin on expression of cell inflammatory factors stimulated by LPS 图中数据为平均数±标准误(n=6);各图中柱子上凡具有一个相同大、小写字母者,表示同种细胞的不同处理间差异不显著(P>0.05, Duncan’s法);*表示相同处理不同细胞间差异达0.05的显著水平(t检验) |
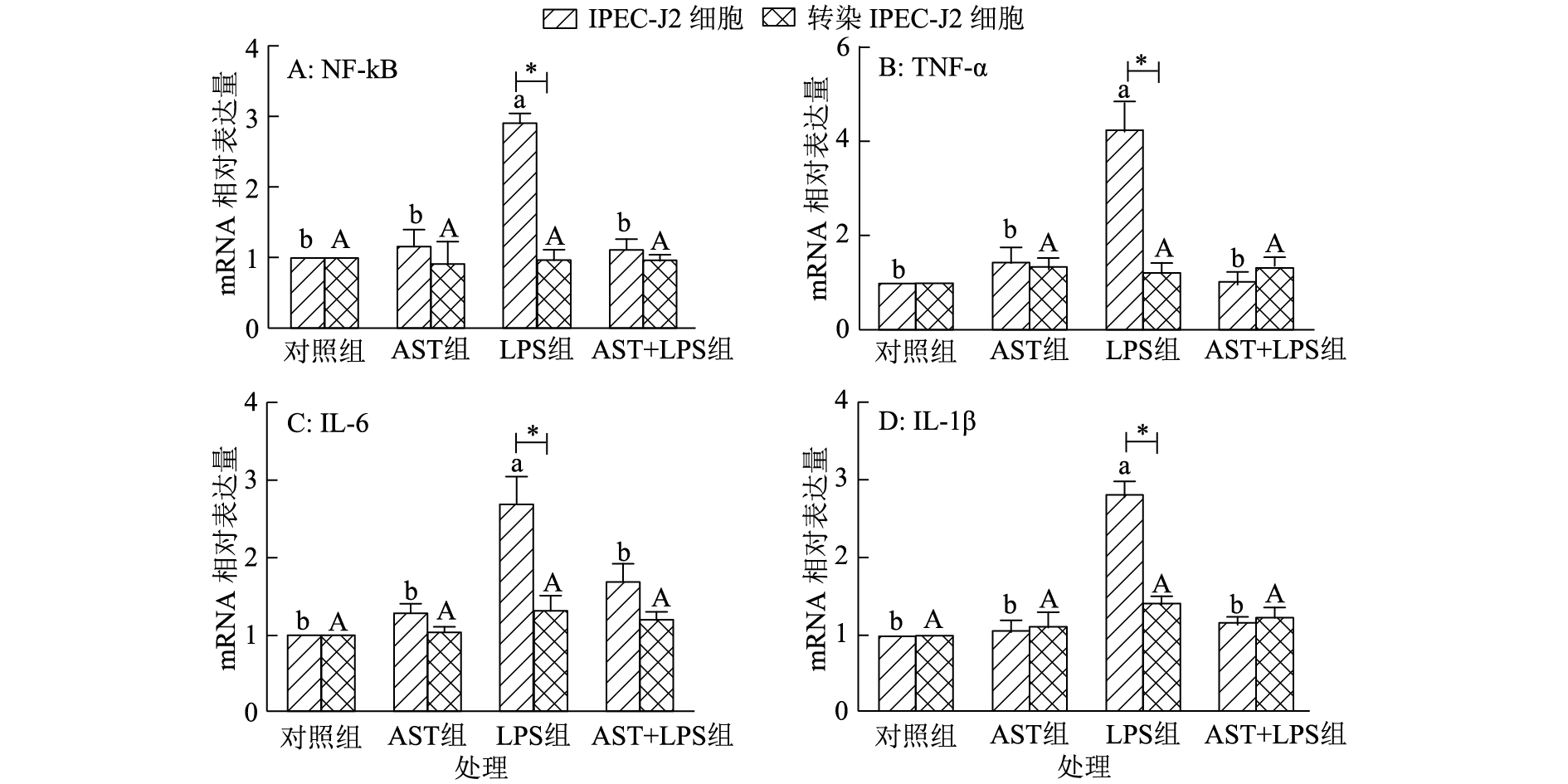
NF-κB是动物炎症调节最重要的信号通路之一,细胞受到炎症介质影响后,LPS可以通过TLR4激活下游NF-κB信号通路,引起细胞炎症因子(NF-κB、TNF-α、IL-6、IL-1β)的表达上调,炎症因子的表达量是衡量炎症严重程度的一个重要指标[6]。如图3所示,IPEC-J2细胞AST组和AST+LPS组与对照组相比无显著差异,而LPS组炎症因子mRNA相对表达量显著高于对照组,说明虾青素预保护能够显著降低LPS刺激正常IPEC-J2细胞促炎基因的mRNA相对表达量。但当IPEC-J2细胞内MyD88蛋白被抑制后,转染IPEC-J2细胞LPS组mRNA相对表达量显著低于IPEC-J2细胞LPS组,虾青素预处理对LPS诱导的炎症因子mRNA相对表达量无显著差异,这与虾青素预保护LPS诱导正常IPEC-J2细胞形成强烈反差。
|
图 2 脂多糖处理对IPEC-J2细胞和转染IPEC-J2细胞活力的影响 Figure 2 Effects of LPS treatment on vitalities of IPEC-J2 cells and transfected IPEC-J2 cells |
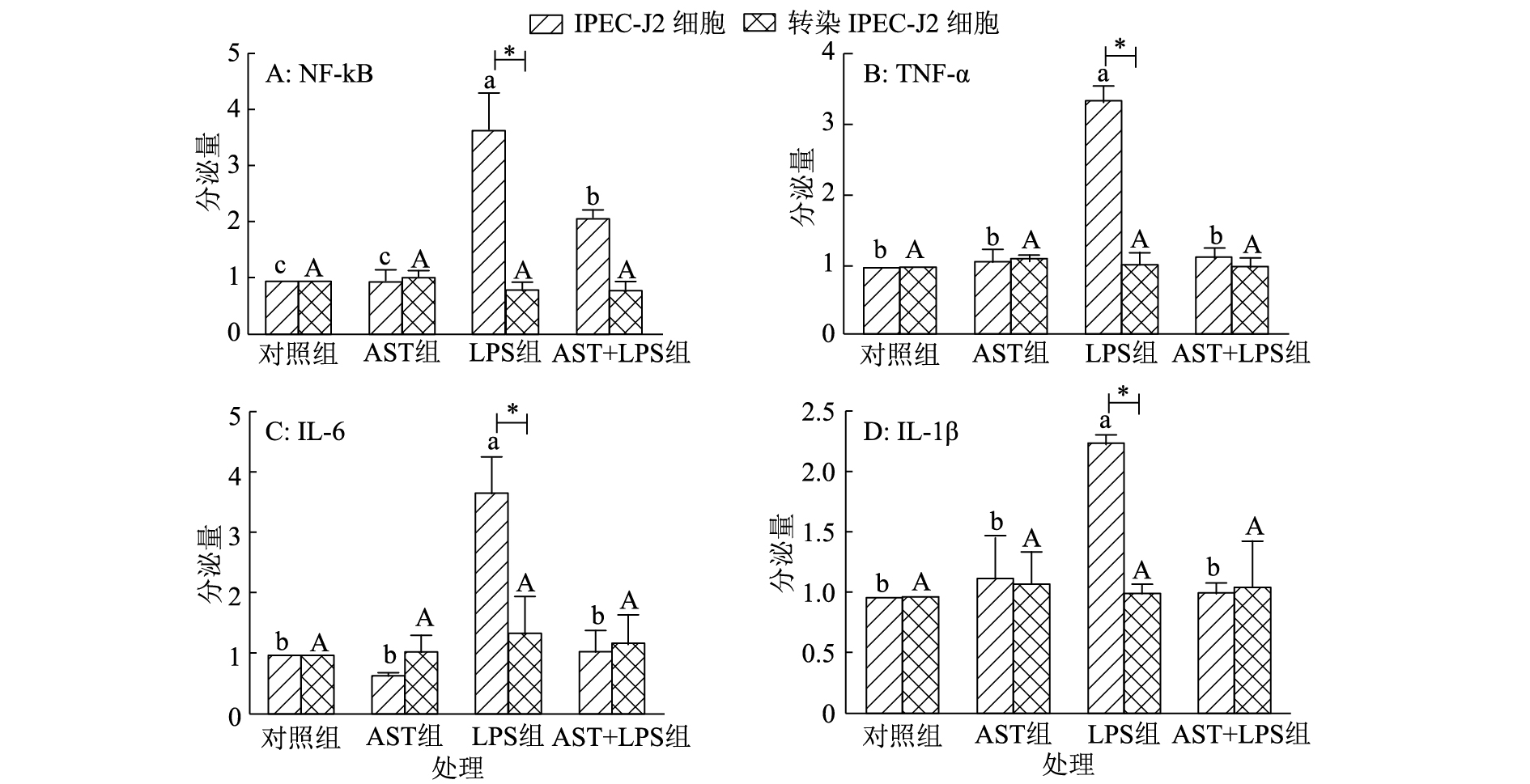
LPS通过TLR4/MyD88/NF-κB信号通路诱导细胞炎症反应[7]。如图4所示,IPEC-J2细胞AST组和AST+LPS组与对照组相比无显著差异,而LPS组炎症因子分泌量显著高于对照组,说明虾青素能够显著降低LPS诱导下对正常IPEC-J2细胞炎症因子的分泌量。但当IPEC-J2细胞内MyD88蛋白被抑制后,转染IPEC-J2细胞LPS组的炎症因子分泌量显著低于IPEC-J2细胞LPS组,虾青素预处理对LPS诱导的炎症因子分泌量无显著差异,这与虾青素预保护LPS诱导正常IPEC-J2细胞形成鲜明对比。由此可以推断,虾青素对细胞炎症的保护作用与TLR4/MyD88/NF-κB信号通路相关。
|
图 4 虾青素对脂多糖刺激细胞炎症因子分泌的影响 Figure 4 Effects of the astaxanthin on secretion of cell inflammatory factors stimulated by LPS 图中数据为平均数±标准误(n=8);各图中柱子上凡具有一个相同大、小写字母者,表示同种细胞的不同处理间差异不显著(P>0.05, Duncan’s法);*表示不同细胞间差异达0.05的显著水平(t检验) |
炎症是机体对外界病毒或化学物质入侵而产生的维持机体自身稳态的自发反应,参与免疫反应的早期和炎症反应各阶段的许多分子都受NF-κB的调控,包括:TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX2、趋化因子、黏附分子、集落刺激因子等[8]。其中NF-κB、TNF-α、IL-6、IL-1β都是多细胞的来源因子,在很多疾病的发生和转化中起到了重要作用。白细胞介素1是由单核细胞、内皮细胞、成纤维细胞和其他类型细胞在应答感染时产生的细胞因子,包括IL-1α与IL-1β 2种类型,其能刺激集落刺激因子、血小板生长因子等细胞因子的产生和使T细胞产生白细胞介素2,在免疫应答和组织修复中起作用[9]。白细胞介素6由纤维母细胞、巨噬细胞、T淋巴细胞、B淋巴细胞、上皮细胞、角质细胞以及多种瘤细胞产生。白细胞介素6能够刺激参与免疫反应的细胞增殖、分化并提高其功能[10]。TNF-α是前期炎症反应中最先产生并且起到最关键作用的炎症因子,主要是由活化的免疫细胞释放的一类免疫调节因子,它诱导生物体代谢,引发一系列炎症介质的产生,进而造成炎性因子的瀑布效应。TNF-α是导致许多疾病生物学变化的重要递质,其分泌量是炎症病理过程中严重程度的标志[11]。
现如今各种炎症严重威胁着我国人民的生命健康,增加不饱和脂肪酸、维生素E、膳食纤维和新鲜果蔬的摄入,有助于控制炎症的发生,除了这些膳食营养的生理调控外,非营养成分对炎症的预防和治疗也成为新的研究热点,其中类胡萝卜素(虾青素、番茄红素和叶黄素等)、多酚类及含硫化合物值得进一步研究[12]。其中,虾青素是一种非维生素A原的类胡萝卜素,主要存在于海洋动植物中,特别是野生红球藻、蟹、虾和鸟类的羽毛中[13]。虾青素作为自然界存在的一种具有高度活性的化合物,其抗氧化性能主要表现在淬灭单线态氧、清除自由基、降低膜的流动性、稳定膜结构、增加抗氧化酶的活性、抑制脂质过氧化等方面[14]。本研究结果表明,AST+LPS组与LPS组差异显著,说明虾青素可以抑制LPS产生的炎症反应,可在临床上起到一定的积极作用。
目的基因的转染是将具有特定功能的核酸转移到细胞内,使该核酸能够在细胞内仍维持生物功能。本试验采用稳定转染细胞系,通过慢病毒侵染的方式建立最稳定MyD88 shRNA的IPEC-J2细胞系。TLR4有2条信号转导途径,MyD88依赖性反应通路和非MyD88依赖性反应通路。MyD88依赖性反应通路会引起细胞内不同信号途径的转导,最终致使NF-κB的激活[15]。TLR4不仅是LPS的信号分子,也是LPS的受体。LPS作为一种多克隆免疫激发剂可模拟机体免疫激发状态, 是研究免疫系统与神经系统之间信息交流的常用模型[16]。革兰阴性菌死亡溶解时会诱发大量LPS释放,当LPS进入血液循环时,就会激发机体启动炎症信号转导[17],通过MyD88途径激活NF-κB,不仅导致肿瘤细胞自主遗传改变(如扩增、突变或缺失),还可调控炎性因子分泌,循环趋化肿瘤细胞生长、侵袭[18]。本试验结果表明,当IPEC-J2细胞内MyD88蛋白被抑制后,转染IPEC-J2细胞LPS组的各项指标均显著低于IPEC-J2细胞LPS组,虾青素预处理对LPS诱导的各项指标无显著差异,这与虾青素预保护LPS诱导正常IPEC-J2细胞形成鲜明对比。Feng等[19]研究表明,当MyD88基因敲除后,细胞的炎症因子表达均显著降低。Li等[20]研究表明,MyD88表达受干扰后,NF-κB表达量显著降低, 该发现与本试验结果相似。由此可以推断,虾青素对细胞炎症的保护作用与TLR4/MyD88/NF-κB信号通路相关。
| [1] |
ADEREM A, ULEVITCH R J. Toll-like receptors in the induction of the innate immune response[J]. Nature, 2000, 406(6797): 782-787. DOI:10.1038/35021228 (  0) 0) |
| [2] |
KOLEK M J, CARLQUIST J F, MUHLESTEIN J B, et al. Toll-like receptor 4 gene Asp299Gly polymorphism is associated with reductions in vascular inflammation, angiographic coronary artery disease, and clinical diabetes[J]. Am Heart J, 2004, 148(6): 1034-1040. DOI:10.1016/j.ahj.2004.05.049 (  0) 0) |
| [3] |
MANDREKAR P, PRUETT S, ARTEEL G, et al. RSA 2004: Combined basic research satellite symposium-session two: Toll-like receptors and organ damage[J]. Alcohol Clin Exp Res, 2005, 29(9): 1744-1748. DOI:10.1097/01.alc.0000179315.09591.55 (  0) 0) |
| [4] |
ZULUAGA M, GUEGUEN V, LETOURNEUR D, et al. Astaxanthin-antioxidant impact on excessive reactive oxygen species generation induced by ischemia and reperfusion injury[J]. Chem Biol Interact, 2018(279): 145-158. (  0) 0) |
| [5] |
吴旻. β–胡萝卜素对脂多糖诱导的IPEC-J2细胞炎症的保护作用及其机制[D]. 长春: 吉林农业大学, 2016.
(  0) 0) |
| [6] |
张晓音, 张珊珊, 吴旻, 等. β–胡萝卜素对脂多糖刺激巨噬细胞RAW264.7炎症因子的影响及其机制
[J]. 中国免疫学杂志, 2017, 33(6): 838-843. (  0) 0) |
| [7] |
张晓音, 吴旻, 张珊珊, 等. β–胡萝卜素的不同添加方式对脂多糖刺激的RAW264.7细胞炎症的影响
[J]. 中国农业大学学报, 2017, 22(11): 114-120. (  0) 0) |
| [8] |
BAUD V, DERUDDER E. Control of NF-κB activity by proteolysis[J]. Curr Top Microbiol Immunol, 2011, 349: 97-114. (  0) 0) |
| [9] |
BOSMANN M, GRAILER J J, RUEMMLER R, et al. Extracellular histones are essential effectors of C5aR-and C5L2-mediated tissue damage and inflammation in acute lung injury[J]. FASEB J, 2013, 27(12): 5010-5021. DOI:10.1096/fj.13-236380 (  0) 0) |
| [10] |
GOKCINAR D, ERGIN V, CUMAOGLU A, et al. Effects of ketamine, propofol, and ketofol on proinflammatory cytokines and markers of oxidative stress in a rat model of endotoxemia-induced acute lung injury[J]. Acta Biochim Pol, 2013, 60(3): 451-456. (  0) 0) |
| [11] |
AOKI Y, NAKAHARA T, ASANO D, et al. Preventive effects of rapamycin on inflammation and capillary degeneration in a rat model of NMDA-induced retinal injury[J]. Biol Pharm Bull, 2015, 38(2): 321-324. DOI:10.1248/bpb.b14-00631 (  0) 0) |
| [12] |
INOUE M, TANABE H, MATSUMOTO A, et al. Astaxanthin functions differently as a selective peroxisome proliferator-activated receptor γ modulator in adipocytes and macrophages[J]. Biochem Pharmacol, 2012, 84(5): 692-700. DOI:10.1016/j.bcp.2012.05.021 (  0) 0) |
| [13] |
CHAN K C, MONG M C, YIN M C. Antioxidative and anti-inflammatory neuroprotective effects of astaxanthin and canthaxanthin in nerve growth factor differentiated PC12 cells[J]. J Food Sci, 2009, 74(7): H225-H231. DOI:10.1111/jfds.2009.74.issue-7 (  0) 0) |
| [14] |
TRIPATHI D N, JENA G B. Astaxanthin intervention ameliorates cyclophosphamide-induced oxidative stress, DNA damage and early hepatocarcinogenesis in rat: Role of Nrf2, p53, p38 and phase-II enzymes[J]. Mutat Res, 2010, 696(1): 69-80. DOI:10.1016/j.mrgentox.2009.12.014 (  0) 0) |
| [15] |
XIAO M, ZHU T, ZHANG W, et al. Emodin ameliorates LPS-induced acute lung injury, involving the inactivation of NF-κB in mice[J]. Int J Mol Sci, 2014, 15(11): 19355-19368. DOI:10.3390/ijms151119355 (  0) 0) |
| [16] |
ZHANG X, XIONG H, LI H, et al. Protective effect of taraxasterol against LPS-induced endotoxic shock by modulating inflammatory responses in mice[J]. Immunopharm Immunotoxicol, 2014, 36(1): 11-16. DOI:10.3109/08923973.2013.861482 (  0) 0) |
| [17] |
HUANG Z Y, STABLER T, PEI F X, et al. Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation[J]. Osteoarthr Cartilage, 2016, 24(10): 1769-1775. DOI:10.1016/j.joca.2016.05.008 (  0) 0) |
| [18] |
KIM Y W, ZHAO R J, PARK S J, et al. Anti-inflammatory effects of liquiritigenin as a consequence of the inhibition of NF-κB dependent iNOS and proinflammatory cytokines production[J]. Brit J Pharmacol, 2008, 154(1): 165-173. DOI:10.1038/bjp.2008.79 (  0) 0) |
| [19] |
FENG Y, XU Z X, BUYS E S, et al. Innate immune adaptor MyD88 mediates neutrophil recruitment and myocardial injury after ischemia-reperfusion in mice[J]. Am J Physiol Heart Circ Physiol, 2008, 295(3): H1311-H1318. DOI:10.1152/ajpheart.00119.2008 (  0) 0) |
| [20] |
LI Y H, WANG J B, LI M H, et al. Quantification of brain edema and hemorrhage by MRI after experimental traumatic brain injury in rabbits predicts subsequent functional outcome[J]. Neurol Sci, 2012, 33(4): 731-740. DOI:10.1007/s10072-011-0768-0 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


