目前,我国养殖业每年抗生素的消耗量高达8万t,然而抗生素在动物体内并不能完全代谢,约60%~90%以原型或代谢产物的形式随粪尿排至环境中[1-2]。同时,我国作为世界第一养猪大国,每年可产生猪粪8.64亿t[3],猪粪中残留量最大的抗生素为四环素类抗生素,占抗生素总残留量的73.5%[4]。金霉素属于四环素类抗生素,常作为饲料添加剂大量应用于畜禽养殖。调查福建省猪场附近耕地土壤中四环素类抗生素残留量,发现金霉素平均残留量最高,为55.6 μg·kg–1,检出率达75%[5]。残留在土壤中的四环素类抗生素会改变土壤微生物原有的群落结构,但牛粪可削弱四环素类抗生素的毒害作用[6]。相对于金霉素,四环素类抗生素耐药基因(Tetracycline resistance gene,TRG)是一种潜在危害更大的污染物。TRGs不仅能在细菌间通过质粒转移,而且在细菌死亡裂解被释放到外环境后仍能保持稳定继续传播[7]。土壤中的TRGs可能是土壤微生物自身携带,也可能是经畜禽粪便引入土壤中。在山东省9个猪场的TRGs相对含量检测中,土壤中TRGs相对含量为9.9×10–5~1.1×10–2,猪粪中TRGs相对含量为3.3×10–5~5.2×10–1[8]。堆放或者作为肥料施用携带四环素类抗生素和TRGs的猪粪,是其进入土壤环境的主要途径。目前有关猪粪中残留的四环素类抗生素和TRGs影响土壤微生物的研究尚少且不够深入。
本研究以金霉素作为胁迫因子,构建室内粪土金霉素暴露胁迫模型,模拟金霉素残留给土壤微生物带来的生态毒性效应,利用高通量测序技术研究菌群群落结构多样性的变化,通过qPCR技术研究TRGs相对含量的改变,为下一步养殖源性抗菌药物残留的生态风险评估提供一定依据。
1 材料与方法 1.1 材料金霉素购自大连美仑生物技术有限公司,纯度(w)95%;10×PCR Buffer、dNTP Mixture、rTaqDNA聚合酶和SYBR Premix Ex TaqII(宝生物染料法荧光定量试剂盒)等均由TaKaRa公司提供。猪粪采自广州市钟落潭镇某猪场(喂养的饲料不添加抗生素),土壤采自华南农业大学树木园无抗生素污染的5~20 cm表层,两者经检测均无抗生素残留。供试土壤为砂质粘壤土,pH 5.77、含水量(w)12.5%、总碳77 mg·kg–1、全氮660 mg·kg–1、总磷270 mg·kg–1。
1.2 方法 1.2.1 金霉素–猪粪–土壤模型构建土壤过2 mm筛后于黑暗条件下室温孵育7 d,猪粪于室温条件下平铺风干,粉碎过2 mm筛后置于–20 ℃冰箱保存。使用超纯水将金霉素配制成相应浓度的母液,并与猪粪、土壤充分混匀,分装到直径10 cm、高15 cm的棕色塑料花盆中,每个花盆土壤用量0.5 kg、猪粪用量10 g,设对照组和金霉素低、中、高剂量组,金霉素用量分别为0、10、100和1 000 μg,各组均设3次重复。各处理花盆置于25 ℃的室温条件下培养,每天定时浇超纯水,使土壤含水量为最大持水量的50%,每天光照时间为12 h。在处理后第1、7、14、28和56天的20:00—21:00采集样品并置于–20 ℃冰箱保存。试验分4期:Ⅰ期(第1~7天)、Ⅱ期(第8~14天)、Ⅲ期(第15~28天)和Ⅳ期(第29~56天)。
1.2.2 TRGs定性及定量检测称取0.9 g样品,依据E.Z.N.A®土壤DNA提取试剂盒(Omega Biotek,美国)的方法提取总DNA。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火30 s (温度见表1),72 ℃延伸45 s,35个循环;72℃延伸10 min[9]。目标TRGs和16S rDNA的引物设计如表1所示。采用25 μL的PCR反应体系:ddH2O 18.375 μL、10×PCR Buffer 2.5 μL、dNTP Mixture 2 μL、上下游引物各0.5 μL、DNA模板1 μL和rTaq DNA聚合酶 0.125 μL。经PCR产物回收、纯化、克隆、连接和质粒提取[10],送生工生物工程(上海)股份有限公司测序。
|
|
表 1 目的基因引物信息 Table 1 Primers of target genes |
对测序合格的质粒进行纯度和浓度检测,D260 nm/D280 nm在1.8~2.0之间,说明所提取的DNA纯度较高。对质粒进行10倍梯度稀释,计算质粒拷贝数,做qPCR标准曲线。采用20 μL的qPCR反应体系:SYBR Premix Ex Taq II 10 μL、ddH2O 7.4 μL、上下游引物各0.8 μL和DNA模板1 μL。每个样品设置3次重复,在LightCycler®96实时荧光定量PCR仪(Roche,瑞士)上反应。
1.2.3 高通量测序将第1、7、14、28、56天的对照组和金霉素低、中、高剂量组中设置的3次重复样品混合,提取DNA,送往金唯智广州公司测序。
1.3 数据分析采用ACE和Chao1指数评估群落丰富度,Shannon指数反映群落多样性。利用SPSS 23.0单因素方差分析对TRGs相对含量(TRGs相对含量=TRGs基因拷贝数/16S rDNA拷贝数)进行差异显著性分析,Fisher’s精确检验进行菌群丰度差异显著性分析,SigmaPlot进行图表绘制。TRGs相对含量的日消减率(Day dissipation rate,DDR)计算公式如下:
| ${\rm{DDR}} = \frac{{{{{N}}_1} - {{{N}}_2}}}{{{{{N}}_1} {{T}}}}\times 100{\text{%}} ,$ |
式中,T为相邻2个采样时间点的间隔时间,N1为TRGs在较前采样时间点样品中的相对含量,N2为TRGs在较后采样时间点样品中的相对含量。
2 结果与分析 2.1 金霉素胁迫下粪土模型中菌群多样性的变化 2.1.1 α多样性指数分析通过对各采样时间对照组和金霉素不同剂量组的宏基因组DNA进行高通量测序分析,每组均获得约32 000条克隆序列,在97%序列相似性水平上共获得456个不同种类的操作分类单元(OTU)。所有试验组的覆盖率均高于90%(表2),表明测序得到的OTU序列覆盖率高,能反映样品中绝大部分菌群的真实情况。随时间延长,各组OTU数量、ACE指数、Chao1指数和Shannon指数整体均呈上升趋势。第1天金霉素组的ACE指数和Chao1指数高于对照组,其余采样时间金霉素组的ACE指数和Chao1指数与对照组相近,可能提示金霉素在第1天对群落丰富度有促进作用,其余时间作用不明显。第7天随金霉素剂量升高,ACE指数从416降低至374,Chao1指数从437降低至388,其余采样时间金霉素不同剂量作用下ACE指数和Chao1指数变化不大,可能提示金霉素剂量升高在第7天减弱了金霉素对群落丰富度的促进作用。各采样时间金霉素组的Shannon指数均与对照组相近,提示金霉素对群落多样性的选择作用可能不明显。
|
|
表 2 金霉素胁迫下粪土模型中菌群α多样性指数分析 Table 2 Analysis of α diversity index of microflora in manure-soil model under chlortetracycline stress |
门水平群落结构组成如图1所示。试验第1天,厚壁菌门Firmicutes菌群相对丰度最高,其次为放线菌门Actinobacteria和变形菌门Proteobacteria;第7和14天,厚壁菌门相对丰度>变形菌门相对丰度>放线菌门相对丰度;第28和56天,变形菌门相对丰度>厚壁菌门相对丰度>放线菌门相对丰度。整个试验过程中,金霉素中、高剂量组放线菌门菌群的相对丰度显著高于对照组和低剂量组;金霉素低剂量组厚壁菌门第7、28和56天的相对丰度显著高于对照组,整个试验周期中、高剂量组相对丰度均显著低于对照组;变形菌门相对丰度除第28天各剂量金霉素组显著低于对照组外,其余时间多显著高于对照组(表3)。
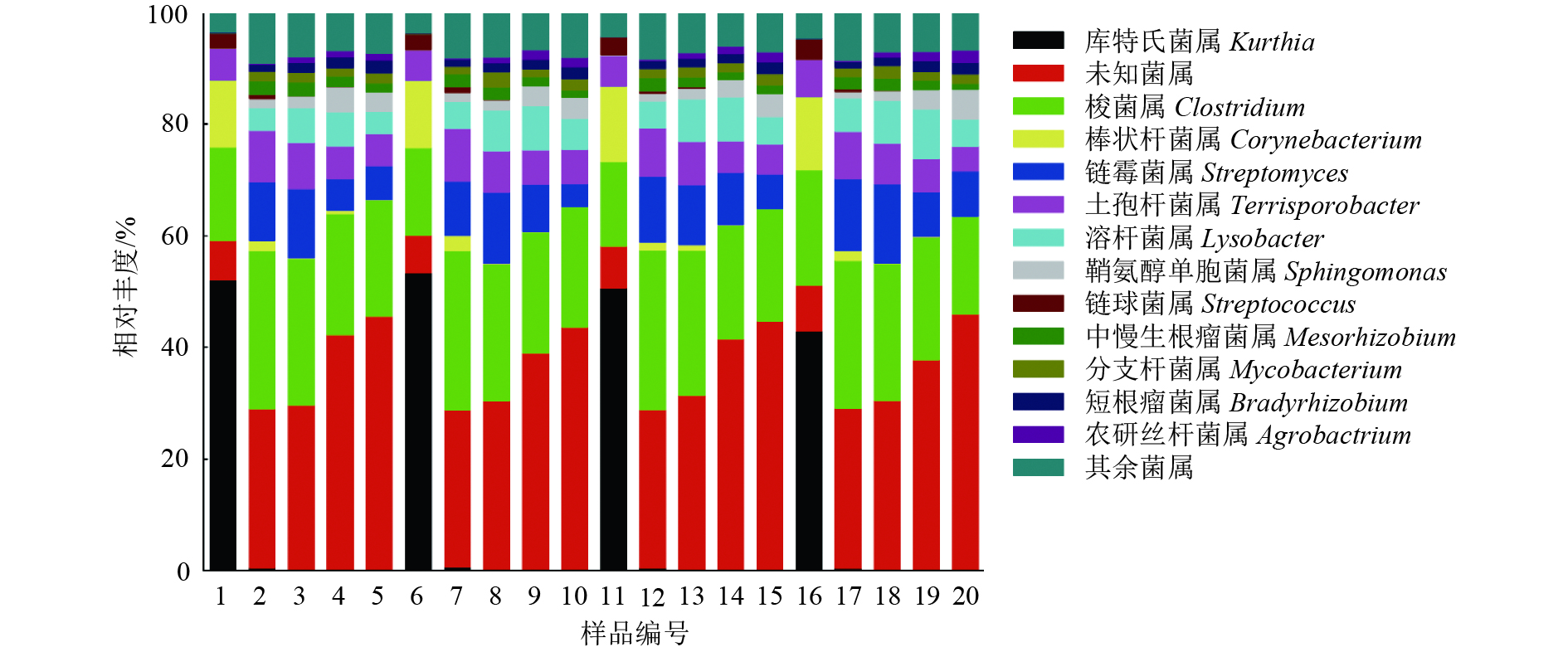
属水平群落结构组成如图2所示。可能携带TRGs的菌属有梭菌属Clostridium、链霉菌属Streptomyces、链球菌属Streptococcus和棒状杆菌属Corynebacterium,梭菌属和链球菌属属于厚壁菌门,链霉菌属和棒状杆菌属属于放线菌门。可能存在致病性的菌属有梭菌属、棒状杆菌属和鞘氨醇单胞菌属Sphingomonas,鞘氨醇单胞菌属属于变形菌门。棒状杆菌属的相对丰度从第1天到第56天持续减少;鞘氨醇单胞菌属的相对丰度从第1天到第56天持续增加,金霉素中、高剂量组第56天的相对丰度显著高于对照组;梭菌属相对丰度从第1天到第7天增加,之后持续降低,金霉素低剂量组第56天的相对丰度显著高于对照组和中、高剂量组(表4)。

|
图 1 金霉素胁迫下粪土模型中门分类水平上的优势菌群相对丰度 Figure 1 Relative abundances of dominant bacteria at phylum level in manure-soil model under chlortetracycline stress 1~5、6~10、11~15、16~20分别为0、10、100、1 000 μg金霉素剂量组,各组中的样品编号依次代表在第1、7、14、28、56天采集的样品 |
|
|
表 3 金霉素胁迫下粪土模型中门分类水平上主要优势菌群的相对丰度差异1) Table 3 Discrepancies of the relative abundances of dominant bacteria at phylum level in manure-soil model under chlortetracycline stress % |
|
|
表 4 金霉素胁迫下粪土模型中属分类水平上主要优势菌群的相对丰度差异1) Table 4 Discrepancies of the relative abundances of dominant bacteria at genus level in manure-soil modelunder chlortetracycline stress % |
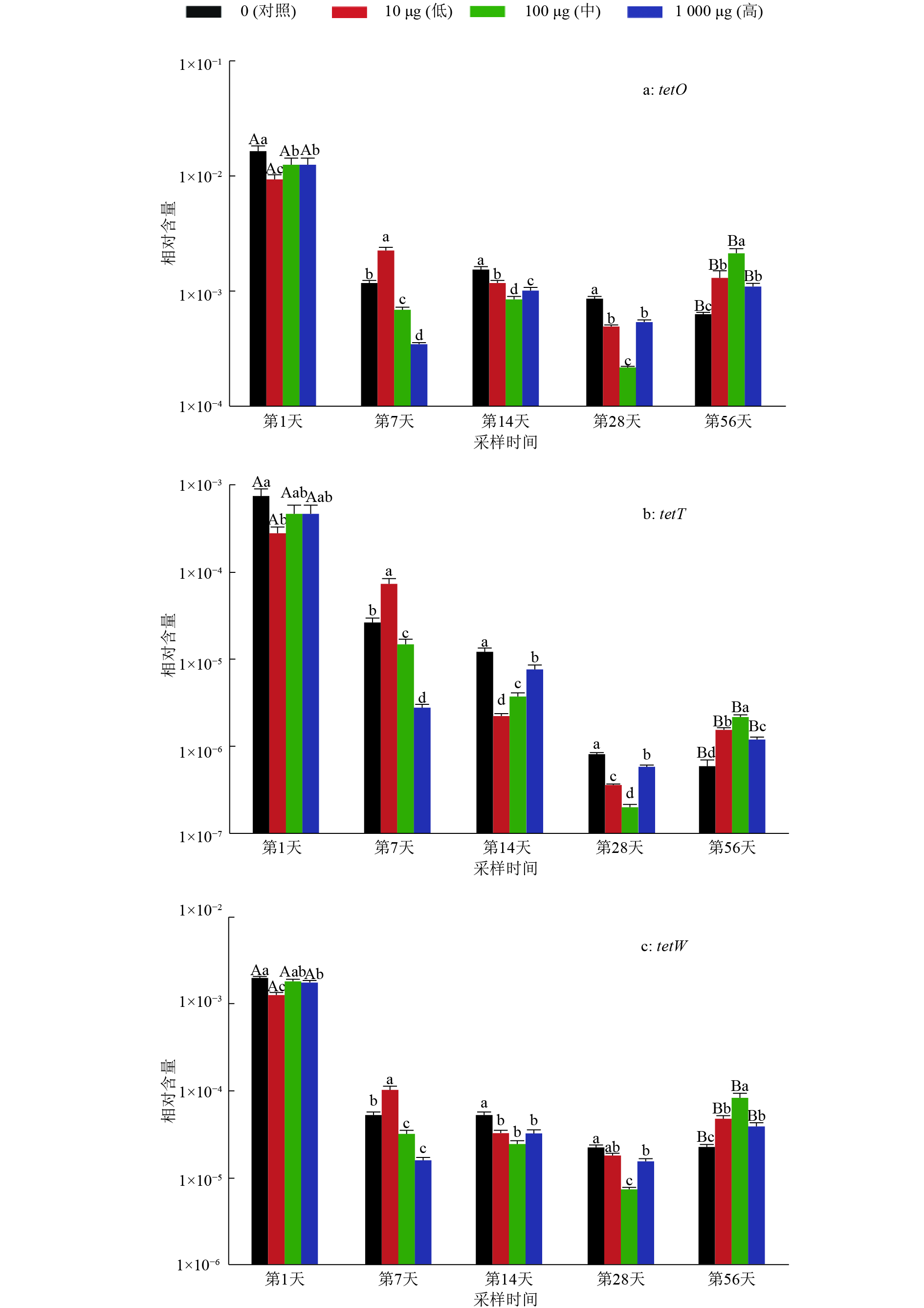
对所有样品进行目标TRGs检测,共检测出3种TRGs:tetO、tetT和tetW,检出率达85%~100%。经qPCR检测得扩增效率为101%~109%,相关系数R2均为0.999。tetO、tetT和tetW基因丰度变化趋势相似:相对于试验第1天,各组第56天的基因丰度均显著减少;金霉素低剂量组第7天的基因丰度显著高于同时期的对照组和中、高剂量组;金霉素中剂量组第56天的基因丰度显著高于同时期的其余各组。tetT、tetO和tetW基因丰度的DDR变化也十分相似:各组DDR在Ⅰ和Ⅲ期相近,在Ⅱ和Ⅳ期出现明显差异;Ⅱ期金霉素低剂量组DDR高于对照组与中剂量组,高剂量组DDR为负值,低于对照组与中剂量组;Ⅳ期金霉素各剂量组DDR均低于对照组,且均为负值,中剂量组DDR最小,其次分别为低、高剂量组(表5,图3)。
|
图 2 金霉素胁迫下粪土模型中属分类水平上的优势菌群相对丰度 Figure 2 Relative abundances of dominant bacteria at genus level in manure-soil model under chlortetracycline stress 1~5、6~10、11~15、16~20分别为0、10、100、1 000 μg金霉素剂量组,各组中的样品编号依次代表在第1、7、14、28、56天采集的样品 |
|
|
表 5 金霉素胁迫下粪土模型中3个四环素类抗生素耐药基因(TRGs)日消减率变化 Table 5 Day dissipation rate changes of three tetracycline resistance genes (TRGs) in manure-soil model under chlortetracycline stress |
|
图 3 金霉素胁迫下粪土模型中3个四环素类抗生素耐药基因(TRGs)相对含量变化 Figure 3 Relative abundance changes of three tetracycline resistance genes (TRGs) in manure-soil model under chlortetracycline stress 相同采样时间不同柱子上方凡是有一个相同小写字母者,表示相同采样时间不同处理组间差异不显著(P>0.05,Fisher’s精确检验法);相同处理组第1天和第56天的柱子上方凡是有一个相同大写字母者,表示相同处理组第1天和第56天处理间差异不显著(P>0.05,Fisher’s精确检验法) |
在对菌群多样性影响方面,随培养时间的延长,各组OTU数量、ACE指数、Chao1指数和Shannon指数整体均呈上升趋势,大部分金霉素组的ACE指数、Chao1指数和Shannon指数均与对照组相近,这可能与金霉素的降解或土壤吸附作用有关。Liu等[15]研究表明土壤对金霉素有较强的吸附作用,从而降低其药效,削弱其对土壤微生物的毒害作用;Chessa等[6]研究发现TCs只能短期影响菌群结构,7 d后作用逐渐下降,60 d内完全消失;Xiong等[16]研究发现相对于金霉素,猪粪对土壤微生物群落结构具有更强的决定性作用,而且施加猪粪可为土壤微生物提供丰富的营养物质。基于以上报道,推测当金霉素和猪粪共同作用于土壤微生物时,金霉素对菌群的毒害作用受抑制,群落丰度与多样性的变化主要是猪粪促进作用的结果。
从试验各组菌群丰度和TRGs相对含量变化可发现厚壁菌门相对丰度持续减少,放线菌门相对丰度先增后减,各组TRGs相对含量总体表现为减少,提示TRGs相对含量变化可能与菌群丰度变化有关。有研究[16]表明带有TRGs的菌门相对丰度减少时,将有助于粪土环境及TCs–粪土环境中TRGs的消减。
有研究表明耐药菌的丰度与抗生素含量有显著相关性[17]。Heuer等[18]认为粪便中的耐药基因通过水平基因转移进入土壤菌群,获得耐药基因的菌群在抗生素环境下更具生存优势。本研究中厚壁菌门金霉素低剂量组的相对丰度高于或显著高于对照组和中、高剂量组,说明厚壁菌门菌群能耐受低剂量金霉素的毒害作用,对中、高剂量金霉素较敏感,从而在中、高剂量金霉素环境中逐渐失去生存优势。放线菌门金霉素中、高剂量组的相对丰度高于或显著高于对照组和低剂量组,可能是由于放线菌门自身可产生TCs,能够适应被金霉素污染的生长环境[16],因此在其他门菌群生存受到金霉素毒害时,放线菌门能耐受住这种毒害作用,生存繁殖更具优势。变形菌门第28天金霉素各剂量组的相对丰度均显著低于对照组,这与Xiong等[16]结果相似,其余时间金霉素各剂量组相对丰度多显著高于对照组,这可能是因为变形菌门是携带耐药基因的主要菌群之一,其生存与耐药基因的产生及产生时间相关[19]。
此外,金霉素也可能改变部分致病菌的相对丰度,低剂量金霉素有利于梭菌属相对丰度的增加,而中、高剂量金霉素更有利于鞘氨醇单胞菌属相对丰度的增加。由此可见,金霉素能引起菌群群落结构发生变化,实质是不同菌群对金霉素敏感程度的差异。
在对TRGs相对含量影响方面,tetO、tetT和tetW相对含量的变化趋势相似,各组第56天的TRGs相对含量均显著低于第1天,这可能是因为样品中的菌群结构发生明显变化。Sengeløv等[20]研究发现由粪便引入的耐药菌大部分不适应土壤环境,只能短暂存活,耐药基因相对含量逐渐下降至未经粪便污染的原土水平。此外,施加粪便后16S rDNA拷贝数的增加也可能促使TRGs相对含量消减[12]。
Ⅱ期金霉素高剂量组和Ⅳ期金霉素各剂量组的DDR均为负值,这说明金霉素在此阶段不仅能延缓TRGs相对含量的消减,还能促进其积累,可能是因为水平基因转移是粪便与土壤之间菌群耐药性传播的重要途径[18],TCs可为土壤中水平基因转移或耐药基因增殖提供必需的抗生素胁迫压力[16],所以在第56天,各剂量金霉素组的TRGs相对含量均高于对照组。
TRGs相对含量随金霉素胁迫剂量的不同而产生差异。试验第7天金霉素低剂量组TRGs的相对含量显著高于对照组,中、高剂量组显著低于对照组,这可能是抗生素的毒物兴奋效应所致,其表现为低剂量促进,高剂量抑制[21]。金霉素中剂量组Ⅳ期的DDR最小,第56天TRGs相对含量显著高于其余各组,其原因可能是金霉素发生自然降解。据报道金霉素在粪(猪粪)土模型中自然降解50 d后,降解率可达97%[18],推测第56天土壤中残留的金霉素已至低剂量范围,促进了TRGs积累,金霉素低剂量组由于本身剂量较低,自然降解后削弱了其促进作用,所以此时各剂量金霉素对TRGs积累的促进效果为:中剂量>低剂量>高剂量。
综上所述,在猪粪–土壤环境中,不同菌群对金霉素敏感程度不同,金霉素可改变优势菌群的相对丰度,从而引起菌群群落结构的变化。金霉素可改变TRGs相对含量的日消减率,从而影响TRGs相对含量。
| [1] |
周志强, 王淑平, 郭丽, 等. 鸭粪和环丙沙星对潮土微生物群落功能多样性的影响[J]. 生态毒理学报, 2014, 9(6): 1118-1125. (  0) 0) |
| [2] |
PAN X, QIANG Z, BEN W, et al. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 2011, 84: 695-700. DOI:10.1016/j.chemosphere.2011.03.022 (  0) 0) |
| [3] |
黄俐晔. 中国养猪业现状、问题与趋势[J]. 广东农业科学, 2015, 42(16): 175-179. DOI:10.3969/j.issn.1004-874X.2015.16.029 (  0) 0) |
| [4] |
郭冬生, 王文龙, 彭小兰, 等. 湖南省畜禽粪便抗生素排放量估算与治理策略[J]. 浙江农业学报, 2014, 26(5): 1315-1318. (  0) 0) |
| [5] |
HUANG X, LIU C, LI K, et al. Occurrence and distribution of veterinary antibiotics and tetracycline resistance genes in farmland soils around swine feedlots in Fujian Province, China[J]. Environ Sci Pollut Res, 2013, 20(12): 9066-9074. DOI:10.1007/s11356-013-1905-5 (  0) 0) |
| [6] |
CHESSA L, PUSINO A, GARAU G, et al. Soil microbial response to tetracycline in two different soils amended with cow manure[J]. Environ Sci Pollut Res, 2016, 23(6): 5807-5817. DOI:10.1007/s11356-015-5789-4 (  0) 0) |
| [7] |
田甜甜, 王瑞飞, 杨清香. 抗生素耐药基因在畜禽粪便–土壤系统中的分布、扩散及检测方法[J]. 微生物学通报, 2016, 43(8): 1844-1853. (  0) 0) |
| [8] |
BEN W, WANG J, PAN X, et al. Dissemination of antibiotic resistance genes and their potential removal by on-farm treatment processes in nine swine feedlots in Shandong Province, China[J]. Chemosphere, 2017, 167: 262-268. DOI:10.1016/j.chemosphere.2016.10.013 (  0) 0) |
| [9] |
WANG M Z, LIU P, XIONG W G, et al. Fate of potential indicator antimicrobial resistance genes (ARGs) and bacterial community diversity in simulated manure-soil microcosms[J]. Ecotoxicol Environ Saf, 2018, 147: 817-823. DOI:10.1016/j.ecoenv.2017.09.055 (  0) 0) |
| [10] |
钟晓霞. 鸭–鱼混养场养殖环境抗菌药物耐药基因污染及微生物群落特征[D]. 广州: 华南农业大学, 2016.
(  0) 0) |
| [11] |
NG L K, MARTIN I, ALFA M, et al. Multiplex PCR for the detection of tetracycline resistant genes[J]. Mol Cell Probes, 2001, 15(4): 209-215. DOI:10.1006/mcpr.2001.0363 (  0) 0) |
| [12] |
HE L Y, LIU Y S, SU H C, et al. Dissemination of antibiotic resistance genes in representative broiler feedlots environments: Identification of indicator ARGs and correlations with environmental variables[J]. Environ Sci Technol, 2014, 48(22): 13120-13129. DOI:10.1021/es5041267 (  0) 0) |
| [13] |
AMINOV R I, GARRIGUES-JEANJEAN N, MACKIE R I. Molecular ecology of tetracycline resistance: Development and validation of primers for detection of tetracycline resistance genes encoding ribosomal protection proteins[J]. Appl Environ Microbiol, 2001, 67(1): 22-32. DOI:10.1128/AEM.67.1.22-32.2001 (  0) 0) |
| [14] |
KOIKE S, AMINOV R I, YANNARELL A C, et al. Molecular ecology of macrolide-lincosamide-streptogramin B methylases in waste lagoons and subsurface waters associated with swine production[J]. Microb Ecol, 2010, 59(3): 487-498. DOI:10.1007/s00248-009-9610-0 (  0) 0) |
| [15] |
LIU F, WU J, YING G G, et al. Changes in functional diversity of soil microbial community with addition of antibiotics sulfamethoxazole and chlortetracycline[J]. Appl Microbiol Biotechnol, 2012, 95(6): 1615-1623. DOI:10.1007/s00253-011-3831-0 (  0) 0) |
| [16] |
XIONG W, WANG M, DAI J, et al. Application of manure containing tetracyclines slowed down the dissipation of tet resistance genes and caused changes in the composition of soil bacteria[J]. Ecotoxicol Environ Saf, 2018, 147: 455-460. DOI:10.1016/j.ecoenv.2017.08.061 (  0) 0) |
| [17] |
GAO P, MUNIR M, XAGORARAKI I. Correlation of tetracycline and sulfonamide antibiotics with corresponding resistance genes and resistant bacteria in a conventional municipal wastewater treatment plant[J]. Sci Total Environ, 2012, 421/422: 173-183. DOI:10.1016/j.scitotenv.2012.01.061 (  0) 0) |
| [18] |
HEUER H, SCHMITT H, SMALLA K. Antibiotic resistance gene spread due to manure application on agricultural fields[J]. Curr Opin Microbiol, 2011, 14(3): 236-243. DOI:10.1016/j.mib.2011.04.009 (  0) 0) |
| [19] |
ZHANG J, CHEN M, SUI Q, et al. Impacts of addition of natural zeolite or a nitrification inhibitor on antibiotic resistance genes during sludge composting[J]. Water Res, 2016, 91: 339-349. DOI:10.1016/j.watres.2016.01.010 (  0) 0) |
| [20] |
SENGELØV G, AGERSØ Y, HALLING-SØRENSEN B, et al. Bacterial antibiotic resistance levels in Danish farmland as a result of treatment with pig manure slurry[J]. Environ Int, 2003, 28(7): 587-595. DOI:10.1016/S0160-4120(02)00084-3 (  0) 0) |
| [21] |
葛会林, 罗金辉, 智霞, 等. 环境中的抗生素与毒物兴奋效应综述[J]. 热带作物学报, 2015, 36(9): 1719-1725. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


