大斑突脐蠕孢菌Exserohilum turcicum 引起的玉米大斑病是世界玉米产区广为发生的典型多循环气传病害[1],在我国东北、华北、西北和南方山区的冷凉玉米产地较易发生流行,一般年发病率约20%,发生严重年份可导致玉米减产50%以上,给我国玉米生产造成严重损失[2]。因此,开展该病害的高效防治技术研究迫在眉睫。
目前,玉米大斑病防治主要采用化学方法,但由于药剂选择、施药时机、用药剂量以及频次与安全间隔期不当等易导致玉米产生抗药性、农药残留污染以及防治失败等诸多问题[3-5],玉米化学防治的农药减量增效技术研发已成为我国的战略需求[6]。玉米大斑病的减药替代方法主要是通过开发生物源农药以及杀菌剂增效混配组合的筛选等手段来实现。微生物源活性代谢产物和化学杀菌剂的增效混配组合防治作物病害符合我国现代农业的发展需求,同时也是实现化学药剂减量增效的重要手段[7]。张红娟等[8]研究发现,2株核桃内生菌HT3与HT5发酵上清液与速克灵50倍稀释液混配对灰葡萄孢菌Botrytis cinerea菌丝生长的抑制具有增效作用,其中V(速克灵)∶V(HT3发酵上清液)=50∶50和V(速克灵)∶V(HT3发酵上清液)=25∶75混剂的抑菌率较高,混剂的10倍稀释液对病菌的抑制率分别为87%和86%,增效比均为1.30;楚文琢等[9]采用Wadley增效比率法得出铜绿假单胞菌Pseudomonas aeruginosa SU8发酵液和乙蒜素混配能够显著增强乙蒜素对草莓灰霉病的防治效果,质量配比9∶1时对灰葡萄孢菌菌丝生长抑制作用显著,增效系数达8.41。孙东磊等[10]利用Horsfall法和共毒系数法测定了发光杆菌Photorhabdus luminescens 1029发酵液与乙膦铝混配剂控制荔枝霜疫霉病的最佳体积比为3∶7。以上研究表明,生防菌代谢产物能够显著增强化学杀菌剂对部分植物病菌的抑制活性。生防芽孢杆菌发酵上清液中由于含有脂肽类等对植物病原菌具有较强抑制作用的次级代谢产物[11],开展发酵上清液与常见化学杀菌剂的混配研究,对于化学杀菌剂的减量增效具有重要意义。
安徽科技学院农学院植物病害防治实验室前期分离到1株对番茄灰霉病病菌有拮抗作用的解淀粉芽孢杆菌Bacillus amyloliquefaciens菌株gfj-4,本研究拟测定解淀粉芽孢杆菌gfj-4发酵上清液、脂肽类粗提物和7种化学杀菌剂以及发酵上清液和化学药剂混配组合对玉米大斑病病菌的抑制活性,以期为化学杀菌剂的减量使用和玉米大斑病的防控提供科学依据。
1 材料与方法 1.1 材料95%(w)苯醚甲环唑原药(山东亿嘉农化有限公司);96%(w)戊唑醇原药(山东华阳农药化工集团有限公司);96%(w)腈菌唑原药(山东联合农药工业有限化司);50%(w)腐霉利可湿性粉剂(日本住友化学株式会社);75%(w)代森锰锌可湿性粉剂(上海禾本药业有限公司);50%(w)福美双可湿性粉剂(南通宝叶化工有限公司);70%(w)丙森锌可湿性粉剂(拜耳作物科学有限公司)。杀菌剂原药采用丙酮溶解,配制成1.0×104 μg·mL–1的母液置于4 ℃冰箱保存备用;制剂用灭菌水溶解,现配现用。
采集河南省南阳市唐合县玉米大斑病典型发病叶片,进行分离纯培养,得到玉米大斑病病菌。解淀粉芽孢杆菌gfj-4分离自番茄灰霉病发病果实,于2014年9月24日保藏于中国典型培养物保藏中心(CCTCC NO: M 2014444),已获得授权发明专利(ZL2014107885788)。
PDA培养基:马铃薯200.0 g,葡萄糖18.0 g,琼脂15.0 g,去离子水1 L。
NA培养基:蛋白胨 5.0 g,牛肉浸膏3.0 g,酵母膏1.0 g,葡萄糖10.0 g,琼脂15.0 g,pH 7.0(不加琼脂制成NB培养基)。
1.2 菌株gfj-4发酵上清液对玉米大斑病病菌的抑制活性测定 1.2.1 种子液菌龄解淀粉芽孢杆菌gfj-4在NA培养基上划线培养48 h,挑取单菌落转接入NB液体培养基中,33 ℃、120 r·min–1培养12 h,然后以10%(φ)的接种量接种到NB培养基中,33 ℃、120 r·min–1培养4、6、8、10和12 h,培养结束后以4 ℃、10 000 r·min–1离心10 min,然后用灭菌水调节菌悬液D600 nm=1.0,得到不同菌龄的种子液,以0.5%(φ)的接种量接种到100 mL NB培养液中,置于33 ℃、120 r·min–1的恒温摇床中培养72 h,然后4 ℃、10 000 r·min–1离心20 min获取发酵上清液,经0.22 μm滤膜过滤后保存于4 ℃冰箱备用。采用菌丝生长速率法测定发酵上清液400倍稀释液对玉米大斑病菌的抑制率,接种结束后置于28 ℃恒温恒湿培养箱中培养120 h,每个浓度处理3皿,重复3次,采用十字交叉法测量菌落直径,参照文献[12]的方法计算不同菌龄种子液制备的发酵上清液对玉米大斑病病菌的抑制率。
1.2.2 培养时间按照1.2.1的方法获取培养6 h的种子液后以0.5%(φ)的接种量接入装有100 mL NB培养液的250 mL三角瓶中,然后置于33 ℃、120 r·min–1的恒温摇床中分别培养24、48、60、72、84、96和108 h,经4 ℃、10 000 r·min–1离心20 min获取发酵上清液,用0.22 μm滤膜过滤后保存于4 ℃冰箱备用。测定不同培养时间制备的发酵上清液对玉米大斑病病菌的抑制率。
1.2.3 稀释倍数将发酵72 h的上清液按一定比例与冷却到50 ℃左右的PDA培养基充分混匀,在抑菌活性预试验的基础上,设计发酵上清液在PDA培养基中的体积分数分别为0.25、0.33、0.50、1.00、2.00和 5.00 μL·mL–1,测定不同体积分数的发酵上清液对玉米大斑病病菌的抑制活性,利用SPSS 13.0软件求出发酵上清液对玉米大斑病病菌的EC50。
1.3 脂肽粗提物制备及对玉米大斑病病菌抑制活性测定参照邓建良等[13]的脂肽粗提物制备方法,将发酵72 h的上清液用甲醇萃取3次,合并提取液备用。在脂肽粗提物抑菌活性预试验的基础上,将脂肽粗提物按一定比例与冷却到50 ℃左右的PDA培养基充分混匀,使脂肽粗提物的含量分别为0.08、0.10、0.14、0.20、0.67和 1.00 μL·mL–1,测定其对玉米大斑病菌的抑制活性,并计算脂肽粗提物对玉米大斑病病菌的EC50。
1.4 7种化学杀菌剂对玉米大斑病病菌的室内毒力测定在7种化学杀菌剂对玉米大斑病菌抑制活性预试验的基础上,设计6个质量浓度测定苯醚甲环唑、戊唑醇、腐霉利、腈菌唑、代森锰锌、福美双和丙森锌7种化学杀菌剂对玉米大斑病病菌的抑制活性,具体设置见表1。接种完毕后置于28 ℃恒温恒湿培养箱中培养120 h,每个浓度处理3皿,重复3次,用十字交叉法测量菌落直径。采用SPSS 13.0软件求出7种化学杀菌剂对病菌的毒力回归方程,EC50及95%置信区间。
|
|
表 1 7种化学杀菌剂浓度梯度设置 Table 1 Concentration gradient of seven chemical fungicides |
采用陈福良等[14]的方法设计菌株gfj-4发酵上清液和化学杀菌剂的混配试验,以发酵72 h的上清液和不同化学杀菌剂对玉米大斑病病菌的EC50为基础,按其EC50值剂量的比例分别设置体积比0∶10、1∶9、2∶8、3∶7、4∶6、5∶5、6∶4,7∶3、8∶2、9∶1、10∶0共11个配比,以不加药剂处理为对照,采用菌丝生长速率法测定各配比的抑菌率并求出各组合的毒性比。每个复配浓度处理3皿,重复3次。
毒性比的计算公式为:
实际抑菌率=[(对照菌落直径–处理菌落直径)/(对照菌落直径–菌饼直径)]×100%;
理论抑菌率=[A的EC50实际抑菌率×A在配比中所占的比例+B的EC50实际抑菌率×B在配比中所占的比例]×100%;
毒性比=实际抑菌率/理论抑菌率。
若毒性比>1为增效作用;毒性比<1为拮抗作用;毒性比为1,则为相加作用。
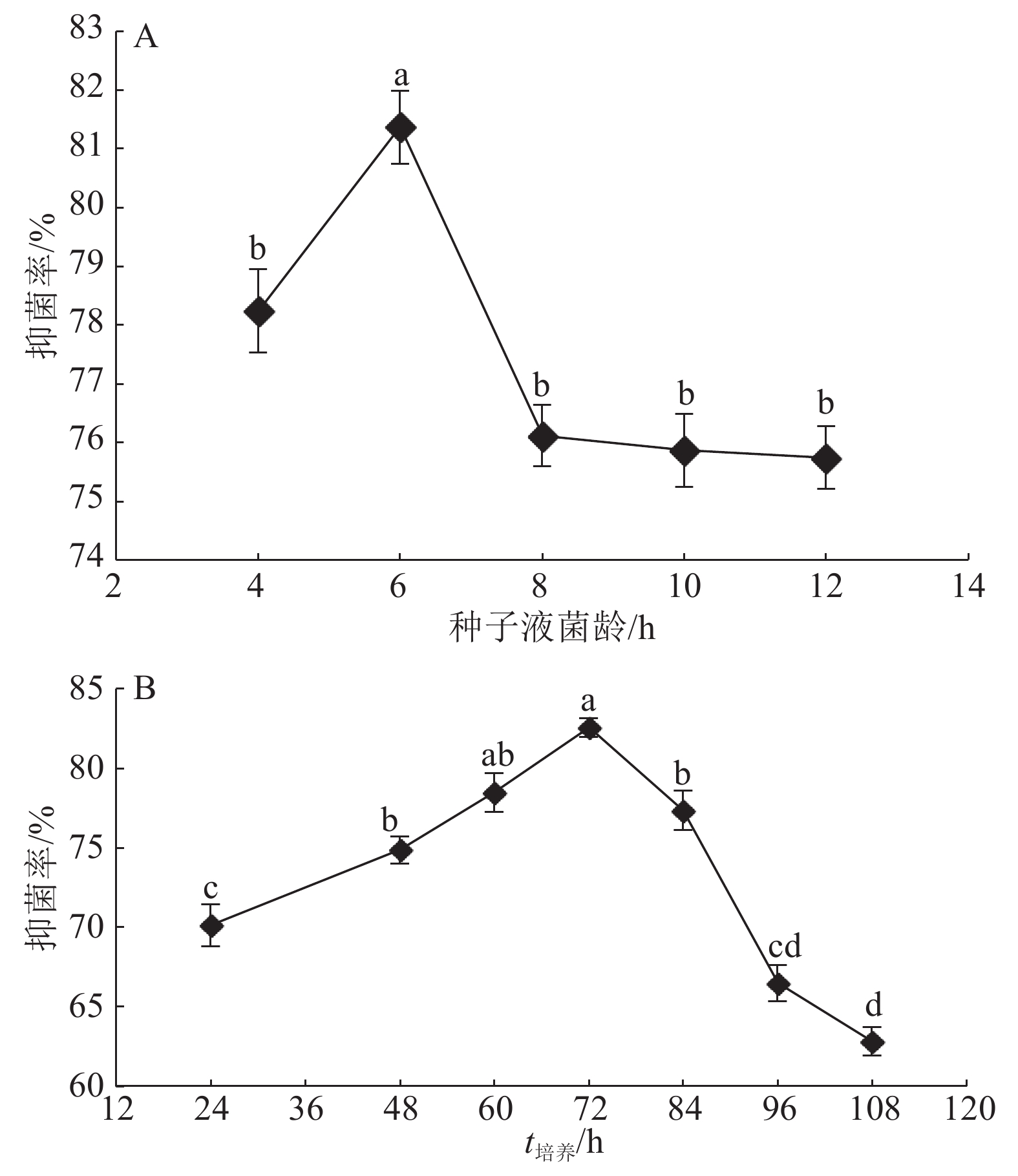
2 结果与分析 2.1 解淀粉芽孢杆菌gfj-4发酵上清液对玉米大斑病病菌的抑制活性由图1A可见,随着菌株gfj-4种子液培养时间的增加,解淀粉芽孢杆菌gfj-4发酵上清液对玉米大斑病病菌的抑制率先升高后降低。种子液菌龄为6 h制得的发酵上清液对病菌的抑制率最大,为81.4%,显著高于其他培养时间(P<0.05)。随着培养时间进一步增加,菌株所产发酵上清液对病菌的抑制率逐步下降,当种子液培养时间为12 h抑制率下降至75.8%。
由图1B可见,随着菌株gfj-4发酵培养时间增加,发酵代谢活性物质对玉米大斑病菌的抑制率先升高后降低。培养时间为72 h制得的发酵上清液对病菌的抑制率最高,为82.6%。随着培养时间进一步延长,发酵上清液对病菌的抑制率下降,培养时间为108 h时抑制率下降至62.9%。
|
图 1 不同菌龄种子液和培养时间对gfj-4发酵上清液抑制活性的影响 Figure 1 Effects of seed broth at different culture time and different culture time on antifungal activity of strain gfj-4 fermentation supernatant 各图中不同处理间凡具有一个相同字母者,表示差异不显著(P>0.05,Duncan’s法) |
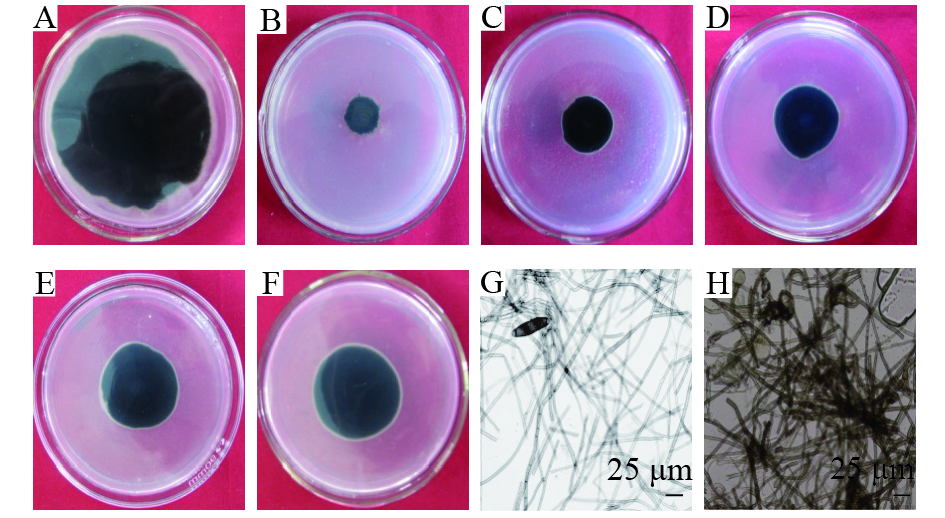
由表2可知,解淀粉芽孢杆菌gfj-4发酵上清液从0.25 μL·mL–1增至5.00 μL·mL–1,其对玉米大斑病菌的抑制率从23.99%增至88.68%,体积分数较大的发酵上清液抑制效果较好。经SPSS13.0软件分析得出毒力回归方程y=1.09x+0.54(R2=0.95)。发酵上清液对玉米大斑病菌的EC50为0.32 μL·mL–1。从图2可以看出,经解淀粉芽孢杆菌发酵上清液处理的玉米大斑病病菌菌丝生长稀疏、扩展缓慢,发酵上清液EC80处理菌丝(图2H)后,与对照(图2G)相比较可以发现,菌丝原生质浓缩,颜色变成棕褐色,呈现出扭曲、散乱的畸形状,有的菌体顶端膨大呈小球状。
|
|
表 2 不同体积分数的解淀粉芽孢杆菌发酵上清液对玉米大斑病病菌的抑制率 Table 2 Inhibition rate of Bacillus amyloliquefaciens fermentation supernatant with different contentration to Exserohilum turcicum |
|
图 2 不同体积分数解淀粉芽孢杆菌发酵上清液对玉米大斑病病菌的抑制效果 Figure 2 Inhibitory effect of Bacillus amyloliquefaciens fermentation supernatant with different contentration on Exserohilum turcicum A:对照;B~F:菌株gfj-4发酵上清液分别为5.00、2.00、1.00、0.50和0.33 μL·mL-1;G:未经发酵上清液处理;H:发酵上清液EC80处理 |
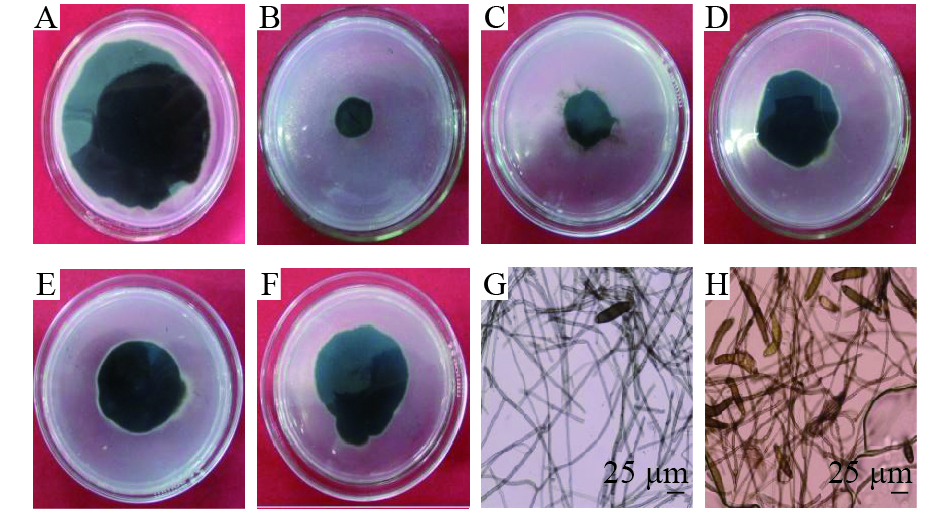
由表3可知,脂肽粗提物从0.08 μL·mL–1增至1.00 μL·mL–1,在28 ℃恒温恒湿培养箱中培养120 h对玉米大斑病菌的抑制率从43.68%增至86.05%,经SPSS13.0软件分析得出,毒力回归方程y=1.16x+1.10(R2=0.98)。发酵上清液对玉米大斑病病菌的EC50为0.11 μL·mL–1。与对照相比较可以发现(图3),经解淀粉芽孢杆菌脂肽粗提物处理的玉米大斑病病菌菌丝扩展缓慢,高浓度脂肽粗提物处理可使菌丝颜色转变为深褐色,边缘生长不规则。由图3H可知,脂肽粗提物EC80处理的菌丝原生质浓缩,菌丝体颜色加深,产孢量比对照(图3G)明显加大,部分病菌菌丝顶端和中部出现膨大泡囊。
|
|
表 3 不同体积分数的脂肽粗提物对玉米大斑病病菌的抑制率 Table 3 Inhibition rate of lipopeptide crude extract with different concentration to Exserohilum turcicum |
|
图 3 不同体积分数的脂肽粗提物对玉米大斑病病菌的抑制效果 Figure 3 Inhibitory effect of lipopeptide crude extract with different concentration on Exserohilum turcicum A:对照;B~F:菌株gfj-4脂肽粗提物分别为0.67、0.20、0.14、0.10、0.08 μL·mL-1;G:未经脂肽粗提物处理;H:脂肽粗提物EC80处理 |
由表4可知,玉米大斑病病菌对麦角甾醇生物合成抑制剂苯醚甲环唑、戊唑醇和腈菌唑的敏感性较高,对药剂敏感性的判断方法参照文献[15]。其中,苯醚甲环唑对玉米大斑病病菌的抑制活性最高,EC50为0.10 μg·mL–1,其次为戊唑醇和腈菌唑对病菌的EC50分别为0.44和0.49 μg·mL–1。二甲酰亚胺类杀菌剂腐霉利对病菌的EC50为0.46 μg·mL–1。有机硫类杀菌剂代森锰锌和福美双对病菌的抑制活性相当,EC50分别为12.03和12.08 μg·mL–1,表现为中度敏感,而丙森锌对病菌的抑制活性较差,EC50为24.73 μg·mL–1。
|
|
表 4 7种化学杀菌剂对玉米大斑病病菌的毒力测定 Table 4 Toxicity levels of seven chemical fungicides to Exserohilum turcicum |
由表5可见,解淀粉芽孢杆菌gfj-4发酵上清液和3种三唑类化学杀菌剂以一定的比例复配对玉米大斑病病菌的抑制活性既表现有增效作用,也有相加作用和拮抗作用。发酵上清液和苯醚甲环唑混配主要表现为相加作用,其中以3∶7的体积比混配毒性比最高,达1.28;发酵上清液与戊唑醇混配主要表现为相加作用,部分比例则表现为拮抗作用,其中以2∶8的体积比混配毒性比最高,为1.08;发酵上清液和腈菌唑混配主要表现为拮抗作用,其中以1∶9的体积比混配表现为相加作用。解淀粉芽孢杆发酵上清液和腐霉利混配既有增效作用,也有拮抗和相加作用,其中以3∶7的体积比混配毒性比最高,为1.16。
|
|
表 5 解淀粉芽孢杆菌发酵上清液与4种选择性化学杀菌剂复配对玉米大斑病病菌的毒性比 Table 5 Toxicity ratio of Bacillus amyloliquefaciens fermentation supernatant mixed with four selective chemical fungicides to Exserohilum turcicum |
由表6可见,解淀粉芽孢杆菌gfj-4发酵上清液和3种保护性化学杀菌剂以一定的比例复配对玉米大斑病病菌的抑制活性既表现有增效作用,也有相加作用和拮抗作用。发酵上清液与代森锰锌以2∶8的体积比混配毒性比最高,为1.28;发酵上清液与福美双混配主要表现为相加和拮抗作用;发酵上清液与丙森锌以2∶8的体积比混配毒性比最高,达1.67。综合以上结果得出,生防菌gfj-4发酵上清液与苯醚甲环唑、丙森锌以体积比3∶7和2∶8混配对玉米大斑病病菌的抑制效果较好。
|
|
表 6 解淀粉芽孢杆菌发酵上清液与3种保护性化学杀菌剂复配对玉米大斑病病菌的毒性比 Table 6 Toxicity ratio of Bacillus amyloliquefaciens fermentation supernatant mixed with three protective chemical fungicides to Exserohilum turcicum |
玉米大斑病作为我国重要粮食作物玉米的重大病害,严重影响玉米产量和品质,开展其高效防治措施研究具有重要意义[16-17]。赵淑莉等[18]从土壤中筛选出对玉米大斑病病菌CC9的菌丝生长和孢子萌发均有较强抑制作用的壮观链霉菌Streptomyces spectabilis BZ45,其发酵滤液10倍稀释液对玉米大斑病病菌的抑制率为75.51%;沈玲等[19]从采自安徽黄山的土壤中分离到1株卡那霉素链霉菌Streptomyces kanamyceticus 菌株AH-1,其发酵液10倍稀释液对玉米大斑病病菌菌丝生长的抑制率为79.1%,推测该菌株发酵液中可能含有广谱抑菌活性物质。本研究利用菌丝生长速率法检测解淀粉芽孢杆菌gfj-4发酵上清液200倍稀释液对玉米大斑病病菌的抑制率达88.68%,脂肽粗提物1 000倍稀释液对玉米大斑病病菌的抑制率高达86.05%,12 000倍稀释液的抑制率还可达到43.68%,具有较高的利用价值。
抗真菌类物质主要作用是抑制真菌细胞壁的合成,使细胞壁变薄或失去完整性,造成细胞膜暴露,最后由于渗透压差导致原生质渗漏,引起菌丝尖端和芽管膨大;其次是抑制蛋白质和核酸等的生物合成[20-21]。牛慧芹等[22]从玉米叶片上分离到1株对玉米大斑病病菌具有良好抑制作用的洋葱伯克霍尔德氏菌Burkholderia cepacia 菌株SCG-02,发酵滤液使玉米大斑病病菌菌丝畸形生成串珠状,严重时可产生很多囊泡,并且使孢子萌发受到抑制。候美玲等[23]采用枯草芽孢杆菌Bacillus subtilis蛋白粗提液处理玉米大斑病病菌,可使其菌丝由丝状畸变为串珠状,蛋白粗提液质量浓度为0.78 μg·μL–1时可完全抑制分生孢子萌发,并导致原生质体裂解,初步判定该抑菌过程主要通过cAMP信号转导途径发挥作用。本研究经发酵上清液和脂肽粗提物处理玉米大斑病病菌后,发现与对照相比,菌丝颜色变褐,菌丝未出现明显的串珠状,但是产生囊泡较多,可以推测两者在抑菌机制方面存在差异。
解淀粉芽孢杆菌是一种广泛分布于自然界的革兰阳性菌,为典型的植物促生防病菌,能够分泌抗菌蛋白、抗生素、挥发性化合物、酶和多肽等活性物质,可诱导作物产生抗性,具有很好的生防应用潜力,其产生的脂肽类抗生素能够广谱抑制植物病原物,主要包括表面活性素、伊枯草菌素和丰原素3大类,对外界环境条件具有较高的耐受性[24-26]。伊枯草菌素和丰原素能抑制植物病原真菌的生长,表面活性素能有效抑制细菌、病毒和支原体的繁殖[27-28]。脂肽类抗生素现已报道对油菜菌核病、辣椒灰霉病、黄瓜霜霉病和辣椒病毒病等多种植物病害都表现为较好的防病效果[29]。刘邮洲等[30]通过比较9个种23株芽胞杆菌产脂肽类物质的抑菌活性得出,生防菌的抑菌能力取决于菌株个体,不具有种的共性,同一种的芽胞杆菌抑菌能力存在很大差异。本研究涉及的菌株gfj-4产脂肽类物质对玉米大斑病病菌抑制效果优异,EC50达0.11μL·mL–1,至于何种脂肽类抗生素起主要抑菌作用有待进一步研究。
本研究开展的解淀粉芽孢杆菌gfj-4发酵上清液和化学杀菌剂增效复配剂的研发与当前国家部署的化学农药减量增效的使用要求完全一致[31]。微生物源抑菌活性物质增强化学杀菌剂对植物病菌抑制活性的报道主要体现在抑菌机制层面存在差异,从而表现为增效作用。王国平等[32]研究发现木霉菌素与嘧霉胺以体积比1∶9进行复配,共毒系数达171.1,盆栽药效比嘧霉胺单一防效高21.4%,增效机制主要是因为木霉菌素是生物蛋白合成、延伸与终止的优良抑制剂,其作用机制与嘧霉胺完全不同,但木霉菌素生产成本较高,两者复配能够增强药效,减少化学药剂的使用量。王中华等[33]探明鲍曼菌素与嘧霉胺复配对梨黑斑病病菌Alternaria alternata具有较强的抑制作用,鲍曼菌素的作用机制为破坏病原真菌细胞壁,导致细胞破裂,而嘧霉胺的作用机制主要是通过抑制病菌侵染酶类的产生,两者混配有望成为一种新的生物杀菌剂应用于植物病害防治领域。本研究以解淀粉芽孢杆菌gfj-4产发酵上清液和7种化学药剂混配得出复配增效组合,以生防菌gfj-4发酵上清液与苯醚甲环唑和丙森锌混配对玉米大斑病病菌的抑制作用较好,这可能与2种化学杀菌剂和菌株产生的抑菌活性物质的化学结构不同有关,进而导致其抑菌活性表现出较强的协同作用。下一步将从制剂的研制和环境毒理等方面开展系统研究。
| [1] |
冯胜泽, 刘星晨, 王海祥, 等. 玉米大斑病菌分生孢子形成的影响因素及GATA转录因子家族的表达分析[J]. 中国农业科学, 2017, 50(7): 1234-1241. DOI:10.3864/j.issn.0578-1752.2017.07.006 (  0) 0) |
| [2] |
王晓鸣, 巩双印, 柳家友, 等. 玉米叶斑病药剂防控技术探索[J]. 作物杂志, 2015(3): 150-154. (  0) 0) |
| [3] |
陈乐乐, 郭贝贝, 李北兴, 等. 四霉素对番茄叶霉病菌的毒力效应及田间防治效果[J]. 农药学学报, 2017, 19(3): 324-330. (  0) 0) |
| [4] |
雷仲仁. 病虫害生物防治是实现蔬菜安全生产的主要途径[J]. 中国农业科学, 2016, 49(15): 2932-2934. DOI:10.3864/j.issn.0578-1752.2016.15.007 (  0) 0) |
| [5] |
张国军. 八种常用杀菌剂" 三致”作用及生殖毒性研究进展[J]. 中国预防医学杂志, 2007, 8(3): 320-321. (  0) 0) |
| [6] |
王宣, 黄涛珍. 农药污染问题及对策研究[J]. 陕西农业科学, 2016, 62(10): 108-111. DOI:10.3969/j.issn.0488-5368.2016.10.036 (  0) 0) |
| [7] |
严婉荣, 赵廷昌, 肖彤斌, 等. 生防细菌在植物病害防治中的应用[J]. 基因组学与应用生物学, 2013, 32(4): 533-539. (  0) 0) |
| [8] |
张红娟, 卢海波, 赵丽娟, 等. 生防菌HT3和HT5代谢产物对灰葡萄孢菌的抑菌作用[J]. 山西农业科学, 2013, 41(12): 1372-1375. (  0) 0) |
| [9] |
楚文琢, 彭双强, 廖晓兰, 等. 铜绿假单胞菌SU8发酵液与乙蒜素混配对草莓灰霉病的防效[J]. 江苏农业科学, 2017, 45(6): 79-83. (  0) 0) |
| [10] |
孙东磊, 管楚雄, 曾杨, 等. 发光杆菌1029发酵液和乙膦铝混配对荔枝霜疫霉病菌的抑制作用[J]. 广东农业科学, 2009, 36(9): 105-107. (  0) 0) |
| [11] |
张龙来, 康向辉, 魏孝义, 等. 1株解淀粉芽孢杆菌HN011 抑菌次级代谢产物的分析[J]. 华南农业大学学报, 2016, 37(1): 63-69. DOI:10.7671/j.issn.1001-411X.2016.01.011 (  0) 0) |
| [12] |
中华人民共和国农业部. 农药室内生物测定试验准则(杀菌剂)第2部分: 抑制病原真菌菌丝生长试验平皿法: NY/T 1156.2—2006[S]. 北京: 农业部市场与经济信息司, 2006: 1-6.
(  0) 0) |
| [13] |
邓建良, 刘红彦, 刘玉霞, 等. 解淀粉芽孢杆菌YN-1抑制植物病原真菌活性物质鉴定[J]. 植物病理学报, 2010, 40(2): 202-209. (  0) 0) |
| [14] |
陈福良, 郑斐能, 王仪. 农药混配室内毒力测定的一种实验技术[J]. 农药科学与管理, 1997(4): 30-34. (  0) 0) |
| [15] |
秦虎强, 陈芳颖, 付鼎程, 等. 油菜菌核病菌对10种杀菌剂的敏感性及不同药剂田间防效[J]. 西北农林科技大学学报(自然科学版), 2011, 39(7): 117-122. (  0) 0) |
| [16] |
郭建国, 杨凤珍, 杜蕙, 等. 甘肃玉米大斑病菌对嘧菌酯的敏感基线与抗药性监测[J]. 植物保护学报, 2015, 42(6): 1044-1049. (  0) 0) |
| [17] |
刘杰, 姜玉英, 曾娟. 2012年玉米大斑病重发原因和控制对策[J]. 植物保护, 2013, 39(6): 86-90. (  0) 0) |
| [18] |
赵淑莉, 任飞娥, 刘金亮, 等. 玉米大斑病生防放线菌的筛选鉴定及发酵条件优化[J]. 微生物学报, 2012, 52(10): 1228-1236. (  0) 0) |
| [19] |
沈玲, 朱欣洁, 王恒超, 等. 放线菌菌株AH-1的分离鉴定与抑菌活性研究[J]. 西北农业学报, 2015, 24(5): 128-132. DOI:10.7606/j.issn.1004-1389.2015.05.021 (  0) 0) |
| [20] |
蒋细良, 谢德龄. 农用抗生素的作用机理[J]. 生物防治通报, 1994, 10(2): 76-81. (  0) 0) |
| [21] |
孙延忠, 曾洪梅, 石义萍, 等. 武夷菌素对番茄灰霉菌(Botrytis cinerea)的作用方式
[J]. 植物病理学报, 2003, 33(5): 434-438. (  0) 0) |
| [22] |
牛慧芹, 刘春辉, 沈检龙, 等. 玉米大斑病生防细菌的筛选、鉴定及其抑制作用[J]. 中国农学通报, 2014, 30(28): 275-279. (  0) 0) |
| [23] |
候美玲, 辛媛媛, 郝志敏, 等. 玉米内生芽胞杆菌的抗菌活性物质及其拮抗玉米大斑病菌机理的初步研究[J]. 农业生物技术学报, 2012, 20(9): 1018-1027. (  0) 0) |
| [24] |
ONGENA M, JACQUES P. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol
[J]. Trends Microbiol, 2008, 16(3): 115-125. DOI:10.1016/j.tim.2007.12.009 (  0) 0) |
| [25] |
陈中义, 张杰, 黄大昉. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J]. 植物病理学报, 2003, 33(2): 97-103. (  0) 0) |
| [26] |
侯红漫, 靳艳, 金美芳, 等. 环脂肽类生物表面活性剂结构、功能及生物合成[J]. 微生物学通报, 2006, 33(5): 122-128. (  0) 0) |
| [27] |
ARREBOLA E, JACOBS R, KORSTEN L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens
[J]. J Appl Microbiol, 2010, 108(2): 386-395. DOI:10.1111/jam.2009.108.issue-2 (  0) 0) |
| [28] |
李宝庆, 鹿秀云, 郭庆港, 等. 枯草芽孢杆菌BAB-1产脂肽类及挥发性物质的分离和鉴定[J]. 中国农业科学, 2010, 43(17): 3547-3554. DOI:10.3864/j.issn.0578-1752.2010.17.008 (  0) 0) |
| [29] |
王帅. 芽孢杆菌及其脂肽类化合物防治植物病害和促进植物生长的研究[D]. 南京: 南京农业大学, 2009.
(  0) 0) |
| [30] |
刘邮洲, 陈夕军, 尹小乐, 等. 23株芽胞杆菌及其脂肽类化合物抑菌活性比较[J]. 江苏农业学报, 2017, 33(3): 533-542. (  0) 0) |
| [31] |
王文桥, 马志强, 张小风, 等. 植物病原菌对杀菌剂抗性风险评估[J]. 农药学学报, 2001, 3(1): 6-11. (  0) 0) |
| [32] |
王国平, 曾邵平, 徐彬, 等. 木霉菌素和嘧霉胺复配剂防治抗药性灰霉病[J]. 农药, 2013, 52(5): 377-379. (  0) 0) |
| [33] |
王中华, 杨青松, 蔺经, 等. 鲍曼菌素对梨黑斑病菌的毒力及药效评价[J]. 南方农业学报, 2011, 42(10): 1217-1220. DOI:10.3969/j.issn.2095-1191.2011.10.011 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39

