2. 广东省微生态制剂工程技术研究中心,广东 广州 510640
2. Research Center for Microecologics Engineering of Guangdong Province, Guangzhou 510640, China
癌症对人类的健康和生命构成了严重的威胁,是目前仅次于心脑血管疾病的第2大致死疾病[1] 。紫杉醇(Taxol)作为从红豆杉属Taxus植物中分离出的一种二萜类化合物,是现已被广泛应用的高效低毒的广谱抗癌药物[2-3]。紫杉醇原料药可以来源于植物提取、化学全合成、化学半合成等途径。其中,植物提取主要通过红豆杉树皮作为原料来实现。而红豆杉是我国二级濒危植物品种,从红豆杉中直接提取紫杉醇,具有产量低、分离度低、破坏珍稀植物资源的缺点。另一方面,由于紫杉醇结构相对复杂,化学全合成紫杉醇步骤繁多、工艺复杂、环境污染问题严重,难以实现可持续生产[4-5]。红豆杉针叶中含有较多的10–去乙酰巴卡亭Ⅲ(10-deacety baccatin Ⅲ, 10-DAB),通过从针叶中提取10-DAB,可在避免破坏红豆杉植物资源的前提下,实现紫杉醇的化学半合成。目前,紫杉醇的天然生物合成反应途径已基本明确,其中,紫杉烷环母核上的最后1步修饰反应是反应途径中的关键步骤,由10β–去乙酰巴卡亭Ⅲ乙酰氧基转移酶(10-deacetyl baccatin Ⅲ-10β-O-acetyl transferase, DBAT)催化乙酰化完成。DBAT利用天然酰基供体乙酰CoA,可催化10-DAB的C10位羟基乙酰化,形成紫杉醇重要前体物质—巴卡亭Ⅲ[6-8]。因此,通过异源表达DBAT来合成紫杉醇前体物巴卡亭Ⅲ,再经过化学半合成紫杉醇,是目前紫杉醇药源最具应用前景的生产方法,可有效缓解市场上突出的紫杉醇供求矛盾,对濒危药用植物红豆杉的保护也具有非常重要的意义[9-11]。
天然10β–去乙酰巴卡亭Ⅲ乙酰氧基转移酶活性较低,难以满足工业化生产需求。从基因水平上对DBAT进行改造,主要可选择非理性设计、半理性设计和理性设计3种技术思路。其中理性设计是在一定的结构或功能信息辅助下,依据某种结构功能特性,预测特定氨基酸位点的优化结果,并结合分子生物学方法进行验证的改造策略[12-13]。疏水相互作用是促进蛋白质正确折叠的主要驱动力,也是维持蛋白构象稳定的重要因素之一[14-15]。有研究表明,将聚合酶活性位点的水分子驱除,会放大无误碱基对与错配碱基对之间的自由能差异,从而促进聚合酶的高保真度与准确度[16]。据此,推测在DBAT酶分子催化口袋内部或邻近区域引入疏水性残基,或能通过促进水分子的驱除,加强底物与活性位点残基的反应[17]。本研究以改变DBAT活性中心的疏水环境为切入点,通过分子模拟对接和定点突变试验,构建并验证突变体,以期在增强氨基酸残基之间的疏水相互作用、提高蛋白质构象稳定的同时,提高酶的催化性能,为该酶的后续深入研究和工业应用提供依据,并为其突变酶及酶促反应提供技术支撑。
1 材料与方法 1.1 材料含有dbat基因的表达载体pET-32a-dbat和DBAT同源建模模型,分别由广东省微生态制剂工程技术研究中心的尤琳峰和黄佳俊博士构建;大肠埃希菌Escherichia coli菌株DH5α和BL21(DE3),由广东省微生态制剂工程技术研究中心保存。
1.2 分子对接使用Auto Vina软件对DBAT及其天然底物乙酰CoA进行分子对接模拟,利用WinPyMol软件对活性中心氨基酸进行模拟突变并与底物对接,依据氨基酸疏水性和对接后结合能的变化,选定拟突变位点进行下一步试验。
1.3 突变质粒的构建和转化 1.3.1 引物设计根据分子对接选定的拟突变位点,设计突变引物(表1)。
|
|
表 1 点突变引物 Table 1 Primers of site-directed mutation |
以pET-32a-dbat质粒为模板,利用相应的点突变引物进行全质粒PCR扩增。10 g·L–1琼脂糖凝胶电泳检测PCR扩增成功后,利用E.Z.N.A.Cycle Pure Kit试剂盒纯化回收PCR产物。回收产物加入DpnⅠ限制性内切酶消化后转化至大肠埃希菌DH5α。经含氨苄青霉素的培养基筛选后,挑选单菌落转接培养,提取质粒并测序。利用DNAMAN6.0将测序结果与原始dbat基因序列进行比对,若除特定突变位点外,完全匹配且无错配碱基,将载体转化至大肠埃希菌BL21(DE3)。
1.3.3 重组蛋白的表达及纯化挑取单菌落接种到10 mL的含100 μg·mL–1氨苄青霉素的LB液体培养基中,37 ℃过夜培养。吸取1 mL菌液接种至100 mL的LB液体培养基中,37 ℃、220 r·min–1条件下培养2.5 h至D600 nm达到0.6~0.8,加入终浓度为0.1 mmol·L–1的IPTG,20 ℃、120 r·min–1条件下诱导培养18 h。超声细胞破碎仪对重悬菌体进行破碎,4 ℃、8 000 r·min–1离心10 min收集上清。利用Ni-NTA亲和层析对重组蛋白进行纯化,SDS-PAGE检测蛋白的表达及杂蛋白洗脱情况。
1.4 重组酶酶学性质测定DBAT酶活力单位1 U为最适反应条件下,每分钟转化10-DAB生成1 μmol巴卡亭Ⅲ所需的酶量。重组酶测定体系(400 μL)为:0.4 mmol·L–1 10-DAB,0.4 mmol·L–1乙酰CoA,5 mmol·L–1 MgCl2溶液,20 μL酶,245.5 μL PBS溶液(不同pH),分别置于不同的温度下反应60 min后,加入400 μL乙腈终止反应。液相色谱条件为:C18反向柱(5 μm,250 mm×4.6 mm),波长227 nm,流速1 mL·min–1,柱温30 ℃,流动相为乙腈和水,体积比为40∶60,进样量20 μL。利用相同条件对巴卡亭Ⅲ标品制作标准曲线,采用面积外标法对样品进行定量分析。并采用Michaelis-Menten方程对不同底物浓度(c)下的反应速率(v)进行非线性拟合,计算得到各突变酶的Km、vmax、kcat/Km常数。Km值为米氏常数,其数值体现酶对底物的亲和力大小;kcat/Km值为酶的催化常数,其数值体现酶的催化效率。
2 结果与分析 2.1 分子对接利用Auto Dock Vina软件对DBAT和天然底物乙酰CoA进行分子对接,对接后的三维结构如图1所示,利用Pymol软件在酶活性中心区域将其中亲水性氨基酸模拟突变成疏水性氨基酸,并与底物分子模拟对接。对接结果发现其中的Cys165Trp、Asn300Ile与乙酰CoA的结合能有所降低,而能量越低,酶结构更稳定。160位Phe突变成亲水氨基酸Cys后与乙酰CoA的结合能稍有提高。故选定Cys165Trp(C165W)、Asn300Ile(N300I)、Phe160Cys(F160C)来探究疏水性变化对酶构象和催化性质的影响。

|
图 1 模拟分子对接后的三维结构 Figure 1 Three-dimensional structure after simulated molecular docking |
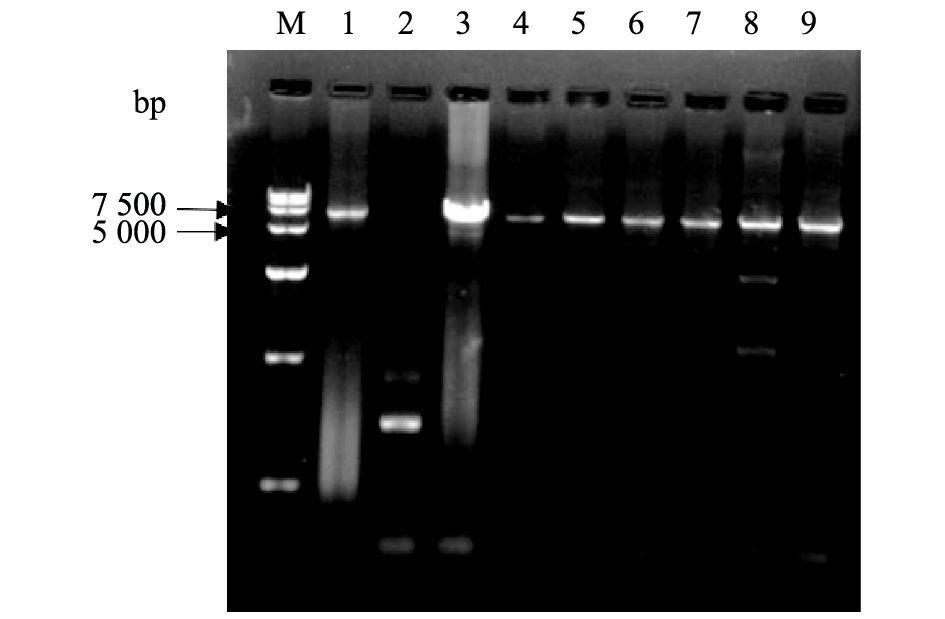
利用点突变引物对pET-32a-dbat进行全质粒PCR扩增目的片段,凝胶电泳检测结果见图2,除第2泳道的DBATF160C的1个样品外,突变体DBATC165W、DBATN300I、DBATF160C分别在5 000~7 500 bp处有对应的亮带。测序结果与野生型dbat基因比对,除特定突变位点外,完全匹配且无错配碱基,表明C165W、N300I、F160C对应的突变体构建成功。
|
图 2 全质粒PCR产物电泳分析 Figure 2 Electrophoretic analysis of whole-plasmid PCR products M:DNA Marker DS15 000,1~3:DBATF160C,4~6:DBATC165W,7~9:DBATN300I |
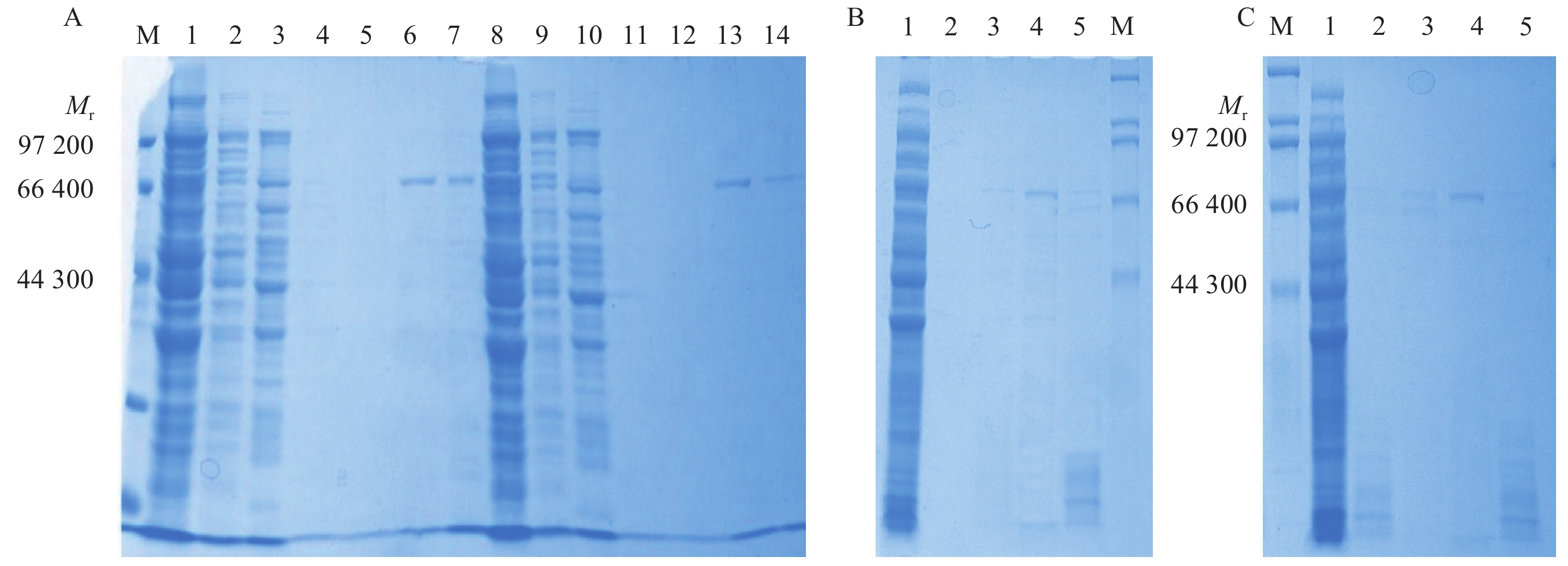
蛋白粗酶液和经Ni-NTA纯化后的蛋白收集液经SDS-PAGE电泳,结果如图3所示,在蛋白相对分子质量为67 000处可见明显特征条带,表明重组蛋白的相对分子质量大小与理论值67 000相符,重组蛋白被成功表达。
|
图 3 野生和突变酶SDS-PAGE电泳分析 Figure 3 SDS-PAGE analysis of wild type and recombinant enzymes A:DBAT和DBATF160C,M:即用型蛋白质相对分子质量标准(低),1:DBAT粗酶液,2~3:DBAT漂洗液,4~7:DBAT纯化洗脱液,8:DBATF160C粗酶液,9~10:DBATF160C漂洗液,11~14:DBATF160C纯化洗脱液;B:DBATC165W,1:粗酶液,2~5:纯化洗脱液,M:即用型蛋白质相对分子质量标准(高);C:DBATN300I,M:即用型蛋白质相对分子质量标准(高),1:粗酶液,2~5:纯化洗脱液 |
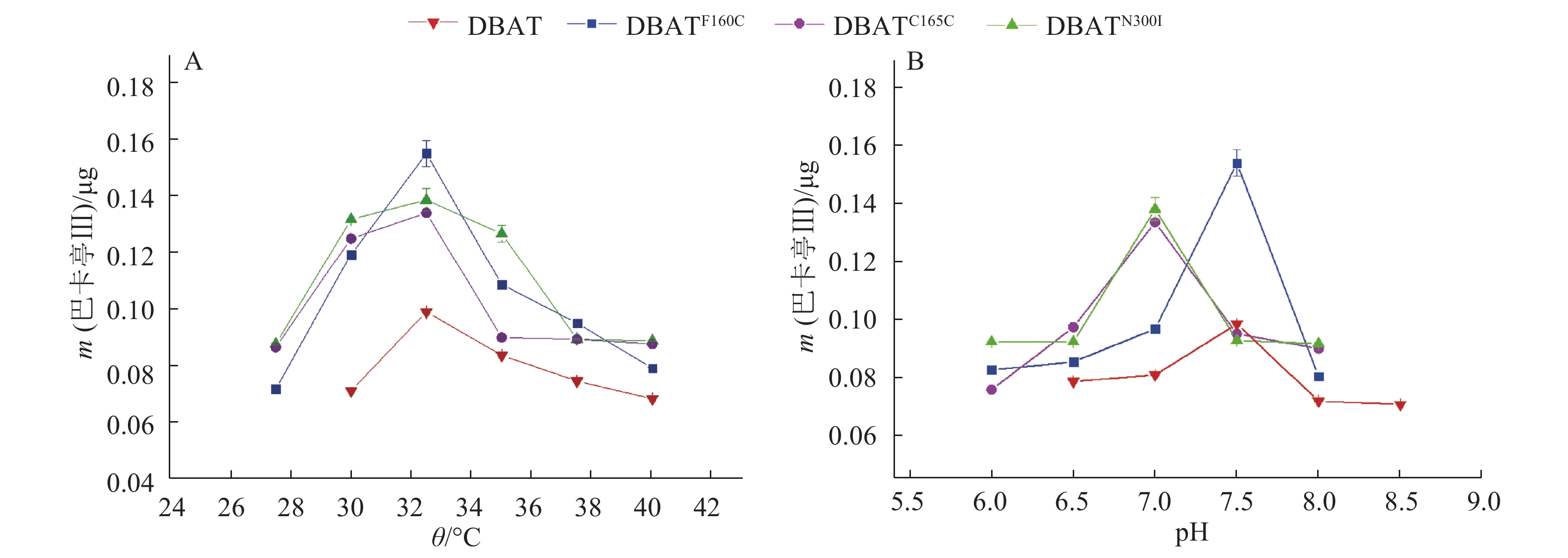
在催化巴卡亭Ⅲ生成的反应中,如图4A所示,DBATF160C、DBATC165W和DBATN300I最适温度均为32.5 ℃,与野生酶DBAT一致;由图4B可知,DBAT、DBATF160C最适pH均为7.5;DBATC165W和DBATN300I最适pH为7.0,相对于野生型下降了0.5个单位。结果表明在催化巴卡亭Ⅲ生成的反应中,突变酶在温度和pH耐受程度上与野生酶无明显差异。
|
图 4 温度和pH对酶活性的影响 Figure 4 Effects of temperature and pH on enzyme activities |
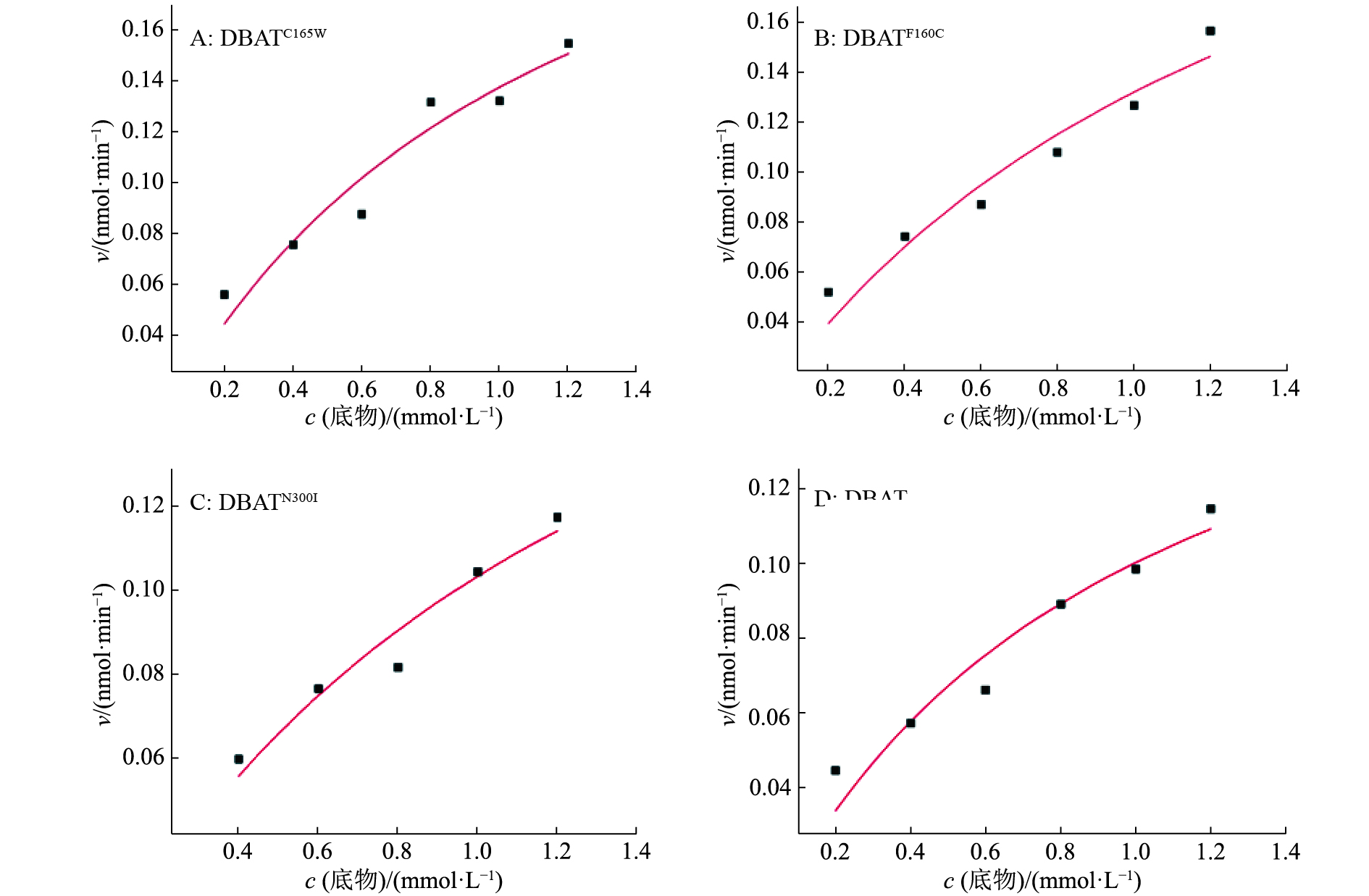
对各DBAT突变体的比活力进行了测定,并对不同底物浓度下的反应速率进行了非线性拟合(图5),分析结果如表2所示。DBATC165W的比活力相对于野生型提高了61.5%,催化效率提高了55.4%。DBATN300I的比活力相对于野生型提高了19.2%,催化效率提高了2.9%,与野生型相差不大。DBATF160C的比活力相对于野生型提高了59.6%,其催化效率也得到了35.1%的提高。但3个突变酶的米氏常数均有提高,表明对底物10-DAB的亲和力均表现为下降。最大反应速率相比野生型均有不同程度的提高。
|
图 5 酶反应的非线性回归曲线 Figure 5 Nonlinear regression curve of enzyme reaction |
|
|
表 2 酶活力及动力学参数 Table 2 Enzyme activities and kinetic parameters |
突变酶DBATC165W比活力及催化效率的提高,推测是该位点的疏水突变增加了酶的疏水作用,从而影响了催化中心,促使酶活力也得到提高。突变酶DBATN300I的比活力相对于野生型提高了19.2%,推测氨基酸的疏水集群作用使得酶的构象更稳定从而影响了酶的催化性质。但是,其Km值的增大表明其对底物的亲和力有所下降,猜测该位点的突变虽使得疏水作用增强,酶活力也得到提高。由于Asn带有具有极性性质的侧链基团,这些侧链基团可形成氢键使底物与酶的结合比较稳定,因而该位点的疏水突变没有引起催化效率的明显改善。
通过将DBATF160C与乙酰CoA计算机分子模拟对接发现,该位点突变后,底物与活性中心的距离由原来的6.7 Å变成了7.6 Å,推测可能是因为底物与活性中心距离的增大,使得底物与酶的结合难度增大,导致酶与底物的亲和力降低。另一方面,突变酶DBATF160C的比活力和催化效率却得到了较大的提高。有研究表明,通过点突变使2个氨基酸之间形成新的二硫键来增加蛋白的稳定性,突变体的酶活力也可得到显著提高[18]。因此,推测160位Phe突变成侧链含有硫的Cys会使得酶内部的二硫键增加,使突变酶结构更稳定,且侧链带有苯环的Phe突变成侧链更小的Cys后,使得活性中心内部空穴变大,这些因素的作用共同影响了突变酶的催化性质,使得酶活提高。Gallardo等[19]通过定向进化的方法得到热稳定性提高的木聚糖酶突变体,经过分析,发现大部分突变均是亲水残基变为疏水残基,增加了蛋白质的疏水堆叠,提高其稳定性。Koudelakova等[20]将酶的底物通道周围的氨基酸突变为疏水氨基酸,在提高热稳定性的同时,也极大的提升了酶对有机溶剂的抗性。Wahab等[21]将蛋白内部氧阴离子穴内的氨基酸突变为疏水性氨基酸,改变了酶构象的稳定性的同时,也改变了酶的催化属性。这些研究表明,酶的疏水性质与酶构象之间是相互影响的,而构象的稳定又与酶的催化性质相互影响。在本研究结果中虽未能验证活性中心区域疏水氨基酸的改变与酶活力之间的关系,但继续深入探究如何改变活性口袋内部或附近的疏水环境,实现对蛋白内部结构的有利调整,进而提高酶的催化性能具有非常重大的价值和意义。
本研究通过模拟突变与分子对接确定了C165W、N300I、F160C 3个突变位点。3种突变重组酶的最适反应温度均为32.5 ℃,与野生酶DBAT一致;DBATF160C与DBAT的最适反应pH为7.5,而DBATC165W和DBATN300I的最适反应pH为7.0;DBATC165W、DBATF160C和DBATN300I的比活力及催化效率与DBAT相比均有所提高,其中以DBATC165W的比活力和催化效率为最高。本试验中构建的突变体,其酶活力均得到不同程度的提高,研究结果为对DBAT的进一步深入探究和改造提供了一定参考,也为体外高效酶促合成紫杉醇的前体物巴卡亭Ⅲ奠定了基础。
| [1] |
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 (  0) 0) |
| [2] |
邓立新. 抗癌新药紫杉醇简介[J]. 化学教学, 2006(1): 46-48. (  0) 0) |
| [3] |
WANI M C, TAYLOR H L, WALL M E, et al. Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia
[J]. J Am Chem Soc, 1971, 93(9): 2325-2357. DOI:10.1021/ja00738a045 (  0) 0) |
| [4] |
刘先芳, 梁敬钰, 孙建博. 紫杉醇: 具有里程碑意义的天然抗癌药物[J]. 世界科学技术: 中医药现代化, 2017, 19(6): 941-949. (  0) 0) |
| [5] |
周培华, 刘兰, 李干雄, 等. 紫杉醇的生产研究[J]. 轻工科技, 2012(5): 8-9. (  0) 0) |
| [6] |
KINGSTON D. The shape of things to come: Structural and synthetic studies of taxol and related compounds[J]. Phytochemistry, 2007, 68(14): 1844-1854. DOI:10.1016/j.phytochem.2006.11.009 (  0) 0) |
| [7] |
WALKER K, CROTEAU R. Molecular cloning of a 10-deacetylbaccatin III-10-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli
[J]. Proc Natl Acad Sci USA, 2000, 97(2): 583-587. DOI:10.1073/pnas.97.2.583 (  0) 0) |
| [8] |
匡雪君, 王彩霞, 邹丽秋, 等. 紫杉醇生物合成途径及合成生物学研究进展[J]. 中国中药杂志, 2016, 41(22): 4144-4149. (  0) 0) |
| [9] |
LI Y, ZHANG G J, PFEIFER B A. Current and emerging options for taxol production[J]. Adv Biochem Eng Biotechnol, 2015, 148: 405-425. (  0) 0) |
| [10] |
杨春, 孔令义, 汪俊松. 加拿大红豆杉中紫杉烷类成分的研究进展及药源危机解决方法探讨[J]. 中国中药杂志, 2014, 39(11): 1961-1971. (  0) 0) |
| [11] |
LIU W C, GONG T, ZHU P. Advances in exploring alternative taxol sources[J]. RSC Advances, 2016, 6(54): 48800-48809. DOI:10.1039/C6RA06640B (  0) 0) |
| [12] |
郭斐. 利用半理性和理性策略对酶活性及手性选择性的设计[D]. 杭州: 浙江大学, 2015.
(  0) 0) |
| [13] |
CHICA R A, DOUCET N, PELLETIER J N. Semi-rational approaches to engineering enzyme activity: Combining the benefits of directed evolution and rational design[J]. Curr Opin Biotechnol, 2005, 16(4): 378-384. DOI:10.1016/j.copbio.2005.06.004 (  0) 0) |
| [14] |
DILL K A. Dominant forces in protein folding[J]. Biochemistry, 1990, 29(31): 7133-7155. DOI:10.1021/bi00483a001 (  0) 0) |
| [15] |
王克夷. 疏水作用和蛋白质[J]. 生命的化学, 1999, 19(5): 233-235. (  0) 0) |
| [16] |
PETRUSKA J, SOWERS L, GOODMAN M. Comparison of nucleotide interactions in water, proteins, and vacuum: Model for DNA polymerase fidelity[J]. Proc Natl Acad Sci USA, 1986, 83(6): 1559-1562. DOI:10.1073/pnas.83.6.1559 (  0) 0) |
| [17] |
SHARMA B, KAUSHIK N, SINGH K, et al. Substitution of conserved hydrophobic residues in motifs B and C of HIV-1 RT alters the geometry of its catalytic pocket[J]. Biochemistry, 2002, 41(52): 15685-15697. DOI:10.1021/bi026311z (  0) 0) |
| [18] |
HAN Z, HAN S, ZHENG S, et al. Enhancing thermostability of a Rhizomucor miehei lipase by engineering a disulfide bond and displaying on the yeast cell surface
[J]. Appl Microbiol Biotechnol, 2009, 85(1): 117-126. DOI:10.1007/s00253-009-2067-8 (  0) 0) |
| [19] |
GALLARDO Ó, PASTOR FI, POLAINA J, et al. Structural insights into the specificity of Xyn10B from Paenibacillus barcinonensis and its improved stability by forced protein evolution
[J]. J Biol Chem, 2010, 285(4): 2721-2733. DOI:10.1074/jbc.M109.064394 (  0) 0) |
| [20] |
KOUDELAKOVA T, CHALOUPKOVA R, BREZOVSKY J, et al. Engineering enzyme stability and resistance to an organic cosolvent by modification of residues in the access tunnel[J]. Angew Chem Int Ed Engl, 2013, 52(7): 1959-1963. DOI:10.1002/anie.v52.7 (  0) 0) |
| [21] |
WAHAB R A, BASRI M, RAHMAN M B A, et al. Engineering catalytic efficiency of thermophilic lipase from Geobacillus zalihae by hydrophobic residue mutation near the catalytic pocket
[J]. Adv Biosci Biotechnol, 2012, 3(2): 158-167. DOI:10.4236/abb.2012.32024 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


