2. 农业部农业物联网重点实验室, 陕西 杨凌 712100;
3. 西北农林科技大学 葡萄酒学院,陕西 杨凌 712100
2. Key Laboratory of Agricultural Internet of Things, Ministry of Agriculture, Yangling 712100, China;
3. College of Enology, Northwest A&F University, Yangling 712100, China
花色苷是影响着葡萄酒呈色及口感等品质的重要酚类化合物之一[1],它主要存在于葡萄浆果表皮3~4层细胞的液泡内[2]。在葡萄果实的生长过程中,花色苷会在葡萄转色后开始迅速积累,并且含量在果实成熟时期达到最大,但在葡萄果实过成熟时,其含量会略微下降[3],所以酿酒葡萄成熟期花色苷含量的检测对于确定葡萄的最佳采摘日期有着重要的影响。为了提高葡萄酒的品质,越来越多的酿酒商开始对花色苷含量进行监控检测。目前从葡萄中提取花色苷主要以化学方法居多[4-7],但是,大部分化学方法都存在着试验成本高、操作繁琐、耗时费力、对样本破坏大、检测速度慢、不适用于大数量样本等缺陷,难以适应现代化的葡萄酒生产规模。因此,研究一种能快速、无损的检测花色苷含量的方法是十分必要的。
高光谱成像技术由于具有波段连续且众多、光谱分辨率高、“图谱合一”等优点[8],已广泛地应用于农产品无损检测领域。目前,国内外研究人员运用该技术对各种水果和农作物的表面擦伤[9-11]、农药表面残留[12-14]和肉类表面菌落总数[15]、表面污染[16-17]等一系列外部品质进行了分析,除此之外,也对水果果实糖分含量[18-19]、猪肉pH[20-21]、羊肉水分含量[22]等内部物质进行了检测。在影响葡萄品质的无损检测方面,González-Caballero等[23]利用高光谱成像技术对酿酒葡萄的成熟度进行了检测;刘旭等[24]以酿酒红葡萄品种‘赤霞珠’作为研究对象,利用高光谱成像结合多元回归分析等方法预测花色苷含量。但此类模型在成熟期仅采集1次样本,且仅预测1个品种的花色苷含量,其适应性和推广性具有一定的局限性。
综上所述,高光谱成像技术在国内外无损检测方面具有广泛应用,但对于检测酿酒葡萄中花色苷含量的研究仍相对较少,目前仅限于对单一品种的酿酒葡萄果皮中花色苷的含量进行检测。本研究对多品种成熟期酿酒葡萄果皮的花色苷含量建立检测模型,以期提高模型的适应性和花色苷检测效率,对于确定酿酒葡萄的最佳采摘日期,从而生产出高质量的葡萄酒具有重要的意义。
1 材料与方法 1.1 试验材料研究对象为‘赤霞珠’(Cabernet Sauvignon)、‘黑比诺’(Pinot Noir)、‘媚丽’(Meili)、‘马瑟兰’(Marselan)、‘西拉’(Shiraz)、‘嘉年华’(Jianianhua) 6个品种的酿酒红葡萄成熟期果实。
样本采集地点为陕西省杨凌区盛唐酒庄,于2015年7月酿酒葡萄转色后1周开始至果实成熟期间进行样本采集。由于水分、光照等外界环境的影响,同品种不同植株、同植株不同部位间的葡萄都存在差异。为使样本具有代表性,每组葡萄均采用Z型采样法采摘自不同植株的不同部位。对不同品种的植株以7~10 d为1个间隔,各品种每次采摘200颗,随机选出其中的120颗葡萄,在保证每组间样本质量相似的前提下分为6组,每20颗酿酒葡萄为1组,其中的3组作为研究样本,另3组作为备份样本,3组研究样本随机选取2组作为训练集,1组作为校验集。每品种共采集4次,其中‘嘉年华’品种采集了5次,故最终得到75组研究样本,其中训练集50组,校验集25组。将所有样本放于–20 ℃恒温存储,待试验研究时再放置于室温条件下解冻30~60 min。
1.2 试验试剂十二烷基硫酸钠(SDS)100 g;三乙醇胺500 mL;六水三氯化铁100 g;牛血清白蛋白(BSA)10 g;5.0 mol·L–1的氢氧化钠溶液150 mL;φ为37%的盐酸溶液1 L;冰醋酸500 mL;氯化钠500 g;顺丁烯二酸(马来酸);儿茶素水合物;丙酮溶液[V(丙酮)∶V(蒸馏水)=2∶1];亚硫酸钾100 g;柠檬酸2 mg;酒石酸氢钾5 g;φ为96%的乙醇溶液120 mL,除儿茶素购买自Sigma-Aldrich,其他试剂均为分析纯,购买自阿拉丁试剂有限公司。
1.3 试验设备分析天平,漩涡震荡仪,紫外分光光度计(Shimadzu UV-1700),光谱分辨率为3.3 nm的近红外高光谱成像仪(ImSpector N17E,Spectral Imaging Ltd.,Finland),320×256像素的面阵CCD探测器(XEVA3616,XenICs Ltd.,Belgium)。
硬件包括成像光谱仪、CCD面阵探测器、镜头、暗箱、照明单元、电动位移台和计算机系统等部分。采用线扫描方式并结合Spectral SENS-V17E (Gilden Photonics Ltd.,England)软件来获取样本高光谱图像。整个高光谱成像系统如图1所示,它能采集900~1 700 nm范围内的光谱。在成像系统中,相机物距为200 mm,曝光时间为10 ms,载物台移动速度为20 mm·s–1。
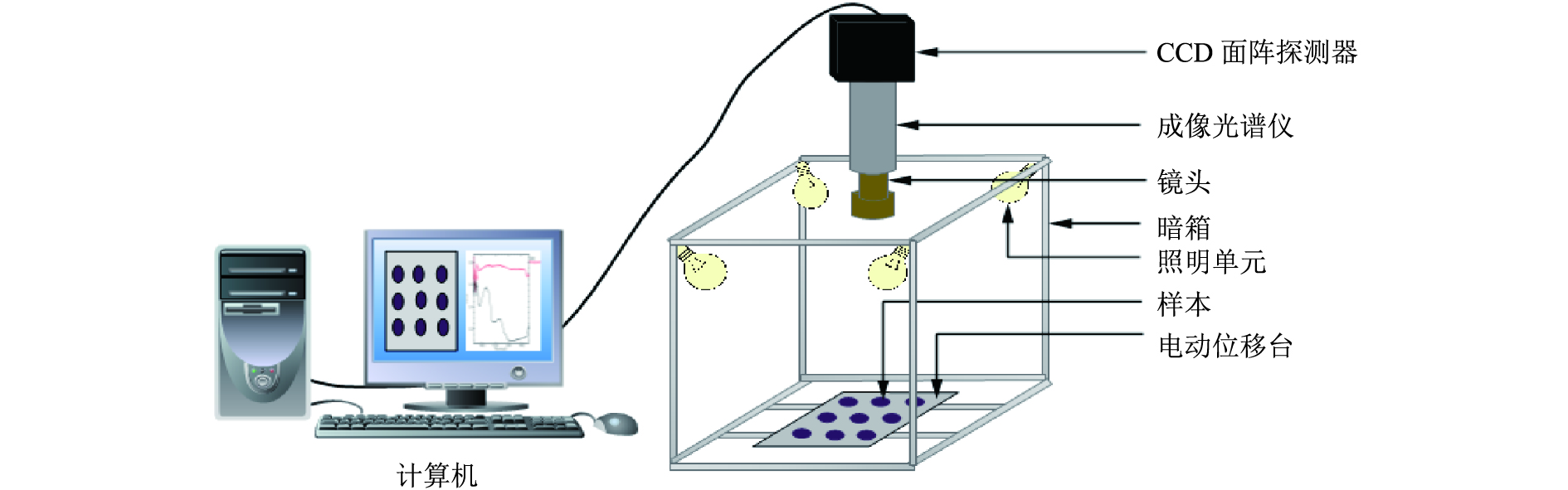
|
图 1 高光谱成像系统组成图 Figure 1 The components of hyperspectral imaging system |
将葡萄样本撕下果皮,置于装有50 mg·L–1焦亚硫酸钾和0.1%(φ)柠檬酸冰水溶液的小烧杯中。撕取完成后滤出果皮,用镊子夹下附着的果肉,放入蒸馏水中冲洗多次,将果皮上附着的果肉完全剥离干净,将果皮表面的糖去掉;并用吸水纸吸干,放入干净的小样品袋中,分别称质量(得到湿质量)。浸提时,每个样品的果皮分别加入20 mL丙酮溶液,避光振荡浸提24 h,抽滤(通风橱中进行),并于–20 ℃条件下贮藏。
测定时,用800 mL去离子水溶解5 g酒石酸氢钾,冷却至室温添加120 mL φ为96%的乙醇溶液,用盐酸调节pH至3.3,添加去离子水至1 L配制模式葡萄酒溶液。吸取400 μL的模式葡萄酒到1.5或2.0 mL的离心管中,顺序添加100 μL果汁样本与1 mL花色甘缓冲液。涡旋振荡,在室温下培养5 min。用1 mL花青素缓冲液将分光光度计调0,样本在520 nm处读数。记录数据作为花色苷化学最终测定值。由于每组有20颗酿酒葡萄,故最终每组花色苷化学值取组内20颗葡萄的平均值。
1.4.2 酿酒葡萄样本高光谱图像的采集利用高光谱成像系统采集图像时,先将每组样本放置于电动平移载物台上,并保证载物台上的定位孔对准相机,用4组点光源照射,同时在光学焦平面垂直的方向上安装近红外高光谱成像仪对样本进行扫描,以此获得一行图像像素在光谱区域上的信息,同时用软件控制载物台移动,使样本随之移动来获取所有图像行的光谱信息,最终得到该组样本的整个光谱图像,完成图像的采集。重复以上步骤,采集75组样本的高光谱图像。
1.4.3 酿酒葡萄高光谱图像的预处理光谱信息中一般含有部分无关信息和大量噪声,若直接用高光谱图像建模不仅会产生较大误差而且效率也低,所以一般需要对数据进行预处理。数据预处理的方法众多,方法不同所产生的效果也不一样,合适的方法不仅能减弱甚至消除噪声、光畸变、光散射等对高光谱曲线造成的影响,提高最终模型的预测能力,同时还可以大幅提升模型稳定性。
采用多元散射校正(Multiplicative scatter correction,MSC)、归一化处理、Zscore处理、S-G滤波(Savisky-golay filtering) 4种预处理方法对样本平均光谱数据进行处理。MSC是通过建立一条“理想光谱曲线”反映光谱变化与酿酒葡萄内部花色苷变化间的线性关系,它能消除光散射和基线漂移对光谱曲线的影响[25];归一化处理可降低由于样本表面凹凸不平引起的光散射现象的影响;Zscore方法是对初始光谱数据进行整体的放大和缩小,用数据减去原始数据的平均值,所得值再除以标准差;S-G滤波是一种在时域内运用局部多项式,结合最小二乘法得到最优拟合的滤波算法,该算法在对数据去噪时能保证原始数据的宽度、形状等特征不发生变化。后续分析基于这4种预处理方法进行。
1.4.4 酿酒葡萄光谱数据降维方法预处理后要对酿酒葡萄平均光谱数据进行降维,压缩波段选出合适的特征波长,用特征波长最大限度还原初始数据,并保证不丢失光谱的关键信息,在除去冗余信息及多余噪声的同时减少数据处理量,提高后续建模的精度,实现快速检测。
采用连续投影法(Successive projections algorithm,SPA)和主成分分析法(Principal componens analysis,PCA) 2种方法对葡萄样本光谱进行降维。SPA能从重叠的平均光谱数据中提取特征波段,简化模型,缩短校正时间 [26-27]。PCA主要是围绕酿酒葡萄光谱数据的相关性进行分析,把具有相关性的变量用线性变化转换成彼此间相互独立的变量,从而突出最能表现样本属性的变量,以此降低维度,提取出感兴趣区域的主要信息。
1.4.5 花色苷含量预测建模方法花色苷中主要含有氢氧基团,它对不同波段的近红外光谱会产生不同的吸收和反射作用。基于这个原理可以推断出采集到的高光谱数据与酿酒葡萄内部的花色苷存在着一定的联系。建立出性能优良的预测模型是利用高光谱图像进行无损检测的关键。为了找出近红外高光谱图像和花色苷含量的映射关系,本文采用支持向量机回归(Support vector regression, SVR)对光谱数据和花色苷化学测量值进行建模。SVR是一种针对有限样本的学习方法,具有学习速度快、结构简单、预测精度较高的特点,对解决非线性、高维度、小样本问题有很好的效果。SVR采用核函数实现非线性回归,通过非线性映射将复杂的数据映射至高维度特征空间,可以较好地避免过拟合现象[28]。
2 结果与分析 2.1 样本果皮花色苷含量分析6个品种酿酒葡萄在成熟期不同阶段的果皮花色苷含量化学测量结果如表1所示,其中,除嘉年华采集了5个阶段外,其余5个品种均采集了4个阶段。由表1可以看出,在葡萄成熟过程中,不同品种的花色苷含量有明显区别,分布区间差异较大。各个阶段花色苷含量总体在不断上升,‘嘉年华’在第5个阶段出现了略微下降,这与花色苷在酿酒葡萄成熟期的变化趋势总体相符。成熟期中‘马瑟兰’的平均花色苷含量最高,‘西拉’次之,‘黑比诺’中花色苷含量最少,但其方差比其他品种小。6个品种整体标准差较低,可用于建立模型预测果皮中的花色苷含量。
训练集和校验集的花色苷化学值含量统计结果如表2所示,对比二者的最大值、最小值、平均值和标准差可以发现基本一致,说明采集的样本分布均匀,分集结果具有较好的合理性和代表性。
|
|
表 1 6种酿酒葡萄成熟期果皮的花色苷含量统计表 Table 1 Statistics of anthocyanin content during ripening in winegrape skins of six varieties |
|
|
表 2 训练集和校验集花色苷含量统计表 Table 2 Statistics of anthocyanin contents in the training set and the testing set |
采集高光谱图像后,将图像导入ENVI 4.7 (Research System Inc.,USA)软件中进行预处理。通常光谱曲线的两端处噪声较多,为提高模型精度,选取960~1 665 nm区间的208个波段光谱数据用于后续处理。图2a所示是酿酒葡萄样本在1 011 nm下的原始高光谱图像。除此之外,选取酿酒葡萄高光谱曲线的波峰(1 057 nm)和波谷(1 396 nm)处的光谱图像亮度值进行波段比运算,并对波段比图像采用阈值法和形态学滤波生成掩膜,用于去除载样台、定位孔等无关背景,提取葡萄样本区域的高光谱数据。图2b是掩膜分割后提取的酿酒葡萄在1 101 nm波段下的图像。
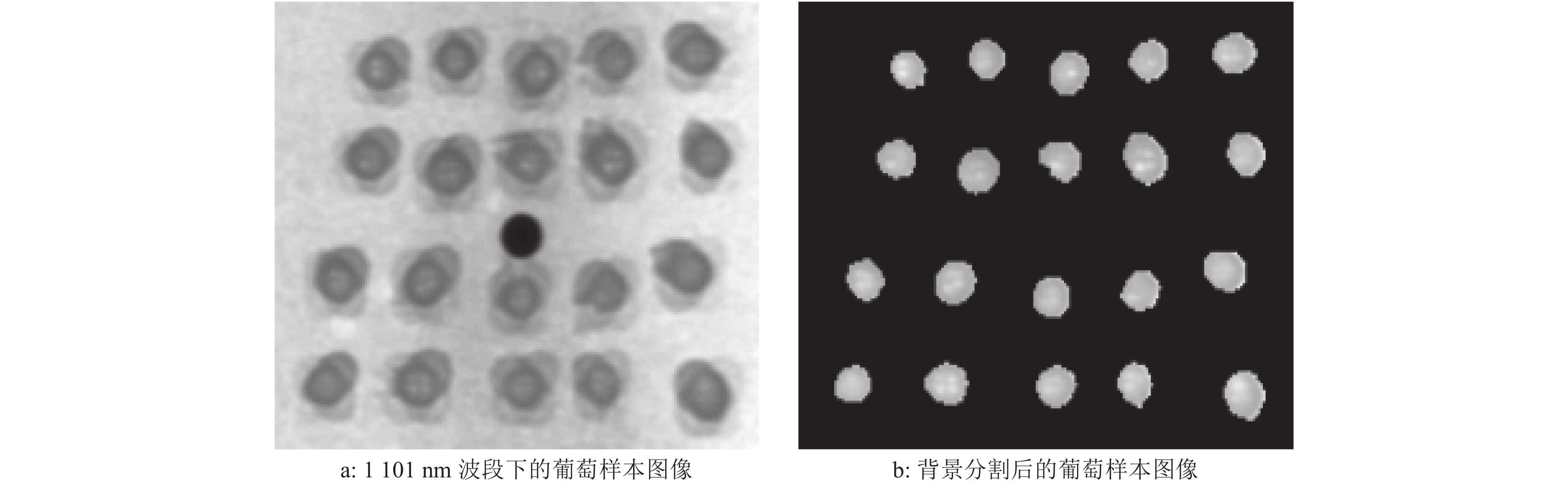
|
图 2 酿酒葡萄样本提取 Figure 2 Sample extraction of winegrape |
图3是6个不同品种的酿酒葡萄样本在960~1 665 nm波长范围内的平均光谱曲线,由曲线可以直观地看出,‘马瑟兰’的光谱反射值最高,‘赤霞珠’次之,‘媚丽’最低。不同品种的光谱曲线变化不大,6个品种的光谱反射曲线走势基本一致,都是在1 065和1 275 nm附近出现波峰;在1 190和1 450 nm附近出现波谷。这是由于近红外波段适用于测量含有氢氧基团的物质,花色苷中含的氢氧基团对近红外光吸收率不同而造成的。
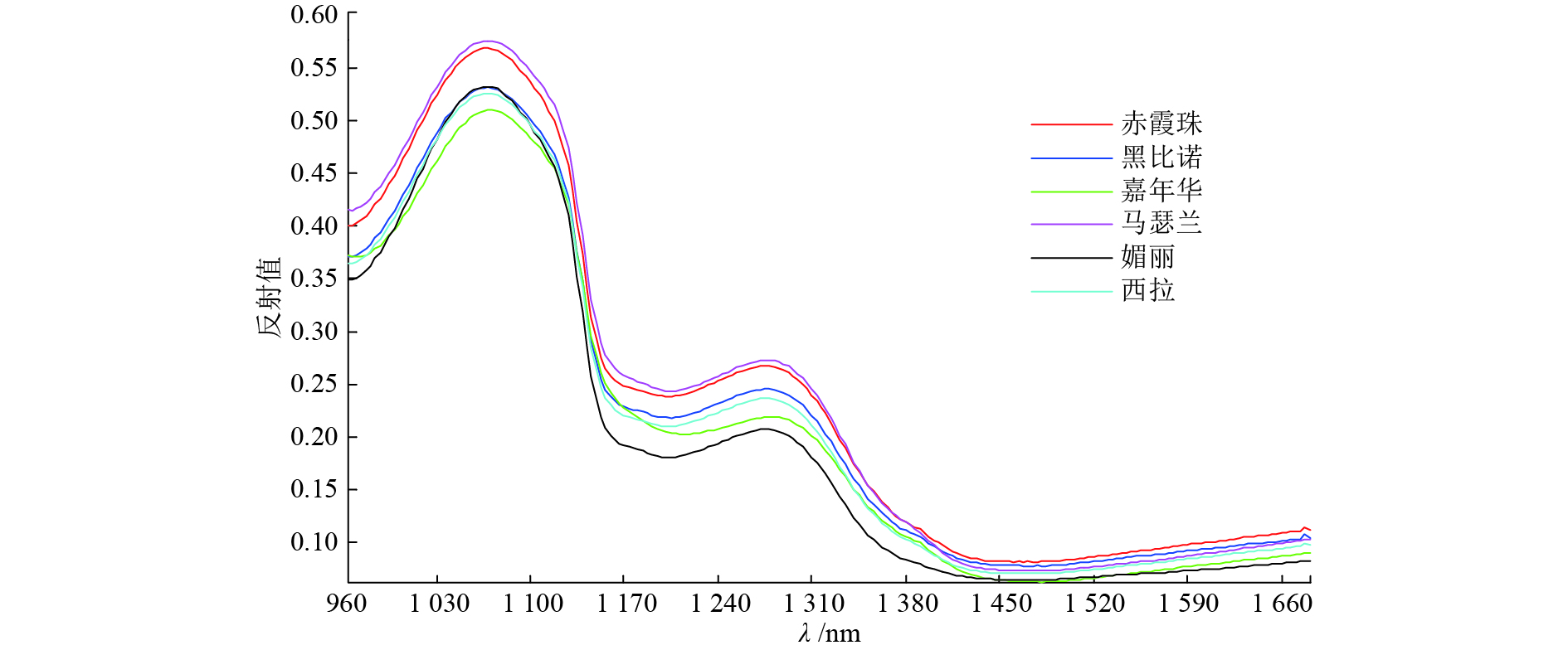
|
图 3 6种酿酒葡萄的平均光谱曲线 Figure 3 The mean spectral profiles of six different winegrape varieties |
分别对预处理后的数据利用SPA和PCA降维。SPA降维时,限制选择的特征波段数不超过20个;而用PCA降维时,限制主成分的累计贡献率在99.5%以上。为了避免过拟合,在训练集内部进行10折交叉验证,通过对比交叉验证的均方根误差(Root mean square error,RMSE)来确定最佳的特征波段。
图4反映了Zscore+SPA的降维结果,由图4a可知,该模型将原来的208个波段降为8个特征波段,极大地减少了冗余信息,其RMSE为0.209 69,是所有SPA降维结果中最低的。由图4b可以看出,8个特征波长分别在960、1 063、1 161、1 380、1 416、1 531、1 590、1 662 nm处,它们大部分都处于光谱曲线的波峰和波谷位置,可以较好地反映出曲线的走势。
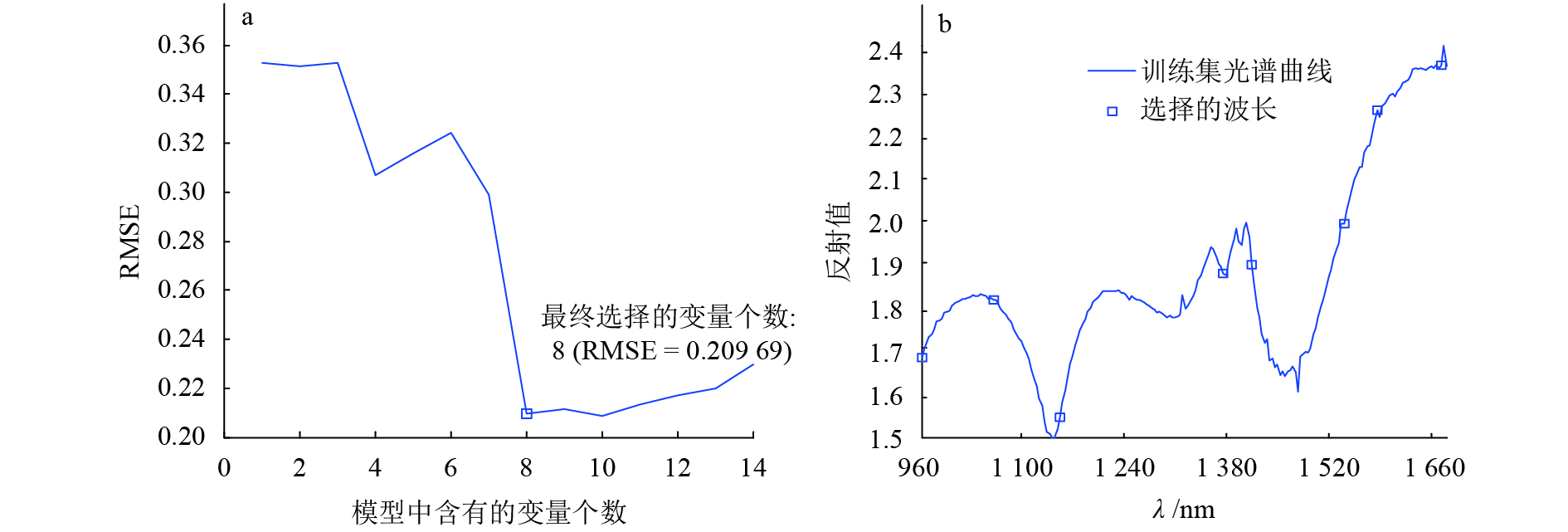
|
图 4 基于SPA的特征降维分析 Figure 4 The feature reduction analysis by SPA |
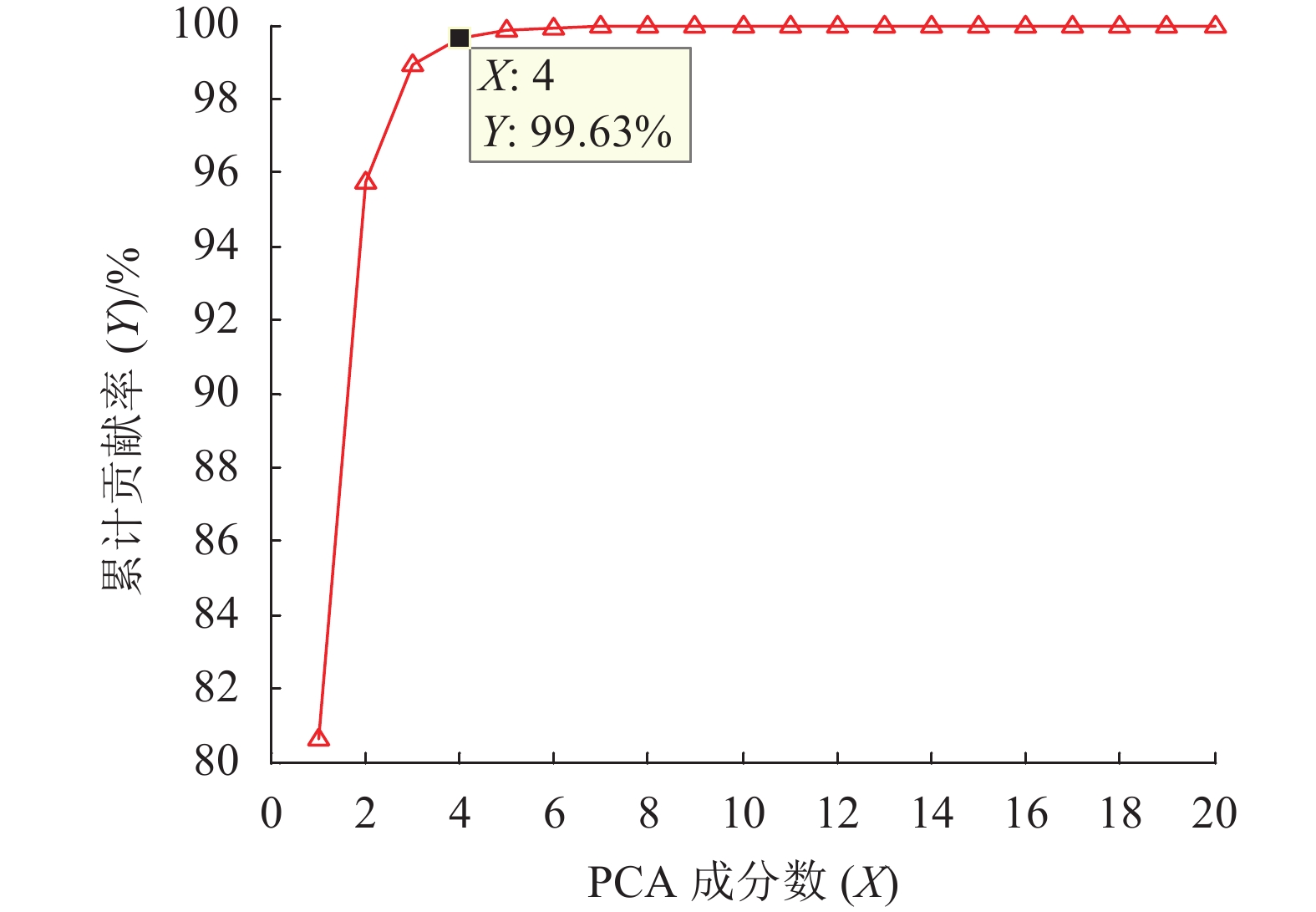
图5是01归一化+PCA的降维结果,由图5可知,前4个主成分的累积贡献率已超过99.50%,达到99.63%。其中第1主成分到第4主成分的贡献率分别为80.63%、15.14%、3.15%和0.71%。
|
图 5 PCA累计贡献率 Figure 5 The cumulative contribution rate of PCA |
以选出的特征波长或主成分作为SVR的输入变量,花色苷的化学值作为因变量,利用libSVM函数库[21],建立对应的PCA+SVR、SPA+SVR预测模型。SVM类型设置为epsilon-SVR,核函数类型为默认的径向基函数(Radial basis function,RBF),损失函数取值为0.01,结合网格参数寻优确定最优的c和g值。
为比较各预测模型的优劣,获得最优模型,采用训练集决定系数(
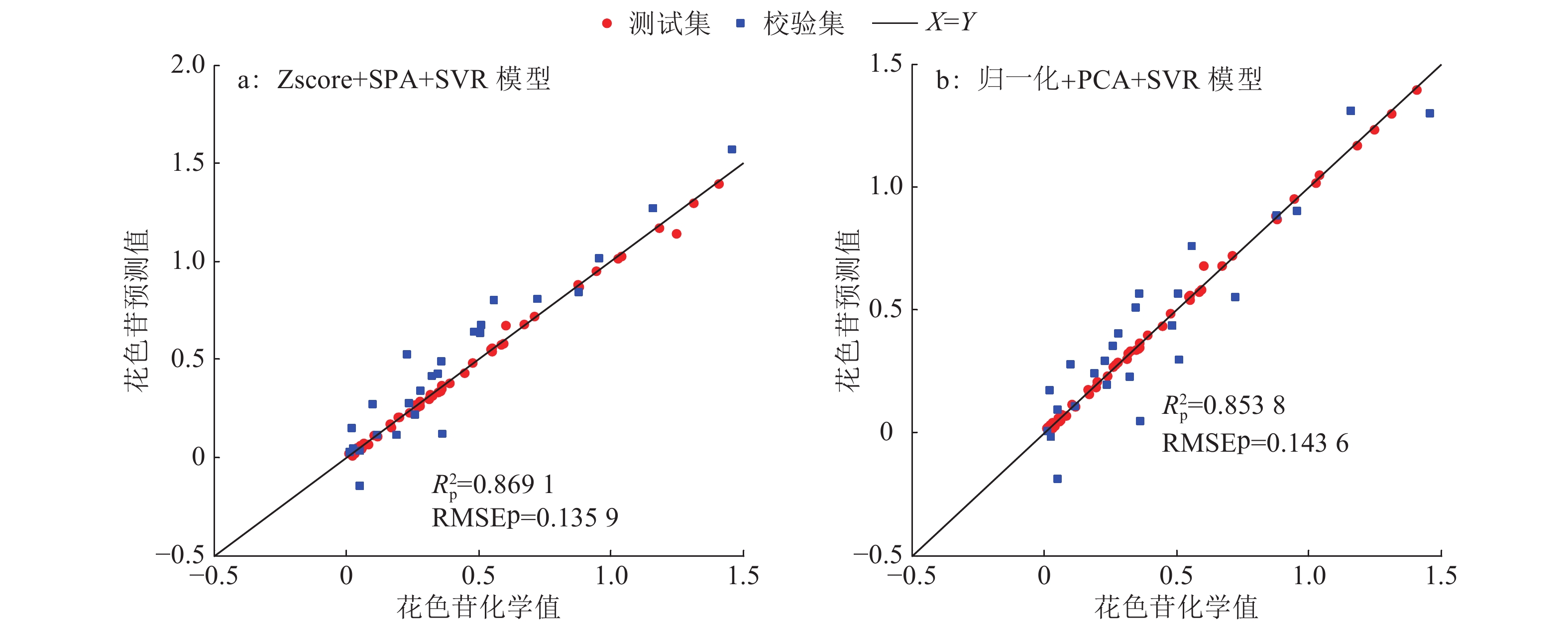
表3为各预测模型相关统计结果,由表3可知,SVR模型整体预测能力较好,预测均方根误差基本在0.2左右,说明SVR较好地解决了光谱图像和花色苷化学值间存在的复杂、非线性、高维度映射关系等问题。从预处理方法看,原始数据虽然整体建立的模型识别准确率较高,但是它的特征波段数较多,增加了数据处理的时间和信息的冗余,不利于实现快速检测;从选取的特征波长个数和最终模型的预测准确率看,Zscore处理整体优于其他预处理方法,同时,它也是SPA+SVR模型中的最优预处理方法,PCA+SVR模型采用归一化处理也得到了良好的结果。从降维效果看,对于相同预处理方法,SPA降维后特征波长个数均多于PCA降维后的主成分个数,也就是说,PCA降维效果整体略优于SPA。从模型整体性能看,Zscore+SPA+SVR模型(图6a)、归一化+PCA+SVR模型(图6b)、多元散射+PCA+SVR模型、S-G滤波+PCA+SVR模型性能整体较好,其中,以归一化+PCA+SVR模型的降维效果最好,极大地减少了数据处理量,简化了模型,满足了快速检测的要求;而Zscore+SPA+SVR模型预测准确率最高,
|
|
表 3 预测模型性能统计表 Table 3 Performance of different prediction models |
|
图 6 酿酒葡萄果皮花色苷模型实际值与预测值比较 Figure 6 Comparison of observed values and predicted values from different models precticting anthocyanin contents in wine-grape skins |
为了快速检测多品种酿酒葡萄成熟期不同阶段的花色苷含量,本文基于高光谱成像技术和多元回归模型,研究建立酿酒葡萄成熟期的花色苷含量预测模型。以6个红葡萄品种为研究对象,采集900~1 700 nm近红外高光谱图像,运用主成分分析(PCA)和连续投影法(SPA)对光谱数据降维,选择最优波段,以减少预测模型的复杂度。进一步结合化学测量值和支持向量回归(SVR)的统计方法建立并选取最优的花色苷含量检测模型。试验结果表明,酿酒葡萄成熟期的高光谱图像与其花色苷含量相关性强,采用基于Zscore预处理及连续投影法降维的支持向量回归(Zscore+SPA+SVR)模型具有最优的性能。本研究提出的方法为快速和高效地检测多品种成熟期的酿酒葡萄果皮花色苷含量提供了一种有效的途径。
| [1] |
PARPINELLO G P, VERSARI A, CHINNICI F, et al. Relationship among sensory descriptors, consumer preference and color parameters of Italian Novello red wines[J]. Food Res Int, 2009, 42(10): 1389-1395. DOI:10.1016/j.foodres.2009.07.005 (  0) 0) |
| [2] |
NÚÑEZ V, MONAGAS M, GOMEZ-CORDOVÉS M C, et al. Vitis vinifera, L. cv. Graciano grapes characterized by its anthocyanin profile
[J]. Postharvest Biol Tec, 2004, 31(1): 69-79. DOI:10.1016/S0925-5214(03)00140-6 (  0) 0) |
| [3] |
ALCALDE-EON C, ESCRIBANO-BAILÓN M T, SANTOS-BUELGA C, et al. Changes in the detailed pigment composition of red wine during maturity and ageing : A comprehensive study[J]. Anal Chim Acta, 2006, 563(1/2): 238-254. (  0) 0) |
| [4] |
段玮, 唐荣华, 田清青, 等. 欧洲越橘类保健食品中花色苷含量测定方法的研究[J]. 中国食品卫生杂志, 2011, 23(4): 306-310. (  0) 0) |
| [5] |
李颖畅, 孟宪军. 酶法提取蓝莓果中花色苷的研究[J]. 食品工业科技, 2008(4): 215-218. (  0) 0) |
| [6] |
王继萍, 柏广新, 李劲然, 等. 溶剂萃取法提取蓝莓中花色苷[J]. 分析化学, 2012, 40(12): 1952-1953. (  0) 0) |
| [7] |
NILE S H, KIM D H, KEUM Y S. Determination of anthocyanin content and antioxidant capacity of different grape varieties[J]. Ciênc Téc Vitiviníc, 2015, 30(2): 60-68. DOI:10.1051/ctv/20153002060 (  0) 0) |
| [8] |
刘旭, 吴迪, 梁曼, 等. 基于高光谱的酿酒葡萄果皮花色苷含量多元回归分析[J]. 农业机械学报, 2013, 44(12): 180-186. DOI:10.6041/j.issn.1000-1298.2013.12.030 (  0) 0) |
| [9] |
LU R. Detection of bruises on apples using near-infrared hyperspectral imaging[J]. Trans Asae, 2003, 46(2): 523-530. (  0) 0) |
| [10] |
陈欣欣, 郭辰彤, 张初, 等. 高光谱成像技术的库尔勒梨早期损伤可视化检测研究[J]. 光谱学与光谱分析, 2017, 37(1): 150-155. (  0) 0) |
| [11] |
周竹, 李小昱, 陶海龙, 等. 基于高光谱成像技术的马铃薯外部缺陷检测[J]. 农业工程学报, 2012, 28(21): 221-228. (  0) 0) |
| [12] |
薛龙, 黎静, 刘木华. 基于高光谱图像技术的水果表面农药残留检测试验研究[J]. 光学学报, 2008, 28(12): 2277-2280. DOI:10.3321/j.issn:0253-2239.2008.12.007 (  0) 0) |
| [13] |
张令标, 何建国, 刘贵珊, 等. 基于可见/近红外高光谱成像技术的番茄表面农药残留无损检测[J]. 食品与机械, 2014(1): 82-85. (  0) 0) |
| [14] |
赵曼彤, 李柏承, 周瑶, 等. 香梨表面低浓度农药残留高光谱检测研究[J]. 光学技术, 2016, 42(5): 408-412. (  0) 0) |
| [15] |
陶斐斐, 王伟, 李永玉, 等. 冷却猪肉表面菌落总数的快速无损检测方法研究[J]. 光谱学与光谱分析, 2010, 30(12): 3405-3409. DOI:10.3964/j.issn.1000-0593(2010)12-3405-05 (  0) 0) |
| [16] |
CHO B K, CHEN Y R, KIM M S. Multispectral detection of organic residues on poultry processing plant equipment based on hyperspectral reflectance imaging technique[J]. Comput Electron Agr, 2007, 57(2): 177-189. DOI:10.1016/j.compag.2007.03.008 (  0) 0) |
| [17] |
思振华, 何建国, 刘贵珊, 等. 基于高光谱图像技术羊肉表面污染无损检测[J]. 食品与机械, 2013(5): 75-79. (  0) 0) |
| [18] |
单佳佳, 吴建虎, 陈菁菁, 等. 基于高光谱成像的苹果多品质参数同时检测[J]. 光谱学与光谱分析, 2010, 30(10): 2729-2733. DOI:10.3964/j.issn.1000-0593(2010)10-2729-05 (  0) 0) |
| [19] |
马本学, 肖文东, 祁想想, 等. 基于漫反射高光谱成像技术的哈密瓜糖度无损检测研究[J]. 光谱学与光谱分析, 2012, 32(11): 3093-3097. DOI:10.3964/j.issn.1000-0593(2012)11-3093-05 (  0) 0) |
| [20] |
张雷蕾, 李永玉, 彭彦昆, 等. 基于高光谱成像技术的猪肉新鲜度评价[J]. 农业工程学报, 2012, 28(7): 254-259. (  0) 0) |
| [21] |
QIAO J, WANG N, NGADI M O, et al. Prediction of drip-loss, pH, and color for pork using a hyperspectral imaging technique[J]. Meat Sci, 2007, 76(1): 1-8. DOI:10.1016/j.meatsci.2006.06.031 (  0) 0) |
| [22] |
王婉娇, 王松磊, 贺晓光, 等. 冷鲜羊肉冷藏时间和水分含量的高光谱无损检测[J]. 食品科学, 2015, 36(16): 112-116. DOI:10.7506/spkx1002-6630-201516020 (  0) 0) |
| [23] |
GONZÁLEZ-CABALLERO V, SÁNCHEZ M T, FERNÁNDEZ-NOVALES J, et al. On-vine monitoring of grape ripening using near-infrared spectroscopy[J]. Food Anal Method, 2012, 5(6): 1377-1385. DOI:10.1007/s12161-012-9389-3 (  0) 0) |
| [24] |
刘旭, 吴迪, 梁曼, 等. 基于高光谱的酿酒葡萄果皮花色苷含量多元回归分析[J]. 农业机械学报, 2013, 44(12): 180-186. DOI:10.6041/j.issn.1000-1298.2013.12.030 (  0) 0) |
| [25] |
芦永军, 曲艳玲, 宋敏. 近红外相关光谱的多元散射校正处理研究[J]. 光谱学与光谱分析, 2007, 27(5): 877-880. (  0) 0) |
| [26] |
高洪智, 卢启鹏, 丁海泉, 等. 基于连续投影算法的土壤总氮近红外特征波长的选取[J]. 光谱学与光谱分析, 2009, 29(11): 2951-2954. DOI:10.3964/j.issn.1000-0593(2009)11-2951-04 (  0) 0) |
| [27] |
刘思伽, 田有文, 张芳, 等. 采用二次连续投影法和BP人工神经网络的寒富苹果病害高光谱图像无损检测[J]. 食品科学, 2017, 38(8): 277-282. DOI:10.7506/spkx1002-6630-201708043 (  0) 0) |
| [28] |
张学工. 关于统计学习理论与支持向量机[J]. 自动化学报, 2000, 26(1): 32-42. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39

