养分的营养价值是衡量饲料原料优劣的关键指标,而能量和蛋白质作为动物营养学的重点研究对象,在营养价值评定中有着无法替代的作用,而二者在畜禽饲料中的营养作用又不是孤立的[1],当二者保持在一个适宜的组合水平,一方面可以提高畜禽生产性能、繁殖力、屠宰性能和肉品质;另一方面,可以提高饲料转化率,降低畜禽养殖成本,从而提高养殖业经济效益[2],但传统的生物学方法是在约定俗成的条件下试图直观反应动物在特定生理条件下对饲料的实际消化情况。然而,用生物学方法测定畜禽饲料的生物学效价耗时、耗资、费力,不适用于现代养殖企业的生产实际,因此,建立快速、准确评定畜禽饲料的生物学效价的方法显得尤为重要。赵峰[3]在2008年成功研制出了单胃动物仿生消化系统,该系统是在仿生模拟家禽内源消化液的基础上开发的电脑程控仿生消化系统,能基于体外模拟与家禽内源消化液在生理组成上等效的人工肠液而快速、准确地评定畜禽饲料的生物学效价,因此,掌握肠道消化液中各种消化酶活性的变化规律以及蛋白质、能量的交互作用对其的具体影响是快速评定饲料生物学效价的第1步,然后依据消化酶活性等效性的原则,制备与内源消化液在生理组成上接近的人工模拟小肠液,再利用赵峰[3]研制的单胃动物仿生消化系统即能实现体外饲料养分的快速评定。本试验通过对试验动物进行瘘管手术后饲喂不同蛋白质、能量配比的日粮,收集空肠液食糜,研究不同蛋白质、能量配比日粮对番鸭空肠液主要消化酶活性的影响,旨在为快速评定鸭饲粮养分的营养价值提供一定的科学依据。
1 材料与方法 1.1 试验动物及饲养管理选取24周龄、遗传背景和体质量相近的公番鸭Cairina moschata 50只,单笼饲养于代谢笼(45 cm×40 cm ×85 cm)中。自由采食和饮水,每日光照16 h。饲养管理参考常规饲养管理程序进行。
1.2 瘘管手术及术后护理试验动物在术前禁食24 h,期间自由饮水。手术室及手术台用φ为0.01%的新洁尔灭溶液消毒后再用紫外灯照射30 min。手术工具、套管、缝合针、线以φ为0.05%的新洁尔灭溶液浸泡30 min后再用生理盐水清洗。
试验鸭在代谢笼中适应7 d后进行瘘管手术,瘘管安装过程参照赵峰[3]和任立芹[4]的方法进行。动物腹部朝上,术部(剑状骨至肛门的腹中线两侧宽3~4 cm、长为6~8 cm)除毛,清洁后用碘酒消毒再用φ为75%的乙醇溶液除碘。试验鸭以每公斤体质量翅下静脉注射1 mL φ为10%的水合氯醛溶液进行麻醉,将试验鸭固定在水平支架上,对腹部消毒后沿腹中线切开3~4 cm的纵向切口,依次是皮层、肌肉层和腹膜层。套管安装部位位于卵黄囊憩室附近,上下不超过10 mm,沿背向肠系膜一侧肠道作一恰好让套管纵向插入的切口,置入套管后以4号线作荷包缝合,并在创口附近撒上160万单位的青霉素钠,再将肠道送回腹腔,依次缝合腹膜层(4号线)、肌肉层(10号线)和皮层(10号线),术后将垫圈套在瘘管外并将瘘管塞塞入瘘管中,防止试验期间肠液流出。
试验鸭术后禁食3 d,期间自由饮水。术后3 d的护理:在创口上撒上80万单位的青霉素钠(每日1次),灌服添加适量NaCl和维生素的葡萄糖溶液30 mL(每日2次)。术后第4天自由采食,饲喂恢复期日粮(表1),第15天术部拆线,并在术部附近缝合食糜收集装置。
|
|
表 1 番鸭术后恢复期配方 Table 1 Recovery formula of Muscovy duck after surgery |
试验采用3×3(粗蛋白质×代谢能)完全随机设计,3个粗蛋白质水平(w)为15.0%(低)、16.5%(中)和18.0%(高),3个代谢能水平为11.5(低)、12.0(中)和12.5 MJ·kg–1(高)。对番鸭进行瘘管手术后,选取27只体质量相近、创口恢复较好的鸭,随机分为9组,每组3只鸭,于肠液收集前10 d开始分别饲喂9种试验日粮(表2),以10 d为1个重复收集肠液,每个重复为期3 d,第1天和第3天9:00、13:00、17:00各收集1次,低温离心取上清液,将每个重复内6次收集的肠液等体积混合,分装成15份测酶活性。
|
|
表 2 试验日粮组成及营养成分 Table 2 Composition and nutrient levels of experimental diets |
|
|
糜蛋白酶活力单位的定义:以苯甲酰–L–酪氨酸乙酯为底物在25 ℃、pH7.8的条件下,每分钟释放1 μmol苯甲酞–L–酪氨酸所具有的活性,在256 nm下检测光密度[5]1009。
胰蛋白酶活力单位的定义:以对–苯磺酸–L–精氨酸甲酯为底物在25 ℃、pH8.1的条件下,每分钟释放1 μmol对–甲苯磺酰–L–精氨酸所具有的活性,在247 nm下检测光密度[5]1021。
淀粉酶采用南京建成生物工程研究所生产的C016淀粉酶试剂盒测定。淀粉酶活力单位定义:以可溶性淀粉为底物,在37 ℃条件下10 mL食糜上清液与淀粉作用,30 min内水解1 mg淀粉,即为1个酶活力单位[6]。
脂肪酶采用南京建成生物工程研究所生产的A054-2脂肪酶试剂盒测定。脂肪酶的活力定义为:以6–甲基试卤灵脂为底物,在37 ℃,pH为8.0的条件下,每分钟释放1 mmol的6–甲基试卤灵所具有的活性。
1.5 数据分析数据统计分析按照双因素完全随机设计,采用SAS软件的GLM模块进行方差分析,采用Duncan’s法进行多重比较。
2 结果与分析如表3所示,能量水平对糜蛋白酶、淀粉酶和脂肪酶活性的影响不显著,对胰蛋白酶活性的影响极显著(P<0.01)。蛋白质水平对淀粉酶和脂肪酶活性的影响不显著,对胰蛋白酶和糜蛋白酶活性影响显著(P<0.05)。胰蛋白酶、糜蛋白酶和脂肪酶活性均在第9组(高能量+高蛋白质组)有最大值,能量和蛋白质水平对4种酶活性的影响均无显著的交互作用(P>0.05)。高、中能量组胰蛋白酶的活性显著高于低能量组(P<0.05)(图1A)。高、中蛋白质组胰蛋白酶活性显著高于低蛋白组(P<0.05),高蛋白质组糜蛋白酶活性显著高于低蛋白质组(P<0.05)(图1B)。
|
|
表 3 日粮能量和粗蛋白水平对番鸭空肠液中消化酶活性的影响 Table 3 Effects of dietary energy and crude protein levels on digestive enzyme activities in jejunal fluid of Muscovy duck |
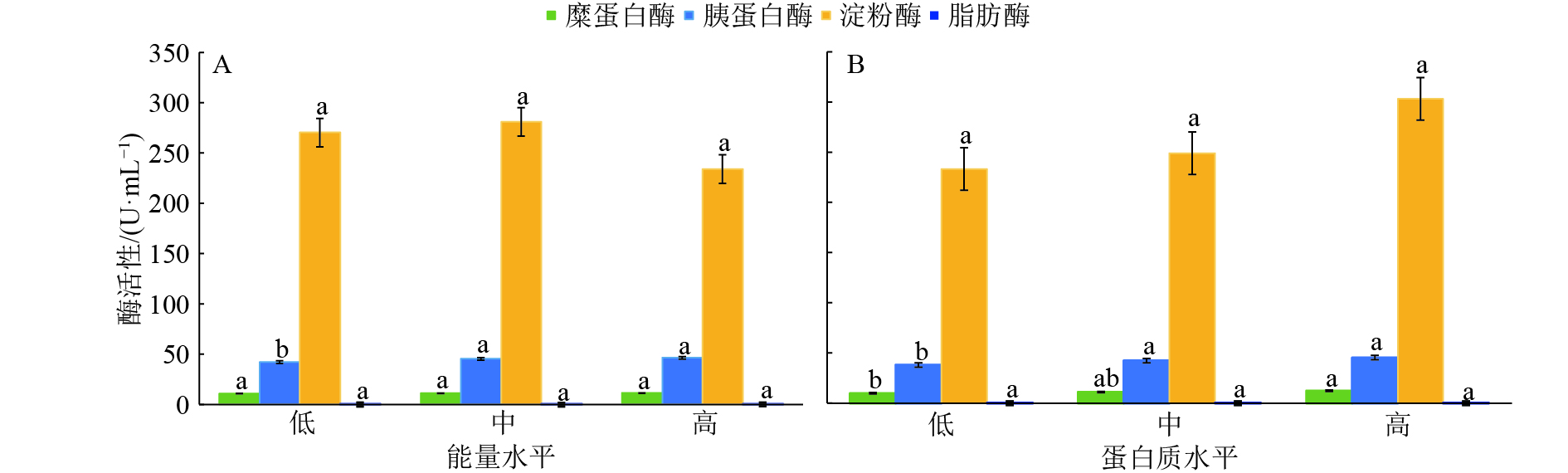
|
图 1 不同日粮能量或蛋白质水平下的番鸭空肠液中消化酶活性 Fig. 1 Digestive enzyme activities in jejunal fluid of Muscovy duck under different dietary energy or protein levels 低、中和高能量组脂肪酶活力分别为0.042 5、0.033 3和0.046 9 U·mL–1;低、中和高蛋白质组脂肪酶活力分别为0.042 3、0.043 8和0.075 4 U·mL–1;各图中同种酶不同处理间凡具有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) |
在试验动物及饲养管理一致的条件下,由于禽类的采食与饮水呈间息式,不同肠段的食糜中消化酶的活性受采食及饮水的影响程度与肠道所处的位置有关[7]。本研究通过套管多次采集鸭空肠食糜,使得食糜样品均来自于小肠的同一相对位置,排除了传统屠宰方法因肠段位置的差异对测试结果的干扰,增加了试验结果的可靠性。
消化酶是反映动物消化代谢能力的重要指标之一,随着日粮养分的变化,肠道消化酶的活性也会改变[8-9]。本试验中,日粮能量水平对胰蛋白酶活性有显著影响,对淀粉酶、糜蛋白酶和脂肪酶活性无显著影响,这与Zhao等[10]、官丽辉等[11]研究结果一致,但随着能量水平的升高,糜蛋白酶活性有上升的趋势,这可能是由于本试验条件下,各日粮中淀粉含量相差较小,从而导致淀粉水解成二糖的总量变异不大,然而二糖酶的活性对日粮中二糖的含量具有适应性[12],因此,表现出随着能量水平的升高,胰蛋白酶活性显著增强了,而淀粉酶、糜蛋白酶和脂肪酶的活性无明显变化;日粮蛋白质水平对胰蛋白酶和糜蛋白酶活性有显著影响,对淀粉酶和脂肪酶活性无显著影响,这与赵峰[3]、Yang等[13]、李贵峰等[14]研究结果一致,这表明鸭空肠液中淀粉酶活性对饲粮中蛋白水平的变化具有较强的适应性,蛋白质水平的升高对胰蛋白酶和糜蛋白酶活性的影响差异显著,这与Zhao等[10]研究得出的鸭空肠液中蛋白酶活性主要由饲粮蛋白质水平决定的结论一致,可能是由于饲粮蛋白质水平的升高导致其对肠道消化液分泌系统的刺激加强,蛋白酶原被激活,引起蛋白酶合成增加,进而增强了2种酶的活性,同时,胰蛋白酶作为特异性最强的蛋白酶,它不仅起消化酶的作用,还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其他酶的前体,对酶起活化作用,这也可能是糜蛋白酶活性增加的原因之一,因此表现出随着蛋白质水平的升高,胰蛋白酶和糜蛋白酶活性显著增强,而淀粉酶和脂肪酶的活性无明显变化。在本研究中蛋白质和能量水平对番鸭空肠液中几种主要消化酶活性无明显的互作效应。关于番鸭空肠液中几种主要消化酶活性的最大值本研究尚未涉及,还有待扩大蛋白质和能量水平的范围进一步试验。
| [1] |
曹赞. 代谢能和粗蛋白水平对22~42日龄科宝肉鸡生产性能、养分表观代谢率及肠道消化酶活性的影响[J]. 中国兽医学报, 2016, 36(5): 839-846. (  0) 0) |
| [2] |
陈明. 蛋白能量水平在畜禽营养中的研究进展[J]. 畜禽业, 2012(10): 30-32. DOI:10.3969/j.issn.1008-0414.2012.10.030 (  0) 0) |
| [3] |
赵峰. 用酶法评定鸭饲料代谢能的方法学研究[D]. 北京: 中国农业科学院, 2006.
(  0) 0) |
| [4] |
任立芹. 仿生法评定黄羽肉鸡常用饲料代谢能和可消化氨基酸研究[D]. 北京: 中国农业科学院, 2012.
(  0) 0) |
| [5] |
WIRNT R. Methods of enzymatic analysis [M]. Weinheinm: Verlag Chemie, 1974.
(  0) 0) |
| [6] |
DAHLQVIST A. A method for the determination of amylase in intestinal content[J]. Scand J Clin Lab Invest, 1962, 14: 145-151. DOI:10.3109/00365516209079686 (  0) 0) |
| [7] |
郑卫宽, 赵峰, 张宏福. 日粮类型及肠液储存条件对鸭空肠液组成与特性的影响[J]. 动物营养学报, 2009, 21(5): 652-658. DOI:10.3969/j.issn.1006-267x.2009.05.008 (  0) 0) |
| [8] |
BRZĘK P, CIMINARI M E, KOHL K D, et al. Effect of age and diet composition on activity of pancreatic enzymes in birds[J]. J Comp Physiol B, 2013, 183(5): 685-697. DOI:10.1007/s00360-012-0731-2 (  0) 0) |
| [9] |
SHIH B L, YU B, HSU J C. The development of gastrointestinal tract and pancreatic enzymes in White Roman geese[J]. Asian-Aust J Anim Sci, 2005, 18(6): 841-847. DOI:10.5713/ajas.2005.841 (  0) 0) |
| [10] |
ZHAO F, HOU S S, ZHANG H F, et al. Effects of dietary metabolizable energy and crude protein content on the activities of digestive enzymes in jejunal fluid of Peking ducks[J]. Poultry Sci, 2007, 86(8): 1690-1695. DOI:10.1093/ps/86.8.1690 (  0) 0) |
| [11] |
官丽辉, 刘海斌, 张立永, 等. 不同能量、蛋白水平日粮对育雏期塞北乌骨鸡生长发育规律、生化指标和肠道消化酶的影响[J]. 中国兽医学报, 2013, 33(8): 1292-1300. (  0) 0) |
| [12] |
SIDDONS R C. Effect of diet on disaccharidase activity in the chick[J]. Br J Nutr, 1972, 27(2): 343-352. DOI:10.1079/BJN19720100 (  0) 0) |
| [13] |
YANG J, YANG L, WANG Y, et al. Effects of dietary protein and energy levels on digestive enzyme activities and electrolyte composition in the small intestinal fluid of geese[J]. Anim Sci J, 2017, 88(2): 294-299. DOI:10.1111/asj.2017.88.issue-2 (  0) 0) |
| [14] |
李贵锋, 蒋广震, 刘文斌, 等. 不同蛋白质和能量水平对建鲤幼鱼生长性能、体组成和消化酶活性的影响[J]. 上海海洋大学学报, 2012, 21(2): 225-232. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


