金黄色葡萄球菌Staphylococcus aureus,又称金葡菌,是一种常见的革兰阳性菌,广泛存在于空气、水、灰尘及人和动物的排泄物中。它是一种人兽共患病原菌,可导致人和动物的多种疾病,包括伪膜性肠炎、败血症和脓毒症等,严重威胁人类和动物的生命安全[1]。长期以来,青霉素和甲氧西林广泛用于治疗敏感菌引起的感染性疾病[2]。随着抗菌药物的大规模使用以及人类的滥用和不合理使用,耐药菌株层出不穷[3]。金葡菌耐药性最为突出,其中以耐甲氧西林金葡菌(Methicillin-resistant S. aureus,MRSA)危害最大[4]。据报道显示,MRSA感染已经和HBV感染、AIDS并列为世界范围内三大难解决感染性疾病[5]。万古霉素是治疗MRSA感染的首选药物,但近年来发现,某些菌株对万古霉素已经中度耐药甚至完全耐药[6]。对于MRSA感染,临床上将面临无药可用的窘境,所以寻找有效的抗MRSA药物迫在眉睫。
百里香酚(5–甲基–2–异丙基酚),又名麝香草酚,主要存在于百里香属植物中,是百里香挥发油和牛至油的主要组成成分,属于单萜类化合物[7-9]。研究表明百里香酚具有广泛的杀菌、抗氧化、消炎和抗肿瘤作用[10-11]。段雪娟等[12]研究显示,百里香酚对金葡菌、大肠埃希菌Escherichia coli、单增李斯特菌Listeria monocytogenes、沙门氏菌Saimonella和副溶血性弧菌Vibrio parahemolyticus均有较强的抑制作用。本研究在前期工作中发现百里香酚对MRSA具有抑制作用,但抑菌机制尚不清楚。因此,本试验选取MRSA标准菌株USA300为研究对象,通过研究百里香酚对USA300细胞膜通透性、可溶性蛋白质含量、形态结构和生物被膜形成等方面的影响,阐述百里香酚抑制MRSA的作用机制,研究结果将为开发高效低毒的抗MRSA药物提供可靠的理论依据。
1 材料与方法 1.1 材料百里香酚[纯度(w)>98%,色谱纯]购自成都瑞芬思生物科技公司,用DMSO(Sigma-Aldrich,美国)溶解,配成质量浓度为40.96 g·L–1的母液备用;MRSA标准菌株USA300(ATCC® BAA-1717)购自美国标准菌种库;pH 7.0的磷酸缓冲盐粉剂(1×PBS,无钙镁)购自索莱宝生物科技有限公司,按使用说明配成2 000 mL的PBS磷酸缓冲溶液;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司。脑心浸出液肉汤(BHI液体培养基):胰蛋白胨10 g,牛心浸粉17.5 g,氯化钠5 g,葡萄糖2 g,十二水磷酸氢二钠2.5 g,用蒸馏水定容至1 000 mL,pH 7.4;脑心浸出液琼脂(BHI固体培养基):牛脑浸粉4 g,牛心浸粉4 g,蛋白胨5 g,酪蛋白胨16 g,氯化钠5 g,葡萄糖2 g,磷酸氢二钠2.5 g,琼脂13.5 g,用蒸馏水定容至1 000 mL,pH 7.4;TSB培养基:胰蛋白胨17 g,大豆蛋白胨3 g,氯化钠5 g,葡萄糖2.5g,磷酸氢二钠2.5 g,用蒸馏水定容至1 000 mL,pH 7.3。
1.2 百里香酚对USA300最低抑菌浓度、最低杀菌浓度和生长曲线测定采用微量肉汤稀释法测定百里香酚对USA300的最低抑菌浓度(Minimum inhibitory concentration,MIC),其中第1孔至第8孔百里香酚质量浓度分别为1 024、512、256、128、64、32、16和8 mg·L–1;第9孔为阳性对照,培养基中只加5 μL菌液;第10孔为阴性对照,培养基中只加2.5 μL百里香酚药液,第11孔为空白对照。37 ℃条件下静置培养24 h,肉眼观察无菌生长的最低质量浓度孔的百里香酚质量浓度为MIC。根据MIC测定结果,从无菌生长的孔内吸取100 μL培养基,均匀涂布于BHI固体培养基,37 ℃条件下静置培养24 h,以生长的菌落个数不超过5个的百里香酚质量浓度为该药的最低杀菌浓度(Minimum bactericidal concentration,MBC)。试验设3次重复,取平均值。
USA300在BHI液体培养基中过夜培养后,菌液用新鲜BHI液体培养基按体积比1∶100稀释,置于37 ℃培养箱静置培养。当菌液光密度D600 nm=0.3时,分装于200 mL锥形瓶,加入百里香酚,使培养基中百里香酚的终质量浓度分别为0、8、16、32、64、256和512 mg·L–1。锥形瓶置于气浴恒温振荡器(37 ℃,200 r·min–1)培养,在培养0、1、2、4、6、8、16和24 h后测定培养基的D600 nm,绘制生长曲线。
1.3 百里香酚对USA300菌液电导率的影响将培养至对数期(D600 nm=1.8)的USA300菌液,按2%接种量接种于50 mL TSB培养基并置于气浴恒温振荡器(37 ℃,120 r·min–1)培养16 h后,加入百里香酚,使其终质量浓度为512 mg·L–1。37 ℃条件下静置培养0、1、2、4、6和8 h后,分别取菌悬浮液5 mL离心(4 500 r·min–1,10 min),将上清液用质量分数为5%的葡萄糖溶液稀释40倍后测定其电导率[13]。其他条件不变,加入百里香酚改为加入相同体积的DMSO作为对照组。试验设3次重复,取平均值。
1.4 百里香酚对USA300 DNA外渗量的影响将培养至对数期(D600 nm=1.8)的USA300菌液,用PBS缓冲液洗涤2次,制成107 cfu·mL–1的菌悬浮液,加入百里香酚,使其终质量浓度为512 mg·L–1,37 ℃条件下静置培养。在百里香酚作用0、1、2、4、6和8 h后,将菌悬浮液于4 500 r·min–1离心10 min,取上清液,用微量分光光度计NanoDrop One (Thermo,美国)测定上清液中DNA含量[14]。其他条件不变,加入百里香酚改为加入相同体积的DMSO作为对照组。试验设3次重复,取平均值。
1.5 百里香酚对USA300可溶性蛋白质含量的影响向培养至对数期(D600 nm=1.8)的USA300菌液中加入百里香酚,使菌液中百里香酚终质量浓度为512 mg·L–1,然后在气浴恒温振荡器中培养(37 ℃,200 r·min–1)。从加入百里香酚开始培养进行计时,在16和24 h时分别取菌悬浮液并将其稀释至D600 nm=0.6。取稀释后的菌悬浮液50 mL,4 500 r·min–1离心10 min,收集菌体沉淀。用100 μL的PBS缓冲液将菌体混匀,超声破碎,用BCA蛋白浓度测定试剂盒测定其蛋白质含量。超声破碎液按体积比4∶1加入5×上样缓冲溶液,混匀,在沸水浴中煮沸5 min,4 500 r·min–1离心5 min,取上清液进行SDS-PAGE[15]。其他条件不变,加入百里香酚改为加入相同体积的DMSO作为对照组。试验设3次重复,取平均值。
1.6 百里香酚对USA300形态结构的影响参考薛东芳[16]的方法,在活化培养至对数期(D600 nm=1.8)的USA300菌液中加入百里香酚,使百里香酚终质量浓度为512 mg·L–1,然后置于气浴恒温振荡器中培养(37 ℃,200 r·min–1)。分别在培养4、16和24 h时取菌悬浮液,离心(4 500 r·min–1,10 min)后收集菌体,用PBS缓冲液洗涤菌体沉淀3次,将得到的菌体按透射电镜样品制备方法制成电镜样品[17-18],于H-600IV型透射电镜(日立,日本)下放大30 000倍观察菌体形态和结构变化。其他条件不变,加入百里香酚改为加入相同体积的DMSO作为对照组。试验重复3次,选取变化最明显的一次作为试验结果。
1.7 百里香酚亚抑菌浓度对USA300生物被膜形成的影响USA300菌株分别在含有8、16、32和64 mg·L–1百里香酚的BHI液体培养基中培养至D600 nm=0.6,在上述BHI液体培养基中各取10 μL菌液加入96孔板中,再加入290 μL蔗糖质量分数为3%的含相同质量浓度百里香酚的新鲜BHI液体培养基,使最终混合液依旧保持原有百里香酚的质量浓度,并在厌氧条件下37 ℃静置培养18 h。移除96孔板中所有液体,加入体积分数为10%的甲醛溶液100 μL,室温过夜培养。移除甲醛溶液,在每个孔中加入质量分数为0.1%的结晶紫100 μL,室温放置30 min。用双蒸水冲洗并加入体积分数为33%的乙酸溶液200 μL,充分混匀,用酶标仪(Thermo,美国)测量D490 nm,以光密度值反映USA300菌株生物被膜的形成能力[19]。其他条件不变,加入百里香酚菌液改为加入相同体积的DMSO作为对照组,试验设3次重复,取平均值。
1.8 统计学分析采用Prism 5.0对数据进行分析,正态计量数据用平均值±标准误表示,组间两两比较采用t检验法。
2 结果与分析 2.1 百里香酚对USA300在BHI液体培养基中生长的影响百里香酚对USA300的MIC和MBC均为256 mg·L–1。由图1可知,在百里香酚质量浓度为256和512 mg·L–1的条件下,USA300生长被抑制,百里香酚质量浓度为8、16、32和64 mg·L–1时对USA300生长几乎没有影响。
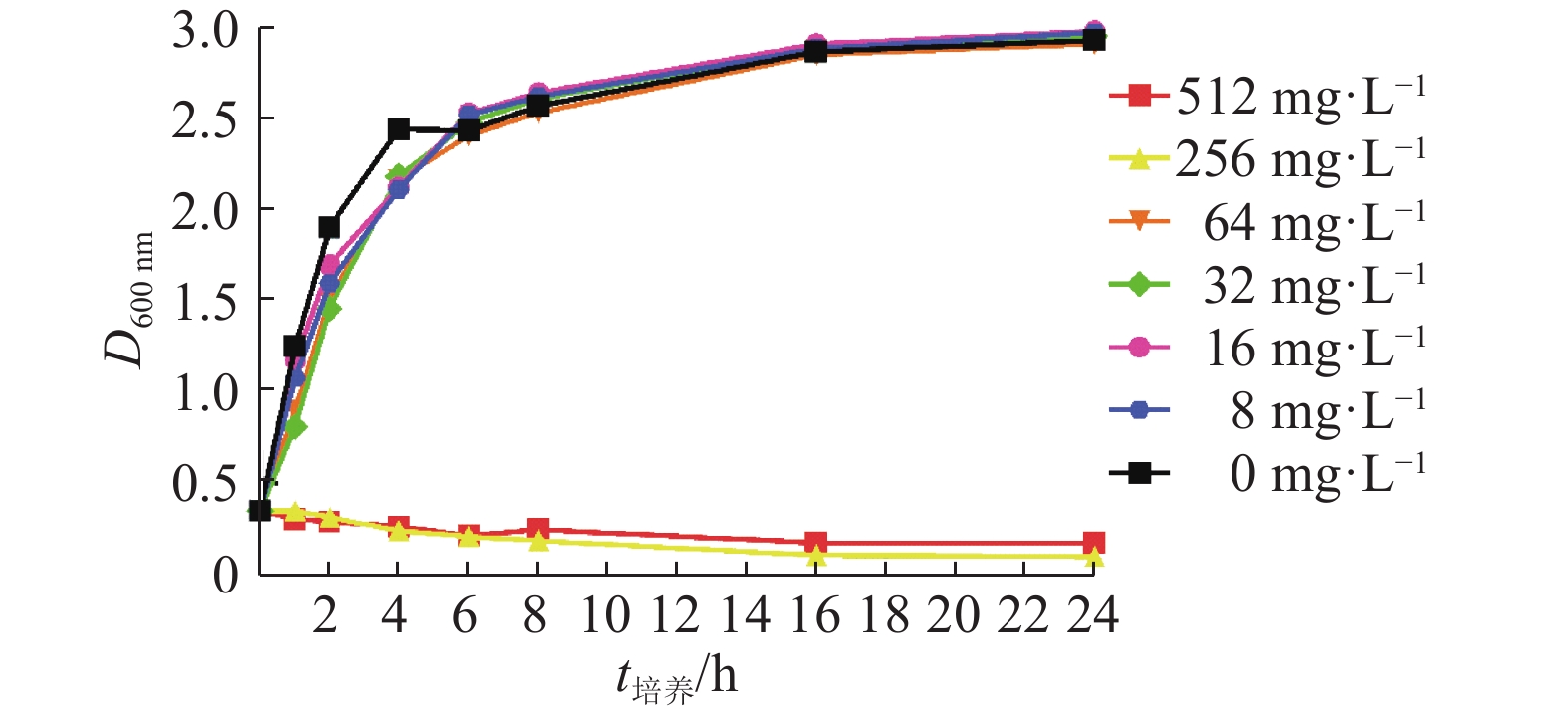
|
图 1 不同质量浓度的百里香酚对USA300在BHI液体培养基中生长的影响 Fig. 1 Effects of different mass concentrations of thymol on USA300 growth in BHI liquid medium |
为考察百里香酚对USA300细胞膜通透性的影响,本试验对加入百里香酚后的菌液电导率进行测定。图2显示,与培养0 h相比,培养1 h后菌液的电导率为18.08%±1.80%,培养2 h后菌液的电导率为22.86%±0.42%,培养至8 h时菌液的电导率为22.06%±0.83%,均与相同培养时间的对照组差异极显著(P<0.01)。对照组培养时间从1至8 h,电导率基本没有变化。菌液电导率的改变可以反映USA300菌体细胞膜渗透性的变化,加入百里香酚后,菌液电导率增加,说明百里香酚可以使菌体细胞膜的通透性增加,使菌体细胞质渗漏到了细胞外。
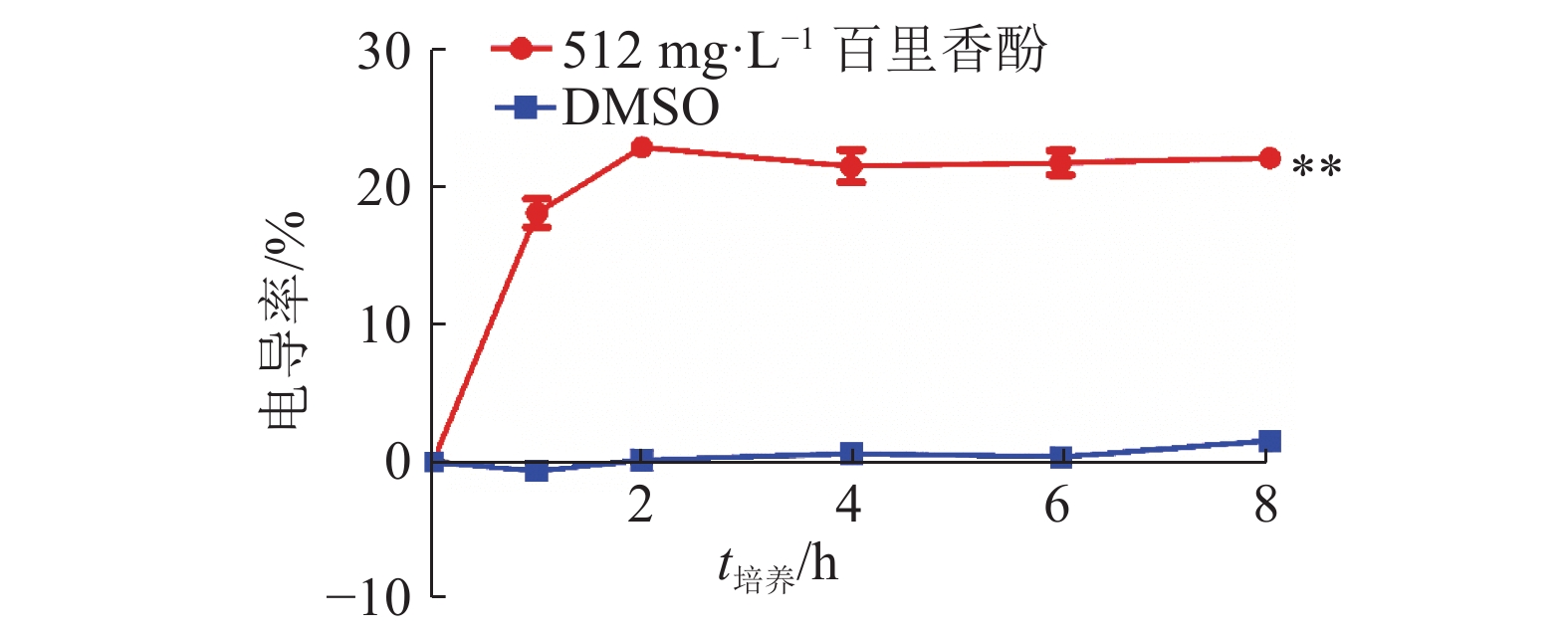
|
图 2 512 mg·L–1百里香酚对USA300菌液电导率的影响 Fig. 2 Effect of 512 mg·L–1 thymol on conductivity of USA300 bacterium solution “**”表示相同培养时间的对照组和512 mg·L–1百里香酚处理组间差异极显著(P<0.01,t检验) |
为验证百里香酚对USA300细胞膜通透性的影响,本试验对加入百里香酚后菌体细胞内大分子物质(DNA)的外渗量进行了测定,结果如图3所示。百里香酚作用菌体1 h后,512 mg·L–1百里香酚处理组菌液的DNA含量比对照组增加了(123.40±8.06) mg·L–1(P<0.01),证明百里香酚可以改变USA300细胞膜的通透性。
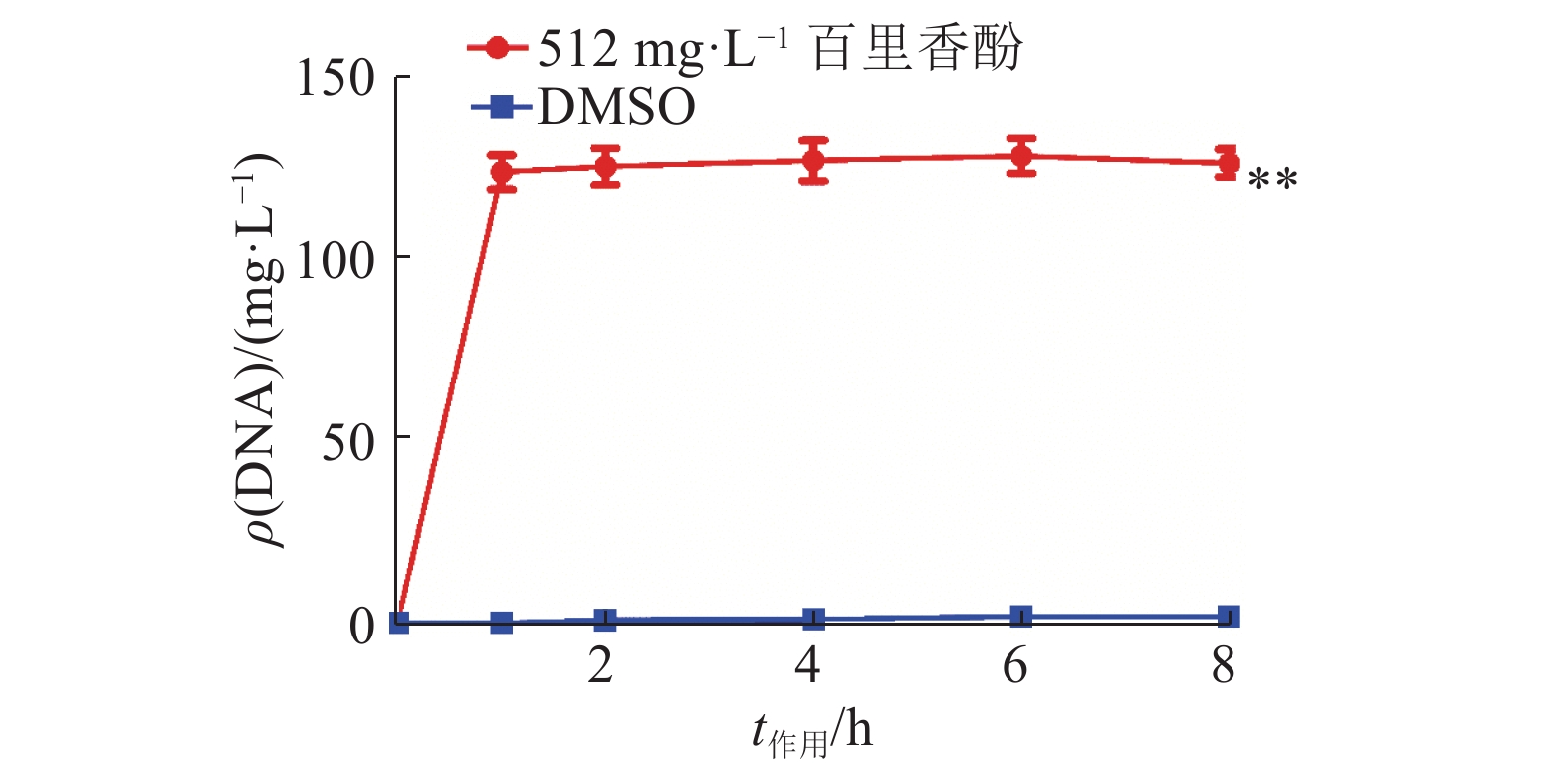
|
图 3 512 mg·L–1百里香酚对USA300 DNA外渗量的影响 Fig. 3 Effect of 512 mg·L–1 thymol on DNA exosmosis amount of USA300 “**”表示相同作用时间的对照组和512 mg·L–1百里香酚处理组间差异极显著(P<0.01,t检验) |
为探究百里香酚对USA300菌体可溶性蛋白质含量的影响,本试验对添加百里香酚后菌体可溶性蛋白质的含量进行了测定。SDS-PAGE结果显示,百里香酚可以影响多种可溶性蛋白质的代谢(图4)。BCA蛋白浓度测定试剂盒测定结果显示,加入百里香酚作用16、24 h后,百里香酚处理组的菌体可溶性蛋白总量分别比对照组减少68.10%±0.23%、68.20%±0.15%(P<0.01)。结果表明,百里香酚可以通过影响USA300菌体可溶性蛋白质的代谢发挥其抑菌作用。
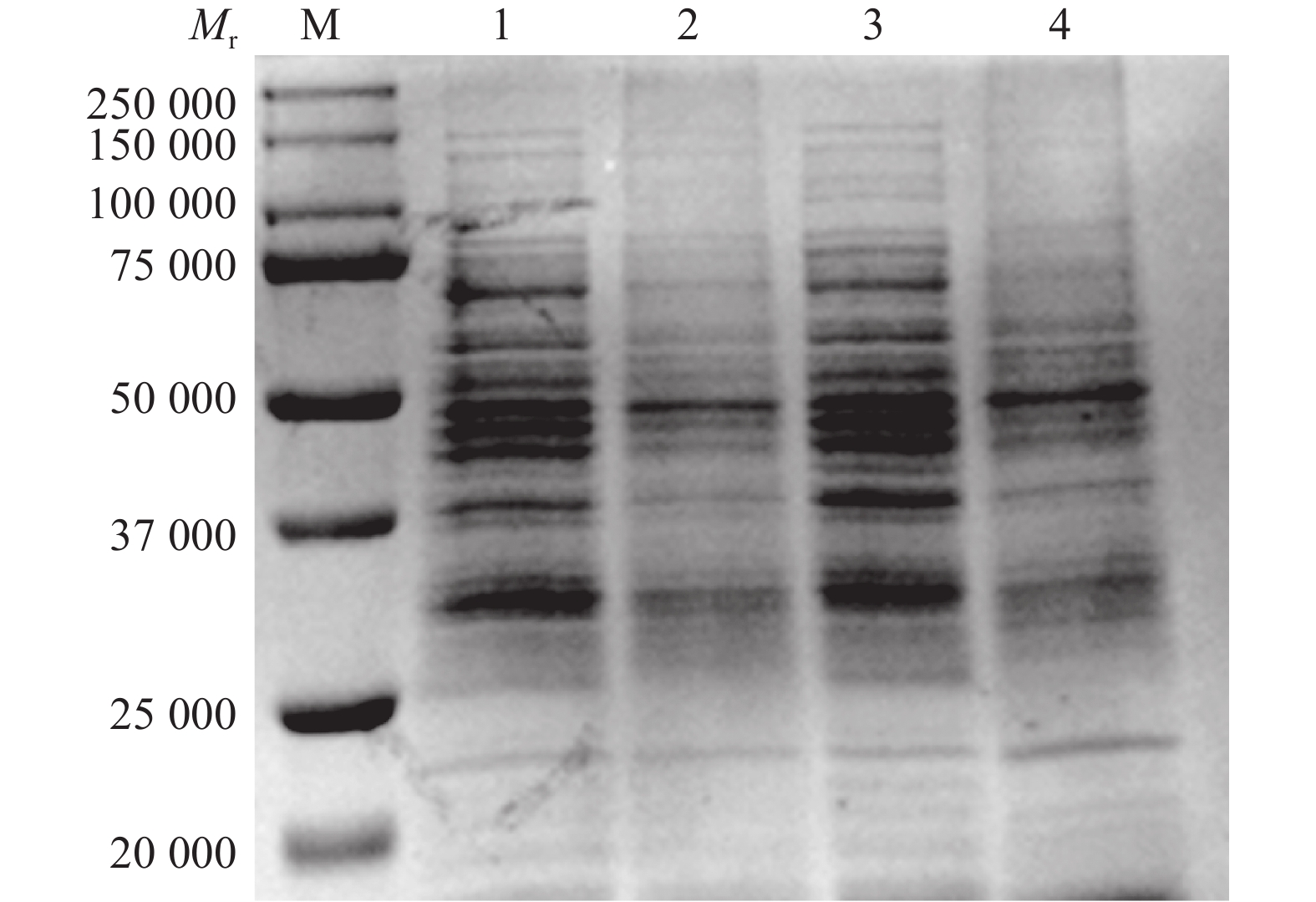
|
图 4 512 mg·L–1百里香酚对USA300可溶性蛋白质代谢的影响 Fig. 4 Effect of 512 mg·L–1 thymol on soluble protein synthesis of USA300 M:标准分子量蛋白Marker;1:16 h对照组;2:16 h 512 mg·L–1 百里香酚处理组;3:24 h对照组;4:24 h 512 mg·L–1百里香酚处理组 |
透射电镜结果显示经512 mg·L–1百里香酚作用4 h后,菌体细胞皱缩、变形,完整性受到破坏,细胞壁、细胞膜损伤(图5A1)。随百里香酚作用时间延长,细胞内物质损耗,细胞质固缩,出现明显的空泡化,部分菌体细胞的细胞壁和细胞膜完全破损,细胞浆外溢,并且菌体的二分裂出现异常,由均等分裂变为不均等分裂(图5B1、C1)。对照组菌体细胞结构完整清晰,形态饱满光滑,未有细胞破损情况,无内容物溢出,分裂正常,具有清晰的二分裂期分裂缢痕(图5A2、B2、C2)。说明百里香酚破坏了USA300的细胞结构并影响其分裂。

|
图 5 512 mg·L–1 百里香酚不同作用时间对USA300菌体细胞超微结构的影响 Fig. 5 Effects of different treating time of 512 mg·L–1 thymol on ultra structures of USA300 cells A1:4 h 百里香酚处理组;A2:4 h对照组;B1:16 h 百里香酚处理组;B2:16 h对照组;C1:24 h 百里香酚处理组;C2:24 h对照组 |
低于MIC的药物浓度称为亚抑菌浓度。为考察百里香酚亚抑菌浓度对USA300生物被膜形成能力的影响,本试验对百里香酚作用后USA300的生物被膜进行了测定。结果显示,对照组D490 nm远远大于其他组(图6)。经8 mg·L–1百里香酚处理后,USA300生物被膜总量比对照组减少62.68%±5.34%(P<0.01);64 mg·L–1百里香酚处理后,USA300生物被膜总量比对照组减少93.45%±0.49%(P<0.01);16和32 mg·L–1百里香酚处理组分别比对照组减少75.60%±2.08%(P<0.01)、83.74%±1.54%(P<0.01)。试验结果表明,百里香酚能有效抑制USA300生物被膜的形成,且呈浓度依赖性。
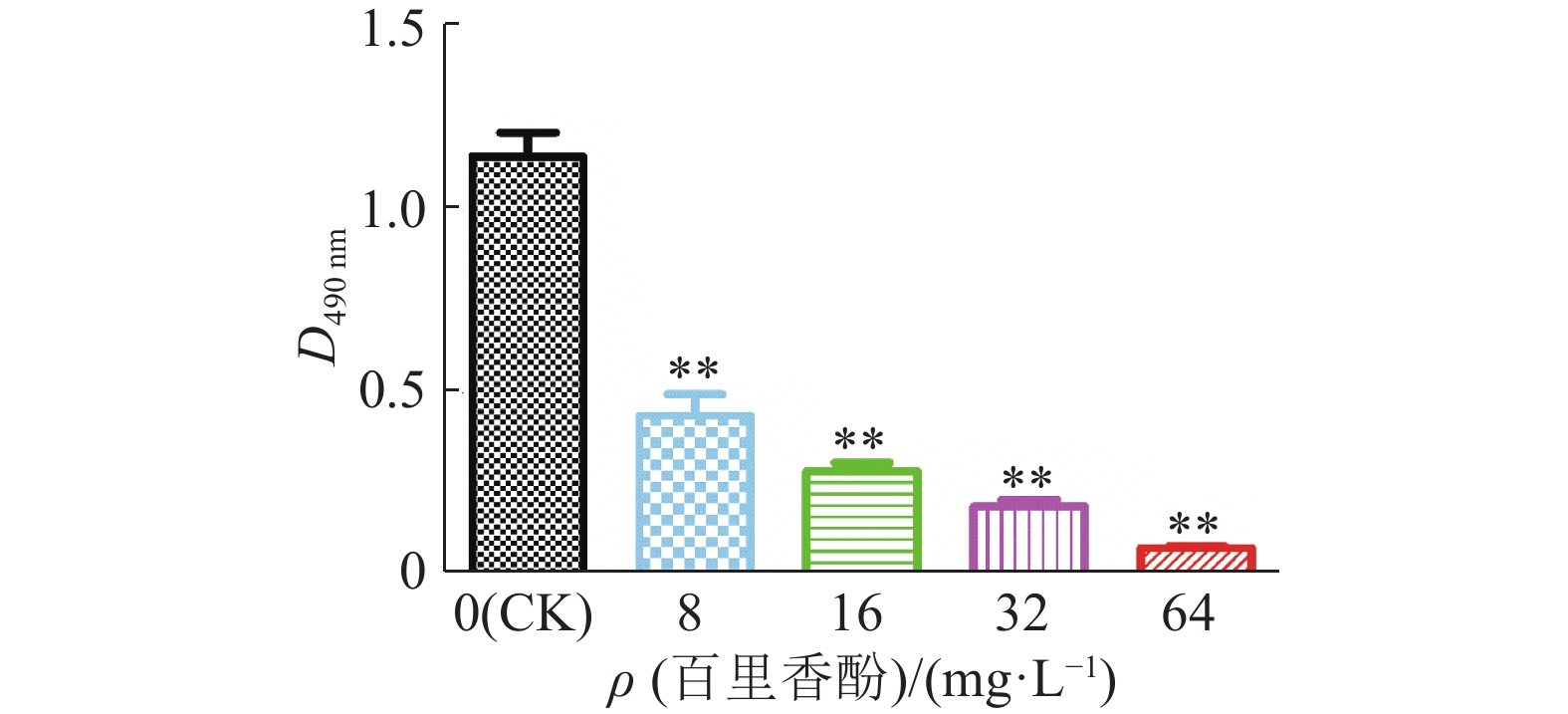
|
图 6 不同质量浓度百里香酚对USA300生物被膜形成能力的影响 Fig. 6 Effects of different mass concentrations of thymol on biofilm formation ability of USA300 “**”表示百里香酚处理组与对照组差异极显著(P<0.01,t检验) |
MRSA是医院感染的主要病原菌之一[20-21]。MIC、MBC试验表明百里香酚对USA300具有显著的抑制和杀灭作用,说明百里香酚具有开发为抗MRSA感染药物的潜力。细胞膜是保证细胞内环境稳定和细胞正常代谢的屏障结构,细胞膜破坏会影响菌体正常的生命活动[22]。电导率试验表明百里香酚可以使USA300菌液的电导率在1 h内迅速增加,说明百里香酚可以在短时间内改变USA300的细胞膜通透性。DNA外渗量的测定试验再次验证了电导率试验结果。由于DNA属生物大分子,几乎不会通过渗透作用穿过细胞膜,所以DNA外渗可以说明百里香酚能够破坏细胞膜结构,影响MRSA菌体的渗透作用。该结果与王晓君等[23]研究一致。
透射电镜技术广泛用于抑菌机理的研究。试验结果显示,对照组细胞结构完整,分裂正常,与文献报道[24]一致。百里香酚处理组出现细胞壁、胞膜破损,细胞质固缩,二分裂异常,再次验证百里香酚可以改变细胞膜通透性,同时干扰细菌正常的二分裂。
蛋白质是生命活动的物质基础,它是将生命各种形式活动紧密联系在一起的物质。可溶性蛋白是细菌重要的渗透调节物质,其增加和积累能提高细胞的保水能力,对细胞生命物质及细胞膜起到保护作用。本试验结果显示,百里香酚作用于菌体后,菌体可溶性蛋白质总量比对照组明显减少,说明百里香酚可以减少菌体内可溶性蛋白质含量,干扰菌体可溶性蛋白质的代谢并间接影响菌体的渗透作用。
细菌生物被膜是一种被胞外聚合物包裹的细菌聚合体,能降低细菌对抗菌药物的敏感性[25],它是细菌在导尿管、假关节等医疗器械中引起感染和慢性MRSA感染的主要毒力因子[26]。抗毒力因子策略是指在不杀死或抑制细菌的条件下,针对细菌特殊毒力因子的一种新型治疗方法[27],因此针对植入性医疗器械感染和慢性MRSA感染可以以生物被膜为毒力靶标。本试验结果表明,64 mg·L–1的百里香酚几乎不影响细菌生长并可以有效抑制USA300生物被膜的形成,说明百里香酚在亚抑菌浓度可以抑制MRSA生物被膜的形成,增强MRSA对抗生素的敏感性,降低粘附能力。因此百里香酚具有开发为抗毒力因子药物的潜力。
综上所述,百里香酚可以通过改变细胞膜通透性,破坏菌体细胞膜和细胞壁完整性,干扰菌体内蛋白质代谢等途径来抑制USA300的生长繁殖,并在亚抑菌浓度能够抑制细菌生物被膜的形成。关于其他作用机制还有待于进一步研究。
| [1] |
TACCONELLI E, TUMBARELLO M, CAUDA R. Staphylococcus aureus infections
[J]. N Engl J Med, 1998, 339(27): 2026-2027. (  0) 0) |
| [2] |
王小兵, 周雄英. 金黄色葡萄球菌感染现状分析[J]. 医学检验与临床, 2013, 24(5): 40-42. DOI:10.3969/j.issn.1673-5013.2013.05.015 (  0) 0) |
| [3] |
CHAMBERS H F, DELEO F R. Waves of resistance: Staphylococcus aureus in the antibiotic era
[J]. Nat Rev Microbiol, 2009, 7(9): 629-641. DOI:10.1038/nrmicro2200 (  0) 0) |
| [4] |
HARRIS S R, FEIL E J, HOLDEN M T G, et al. Evolution of MRSA during hospital transmission and intercontinental spread[J]. Science, 2010, 327(5964): 469-474.
(  0) 0) |
| [5] |
李德发, 祖莹, 陈虹宇, 等. 深圳地区儿童耐甲氧西林金黄色葡萄球菌感染的临床分布与耐药性特点分析[J]. 中华医院感染学杂志, 2017, 27(15): 3563-3566. (  0) 0) |
| [6] |
程禹, 罗敏玉, 陈代杰. 耐甲氧西林金葡菌到万古霉素高度耐药金葡菌的发展及其感染的药物治疗[J]. 世界临床药物, 2011, 32(8): 482-487. (  0) 0) |
| [7] |
崔志斌, 蒋开年, 马晨, 等. 百里香酚的Mannich反应及其产物的抑菌活性[J]. 化学研究与应用, 2008, 20(12): 1626-1629. DOI:10.3969/j.issn.1004-1656.2008.12.020 (  0) 0) |
| [8] |
王新伟, 刘欢, 魏静, 等. 牛至油、香芹酚、柠檬醛和肉桂醛抑菌作用研究[J]. 食品工业, 2010(5): 13-16. (  0) 0) |
| [9] |
张静, 冯岗, 袁旭超, 等. 百里香酚抑菌活性初探[J]. 中国农学通报, 2009, 25(21): 277-280. (  0) 0) |
| [10] |
殷清华, 庄英帜, 严奉祥. 百里香酚的抗肿瘤作用[J]. 现代生物医学进展, 2010, 10(11): 2073-2075. (  0) 0) |
| [11] |
LI Y, WEN J M, DU C J, et al. Thymol inhibits bladder cancer cell proliferation via inducing cell cycle arrest and apoptosis[J]. Biochem Biophys Res Commun, 2017, 491(2): 530-536. DOI:10.1016/j.bbrc.2017.04.009 (  0) 0) |
| [12] |
段雪娟, 吴克刚, 柴向华. 香辛料精油成分对生鲜食品中有害菌杀灭活性研究[J]. 林产化学与工业, 2012, 32(3): 87-91. (  0) 0) |
| [13] |
王海涛. 大豆异黄酮的抑菌活性及其机制的研究[D]. 大连: 辽宁师范大学, 2009.
(  0) 0) |
| [14] |
CHEN C Z S, COOPER S L. Interactions between dendrimer biocides and bacterial membranes[J]. Biomaterials, 2002, 23(16): 3359-3368. DOI:10.1016/S0142-9612(02)00036-4 (  0) 0) |
| [15] |
周磊, 云宝仪, 汪业菊, 等. 大黄素对金黄色葡萄球菌的抑菌作用机制[J]. 中国生物化学与分子生物学报, 2011, 27(12): 1156-1160. (  0) 0) |
| [16] |
薛东芳. 黄连生物碱及8–烷基小檗碱衍生物对嗜水气单胞菌抑菌机制的研究[D]. 重庆: 西南大学, 2015.
(  0) 0) |
| [17] |
方展强, 邱玫, 王春凤. 剑尾鱼鳃结构的光镜、扫描和透射电镜观察[J]. 电子显微学报, 2004, 23(5): 553-559. DOI:10.3969/j.issn.1000-6281.2004.05.009 (  0) 0) |
| [18] |
方克明, 邹兴, 苏继灵. 纳米材料的透射电镜表征[J]. 现代科学仪器, 2003(2): 15-17. DOI:10.3969/j.issn.1003-8892.2003.02.004 (  0) 0) |
| [19] |
ZHANG B, TENG Z, LI X, et al. Chalcone attenuates Staphylococcus aureus virulence by targeting Sortase A and alpha-hemolysin[J]. Front Microbiol, 2017, 8. doi: 10.3389/fmicb.2017.0715.
(  0) 0) |
| [20] |
POTTINGER P S. Methicillin-resistant Staphylococcus aureus infections
[J]. Med Clin North Am, 2013, 97(4): 601-619. DOI:10.1016/j.mcna.2013.02.005 (  0) 0) |
| [21] |
WUNDERINK R G. How important is methicillin-resistant Staphylococcus aureus as a cause of community-acquired pneumonia and what is best antimicrobial therapy
[J]. Infect Dis Clin North Am, 2013, 27(1): 177-188. DOI:10.1016/j.idc.2012.11.006 (  0) 0) |
| [22] |
CORNEO G, POGLIANI E, BIASSONI D, et al. Inhibition of DNA restriction enzyme digestion by anthracyclines[J]. Ric Clin Lab, 1988, 18(1): 19-22. DOI:10.1007/BF02918815 (  0) 0) |
| [23] |
王晓君, 蒋琳琳, 程天印. 百里香酚和香芹酚对细菌形态结构的影响[J]. 畜牧兽医杂志, 2012, 31(3): 10-11. DOI:10.3969/j.issn.1003-7950.2012.03.010 (  0) 0) |
| [24] |
胡静, 赵小慧, 朱春玉, 等. 槐糖脂对金黄色葡萄球菌的抑菌机理[J]. 食品科学, 2012, 33(5): 33-36. (  0) 0) |
| [25] |
盛清. 细菌生物膜[J]. 国外医学 (流行病学传染病学分册), 2003, 30(4): 241-243. (  0) 0) |
| [26] |
YOSHII Y, OKUDA K I, YAMADA S, et al. Norgestimate inhibits staphylococcal biofilm formation and resensitizes methicillin-resistant Staphylococcus aureus to β-lactam antibiotics
[J]. Npj Biofilms Microbiomes, 2017, 3(1): 30. DOI:10.1038/s41522-017-0038-x (  0) 0) |
| [27] |
RASKO D A, SPERANDIO V. Anti-virulence strategies to combat bacteria-mediated disease[J]. Nat Rev Drug Discov, 2010, 9(2): 117-128. DOI:10.1038/nrd3013 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


