土壤微生物是土壤的重要组成成分,可以作为土壤环境变化的预警指标[1],反映土壤质量变化。传统的微生物分离培养法常用于土壤优势菌群的可培养性探究,但由于培养基与真实土壤环境存在差异,培养出的微生物仅占土壤环境中的1%[2]。因此,客观评价土壤活体微生物群落多样性的探究成为了研究热点。
Biolog技术作为一种有效的工具,可评估微生物群落对31种选择性碳源利用能力的多样性变化,方便快速地从宏观上判断复杂的土壤环境的特点。磷脂脂肪酸(Phospholipid fatty acid,PLFA)是活体细胞膜上的特定标记物,细胞死亡后迅速降解消失,可依此检测复杂环境中活体微生物的存在[2-3]。PLFA标记法具有快速、灵敏和应用范围广等特点[4]。
磺胺二甲嘧啶(Sulfadimidine,SM2)是畜禽养殖场广泛使用的一种磺胺类兽用抗生素,常用于畜禽疾病治疗与预防。抗生素在动物体内不能完全代谢,常伴随动物粪便进入周围土壤、底泥、表层水或地下水等环境中,对生态环境造成严重威胁[5-7]。SM2在土壤中的残留量在pg·g–1~ng·g–1之间,由于多种粪便样品中频繁检测到SM2,导致土壤中SM2残留量高达μg·g–1[5]。土壤中残留的抗生素会对土壤微生物群落结构产生显著影响,随时间延长,土壤微生物会对抗生素表现出抗性[8],据报道SM2与土霉素结合会显著影响微生物群落功能多样性[9]。
长期接触畜禽粪便的土壤很容易受到抗生素的污染,目前养殖场附近土壤中已相继检测到多种抗生素残留[10-11]。有关抗生素残留影响土壤微生物群落结构与功能多样性的研究较多[12],多采用分子生物学技术分析,不能区分活体微生物的变化。本研究采集长期未施用粪肥和任何药物的菜地土壤以及未接触任何抗生素的农户猪舍内的猪粪为试验材料,选取养殖场附近检出率较高的SM2作为抗生素胁迫因子,构建室内土壤–粪便模型,采用Biolog技术和PLFA标记法分析土壤活体微生物群落结构和功能变化,探究SM2随粪便施用后对土壤环境的影响,为合理进行养殖场周围土壤环境质量评估和土地施肥管理提供一定参考依据。
1 材料与方法 1.1 材料试验于2016年11月至2017年1月在华南农业大学兽医学院进行,土壤采集于华南农业大学农学院试验基地,孵育2个月以去除所有抗生素污染。粪便采集于广西壮族自治区恭城县一未施用任何抗生素的农户猪舍,经高效液相色谱仪未检测到SM2。采集的土壤风干磨碎后过100目筛用于背景理化性质检测。
SM2购自大连美仑生物公司,纯度(w)≥99%;内标十九酸甲酯购自美国Sigma-Aldrich公司;Biolog®ECO微平板购自美国Biolog公司;SPE硅胶柱购自德国CNW公司;其余有机试剂购自广州华奇盛生物科技有限公司。
1.2 背景理化性质检测pH用电位法测定:m(土)∶m(水)=1∶2.5,100 r·min–1震荡10 min,澄清后测定;总氮含量用TOC分析仪测定;有机质含量采用重铬酸钾容量法测定:以重铬酸钾–硫酸溶液作为消煮液,结果判定时加入邻啡罗啉指示剂,用硫酸亚铁溶液滴定;总磷含量采用氢氧化钠熔融–钼锑抗比色法测量,经分光光度计于700 nm波长处比色得到[13]。经检测,供试土壤pH 5.77,总氮、有机质和总磷含量(w)分别为0.66、18.2和0.27 g·kg–1。
1.3 试验设计及样品采集试验设4个处理:对照组为4 kg土壤+20 g猪粪,低剂量组为4 kg土壤+20 g猪粪+5 μg·kg–1 SM2,中剂量组为4 kg土壤+20 g猪粪+500 μg·kg–1 SM2,高剂量组为4 kg土壤+20 g猪粪+5 000 μg·kg–1 SM2,各设3次重复。
土壤样品于2016年11月19日—2017年1月19日分点采集,分别于施入猪粪和SM2后的1、7、14和50 d采集,模型构建期间通过称重法使土壤含水量保持最大持水量的60%,室内温度的变化范围为7~25 ℃。采集到的3个平行样品充分混匀后分成2份,各200 g,1份于4 ℃冰箱冷藏,1个星期内完成Biolog检测;另1份经冻干机冻干后于–20 ℃冰箱避光保存,用于PLFA检测。
1.4 Biolog检测将8.5 g·L–1的生理盐水90 mL加入含10 g混匀土样的锥形瓶中,置于摇床上于210 r·min–1、25 ℃条件下震荡30 min,再用生理盐水倍比稀释1 000倍,加入到含有31种碳源的Biolog® ECO(GENⅢ,美国)微平板中,每孔150 μL,28 ℃条件下培养240 h,每天通过酶标仪(Thermo,美国)读取光密度(D)值,作为碳源利用能力变化的判断依据。平均颜色变化率(Average well color development,AWCD)是反映土壤微生物活性,即单一碳源利用能力的一个重要指标。AWCD的计算公式如下:
| ${\rm{AWCD}} = \sum {({C_i} - R)} /31,$ | (1) |
式中,Ci为每个样品孔的D值,R为控制孔的D值。
取培养96 h的ECO板整体D值进行多样性分析,采用的多样性指数有Simpson物种优势度指数
| $D^\prime = 1 - \sum {P_i^2} ,$ | (2) |
| $H = \sum {{P_i}\left( {{\rm{ln}}{P_i}} \right),} $ | (3) |
| $U = \sqrt {\sum {n_i^2} } ,\quad\quad$ | (4) |
式中,Pi为单一碳源在96孔板上的相对D值,
土壤样品的PLFA组成用气相色谱与质谱联用仪GC-MS QP2010 Plus(岛津,日本)进行定性和定量检测,参照Chowdhury等[15]的方法并有所改进,具体如下:将22.8 mL Bligh-Dyer单相提取液(柠檬酸液、氯仿和甲醇体积比为0.8∶1.0∶2.0)分2次加到冻干的4 g土壤中进行提取,氮吹后经SPE固相萃取柱分离磷脂,将分离到的磷脂甲酯化,然后加入内标十九酸甲酯,用正己烷定容至200 μL,上机检测。仪器检测采用DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),载气为He,流量0.8 mL·min–1。升温程序:50 ℃保持1 min;12 ℃·min–1升至180 ℃,保持2 min;6 ℃·min–1升至220 ℃,保持2 min;15 ℃·min–1升至240 ℃,保持1 min;15 ℃·min–1升至260 ℃,保持15 min。不分流进样,进样口温度250 ℃,进样量1 μL。质谱条件:离子源温度230 ℃,尾吹气为N2,电喷雾离子源扫描,扫描范围50~500 N,每次扫描时间为1 s,电喷雾电压70 eV。
PLFA含量用脂肪酸甲酯的摩尔百分比表示。一般脂肪酸的命名方式为(a/i)X: YwZ(c/t),X为碳原子数,Y为双键数,Z为双键所在的碳原子位置,a、i分别表示反式、异式支链脂肪酸,w表示自甲基端起双键的位置,c、t分别表示顺式、反式脂肪酸,脂肪酸含量测定以十九酸甲酯为内标,通过色谱峰面积定量。同一样品中所有微生物PLFA含量相加作为该样品的PLFA总量,同一类型微生物PLFA含量相加用于估算该种微生物在土壤环境中的含量。
1.6 数据分析采用GraphPad Prism7和Origin Pro 2017C对数据进行处理和绘图,采用SPSS 22.0对数据进行差异显著性检验,应用单变量双因素方差分析比较培养时间、粪便和SM2施入时间和SM2剂量对土壤微生物群落功能及结构多样性的影响,其余表格用Microsoft Excel 2007制作。
2 结果与分析 2.1 土壤微生物群落对碳源利用能力的变化不同处理的AWCD随ECO板培养时间的变化如图1所示,AWCD均随培养时间的延长逐渐增加。对照组AWCD在整个培养期间基本处于最低水平,中剂量组表现出明显优势,表明SM2施入后土壤微生物群落的总体碳源利用能力增强。ECO板含有的31种碳源基质通常分为6大类,分别是碳水化合物、醇类、胺类、酯类、氨基酸类和酸类[14]。各处理组在不同采样时间对各类碳源利用能力(AWCD)变化的进一步分析如图2所示。对照组在粪便施入7 d时,酯类利用能力增强,且至粪便施入50 d均表现为酯类利用程度较高,比较粪便施入1~50 d的变化,对照组除对碳水化合物利用能力有所降低外,对其余碳源的利用能力均有不同程度的提高。低剂量组在粪便和SM2施入1 d时,土壤微生物群落对各类碳源的利用能力都强于对照组,但随施入时间的延长增强效应逐渐减弱,可见,施入低剂量SM2可以短期增强土壤微生物群落对各类碳源的利用率。中剂量组土壤微生物对碳水化合物和酯类的利用能力增强,对胺类的利用程度在整个培养期间变化剧烈,比较粪便和SM2施入1~50 d的变化,除醇类的利用程度下降外,其余碳源的利用程度均有所提升。高剂量组在粪便和SM2施入7 d时,土壤微生物对各类碳源的利用能力均出现提升,特别是酯类和氨基酸类,施入时间延长至14 d时,对各类碳源的利用能力减弱,比较粪便和SM2施入1~50 d的变化,高剂量SM2的施入提升了土壤微生物群落对各类碳源的利用能力。结合土壤微生物群落对总体碳源利用能力的变化及不同碳源利用程度的结果分析低剂量SM2的施入可短期(7 d内)增强土壤微生物对碳源的利用能力,增强效应随施入时间延长而下降,中、高剂量SM2的施入增强了土壤微生物对各类碳源的利用能力,中剂量组总体碳源利用能力的增强幅度高于高剂量组。
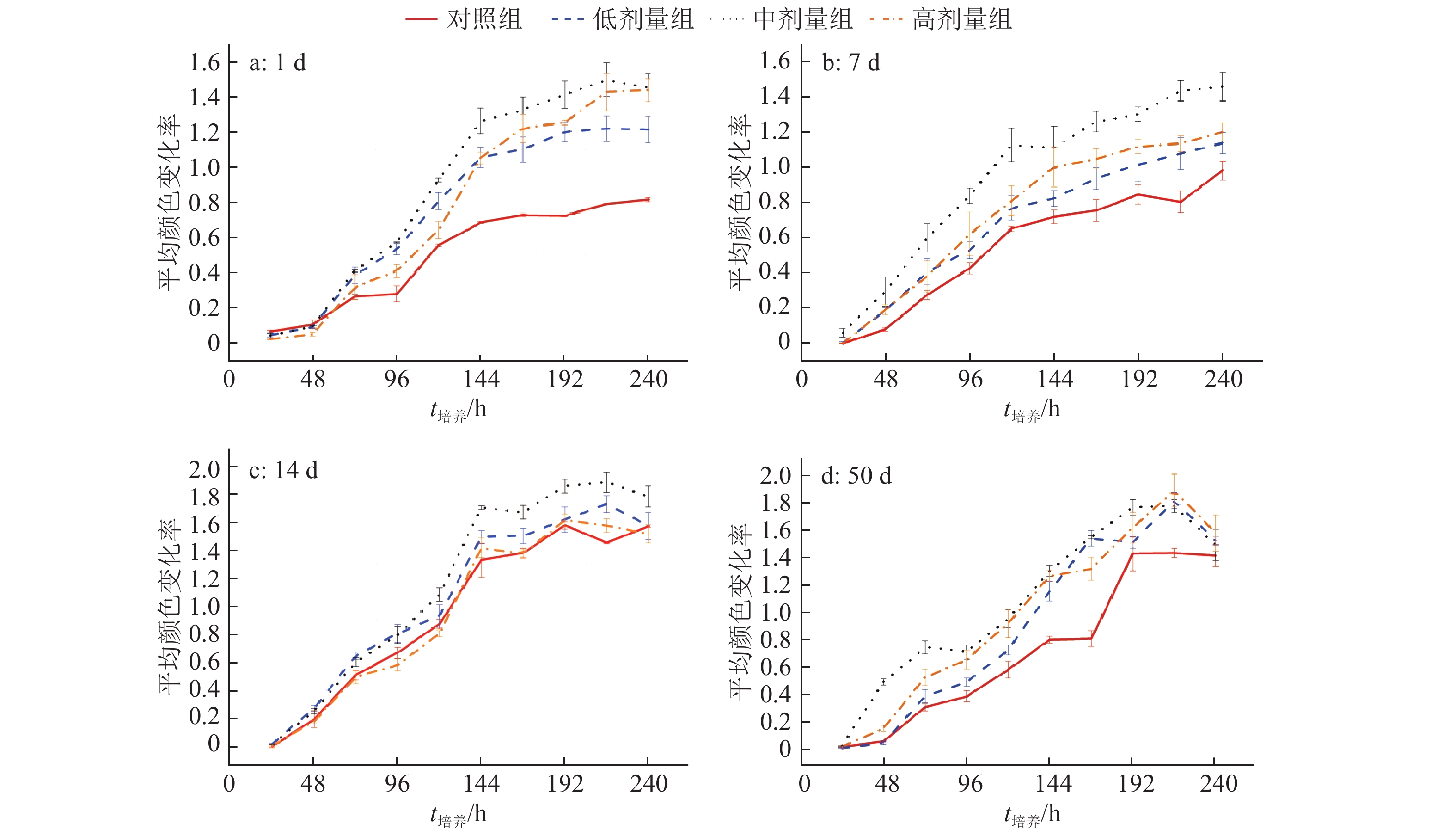
|
图 1 各处理组土壤微生物群落对碳源总体利用能力的变化 Fig. 1 The overall utilization capacity changes of soil microbial community to all carbon sources in each treatment group |
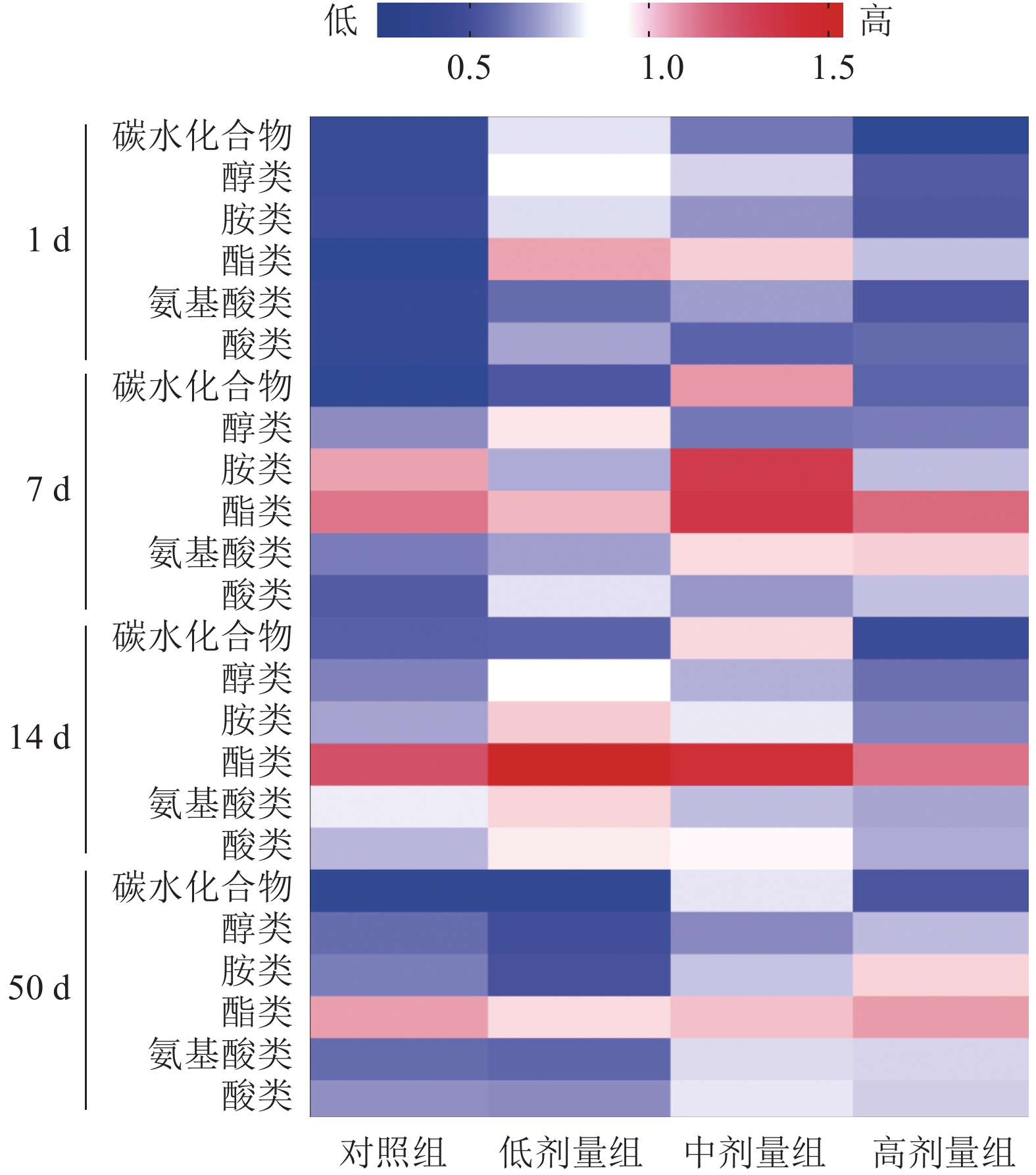
|
图 2 各处理组土壤微生物群落对各类碳源利用能力的变化 Fig. 2 The utilization capacity changes of soil microbial community to each kind of carbon source in each treatment group |
各处理组土壤微生物群落在不同粪便和SM2施入时间的多样性指数分析如图3所示。Simpson物种优势度指数(D)在整个试验期间变化不明显(图3a),中剂量组的物种优势度相对于其他处理组始终维持较高水平,表明中剂量SM2的施入可能会促进土壤中某些物种繁殖。由图3b中 Shannon物种丰富度指数(H)特点可知,随粪便和SM2施入时间延长,对照组和各剂量组土壤微生物群落的物种丰富度均有提高,但差异均不显著。由图3c中 Mclntosh物种均匀度指数(U)的变化可知,粪便和SM2施入1 d时,与对照组相比,高剂量组土壤微生物群落的物种均匀度显著下降,低、中剂量组物种均匀度有所提高,但差异不显著;施入7 d时,高剂量组物种均匀度有所回升,低、高剂量组均高于对照组,但差异不显著,中剂量组显著高于对照组;高剂量组的物种均匀度在第14天时低于对照组,但差异不显著,第50天时显著高于对照组,中、低剂量组的物种均匀度也出现不同程度的升高和降低的变化。总之,随土壤中SM2施入剂量的改变,粪土模型中微生物群落的功能多样性发生了不同程度的变化,中、高剂量SM2的施入可能会影响土壤群落中某些优势物种的繁殖和数量分配。
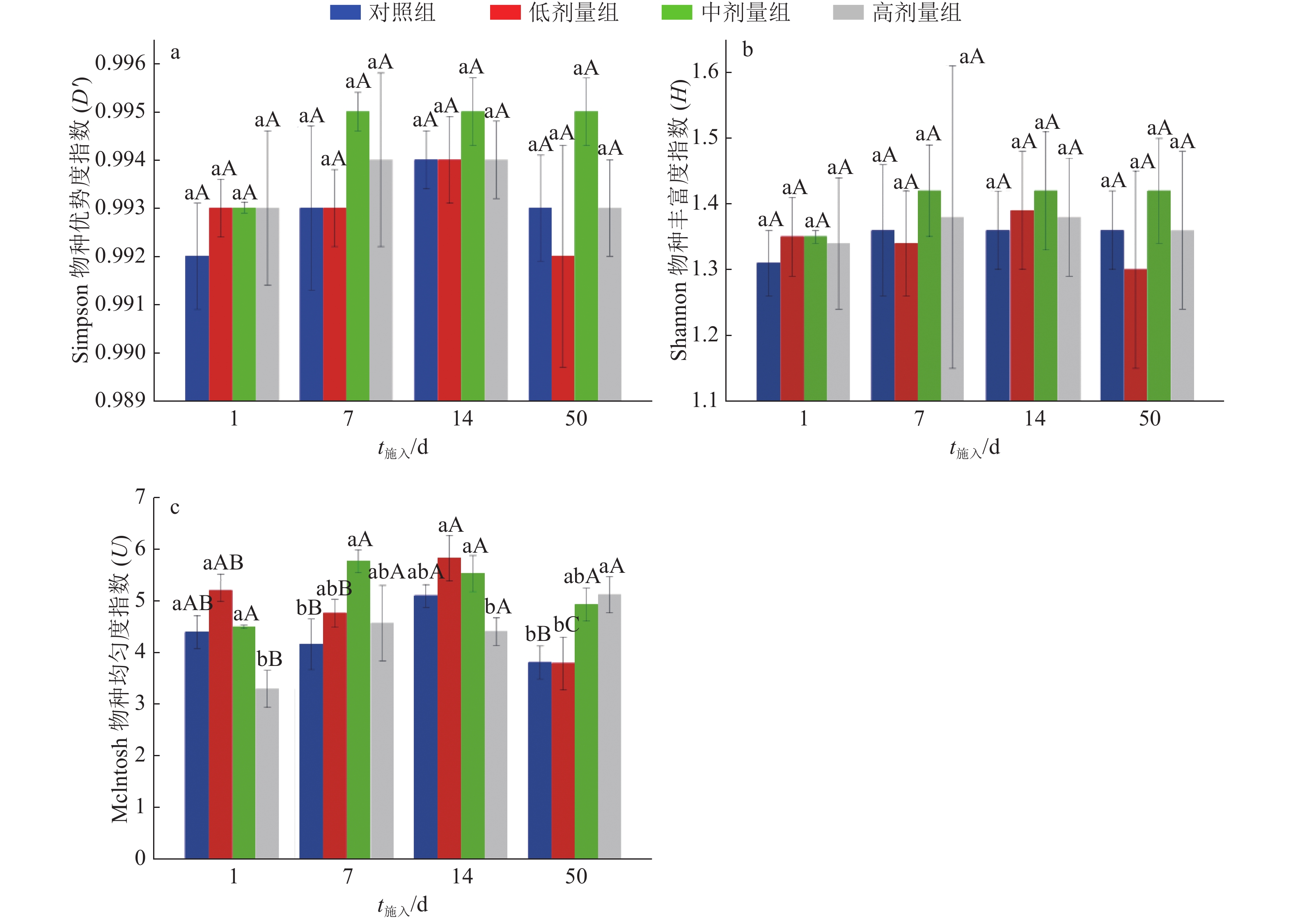
|
图 3 各处理组土壤微生物群落多样性指数分析 Fig. 3 The soil microbial community diversity index analyses in each treatment group 图中数据为3次重复测定的平均值±标准误;相同施入时间不同处理组的柱子上方凡是有一个相同小写字母者,表示处理间差异不显著(P≥0.05,Tukey HSD法),相同处理组不同施入时间的柱子上方凡是有一个相同大写字母者,表示处理间差异不显著(P≥0.05,Tukey HSD法) |
PLFA作为活体细胞膜上的特定标记物,可反映复杂微生物环境中的群落结构。本研究检测出C12~C24共24种PLFA,包括16种细菌(4种革兰阳性菌、12种革兰阴性菌)PLFA、3种真菌PLFA、2种放线菌PLFA和3种原生生物PLFA(表1)。各处理组各种PLFA含量如图4所示,PLFA含量变化表现为革兰阴性菌>革兰阳性菌>真菌>放线菌,各类型菌群的PLFA含量变化趋势与PLFA总量相似。
|
|
表 1 用于估算微生物数量的磷脂脂肪酸标记 Table 1 The phospholipid fatty acid labeling used to evaluate the microbial quantity |
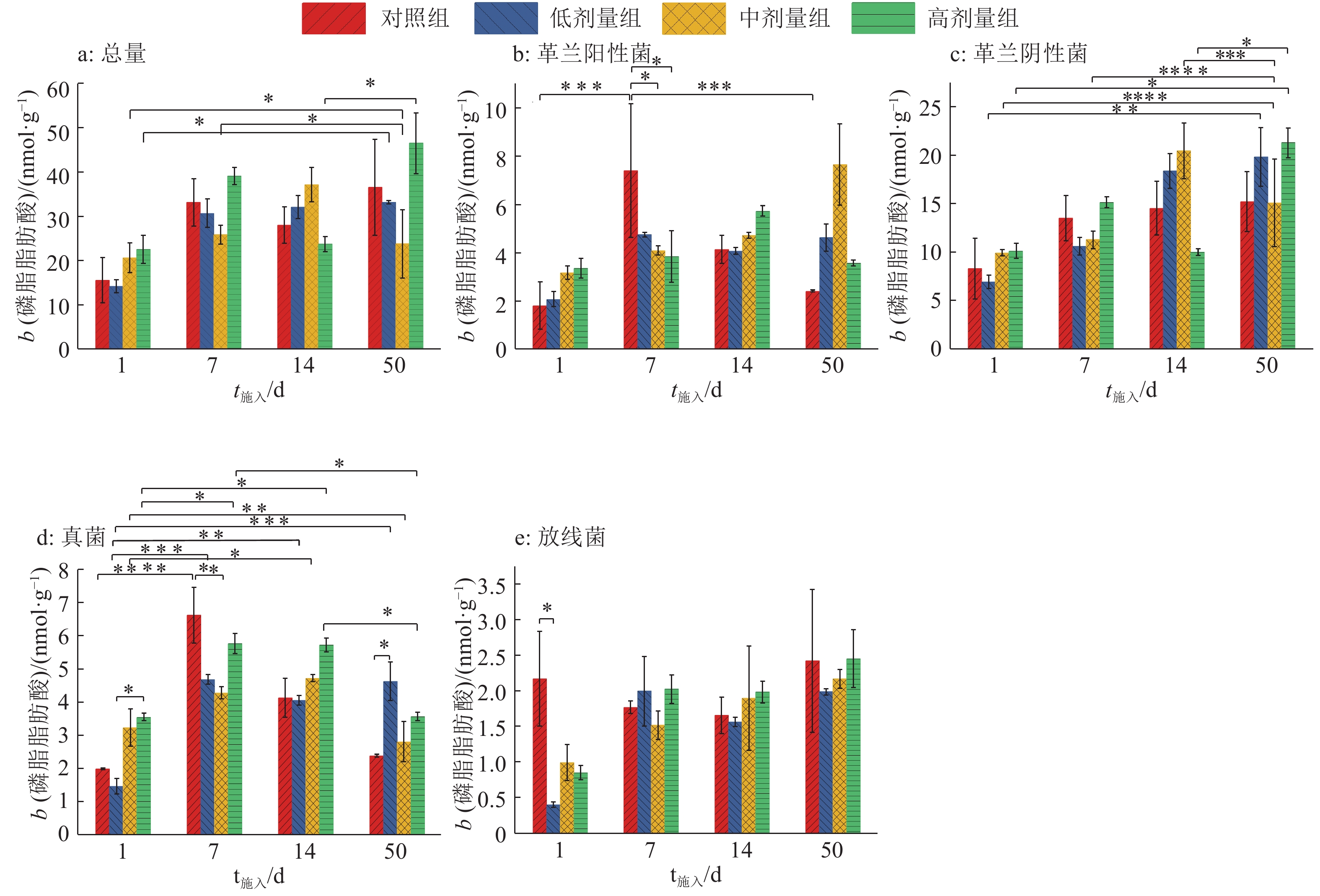
|
图 4 各处理组土壤微生物群落的磷脂脂肪酸含量变化 Fig. 4 The changes of phospholipid fatty acid content in soil microbial community in each treatment group “*”表示在0.01<P<0.05 水平差异显著;“**”表示在0.001<P<0.01 水平差异显著;“***”表示在0.000 1<P<0.001 水平差异显著;“****”表示在P<0.000 1 水平差异显著(Tukey HSD 法) |
双因素方差分析发现,中剂量组粪便和SM2施入1 d时PLFA总量在0.01<P<0.05水平显著低于施入50 d处理,施入7 d在0.01<P<0.05水平显著高于施入50 d,高剂量组施入1和14 d在0.01<P<0.05水平显著低于施入50 d,表明中、高剂量SM2的施入对土壤微生物PLFA总量影响较大。革兰阳性菌中,对照组粪便施入1和50 d时的PLFA含量均在0.000 1<P<0.001水平显著低于施入7 d处理,中、高剂量组施入7 d时的PLFA含量均在0.01<P<0.05水平显著低于对照组,表明粪便和SM2施入7 d时革兰阳性菌变化最剧烈,此时SM2对革兰阳性菌的抑制效应最强。革兰阴性菌中,各处理组PLFA含量随粪便和SM2施入时间延长变化复杂:施入50 d与施入1 d相比,高剂量组PLFA含量在0.01<P<0.05水平显著增加,低、中剂量组分别在0.001<P<0.01和P<0.000 1水平显著增加,中剂量组施入7 d、14 d与施入50 d相比PLFA含量分别在P<0.000 1和0.000 1<P<0.001水平差异显著,高剂量组施入14 d与施入50 d相比PLFA含量在0.01<P<0.05水平差异显著。真菌中,从施入时间看,对照组施入7 d与施入1 d相比PLFA含量在P<0.000 1水平显著增加,低剂量组施入1 d与施入7 d、14 d、50 d相比分别在0.000 1<P<0.001、0.001<P<0.01和0.000 1<P<0.001水平差异显著,中剂量组施入14 d与施入1 d相比在0.01<P<0.05水平显著增加,施入50 d与施入1 d相比在0.001<P<0.01水平显著减少,高剂量组施入7 d、14 d时均在0.01<P<0.05水平显著高于施入1 d和50 d;从不同处理方式看,施入1 d时,低剂量组在0.01<P<0.05水平显著低于高剂量组,施入7 d时,对照组在0.001<P<0.01水平显著高于中剂量组,施入50 d时,对照组在0.01<P<0.05水平显著低于低剂量组。结果表明,SM2随粪便引入土壤后,各处理组真菌PLFA含量呈先升高后降低的变化趋势。相比低剂量组,高剂量组在粪便和SM2施入1 d 时在0.01<P<0.05水平显著促进了真菌增殖,施入50 d时,低剂量组对真菌有更明显的促进作用。放线菌中,粪便和SM2施入1 d时,低剂量组比对照组在0.01<P<0.05水平显著减少,总体表现为施入1 d 时低剂量组放线菌被明显抑制,其余剂量组也出现了放线菌被抑制的现象,但抑制效应不明显。随施入时间延长,SM2对放线菌的抑制效应减弱。以上分析可见,不同的环境具有特异的PLFA 指纹图谱,即不同土壤环境的优势菌群存在差异,因此PLFA标记可以较为准确地指示土壤环境的变化。
3 讨论与结论土壤中的可培养微生物仅有一小部分,与分子生物学试验比较,传统的分离培养方法存在很多缺点,如检查速度慢和准确性低等,本研究采用Biolog技术和PLFA标记相结合的方法,得到了土壤微生物群落碳源利用能力、多样性指数和PLFA标记物含量变化等群落功能与结构多样性信息,其操作简便,可观察性强且准确度较高。抗生素在畜禽养殖场的滥用会导致土壤环境发生较为严重的抗生素残留,继而对土壤环境质量造成影响。研究表明当SM2在土壤中的残留量达到一定水平时,将显著影响土壤微生物的多样性[23]。
Biolog技术在微生物群落功能多样性的研究中应用最为广泛,土壤、水和白酒等的微生物群落结构与功能多样性检测均有相关文献报道[24-25]。通过土壤微生物对不同种类碳源利用能力的分析,可以较为准确地判断菌群功能多样性。本研究发现,粪便和SM2施入50 d时,中、高剂量组对除酯类以外的各类碳源的利用能力均强于对照组,这与Liu等[26]研究结果相似。施入猪粪导致土壤菌群活性增强,而随着土壤中随粪肥引入的药物剂量的升高以及在土壤中残留时间的延长,再次强化了菌群活性,引起菌群功能多样性变化。
由于微生物群落组成的不同,不宜用单一的某种PLFA标记来代表细菌或真菌,可通过多种类型的PLFA标记以减少误差[27]。本研究选择不同类型微生物的PLFA含量对土壤微生物群落进行定量。PLFA总量随粪便和SM2施入时间延长呈逐渐上升趋势,这与张焕军等[28]研究结果相似。长期施肥导致土壤微生物群落的PLFA总量升高,对照组与SM2处理组的PLFA总量在粪便和SM2施入50 d时均出现上升现象,这与Hammesfahr等[29]研究结果有所不同,可能是其选用的磺胺类药物施加剂量较高(最低添加剂量为10 μg·g–1)所致。有研究表明施用有机肥会显著增加土壤中真菌和革兰阴性菌数量[30],相似地,本研究观察到在粪便施入7 d时,对照组真菌数量均达到最大值,之后逐渐下降,可能是由土壤中有机质被逐渐消耗导致。郭芸等[31]提出休闲土壤在未施加任何肥料的条件下,土壤没有外源有机物的输入同时不断消耗有机质,会导致土壤中各类菌群微生物数量逐渐下降。放线菌在各个处理中含量均最低,表明施肥对放线菌存在抑制效应,这与裴雪霞等[30]结果相似,同时前人提出长期施用肥料将促进细菌数量增长,放线菌数量降低,对真菌数量影响不显著[28]。总之,药物伴随粪便在土壤中残留时间及残留量的变化不同程度地改变了土壤微生物的群落结构组成。
本文以Biolog检测和PLFA标记法探究了构建的菜地土壤模型中添加不同剂量的SM2后,土壤微生物群落对碳源的利用能力以及结构功能多样性的变化,确定SM2随粪便施入土壤后将加强土壤群落的总体碳源利用能力,不同剂量的SM2会对土壤群落的功能多样性造成不同程度的影响。同时,SM2显著改变土壤中革兰阳性菌、革兰阴性菌以及真菌群落的组成,对放线菌影响不大。SM2在土壤中残留时间的延长将造成土壤微生物群落的长期不稳定性。
| [1] |
MOSCATELLI M C, LAGOMARSINO A, MARINARI S, et al. Soil microbial indices as bioindicators of environmental changes in a poplar plantation[J]. Ecol Indic, 2005, 5(3): 171-179. DOI:10.1016/j.ecolind.2005.03.002 (  0) 0) |
| [2] |
王曙光, 侯彦林. 磷脂脂肪酸方法在土壤微生物分析中的应用[J]. 微生物学通报, 2004, 31(1): 114-117. DOI:10.3969/j.issn.0253-2654.2004.01.026 (  0) 0) |
| [3] |
于树, 汪景宽, 李双异. 应用PLFA方法分析长期不同施肥处理对玉米地土壤微生物群落结构的影响[J]. 生态学报, 2008, 28(9): 4221-4227. DOI:10.3321/j.issn:1000-0933.2008.09.019 (  0) 0) |
| [4] |
刘国华, 叶正芳, 吴为中. 土壤微生物群落多样性解析法: 从培养到非培养[J]. 生态学报, 2012, 32(14): 4421-4433. (  0) 0) |
| [5] |
TETZNER N F, MANIERO M G, RODRIGUES-SILVA C, et al. On-line solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry as a powerful technique for the determination of sulfonamide residues in soils
[J]. J Chromatogr A, 2016, 1452: 89-97. DOI:10.1016/j.chroma.2016.05.034 (  0) 0) |
| [6] |
ZHOU L J, YING G G, LIU S, et al. Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry[J]. J Chromatogr A, 2012, 1244: 123-138. DOI:10.1016/j.chroma.2012.04.076 (  0) 0) |
| [7] |
FANG H, HAN Y L, YIN Y M, et al. Microbial response to repeated treatments of manure containing sulfadiazine and chlortetracycline in soil[J]. J Environ Sci Health B, 2014, 49(8): 609-615. DOI:10.1080/03601234.2014.911592 (  0) 0) |
| [8] |
徐晨光, 张奇春, 侯昌萍. 外源抗生素对茶园土壤微生物群落结构的影响[J]. 浙江大学学报(农业与生命科学版), 2014, 40(1): 75-84. DOI:10.3785/j.issn.1008-9209.2014.01.009 (  0) 0) |
| [9] |
张凯煜, 谷洁, 赵听, 等. 土霉素和磺胺二甲嘧啶对堆肥过程中酶活性及微生物群落功能多样性的影响[J]. 环境科学学报, 2015, 35(12): 3927-3936. (  0) 0) |
| [10] |
KIM K R, OWENS G, KWON S I, et al. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment[J]. Water Air Soil Pollut, 2011, 214(1/2/3/4): 163-174. (  0) 0) |
| [11] |
WEI R, GE F, ZHANG L, et al. Occurrence of 13 veterinary drugs in animal manure-amended soils in Eastern China[J]. Chemosphere, 2016, 144: 2377-2383. DOI:10.1016/j.chemosphere.2015.10.126 (  0) 0) |
| [12] |
JECHALKE S, HEUER H, SIEMENS J, et al. Fate and effects of veterinary antibiotics in soil[J]. Trends Microbiol, 2014, 22(9): 536-545. DOI:10.1016/j.tim.2014.05.005 (  0) 0) |
| [13] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
(  0) 0) |
| [14] |
党雯, 郜春花, 张强, 等. Biolog法测定土壤微生物群落功能多样性预处理方法的筛选[J]. 中国农学通报, 2015, 31(2): 153-158. (  0) 0) |
| [15] |
CHOWDHURY T R, DICK R P. Standardizing methylation method during phospholipid fatty acid analysis to profile soil microbial communities[J]. J Microbiol Methods, 2012, 88(2): 285-291. DOI:10.1016/j.mimet.2011.12.008 (  0) 0) |
| [16] |
GUTIÉRREZ I R, WATANABE N, HARTER T, et al. Effect of sulfonamide antibiotics on microbial diversity and activity in a Californian Mollic Haploxeralf[J]. J Soils Sediments, 2010, 10(3): 537-544. DOI:10.1007/s11368-009-0168-8 (  0) 0) |
| [17] |
BÅÅTH E, ANDERSON T H. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques[J]. Soil Biol Biochem, 2003, 35(7): 955-963. DOI:10.1016/S0038-0717(03)00154-8 (  0) 0) |
| [18] |
ZOGG G P, ZAK D R, RINGELBERG D B, et al. Compositional and functional shifts in microbial communities due to soil warming[J]. Soil Sci Soc Am J, 1997, 61(2): 475-481. DOI:10.2136/sssaj1997.03615995006100020015x (  0) 0) |
| [19] |
BOSSIO D A, SCOW K M, GUNAPALA N, et al. Determinants of soil microbial communities: Effects of agricultural management, season, and soil type on phospholipid fatty acid profiles[J]. Microb Ecol, 1998, 36(1): 1-12. DOI:10.1007/s002489900087 (  0) 0) |
| [20] |
OHTONEN R, FRITZE H, PENNANEN T, et al. Ecosystem properties and microbial community changes in primary succession on a glacier forefront[J]. Oecologia, 1999, 119(2): 239-246. DOI:10.1007/s004420050782 (  0) 0) |
| [21] |
SMITHWICK E A H, TURNER M G, METZGER K L, et al. Variation in NH4+ mineralization and microbial communities with stand age in lodgepole pine (Pinus contorta) forests, Yellowstone National Park (USA)
[J]. Soil Biol Biochem, 2005, 37(8): 1546-1559. DOI:10.1016/j.soilbio.2005.01.016 (  0) 0) |
| [22] |
WU Y, MA B, ZHOU L, et al. Changes in the soil microbial community structure with latitude in eastern China, based on phospholipid fatty acid analysis[J]. Appl Soil Ecol, 2009, 43(2/3): 234-240. (  0) 0) |
| [23] |
GUTIÉRREZ I R, WATANABE N, HARTER T, et al. Effect of sulfonamide antibiotics on microbial diversity and activity in a Californian Mollic Haploxeralf
[J]. J Soils Sediments, 2010, 10(3): 537-544. DOI:10.1007/s11368-009-0168-8 (  0) 0) |
| [24] |
SALA M M, PINHASSI J, GASOL J M. Estimation of bacterial use of dissolved organic nitrogen compounds in aquatic ecosystems using Biolog plates[J]. Aquat Microb Ecol, 2006, 42(1): 1-5. (  0) 0) |
| [25] |
唐小丽, 翟磊, 信春晖, 等. 利用Biolog技术分析芝麻香型白酒高温大曲微生物群落结构及多样性[J]. 酿酒科技, 2015(12): 7-11. (  0) 0) |
| [26] |
LIU F, WU J, YING G, et al. Changes in functional diversity of soil microbial community with addition of antibiotics sulfamethoxazole and chlortetracycline[J]. Appl Microbiol Biotechnol, 2012, 95(6): 1615-1623. DOI:10.1007/s00253-011-3831-0 (  0) 0) |
| [27] |
FROSTEGÅRD A, BÅÅTH E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biol Fertil Soils, 1996, 22(1/2): 59-65. (  0) 0) |
| [28] |
张焕军, 郁红艳, 丁维新. 长期施用有机无机肥对潮土微生物群落的影响[J]. 生态学报, 2011, 31(12): 3308-3314. (  0) 0) |
| [29] |
HAMMESFAHR U, HEUER H, MANZKE B, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biol Biochem, 2008, 40(7): 1583-1591. DOI:10.1016/j.soilbio.2008.01.010 (  0) 0) |
| [30] |
裴雪霞, 周卫, 梁国庆, 等. 长期施肥对黄棕壤性水稻土生物学特性的影响[J]. 中国农业科学, 2010, 43(20): 4198-4206. DOI:10.3864/j.issn.0578-1752.2010.20.010 (  0) 0) |
| [31] |
郭芸, 孙本华, 王颖, 等. 长期施用不同肥料土PLFA指纹特征[J]. 中国农业科学, 2017, 50(1): 94-103. (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


