2. 广西农业科学院 蔬菜研究所,广西 南宁 530007
2. Institute of Vegetable, Guangxi Academy of Agricultural Sciences, Nanning 530007, China
山药Dioscorea spp. 属于百合目Liliales 薯蓣科Dioscoreaceae 薯蓣属Dioscorea,为1年生或多年生缠绕性草质藤本单子叶植物[1],是世界上重要的十大食用块茎植物之一[2],其地下器官块茎含有丰富的淀粉、蛋白质、糖类等成分,具有补脾养胃、补肺益肾等功效。由于山药块茎深埋土壤,取样和观察较为困难,因此山药块茎发育过程中淀粉积累及蛋白组学研究起步较晚。
而双子叶植物马铃薯近年来在块茎形成与发育的细胞学、生理学与蛋白组学方面有不少的研究。刘梦芸等[3]认为块茎的膨大主要是细胞数量增加,其次是细胞体积增大;王翠松等[4]认为在马铃薯块茎发生和膨大初期,糖分减少和淀粉合成可作为块茎发生和膨大的标记;Fernie等[5]发现马铃薯块茎葡萄糖磷酸变位酶对淀粉合成贡献较大;柳俊等[6]认为短日照、较低温度以及离体条件下,培养基较高的蔗糖浓度有利于块茎形成,块茎形成与膨大与淀粉合成和储藏蛋白基因表达有关;Agrawal等[7]发现在马铃薯块茎发育过程中有219个差异蛋白质表达倍数在2.5倍以上;张小静[8]、刘海霞[9]发现Patatin蛋白在整个块茎发育过程中呈上调表达趋势。
同是块茎作物,对单子叶作物山药块茎发育的研究主要集中于生长分析、细胞学、营养成分分析、化学调控等方面。孙霞[10]发现种植于内蒙古的毕克齐长山药,7月中旬为开花期,7月下旬为块茎始期,8月下旬为膨大中期,9月下旬为膨大盛期,10月上旬为膨大后期,10月下旬为成熟收获期;龚明霞[11]将2个山药品种‘GH5’和‘GH16’块茎生长发育进程划分为3个时期:形成期、膨大期和成熟期。孙启善[12]认为细胞平周分裂会形成圈分生带,由圈分生带分裂的细胞向内分化维管分子和薄壁细胞,使山药的块茎不断增粗;梁任繁等[13]认为块茎中积累的可溶性糖主要为还原糖(果糖、葡萄糖)和蔗糖,它们是块茎品质成分合成的基础原料,也是影响块茎形成和发育重要因素之一;Hou等[14]发现山药块茎中含有一种蛋白质Dioscorin,具有抗二苯代苦味酰肼(DPPH) 和羟自由基活性。山药块茎中淀粉占干物质的质量分数为70%~80%,淀粉积累规律是研究的热点[15-17]。块茎的淀粉积累不仅影响块茎的发育与膨大,还影响块茎重要性状的调控和直接经济效益的形成,目前的研究鲜有从品质、结构及蛋白组水平上综合研究山药块茎生长和发育机理,因而本研究综合利用生理测定、显微技术和双向电泳技术,结合形态结构、生理和蛋白组变化研究山药块茎生长发育过程中淀粉积累规律,寻找块茎淀粉积累的相关关键蛋白,为高产优质山药栽培、育种及生产管理改良提供重要理论依据。
1 材料与方法 1.1 供试材料‘GH16’为供试材料,2012年3月20日催芽,4月10日种植于广西大学农学院教学科研基地,采用定向和搭架栽培,随机区组设计,每个小区的种植面积为15 m2,株距30 cm,行距1 m,3次重复,常规田间管理,当年12月10日收获。期间分别在4月25日、5月10日、6月10日、7月10日、9月10日、11月10日和12月10日进行块茎取样。
1.2 取样方法随机选取9株(每个小区3株)块茎,去掉表层泥土,分别用游标卡尺测量块茎直径,软尺测量长度,电子秤称质量。然后将块茎中段靠近皮层的块茎组织切成直径为0.5 cm,厚度为0.5 cm(块茎直径未发育到0.5 cm的取整个块茎)的样品于FAA固定液中固定,用于石蜡切片包埋。
每个小区分别随机选取3株块茎样品的上、中、下部位混匀(3个小区9株),液氮速冻,3次重复,–80 ℃保存,用于块茎的化学成分测定。
1.3 块茎中细胞和淀粉粒大小观察采用常规石蜡切片法包埋、切片,切片厚度10~12 μm,番红–固绿法染色,中性树胶封固,在Olympus光学显微镜下进行镜检并拍照,每个时期分别拍摄4张清晰的图片,100倍下测量细胞的长轴和短轴直径,400倍下测量淀粉粒的长轴和短轴直径,根据放大倍数换算成实际长度,比较不同发育时期的块茎结构和细胞、淀粉粒的形态变化。
1.4 块茎中蔗糖、还原糖、可溶性蛋白和淀粉的含量测定蔗糖含量测定采用Roe比色法[18],还原糖含量测定采用3,5–二硝基水杨酸法[19],可溶性蛋白含量测定采用考马斯亮蓝G-250比色法[20],淀粉含量测定采用盐酸水解DNS比色法[21]。
1.5 蛋白质双向电泳研究方法 1.5.1 山药块茎蛋白质的提取蛋白质提取采用酚抽提法,参考Carpentier等[22]和Yang等[23]的方法稍做修改:2 g样品迅速在液氮中研磨成粉,加入到6 mL已预冷的蛋白提取液(含50 mmol·L–1 pH8.5的 Tris-HCl、5 mmol·L–1 EDTA、100 mmol·L–1 KCl、10 g·L–1 DTT、300 g·L–1蔗糖、20 g·L–1PVP)中,涡旋混匀30 s,后面步骤同Yang等[23]的方法。蛋白干粉裂解液含7 mol·L–1尿素、2 mol·L–1硫脲、40 g·L–1 CHAPS、8 g·L–1 IPG-buffer、10 g·L–1 DTT,室温涡旋溶解1 h,采用考马斯亮蓝染色法进行蛋白质定量后用于双向电泳分析。
1.5.2 块茎蛋白质双向凝胶电泳第1向等电聚焦(IEF):采用Bio-Rad Protean IEF Cell等电聚焦系统,pH为3~10,采用24 cm IPG胶条,每根胶条上样150 μg蛋白样品,进行第1向等电聚焦,聚焦参数如表1所示。
|
|
表 1 等电聚焦参数 Table 1 Isoelectric focusing (IEF) parameters |
胶条平衡:将聚焦完成的胶条置于10 mL平衡液I(含6 mol·L–1尿素、φ为30%的甘油、20 g·L–1 SDS、10 g·L–1 DTT、50 mmol·L–1 Tris,pH8.8) 中,在水平摇床上平衡15 min。清洗胶条,加入平衡液II(含6 mol·L–1尿素、φ为30%的甘油、20 g·L–1 SDS、25 g·L–1碘乙酰胺、50 mmol·L–1 Tris,pH8.8) 10 mL,在水平摇床上平衡15 min。
第2向电泳(SDS-PAGE):将平衡后的胶条用去离子水清洗1 s后放入凝胶板中,加入低熔点琼脂糖封胶液(5 g·L–1低熔点琼脂糖+电泳缓冲液),室温静置 20 min后开始第2向电泳。第2向SDS-PAGE凝胶质量浓度为 125 g·L–1,电泳参数设定为:100 V电泳45 min,然后设定200 V,冷循环系统设定温度为15 ℃,溴酚蓝至胶下沿0.5 cm处停止电泳。
凝胶染色:凝胶水洗5~10 min后,采用银染法染色,具体操作包括:1)固定:固定液(含φ为40%的甲醇和φ为10%的乙酸)1 L固定30 min后,用φ为10%的乙醇溶液洗2次,每次5 min;然后水洗2次,每次5 min;2)敏化:敏化液(含31.6 g·L–1硫代硫酸钠、41 g·L–1无水乙酸钠、φ为30%的乙醇溶液) 1 L敏化30 min后,双蒸水洗3次,每次10 min;3)银染:银染液(2.5 g·L–1硝酸银溶液)银染20 min后,水洗凝胶2次,每次1 min;4)显色:显影液(含25 g·L–1碳酸钠溶液和400 mL甲醛) 显色3~5 min至图像满意,冰醋酸立即停显10 min,然后用双蒸水洗2次,每次5 min。
1.5.3 图像扫描及分析Bio-Rad/GS-800扫描仪对脱色结束的聚丙烯酰胺凝胶进行扫描,并保存图像,分辨率为300 dpi;PDquest 8.0软件分析扫描图像和差异蛋白点,在3次重复内被发现的差异蛋白点被认为是真实的蛋白点。
1.5.4 差异蛋白点质谱鉴定差异蛋白点从凝胶上挖取,然后进行胶内酶解及ZipTip脱盐、MALDI-TOF/TOF质谱等操作,具体操作参考李奇松等[24]的方法。
1.5.5 差异蛋白点生物信息学分析搜索Mascot数据库,对一级和二级质谱进行综合分析比对,同时在NCBInr数据库中搜索相关匹配的蛋白质。
1.6 数据分析试验重复3次,数据用平均值±标准差表示,采用Excel和SPSS l9.0统计软件进行方差分析,差异显著性采用LSD多重比较法检验。
2 结果与分析 2.1 山药块茎生长发育过程中的形态变化从整个生长周期来看,‘GH16’块茎的长、宽和质量的生长变化曲线都呈“S”型(图1)。块茎形成较早,甚至在播种催芽后肉眼就能见圆锥凸起状块茎,但是,在块茎形成后的2个月内(块茎形成初期)生长较为缓慢,即4—5月块茎质量增加不足整个生育期的十分之一,6—11月(块茎膨大期)快速伸长、膨大、增质量,完成整个生育期质量生长的80%以上,11月后(块茎膨大后期)其生长速度缓慢,12月进入成熟期。在生长期间,块茎皮色也发生变化,由形成初期的白色不断变黄变深变褐,到膨大后期成黄褐色。
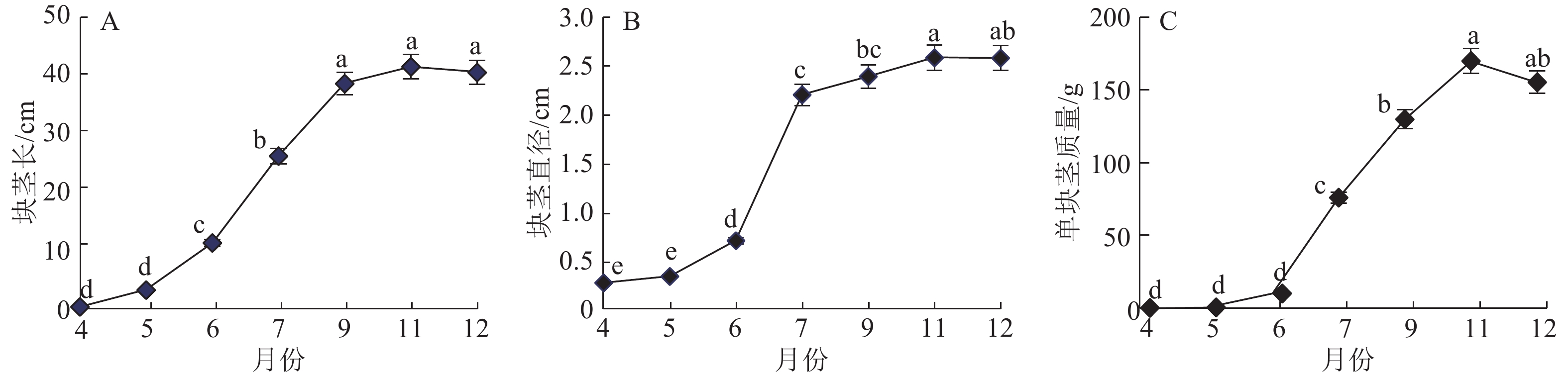
|
图 1 山药块茎发育过程中的形态变化 Fig. 1 Morphological changes during development of Chinese yam tuber 各图中数值上凡是具有一个相同小写字母者,表示不同月份间差异不显著(P>0.05,LSD法) |
在块茎形成初期,糖(蔗糖、还原糖)含量很低(图2A、2B),块茎膨大初期蔗糖、还原糖含量快速升高,此后,蔗糖含量变化表现出上下波动的趋势。还原糖在块茎快速膨大期含量最高;膨大初期后则持续降低,快速降低的还原糖可能用于块茎蔗糖及淀粉的积累;块茎快速膨大期还原糖含量与块茎形成期及块茎膨大后期差异显著,直至11月还原糖含量降到最低,标志着块茎的成熟。
‘GH16’块茎淀粉含量变化见图2C。在块茎形成初期,淀粉含量极低,在膨大期(6—11月)淀粉快速积累,11月达到最高值(98.617 mg·L–1),12月淀粉含量略有下降,不同发育时期淀粉含量差异显著。淀粉积累与可溶性糖含量的变化密切相关。块茎形成初期,蔗糖含量不断升高,细胞中几乎看不到淀粉粒,此时淀粉积累率几乎为零;块茎膨大期,块茎中蔗糖含量急剧降低,蔗糖开始转化为细胞发育和淀粉合成所需的底物,淀粉开始积累,6—11月,淀粉积累速度最快。
‘GH16’可溶性蛋白含量变化如图2D所示。‘GH16’的可溶性蛋白积累较早,在块茎形成初期,各种蛋白质代谢活跃,随着块茎的发育,可溶性蛋白又出现逐渐减少趋势,块茎膨大初期略有上升,自9月后可溶性蛋白快速积累,11月达到峰值,到12月可溶性蛋白积累下降。
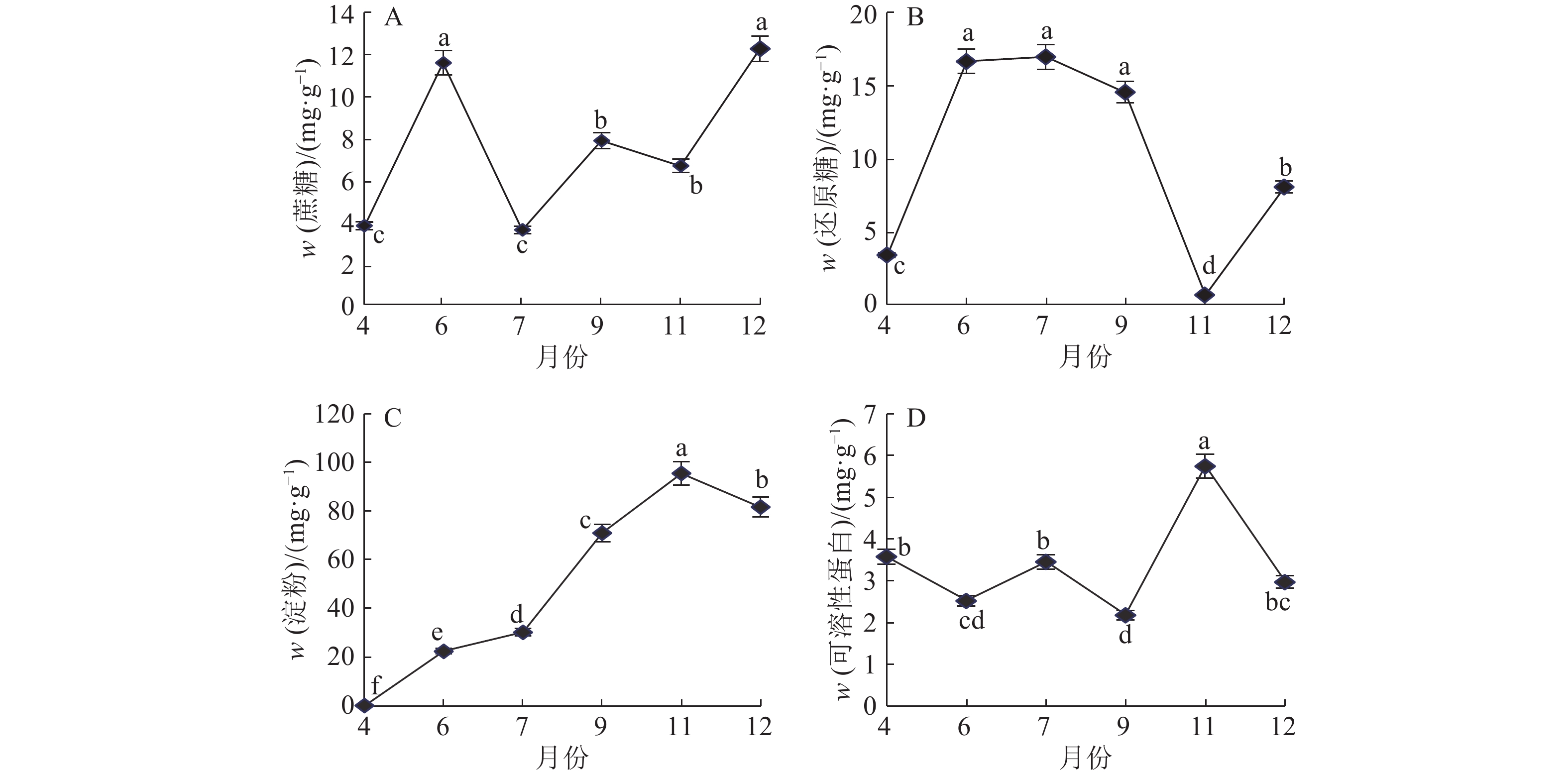
|
图 2 山药块茎发育过程中的营养组分含量变化 Fig. 2 Changes of nutrient constituents during development of Chinese yam tuber 各图中数值上凡是具有一个相同小写字母者,表示不同月份间差异不显著(P>0.05,LSD法) |
‘GH16’的块茎呈圆柱型,由表皮、薄壁组织和散生维管束组成。表皮由4~8层排列不规则的近椭圆形细胞组成,细胞内无淀粉粒。表皮内的薄壁组织和维管组织发达,维管束为外韧有限维管束,散生在薄壁组织中,无形成层,不能形成次生结构(图3)。
如图3、图4所示,块茎中薄壁细胞和淀粉粒的动态消长与块茎生长发育有密切关系,其发育曲线也和块茎长、宽、质量的生长曲线一样呈“S”型。薄壁细胞近圆形或椭圆形,排列较整齐。块茎形成初期的4月和5月,细胞体积较小,维管组织中存在大量分生细胞群,薄壁细胞中无淀粉粒。随着块茎的发育,块茎细胞及维管束间的薄壁细胞逐渐膨大,6月细胞快速生长膨大,其中淀粉粒均匀分布于薄壁组织细胞中。9月后淀粉粒体积膨大缓慢,在靠近维管束处聚集增多,11月细胞达到其最大值,纵径和横径分别达到121.685和89.572 μm,11月后细胞和淀粉粒增大不显著。淀粉粒单粒呈扁卵形、椭圆形或圆形,淀粉粒长径最长达27.608 μm (12月),短径最长达16.450 μm (11月),淀粉粒有脐点,脐点呈点状、人字状、十字状等形状,淀粉粒在6—11月期间迅速累积。
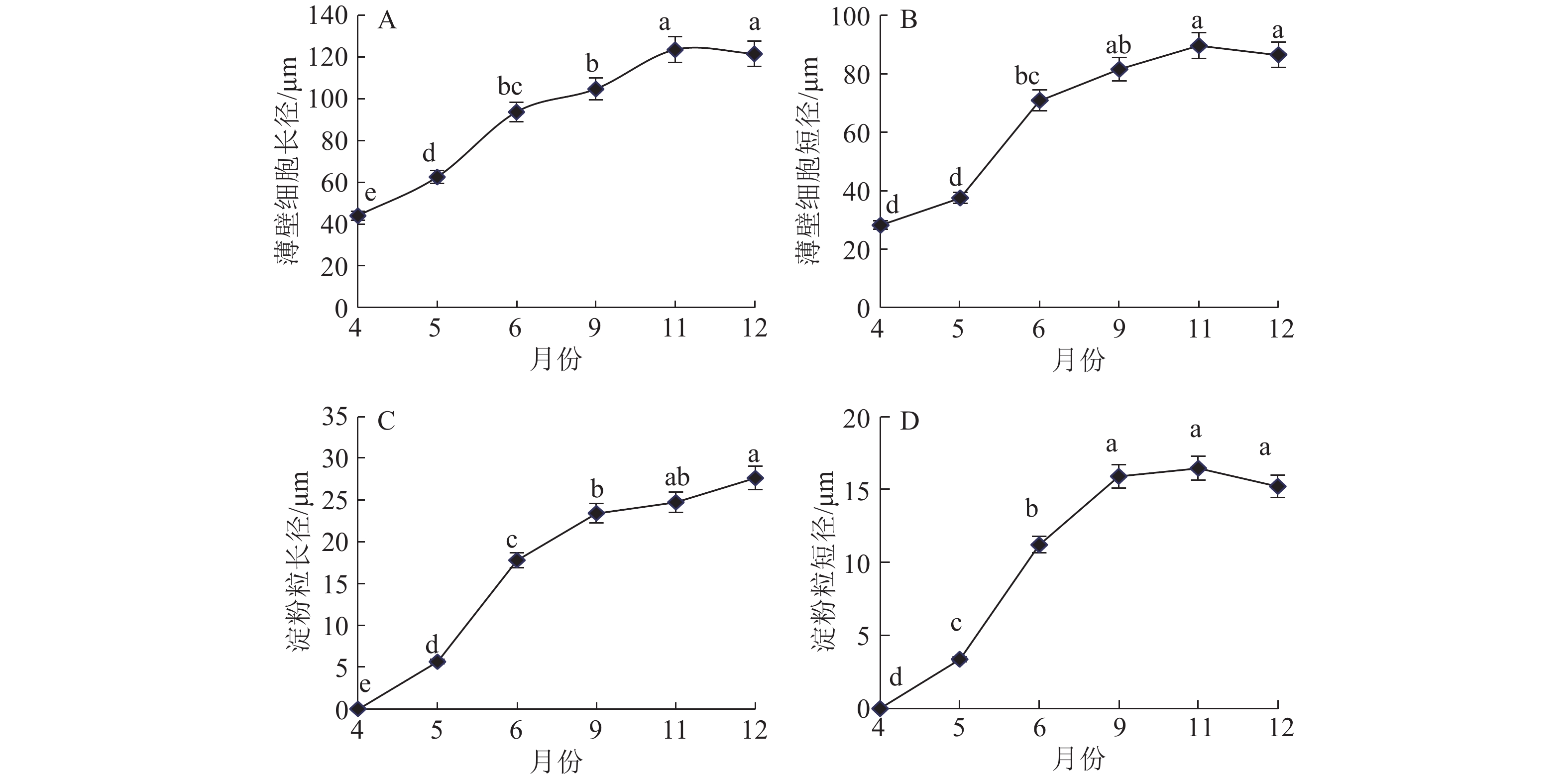
|
图 4 山药块茎发育过程中薄壁细胞与淀粉粒大小变化 Fig. 4 Changes of parenchyma cell and starch grain sizes during development of Chinese yam tuber 各图中数值上凡是具有一个相同小写字母者,表示不同月份间差异不显著(P>0.05,LSD法) |

|
图 3 山药块茎发育的细胞学观察 Fig. 3 The cytology observation during development of Chinese yam tuber A、B和C分别为4、6和12月块茎皮层及其附近组织横切面结构,D、E、F、G、H和I分别为4、5、6、9、11和12月块茎薄壁组织横切面结构;Ep:表皮,Co:皮层,Vc:维管束,Xy:木质部,Pc:薄壁细胞,S:淀粉粒;标尺=100 μm |
如图5所示,通过比较分析5、6和11月份块茎中的蛋白质双向电泳图谱,找到179个差异点。其中,块茎形成初期到块茎膨大初期有下调蛋白50个,上调蛋白47个;块茎形成初期到块茎膨大后期下调蛋白99个,上调蛋白28个;膨大初期到块茎膨大后期下调蛋白116个,上调17个。选取其中差异倍数较大的52个蛋白点进行质谱鉴定,成功鉴定出31个差异表达蛋白点。

|
图 5 山药块茎发育过程中的蛋白质双向电泳图 Fig. 5 Two-dimensional electrophoresis of proteins during development of Chinese yam tuber 红色数字为已鉴定的差异蛋白的序号 |
如表2所示,已鉴定的部分差异蛋白包括几丁质酶、核酮糖–1,5–二磷酸羧化酶/加氧酶大亚基、阳离子过氧化物酶、酸性内切壳多糖酶、果糖–1,6–二磷酸醛缩酶、6–磷酸葡萄糖酸脱氢酶、肽基脯氨酸顺反异构酶、ATP合成酶α亚基、块茎储藏蛋白、UTP–葡萄糖–1–磷酸尿苷酰转移酶、40S核糖体蛋白质、胚胎发育晚期丰富蛋白、磷酸甘油酸激酶1、蛋白酶α亚基、Dioscorin蛋白等,它们主要参与糖代谢与淀粉合成及蛋白质代谢。其中块茎形成初期到块茎膨大后期3个阶段均下调的蛋白有核酮糖–1,5–二磷酸羧化酶/加氧酶大亚基、阳离子过氧化物酶、肽基脯氨酸顺反异构酶,核酮糖–1,5–二磷酸羧化酶/加氧酶大亚基,它们的表达随着块茎发育渐渐减弱。
|
|
表 2 部分差异蛋白质信息列表 Table 2 Information of partial differentially expressed proteins |
6月的块茎中的6–磷酸葡萄糖酸脱氢酶相对表达量最高,为11月的23.61倍,为5月的2倍多,说明在块茎膨大初期6–磷酸葡萄糖酸脱氢酶催化6–磷酸葡萄糖生成6–磷酸葡萄糖酸,供给块茎膨大氨基酸、脂类及核苷酸等物质合成及细胞生长所需的还原力远远大于其他时期;UTP–葡萄糖–1–磷酸尿苷酰转移酶是淀粉合成及糖代谢途径中的关键酶,其在块茎形成初期的表达量不到膨大初期和膨大后期的一半。因此,在块茎膨大过程中,糖代谢和淀粉合成的相关酶如6–磷酸葡萄糖酸脱氢酶、UTP–葡萄糖–1–磷酸尿苷酰转移酶及果糖–1,6–二磷酸醛缩酶、ATP合成酶α亚基、磷酸甘油酸激酶1等在块茎膨大初期后上调表达,正向调控糖代谢和能量代谢,促进淀粉积累和块茎膨大。
几丁质酶、酸性内切壳多糖酶、蛋白酶α亚基等是与抗性相关的蛋白,几丁质酶在3个阶段不断下调表达,说明几丁质酶在块茎形成初期是主要的抗性调控蛋白,保护幼嫩块茎免受病虫害浸染;酸性内切壳多糖酶、蛋白酶则主要是在块茎膨大初期和后期保护块茎的抗性调控蛋白。
胚胎发育晚期丰富蛋白(Mr=17 567)、块茎储藏蛋白(Mr=35 982)和Dioscorin蛋白(Mr=31 815)在块茎膨大过程中大量积累,其中胚胎发育晚期丰富蛋白和茎储藏蛋白在膨大初期(6月)大量积累,Dioscorin蛋白在膨大后期(11月)大量积累。
3 讨论与结论块茎的膨大是一个复杂的生物过程,从块茎形成初期到膨大后期,山药块茎横截面面积扩大了约100倍,而细胞扩大了约10倍。同时,块茎维管束属于外韧有限维管束,散生在薄壁组织中,无形成层,不能进行次生生长。因此,山药块茎膨大主要是细胞分裂和细胞膨大共同作用的结果,与孙启善[12]、Vreugdenhil等[25]的观点一致,块茎顶端细胞分裂、细胞膨大及胞内淀粉粒积累是块茎膨大增粗的主要原因,也决定了块茎增粗到一定程度就不再增大,这与刘梦芸等[3]认为块茎增大主要是细胞数量增多的结果有所不同。
细胞学观察和生理学研究表明,在块茎形成初期(4—5月)几乎未见有淀粉积累,块茎发育阶段差异蛋白研究的结果也表明,在块茎形成初期,淀粉合成相关酶的表达量很弱或没有,说明块茎的形成与淀粉的合成并没有必然联系,这与Müller-Röber等[26]认为块茎淀粉合成途径的中断并不会限制其块茎形成能力的观点相一致。
自块茎膨大初期(6月)后淀粉快速积累,与块茎膨大同步,因而,块茎的膨大离不开淀粉的积累,淀粉是块茎增粗增重的主要贡献因子。块茎膨大初期,与糖代谢和淀粉合成及能量代谢相关的酶如6–磷酸葡萄糖酸脱氢酶、果糖–1,6–二磷酸醛缩酶、ATP合成酶α亚基、UTP–葡萄糖–1–磷酸尿苷酰转移酶、磷酸甘油酸激酶1等较块茎形成初期上调表达,正向调控糖代谢和能量代谢,为淀粉合成提供更多底物和能量,促进淀粉积累和块茎发育膨大。6–磷酸葡萄糖酸脱氢酶是磷酸戊糖途径的关键酶,催化6–磷酸葡萄糖生成6–磷酸葡萄糖酸,具有磷酸葡萄糖脱羧活性,并生成NADPH,氨基酸、脂类及核苷酸等细胞组成物质的合成均需NADPH提供还原力,对细胞正常生长和代谢有重要影响[27]。Huang等[28]发现6–磷酸葡萄糖酸脱氢酶在水稻幼穗中的表达量明显高于根、叶和胚,表明该酶与水稻穗发育密切相关。果糖–1,6–二磷酸醛缩酶是一类重要的糖代谢酶,既参与糖酵解和糖异生过程,又参与磷酸戊糖途径和卡尔文循环,对植物体正常的生命活动具有极其重要的作用,能够影响植株的生长和生物量的积累[29]。Haake等[30]研究发现,轻微地降低质体中果糖–1,6–二磷酸醛缩酶基因的表达就能够降低马铃薯中糖和淀粉的含量,抑制植株的生长。ATP合成酶在胞内或胞膜上发挥合成或水解ATP的功能,利用跨膜离子梯度中储存的能量从ADP和磷酸合成ATP,是细胞能量转换过程中的关键酶,而ATP合成酶α亚基是膜外部ATP合成酶复合体的最大亚基,虽然还没有关于ATP合成酶α亚基与块茎发育的具体报道,但王海云[31]发现ATP合成酶β亚基在生根诱导不同时期表达量差异显著;娄沂春等[32]采用mRNA差异显示技术分离到1个ATP合成酶基因片段,其在赤霉素诱导条件下表达,在诱导16 h后达到高峰;张欣欣等[33]从水稻根cDNA文库中筛选出1个水稻线粒体ATP合成酶亚基,其与碳酸盐逆境有关。这说明ATP合成酶在植物生长发育及能量代谢中不可缺少,同时也说明ATP合成酶α亚基的差异表达调控着能量代谢,调控着块茎的生长发育与膨大。UTP–葡萄糖–1–磷酸尿苷酰转移酶是淀粉合成及糖代谢途径中的关键酶,可以将UDPG催化生成葡萄糖–1–磷酸,葡萄糖–1–磷酸进入糖酵解或者由腺苷二磷酸葡糖焦磷酸化酶催化转化为腺苷二磷酸葡糖,最终形成淀粉储存在组织中[28]。该酶从块茎膨大初期开始表达上调,最终促进块茎淀粉的合成积累。磷酸甘油酸激酶是糖酵解的关键酶,催化1,3–二磷酸甘油酸转变3–磷酸甘油酸,产生1分子ATP。磷酸甘油酸激酶在块茎膨大初期活性最高,说明块茎膨大初期块茎发育需要大量可溶性糖和能量。这些差异蛋白的表达变化与块茎膨大期后淀粉积累呈上升趋势相符,与膨大初期后薄壁细胞中淀粉粒大量积累的现象也相符。
块茎膨大过程中除了淀粉的大量积累外,还有块茎储藏蛋白的大量积累:胚胎发育晚期丰富蛋白(Mr=17 567)、块茎储藏蛋白(Mr=35 982)和Dioscorin蛋白(Mr =31 815)在膨大过程中大量积累,特别是山药块茎中的特异蛋白Dioscorin在膨大后期大量积累。Dioscorin蛋白占块茎可溶性蛋白的质量分数为70%~80%,属于糖蛋白类型,与马铃薯中的Patatin蛋白、甘薯中的Sporamin蛋白同属于变态根茎器官中的特异贮藏蛋白质[2],由于其在块茎中大量存在而且具有抗氧化、降低血压、胰蛋白酶抑制剂以及免疫调节等一系列生理和药理活性成为近年来科学家研究的热点[34]。
| [1] |
裴鉴. 中国植物志: 第16卷: 第1分册[M]. 北京: 科学出版社, 1985.
(  0) 0) |
| [2] |
SHEWRY P R. Tuber storage proteins[J]. Ann Bot, 2003, 91(7): 755-769. DOI:10.1093/aob/mcg084 (  0) 0) |
| [3] |
刘梦芸, 门福义. 马铃薯块茎生长发育的研究[J]. 内蒙古农业大学学报(自然科学版), 1987, 8(2): 104-116. (  0) 0) |
| [4] |
王翠松, 张红梅, 李云峰, 等. 马铃薯块茎发育过程中的影响因子[J]. 中国马铃薯, 2003, 17(1): 29-33. DOI:10.3969/j.issn.1672-3635.2003.01.013 (  0) 0) |
| [5] |
FERNIE A R, ROESSNER U, TRETHEWEY R N, et al. The contribution of plastidial phosphoglucomutase to the control of starch synthesis within the potato tuber[J]. Planta, 2001, 213(3): 418-426. DOI:10.1007/s004250100521 (  0) 0) |
| [6] |
柳俊, 谢从华. 马铃薯块茎发育机理及其基因表达[J]. 植物学通报, 2001, 18(5): 531-539. DOI:10.3969/j.issn.1674-3466.2001.05.003 (  0) 0) |
| [7] |
AGRAWAL L, CHAKRABORTY S, JAISWAL D K, et al. Comparative proteomics of tuber induction, development and maturation reveal the complexity of tuberization process in potato (Solanum tuberosum L.)
[J]. J Proteome Res, 2008, 7(9): 3803-3817. DOI:10.1021/pr8000755 (  0) 0) |
| [8] |
张小静, 马铃薯块茎蛋白质双向电泳技术体系的建立及发育相关蛋白质的分析[D]. 兰州: 甘肃农业大学, 2008.
(  0) 0) |
| [9] |
刘海霞. 马铃薯块茎离体发育过程的差异蛋白质组[D]. 兰州: 甘肃农业大学, 2013.
(  0) 0) |
| [10] |
孙霞. 毕克齐长山药生育和贮藏期间营养成分及相关酶活性的研究[D]. 呼和浩特: 内蒙古农业大学, 2008.
(  0) 0) |
| [11] |
龚明霞. 赤霉素调控山药块茎生长的生理和分子机制[D]. 南宁: 广西大学, 2017.
(  0) 0) |
| [12] |
孙启善. 山药优质高产栽培实用技术[M]. 北京: 中国农业出版社, 2001
(  0) 0) |
| [13] |
梁任繁, 李创珍, 张娟, 等. 山药块茎发育中物质积累及相关代谢酶变化[J]. 作物学报, 2011, 37(5): 903-910. (  0) 0) |
| [14] |
HOU W C, LIU J S, CHEN H J, et al. Dioscorin, the major tuber storage protein of yam (Dioscorea batatas Decne) with carbonic anhydrase and trypsin inhibitor activities
[J]. J Agric Food Chem, 1999, 47(5): 2168-2172. DOI:10.1021/jf980738o (  0) 0) |
| [15] |
FARHAT I A, OGUNTONA T, NEALE R J, et al. Characterization of starches from West African yams[J]. J Sci Food Agr, 1999, 79(15): 2105-2112. DOI:10.1002/(ISSN)1097-0010 (  0) 0) |
| [16] |
AMANI N G, BULEON A, KAMENAN A, et al. Variability in starch physicochemical and functional properties of yam (Dioscorea sp.) cultivated in Ivory Coast
[J]. J Sci Food Agr, 2004, 84(15): 2085-2096. DOI:10.1002/jsfa.1834 (  0) 0) |
| [17] |
OKUNLOLA A, ODEKU O A. Evaluation of starches obtained from four Dioscorea species as binding agent in chloroquine phosphate tablet formulations
[J]. Saudi Pharm J, 2011, 19(2): 95-105. DOI:10.1016/j.jsps.2011.01.002 (  0) 0) |
| [18] |
中国科学院上海植物生理研究所, 上海市植物生理学会. 现代植物生理学实验指南[M]. 北京: 科学出版社, 1999.
(  0) 0) |
| [19] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
(  0) 0) |
| [20] |
王晶英, 敖红, 张杰, 等. 植物生理生化实验技术与原理[M]. 哈尔滨: 东北林业大学出版社, 2003.
(  0) 0) |
| [21] |
陆国权, 李秀玲, 丁守仁, 等. 盐酸水解DNS比色法快速测定甘薯淀粉含量的标准方法研究[J]. 中国粮油学报, 2002, 17(1): 25-28. DOI:10.3321/j.issn:1003-0174.2002.01.007 (  0) 0) |
| [22] |
CARPENTIER S C, WITTERS E, LAUKENS K, et al. Preparation of protein extracts from recalcitrant plant tissues: An evaluation of different methods for two-dimensional gel electrophoresis analysis[J]. Proteomics, 2005, 5(10): 2497-2507. DOI:10.1002/(ISSN)1615-9861 (  0) 0) |
| [23] |
YANG L T, LIN H, TAKAHASHI Y, et al. Proteomic analysis of grapevine stem in response to Xylella fastidiosa inoculation
[J]. Physiol Mol Plant Pathol, 2011, 75(3): 90-99. DOI:10.1016/j.pmpp.2010.11.002 (  0) 0) |
| [24] |
李奇松, 陈军, 林世圣, 等. 水稻籽粒蛋白双向电泳条件的优化及其蛋白组学方法的比较[J]. 作物学报, 2012, 38(5): 921-927. (  0) 0) |
| [25] |
VREUGDENHIL D, SERGEEVA L I. Gibberellins and tuberization in potato[J]. Potato Res, 1999, 42(3/4): 471-481. (  0) 0) |
| [26] |
MÜLLER-RÖBER B, SONNEWALD U, WILLMITZER L. Inhibition of the ADP-glucose pyrophosphorylase in transgenic potatoes leads to sugar-storing tubers and influences tuber formation and expression of tuber storage protein genes[J]. Embo J, 1992, 11(4): 1229-1238. DOI:10.1002/embj.1992.11.issue-4 (  0) 0) |
| [27] |
刘薇, 吴晶晶, 陈宏文. 米曲霉6–磷酸葡萄糖脱氢酶基因gsdA的克隆及生物信息学分析
[J]. 亚热带植物科学, 2012, 41(3): 11-15. (  0) 0) |
| [28] |
HUANG J, ZHANG H, WANG J, et al. Molecular cloning and characterization of rice 6-phosphogluconate dehydrogenase gene that is up-regulated by salt stress[J]. Mol Biol Rep, 2003, 30(4): 223-227. DOI:10.1023/A:1026392422995 (  0) 0) |
| [29] |
汤晓丽, 拟南芥两个胞质果糖–1, 6–二磷酸醛缩酶基因的新功能初探[D]. 泰安: 山东农业大学, 2013.
(  0) 0) |
| [30] |
HAAKE V, ZRENNER R, SONNEWALD U, et al. A moderate decrease of plastid aldolase activity inhibits photosynthesis, alters the levels of sugars and starch, and inhibits growth of potato plants[J]. Plant J, 1998, 14(2): 147-157. DOI:10.1046/j.1365-313X.1998.00089.x (  0) 0) |
| [31] |
王海云. 牡丹试管苗生根诱导过程中蛋白质表达变化的研究[D]. 郑州: 河南农业大学, 2010.
(  0) 0) |
| [32] |
娄沂春, 董海涛, 李德葆, 等. 水稻叶绿体ATP合成酶基因转录丰度受赤霉素诱导调节[J]. 中国水稻科学, 2001, 15(1): 17-20. DOI:10.3321/j.issn:1001-7216.2001.01.004 (  0) 0) |
| [33] |
张欣欣, 柳参奎. 水稻线粒体ATP合成酶小亚基基因的鉴定及解析[J]. 分子植物育种, 2003, 1(5): 605-612. DOI:10.3969/j.issn.1672-416X.2003.05.003 (  0) 0) |
| [34] |
YANG C C, LIN K C. Class A dioscorins of various yam species suppress ovalbumin-induced allergic reactions[J]. Immunopharmacol Immunotoxicol, 2014, 36(3): 242-249. DOI:10.3109/08923973.2014.921691 (  0) 0) |
 2018, Vol. 39
2018, Vol. 39


