2. 吉林大学 生命科学学院,吉林 长春 130012
2. College of Life Sciences, Jilin University, Changchun 130012, China
自由基是在其价轨道中具有不成对电子的分子,通常具有不稳定性和高度反应性。活性氧(Reactive oxygen species, ROS)可引发机体内脂质过氧化,使DNA链断裂,并且无差别地氧化生物膜和组织中的所有分子,从而导致机体损伤[1-2]。肝脏是受ROS影响的主要器官,当ROS过多时,机体内原始的动态平衡被打破,导致氧化应激。氧化应激被认为是导致各种肝病(如慢性病毒性肝炎,酒精性肝病和非酒精性脂肪性肝炎)发生和发展的病理机制之一[3]。与此同时,机体内酶促和非酶促抗氧化系统对于正常生理条件下细胞应答氧化应激至关重要。因此,超氧化物歧化酶 (Superoxide dismutase,SOD) 、谷胱甘肽过氧化物酶 (Glutathione peroxidase,GSH-Px)和过氧化氢酶(Catalase,CAT)等抗氧化酶以及谷胱甘肽(Glutathione,GSH)等非酶抗氧化剂均可作为评价氧化应激水平的指标[4]。一系列研究表明一些抗氧化剂在治疗患有各种肝病的患者中是有效的[5]。
虾青素(Astaxanthin,AST)是存在于海洋生物如鲑鱼、鳟鱼及甲壳类动物体中的一种类胡萝卜素。它在每个环结构上含有2个氧化基团,因此具有强抗氧化特性[6]。近年来,虾青素的生物活性越来越引人注意。研究表明,虾青素作为自由基清除剂和抗氧化剂比β−胡萝卜素和α−生育酚的活性高出几倍[7]。虾青素为脂溶性,研究发现,其被大鼠摄入后会在组织中积累,并没有毒性作用[8]。目前瑞典健康食品委员会已批准其可作为抗氧化食品添加剂,并且美国食品和药物管理局也允许其可用作饲料食用色素添加剂[9]。
脂多糖(Lipopolysaccharide,LPS)是革兰阴性细菌的外膜成分,其与白细胞分化抗原(Cluster of differentiation 14,CD14)相互作用后与Toll样受体4(Toll-like receptor-4,TLR-4)结合[10],而后通过核转录因子(Nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路激活炎症基因表达从而引发炎症反应。炎症反应包括在启动宿主脂质过氧化的各种类型细胞中自由基生成酶的激活[11],所以LPS经常用于炎症和氧化应激的试验模型中。
本试验通过建立LPS诱导的急性肝损伤模型,研究虾青素预保护对急性肝损伤的保护作用,并对其抗氧化保护作用机制进行初步探讨。为虾青素作为食品抗氧化添加剂和药物活性的开发利用以及其在肝脏疾病防治中的应用提供试验依据。
1 材料与方法 1.1 材料试验动物:选取6周龄,体质量相近的雄性ICR小鼠40只,购自长春市亿斯实验动物技术有限责任公司。小鼠饲养在12 h明暗交替循环、室温(25±1) ℃的无菌动物实验室内,适应环境1周后进行试验。所有小鼠饲喂标准小鼠日粮,在整个饲养期间保证小鼠自由摄食和饮水。
主要试剂:虾青素(雅仕达生物技术有限公司);MDA、SOD、CAT、GSH-Px检测试剂盒(南京建成生物研究所有限公司);RNA Lyzol (上海ExCell公司);cDNA逆转录试剂盒(美国Gene Copoeia公司);SYBR® Premix Ex TaqTMⅡ(日本TaKaRa);引物(上海生工生物);ELISA试剂盒(美国R&D system公司)。
主要仪器:高速冷冻离心机(德国Sigma);Thermo酶标仪(上海赛默飞世尔);荧光定量PCR仪(美国Bio-Rad);切片机(德国Leica)。
1.2 方法 1.2.1 动物处理随机将40只小鼠分为4组,分别为:对照组(CK)、AST组、LPS组和虾青素预保护组(AST+LPS组),每组10只。CK和LPS组小鼠每天灌胃橄榄油;AST组和AST+LPS组小鼠每天灌胃50 mg·kg−1虾青素,虾青素溶于橄榄油中。小鼠在第14天灌胃后禁食不禁水,12 h后LPS组和AST+LPS组小鼠按1 mg·kg−1剂量腹腔注射LPS,LPS溶于无菌生理盐水中。同时,CK和AST组腹腔注射无菌生理盐水,3 h后对各组小鼠进行血液和肝脏组织采集。记录小鼠初始体质量、末次体质量及肝脏质量,计算小鼠体质量增加和肝脏系数,肝脏系数=肝质量/体质量×100%。
1.2.2 ELISA检测采用ELISA法检测小鼠血清中髓过氧化物酶(Myeloperoxidase,MPO)含量。小鼠眼球采血,血液置于1.5 mL离心管中,室温下静置30 min以析出血清,4 ℃条件下、3 500 r·min–1离心15 min,分离血清。参照ELISA检测试剂盒说明书,检测并计算各组小鼠血清中MPO含量。每组设3个重复,并且每个样本测3个重复值。
1.2.3 丙二醛含量和氧化酶活性检测取出肝脏,用冰冻的生理盐水冲洗,滤纸吸干后称质量,取部分肝脏,剪碎后加入9倍生理盐水,在冰浴中机械匀浆成肝组织质量分数为10%的肝匀浆液,3 000 r·min–1离心15 min,取上清液,按相应的试剂盒说明操作,测定肝组织蛋白、丙二醛(Malondialdehyde, MDA)含量与SOD、GSH-Px、CAT活性。1 个酶活力单位 (U) 表示每分钟转化1 μmol底物的酶量。
1.2.4 荧光定量PCR检测抗氧化酶的mRNA表达新鲜肝脏取出后置于生理盐水中清洗,吸干水分后在液氮中速冻。根据RNA Lyzol说明书提取各个肝脏组织RNA,样品质量检测结果D260 nm/D280 nm均在1.8~2.0之间。然后按照cDNA逆转录试剂盒的步骤将RNA反转录为cDNA。最后进行荧光定量PCR,采用20 μL的反应体系,SYBR 10 μL、上下游引物各1 μL、cDNA模板2 μL、ddH2O 6 μL,PCR反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,39个循环。每次试验均设置18 S RNA作为内参。用2-ΔΔCt法计算各组小鼠肝脏组织中SOD、GSH-Px、CAT和GCLC等抗氧化酶mRNA的相对表达量,引物序列如表1所示。
|
|
表 1 荧光定量PCR引物序列 Table 1 Fluorescence quantitative PCR primer sequence |
颈椎脱臼处死小鼠,立即取新鲜肝脏右小叶,40 g·L–1多聚甲醛溶液固定,经各级乙醇脱水,二甲苯透明,石蜡包埋、切片,苏木精–伊红(HE)染色,封片后光学显微镜下观察病理改变。
1.3 数据分析应用SPSS19.0软件进行统计学分析,数据用
称量各组小鼠初始体质量,在其适应1周后,每日测量体质量并在取样时称量肝质量,计算肝脏系数。结果如表2所示,2组虾青素灌胃组与2组橄榄油灌胃组相比,添加虾青素使小鼠体质量略增加,但无显著性差异(P>0.05)。LPS组小鼠肝脏系数与对照组相比显著增加(P<0.05),而AST+LPS组与LPS组相比,肝脏系数显著降低(P<0.05)且与对照组相比无显著差异(P>0.05)。小鼠的肝脏系数是衡量肝脏性能的初步观察指标,在此,可以初步推断虾青素具有保护肝脏的作用。
|
|
表 2 不同处理下的小鼠肝脏系数与体质量1) Table 2 The liver index and body weight of mouse under different treatment |
通过ELISA方法检测小鼠血清中MPO的水平。MPO在多形核细胞的颗粒中大量表达,被广泛用作嗜中性粒细胞募集的指标[12],其在机体反应中形成强大的氧化剂次氯酸(HOCl)可加速许多慢性炎症疾病的发生[13],可通过检测MPO含量来评价氧化损伤程度[14]。如图1所示,LPS组血清中MPO含量显著高于对照组和AST+LPS组(P<0.05),提示虾青素降低了LPS诱导的急性肝损伤小鼠血清中的MPO含量,虾青素对产生氧化应激的机体有一定的保护作用。
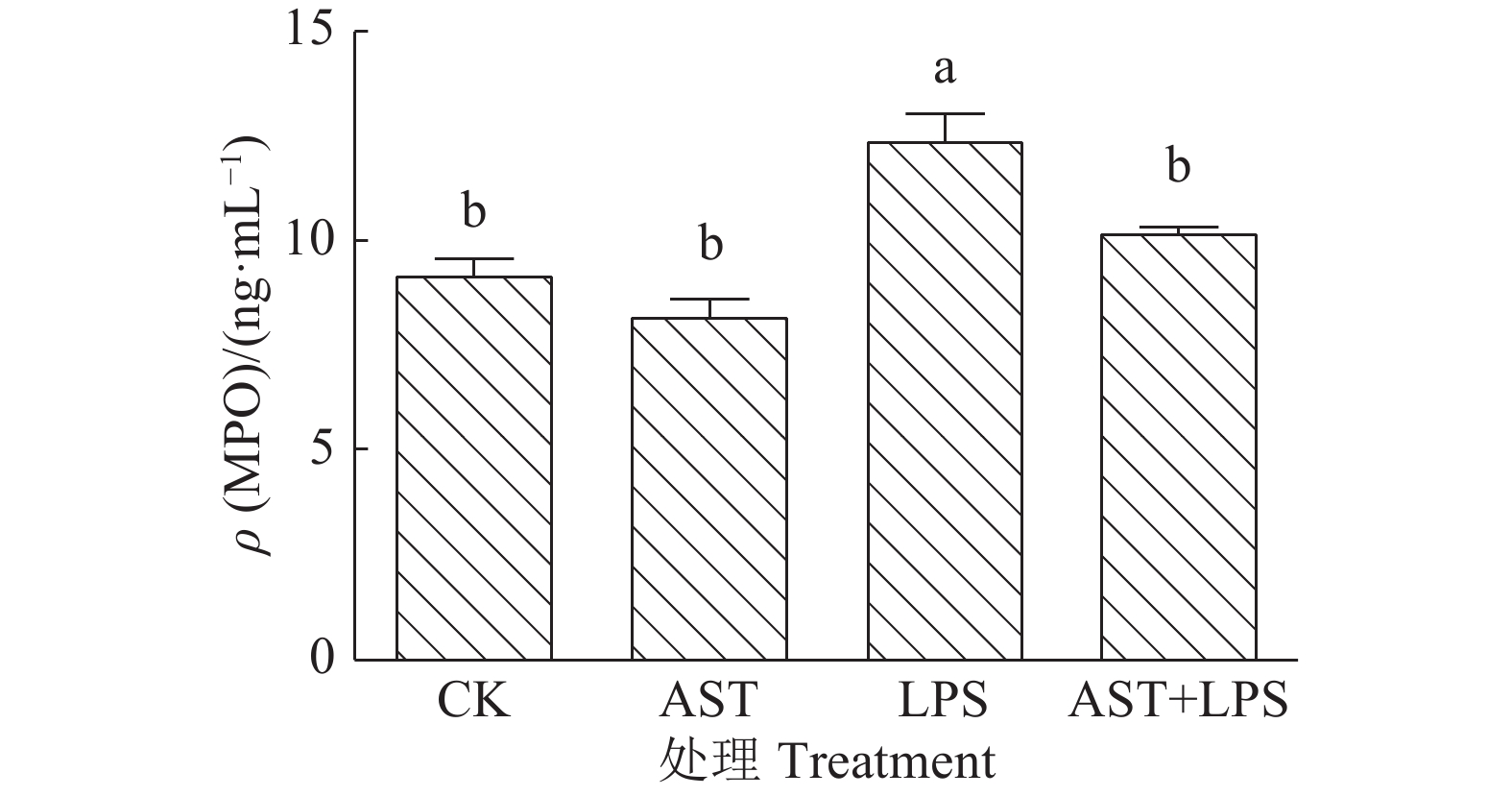
|
图 1 虾青素对小鼠血清MPO含量的影响 Fig. 1 Effect of astaxanthin on MPO content in mouse serum 柱子上方的不同小写字母表示差异显著 (P<0.05, Duncan’s 法) Different lowercase letters on the bars indicated significant difference (P<0.05, Duncan’s test) |
为验证虾青素对肝脏组织氧化损伤及抗氧化酶活性的影响,我们检测了各组小鼠肝组织中MDA含量及SOD、GSH-Px、CAT活性。结果如表3所示,LPS组小鼠与其他组相比肝组织MDA含量显著升高(P<0.05),SOD、GSH-PX、CAT活性显著降低(P<0.05)。AST+LPS组小鼠各项指标和对照组差异不显著(P>0.05)。提示LPS组小鼠肝脏的抗氧化水平显著降低,氧化损伤明显,而虾青素预保护能明显增强小鼠肝脏抗氧化能力,缓解LPS导致的自由基积累现象以及肝脏氧化损伤。
|
|
表 3 虾青素对小鼠肝组织氧化水平的影响1) Table 3 Effect of astaxanthin on oxidation level in mouse liver |
从mRNA水平上进一步分析了虾青素对LPS诱导的小鼠肝脏组织氧化应激抗氧化酶的影响,如图2所示,LPS组SOD、GSH-px、CAT、GCLC的mRNA相对表达量与空白组相比均极显著降低(P<0.01),而AST+LPS组的mRNA相对表达量与LPS组相比均显著升高(P<0.05)。由此看来虾青素能够通过提升抗氧化酶mRNA的表达量来抑制小鼠肝脏组织产生氧化应激进而保护肝脏不受损伤。
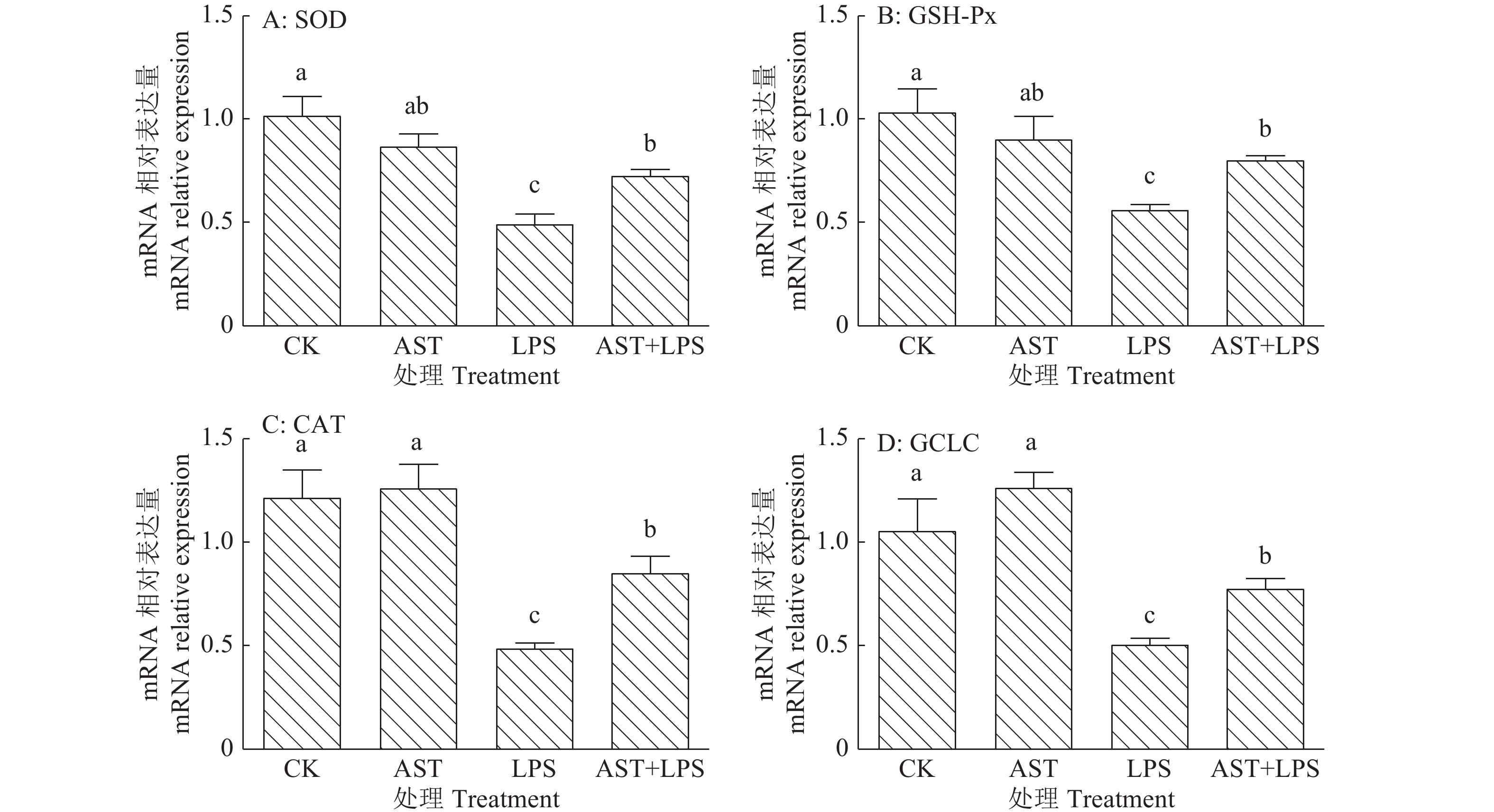
|
图 2 虾青素对小鼠肝脏组织抗氧化酶mRNA表达的影响 Fig. 2 Effect of astaxanthin on mRNA expression of antioxidase in mouse liver 各图中柱子上方的不同小写字母表示差异显著(P<0.05, Duncan’s 法) In each figure, different lowercase letters on the bars indicated significant difference (P<0.05, Duncan’s test) |
显微镜下观察各组小鼠肝脏氧化应激损伤程度。对照组(图3A)与虾青素组(图3B)小鼠肝脏颜色红润,有光泽且富于弹性,肝细胞胞质丰富,细胞核结构清楚,细胞排列整齐,肝小叶结构完整,肝板结构呈清晰条索状,中央静脉及门管区正常。LPS组(图3C)可见出现肝细胞核固缩,体积缩小、深染,出现弥漫性空泡,胞浆疏松,肝小叶结构异常,分界欠清晰,肝细胞索结构杂乱,几乎观察不到正常的肝板、肝窦,有较多炎性细胞浸润,说明肝损伤造模成功。虾青素预保护组(图3D)肝细胞胞浆、细胞核结构及染色正常,肝小叶结构完整,肝索排列较整齐,仅见局灶性肝小叶周边肝板欠完整,间质炎性细胞浸润程度轻微。部分肝细胞仅见轻度的病理改变,病理损伤明显减轻。
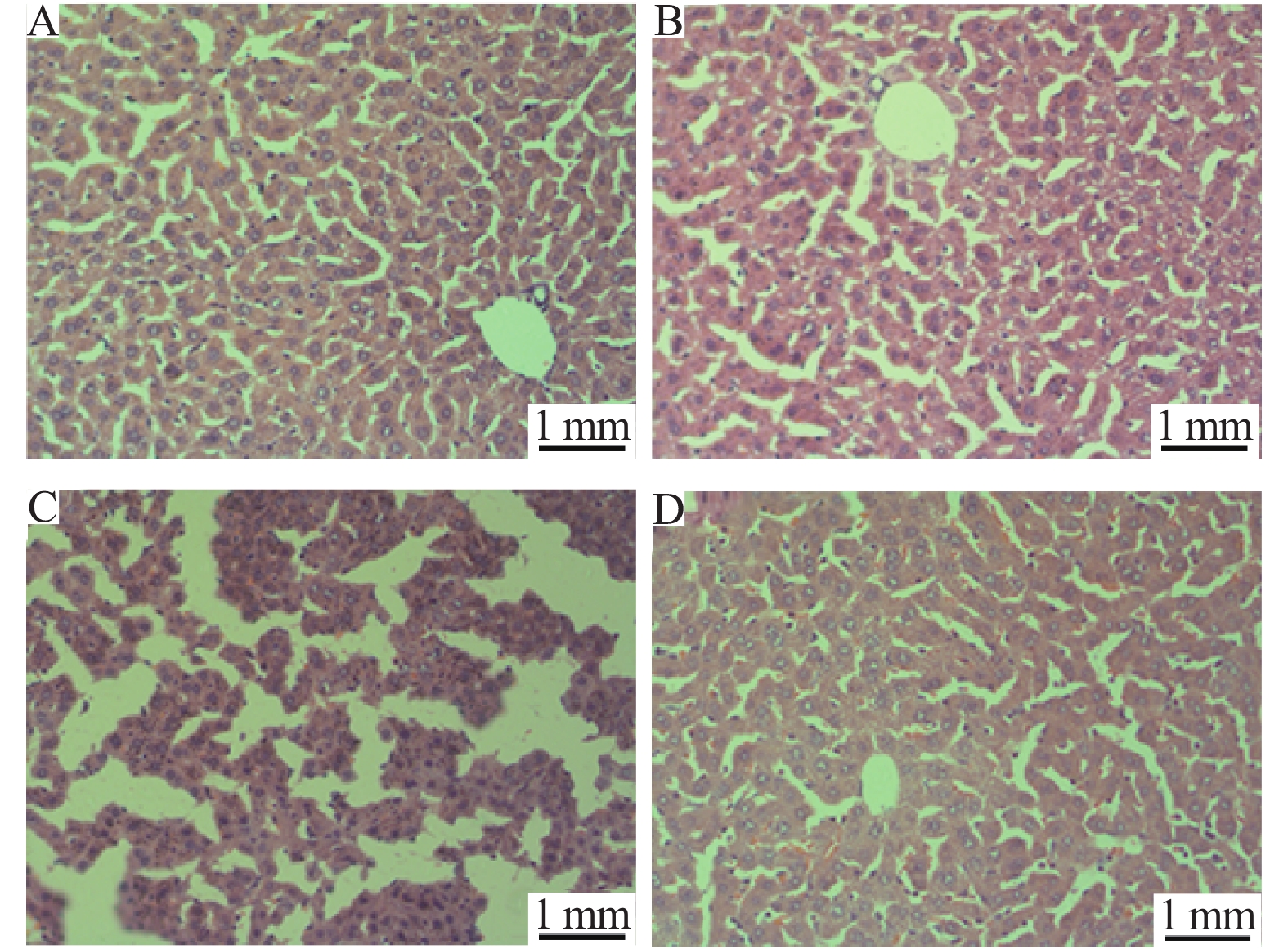
|
图 3 显微观察不同处理组小鼠肝脏组织HE染色结果 Fig. 3 Microscopic examination of HE stained sections of mouse liver from different treatment groups A:CK;B:AST;C:LPS;D:AST+LPS |
氧化应激在特定的生理条件下是有益的,例如它可以在适当的体育锻炼和缺血时增加生物防御机制,并通过诱导细胞凋亡以制备分娩产道[15]。然而,这仅限于特定情况,在大多数情况下,大量的ROS和氧化应激将通过坏死和凋亡机制诱导细胞死亡,导致细胞和组织损伤。肝脏最易受到氧化应激带来的损伤,并且就药物毒性而言,它是最常见的靶器官,已经发现许多药物,如抗炎、抗镇痛、抗癌和抗抑郁药物可以诱导肝脏氧化应激,导致脂质过氧化产生以及肝脏中抗氧化剂的消耗[1]。Nrf2是细胞氧化还原平衡的主要调节因子,在正常生理条件下Nrf2与Keap1蛋白结合,其活性被抑制,当机体处于氧化应激状态时,Nrf2与Keap1解离后被激活并易位至细胞核,与抗氧化反应元件相互作用,促进细胞保护性靶基因(如抗氧化酶)的表达[16-17]。
机体通过抗氧化酶,如SOD、GSH-Px和CAT以及非酶抗氧化剂,如维生素E,β−胡萝卜素,抗坏血酸和GSH来调节机体氧化还原水平,使其稳定在平衡状态[18]。在平衡被打破后,一些与自由基代谢有关的抗氧化酶和保护细胞免受氧化应激的抗氧化剂,例如CAT、SOD、GSH-Px和GSH通常被耗尽。GSH的生物合成通过γ−谷氨酰半胱氨酸合成酶(γ-glutamylcysteinesynthetase,γ-GCS)进行,增加γ-GCS的转录和表达可以增加GSH的合成。而γ-GCS是由其催化亚基(GCLC)和修饰子亚基(GCLM)组成的异二聚体酶[19]。同时,MDA是过量ROS诱导的脂质过氧化产物,广泛用作氧化应激发生的标志物[20]。本研究表明,虾青素显著降低LPS诱导的小鼠急性肝损伤组织中MDA和血清中MPO的含量,并显著提高肝组织中抗氧化酶SOD、CAT、GSH-Px的活性。通过检测mRNA水平进一步验证虾青素可上调组织中抗氧化酶SOD、CAT、GSH-Px、GCLC mRNA的表达。通过HE染色从病理形态学角度展示了虾青素对肝脏氧化损伤的保护,进而说明了虾青素预保护在缓解小鼠急性肝损伤中的积极作用。
自由基、炎症和免疫反应之间存在复杂的联系。研究表明,虾青素可通过抑制脓毒症大鼠模型中的炎症而显著缓解多器官损伤[21]。另有研究提出,免疫细胞对氧化应激特别敏感,通常会产生更多的氧化产物。Park等[7]研究表明虾青素可以下调DNA氧化损伤的生物标志物,减轻炎症并增强免疫反应。总之,虾青素的免疫调节、抗氧化和抗炎活性可能会影响癌症和炎性疾病。尽管虾青素在抗炎、抗氧化等方面具有积极作用,但它在保护组织损伤中的确切作用机制仍需进一步探究。同时,目前并无试验报道虾青素具有毒副作用。这些都提示虾青素是一种潜在的保护机体氧化损伤的保健品或食品添加剂,并为替换非甾体抗炎药开辟一条新的途径。但本研究仅基于动物试验,需要进一步临床研究来评估其是否适用于急性肝损伤的临床治疗。
综上,本研究表明虾青素预保护可降低LPS诱导的急性肝损伤小鼠的肝脏系数、血清MPO水平和肝组织中MDA的含量,提高肝组织中抗氧化酶mRNA表达,减轻肝组织病理损伤程度。潜在的机制与其抑制脂质过氧化反应、增强肝脏抗氧化能力、修复细胞质膜、抗炎活性等密切相关。
| [1] |
LI S, TAN H Y, WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. Int J Mol Sci, 2015, 16(11): 26087-26124. DOI:10.3390/ijms161125942 (  0) 0) |
| [2] |
冉茂良, 高环, 尹杰. 氧化应激与DNA损伤[J]. 动物营养学报, 2013, 25(10): 2238-2245. DOI:10.3969/j.issn.1006-267x.2013.10.007 (  0) 0) |
| [3] |
SINGAL A K, JAMPANA S C, WEINMAN S A. Antioxidants as therapeutic agents for liver disease[J]. LiverInt, 2011, 31(10): 1432-1448. (  0) 0) |
| [4] |
DEY A, LAKSHMANAN J. The role of antioxidants and other agents in alleviating hyperglycemia mediated oxidative stress and injury in liver[J]. Food Funct, 2013, 4(8): 1148-1184. DOI:10.1039/c3fo30317a (  0) 0) |
| [5] |
ESREFOGLU M. Oxidative stress and benefits of antioxidant agents in acute and chronic hepatitis[J]. Hepat Mon, 2012, 12(3): 160-167. DOI:10.5812/hepatmon (  0) 0) |
| [6] |
FASSETT R G, COOMBES J S. Astaxanthin: A potential therapeutic agent in cardiovascular disease[J]. Mar Drugs, 2011, 9(3): 447-465. DOI:10.3390/md9030447 (  0) 0) |
| [7] |
PARK J S, CHYUN J H, KIM Y K, et al. Astaxanthin decreased oxidative stress and inflammation and enhanced immune response in humans[J]. Nutr Metab, 2010, 7: 18. doi: 10.1186/1743-7075-7-18.
(  0) 0) |
| [8] |
STEWART J S, LIGNELLÅ, PETTERSSON A, et al. Safety assessment of astaxanthin-rich microalgae biomass: Acute and subchronic toxicity studies in rats[J]. Food Chem Toxicol, 2008, 46(9): 3030-3036. DOI:10.1016/j.fct.2008.05.038 (  0) 0) |
| [9] |
RAO A R, BASKARAN V, SARADA R, et al. In vivo bioavailability and antioxidant activity of carotenoids from microalgal biomass: A repeated dose study
[J]. Food Res Int, 2013, 54(1): 711-717. DOI:10.1016/j.foodres.2013.07.067 (  0) 0) |
| [10] |
ADEREM A, ULEVITCH R J. Toll-like receptors in the induction of the innate immune response[J]. Nature, 2000, 406(6797): 782-787. DOI:10.1038/35021228 (  0) 0) |
| [11] |
REUTER S, GUPTA S C, CHATURVEDI M M, et al. Oxidative stress, inflammation, and cancer: How are they linked?[J]. Free Radical Bio Med, 2010, 49(11): 1603-1616. DOI:10.1016/j.freeradbiomed.2010.09.006 (  0) 0) |
| [12] |
KANCZKOWSKI W, CHATZIGEORGIOU A, SAMUS M, et al. Characterization of the LPS-induced inflammation of the adrenal gland in mice[J]. Mol Cell Endocrinol, 2013, 371(1/2): 228-235. (  0) 0) |
| [13] |
LOVE D, BARRETT T, HAWKINS C. Role of the myeloperoxidase oxidant hypothiocyanous acid (HOSCN) in the adaption of cells to oxidative stress during inflammation[J]. Free Radical Bio Med, 2017, 108: S30. doi:10.1016/j.freeradbiomed.2017.04.123.
(  0) 0) |
| [14] |
FRIJHOFF J, WINYARD P G, ZARKOVIC N, et al. Clinical relevance of biomarkers of oxidative stress[J]. Antioxid Redox Signal, 2015, 23(14): 1144-1170. DOI:10.1089/ars.2015.6317 (  0) 0) |
| [15] |
MCCORD J M. The evolution of free radicals and oxidative stress[J]. Am J Med, 2000, 108(8): 652-659. DOI:10.1016/S0002-9343(00)00412-5 (  0) 0) |
| [16] |
KLAASSEN C D, REISMAN S A. Nrf2 the rescue: Effects of the antioxidative/electrophilic response on the liver[J]. Toxicol Appl Pharmacol, 2010, 244(1): 57-65. DOI:10.1016/j.taap.2010.01.013 (  0) 0) |
| [17] |
高婷, 王子旭, 陈祝茗. ROS介导的氧化应激与自噬[J]. 中国畜牧兽医, 2018, 45(3): 656-662. (  0) 0) |
| [18] |
CICHOŻ-LACH H, MICHALAK A. Oxidative stress as a crucial factor in liver diseases[J]. World J Gastroenterol, 2014, 20(25): 8082-8091. DOI:10.3748/wjg.v20.i25.8082 (  0) 0) |
| [19] |
DALTON T P, DIETER M Z, YANG Y, et al. Knockout of the mouse glutamate cysteine ligase catalytic subunit (Gclc) gene: Embryonic lethal when homozygous, and proposed model for moderate glutathione deficiency when heterozygous
[J]. Biochem Biophys Res Commun, 2000, 279(2): 324-329. DOI:10.1006/bbrc.2000.3930 (  0) 0) |
| [20] |
URSO M L, CLARKSON P M. Oxidative stress, exercise, and antioxidant supplementation[J]. Toxicology, 2003, 189(1/2): 41-54. (  0) 0) |
| [21] |
ZHOU L, GAO M, XIAO Z, et al. Protective effect of astaxanthin against multiple organ injury in a rat model of sepsis[J]. J Surg Res, 2015, 195(2): 559-567. DOI:10.1016/j.jss.2015.02.026 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


