近年来,养鹅业蓬勃发展,但由于鹅饲料的短缺,一些养殖户为追求肉鹅快速增长,用蛋白质含量较高的鸡、鸭饲料代替鹅饲料,经常引发雏鹅痛风[1]。禽痛风的致病原因较为复杂,达20多种[2],如饲料中含高蛋白质[3]、高钙,维生素A缺乏[4],饮水不足,环境中空气污浊,霉菌毒素中毒,磺胺类药物中毒[5]以及感染能够损害肾脏的疾病(传染性法氏囊病、传染性肾炎、鸡白痢、球虫病等)[6-7]。临床上最常见的是饲喂鸡饲料和鸭饲料引起的鹅痛风。美国全国科学研究委员会(1994)建议0~4周龄鹅的粗蛋白需求量为15%,前苏联畜牧科学研究所(1985)建议0~3周龄鹅对蛋白的需求量为17%,而鸡、鸭饲料中蛋白质质量分数为22%~23%,超出鹅的营养需求,过量的蛋白质在体内代谢生成黄嘌呤,黄嘌呤在黄嘌呤氧化酶的作用下转化成尿酸,血液中蓄积过多尿酸不能迅速排出体外,则会引起高尿酸盐血症[8],进而引发痛风。鸡、鸭饲料引起鹅痛风的临床病例有不少报道,关于其致病机理的研究较少。因此,本研究从鹅生长性能、肝肾功能、组织病理学变化和致炎因子等方面,初步探讨高蛋白饲料引发鹅痛风的机理。
1 材料与方法 1.1 试验饲粮与试验设计基础饲粮参照鹅的营养需要[9]制备,风干后饲粮营养组成及含量见表1。
|
|
表 1 试验饲粮营养组成与含量1) Table 1 Nutrient compositions and levels of experimental diets |
试验选用体质量相近的1日龄雏雁鹅72只,随机分成A、B和C组,每组3个重复,每个重复8只鹅。A组饲喂粗蛋白质量分数为16%的基础饲粮,B组饲喂粗蛋白质质量分数为20%的饲粮,C组饲喂粗蛋白质质量分数为24%的饲粮,试验期为14 d。
1.2 饲养管理试验在安徽农业大学动物科技学院动物房进行。各组间试验鹅分笼饲养,试验期间分别于每天08:00、14:00和21:00喂料,试验鹅自由采食,自由饮水。消毒、卫生防疫和日常管理按照规模化养禽场常规饲养方法进行。每日观察并记录每组雏鹅的精神状态、采食情况和排便情况等。
1.3 样品采集与处理于试验开始第1天早晨,逐只称量试验鹅的体质量,同时以笼为单位每天准确记录投料量、剩料量和耗料量,计算各组间体质量变化、所耗饲料量与体质量增加之比。试验第14天,每组随机选取10只试验鹅,空腹8 h后颈静脉采血3 mL,室温倾斜静置30 min,3 000 r·min–1离心15 min后分离血清,检测生化指标。试验第1、7和14天,按组别逐只称量体质量。取新鲜肝脏、肾脏组织,分成3部分。一部分测炎症因子;一部分固定于体积分数为10%的福尔马林溶液中,24 h后经冲水、梯度乙醇脱水、二甲苯透明、石蜡包埋等处理后,以5 μm的厚度切片,常规苏木精–伊红(HE)染色,普通显微镜下观察并拍照;另一部分取1 cm3肝脏、肾脏组织若干块,固定到体积分数为2.5%的戊二醛溶液中,经脱水、包埋、切片和电子染色(铅、铀染色)等处理后,用日产JEM-1230型透射电镜观察并拍照。
1.4 指标测定 1.4.1 血清生化指标水平测定检测各组鹅血清中尿酸、白蛋白、球蛋白、总蛋白、尿素氮、总胆红素的含量以及碱性磷酸酶、乳酸脱氢酶、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、γ−谷氨酰转移酶活性,37 ℃条件下,每分钟释放1 mmol产物所需的酶量定义为1个酶活力单位(U)。采用迈瑞BS-220全自动生化分析仪测定,试剂盒由深圳迈瑞生物医疗电子股份有限公司提供,试验严格按照试剂盒的说明书步骤操作。
1.4.2 肝脏、肾脏组织中细胞因子含量及黄嘌呤氧化酶活性测定肝脏、肾脏组织中的白细胞介素–1β (Interleukin-1β, IL-β)、白细胞介素–6 (Interleukin-6, IL-6)、白细胞介素–8 (Inderleukin-8, IL-8)、肿瘤坏死因子–α (Tumor necrosis factor-α, TNF-α)、肿瘤坏死因子–β (Tumor necrosis factor-β, TNF-β)含量和黄嘌呤氧化酶的活性。采用酶联免疫吸附(ELISA)试剂盒,使用MK3型半自动酶联免疫分析仪(Thermo,美国)测定,试剂盒由上海源叶生物科技有限公司提供,试验严格按照试剂盒的说明书步骤操作。以37 ℃条件下,每分钟内催化1 μmol底物转化为产物所需的酶量为1个黄嘌呤氧化酶活力单位(U)。
1.5 数据处理原始数据用Excel 2010初步整理,采用SPSS 19.0软件进行单因素方差分析和Duncan’s多重比较,试验数据用平均值±标准差表示。
2 结果与分析 2.1 试验鹅临床症状试验第7天,C组部分鹅开始出现精神沉郁,食欲不佳和排便较稀的现象。试验第11天,C组鹅开始陆续死亡,剖检可见内脏覆盖了一层白膜,肾脏肿胀,输尿管有尿酸盐沉积等痛风症状。A组和B组鹅正常,没有出现类似C组的临床症状。
2.2 试验鹅生长性能由表2可知,试验第1天,各组鹅体质量没有差异;试验第7和第14天,C组鹅体质量显著低于A、B组(P<0.05)。试验第1~7天,A组料重比为2.29%,B组为2.83%,C组为3.20%;试验第8~14天,A组料重比为1.79%,B组为2.37%,C组为3.32%。
|
|
表 2 不同试验组鹅体重与料重比变化 Table 2 Changes in the body weight and feed weight ratio of goose in different experimental group |
由表3可知,C组鹅丙氨酸氨基转移酶和乳酸脱氢酶活性、尿酸和尿素氮含量显著高于A、B组(P<0.05)。与A组相比,B、C组鹅的总胆红素含量显著降低(P<0.05)。各组间天冬氨酸氨基转移酶和γ−谷氨酰转移酶活性随饲粮中粗蛋白水平的增加而增加,但差异不显著(P>0.05)。各组间碱性磷酸酶活性及白蛋白、球蛋白和总蛋白含量无显著变化(P>0.05)。
|
|
表 3 14日龄雏鹅血清生化指标1) Table 3 Serum biochemical indicators of 14-day-old goslings |
显微镜观察发现,A组鹅的肝脏(图1a)和肾脏(图1e)组织正常;B组鹅的肝脏组织有轻微炎性细胞(图1b),肾脏组织正常(图1f);C组鹅的肝脏组织出现水肿(图1c)、坏死和炎性细胞浸润(图1d),肾脏组织出现肾小球萎缩(图1g)和肾小管空泡变性(图1h)。
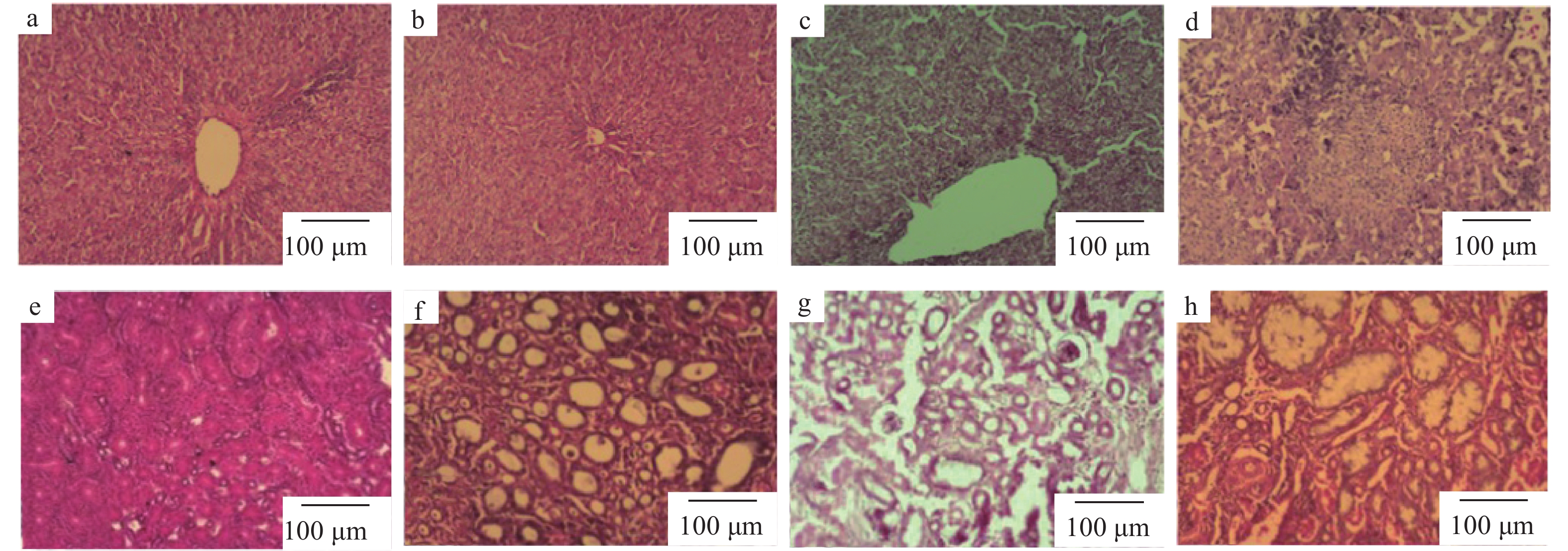
|
图 1 鹅肝脏和肾脏HE染色后的显微照片 Fig. 1 Microscopic pictures of goose liver and kidney after HE staining a、e分别为A组鹅的肝脏和肾脏组织结构;b、f分别为B组鹅的肝脏和肾脏组织结构;c、d均为C组鹅的肝脏组织结构;g、h均为C组鹅的肾脏组织结构 a and e were liver and kidney tissue structures in geese of group A, respectively; b and f were liver and kidney tissue structures in geese of group B, respectively; c and d were liver tissue structures in geese of group C; g and h were kidney tissue structures in geese of group C |
A组鹅的肝脏(图2a)和肾脏(图2d)细胞结构正常,线粒体结构完整,糖原含量丰富。B组鹅的肝脏细胞线粒体开始出现肿胀,糖原含量相对减少(图2b),肾小管上皮细胞线粒体脊断裂,线粒体出现肿胀(图2e)。C组鹅的肝脏细胞线粒体空泡变性,糖原含量明显减少(图2c),肾小管上皮细胞线粒体空泡变性,内质网肿胀(图2f)。

|
图 2 鹅肝脏、肾脏透射电镜图片 Fig. 2 Transmission electron microscope pictures of goose liver and kidney a、b和c分别为A、B和C组肝脏细胞结构;d、e和f分别为A、B和C组肾小管上皮细胞结构 a, b and c were liver cell structures in group A, B and C, respectively; d, e and f were renal tubular epithelial cell structures in group A, B and C, respectively |
由表4可知,C组肝脏组织中的IL-1β、IL-8含量和黄嘌呤氧化酶活性显著高于A、B组(P<0.05),随饲粮粗蛋白水平的增加,IL-6、TNF-α和TNF-β的含量呈上升趋势,但组间差异不显著(P>0.05)。
|
|
表 4 不同试验组鹅肝脏中炎症因子水平1) Table 4 The inflammatory cytokine level of goose liver in different experimental group |
由表5可知,C组鹅的肾脏组织中TNF-α含量显著高于A、B组(P<0.05),各试验组鹅的IL-6和TNF-β含量及黄嘌呤氧化酶活性随饲粮粗蛋白水平的增加而增加,但组间差异不显著(P>0.05)。A、B、C组鹅肾脏组织中IL-1β和IL-8的含量无规律性变化。
|
|
表 5 不同试验组鹅肾脏中炎症因子水平1) Table 5 The inflammatory cytokines level of goose kidney in different experimental group |
本研究各试验组间鹅的采食量差别不大,但随着饲粮中粗蛋白水平的增加,鹅的体质量反而减小。我国各地区鹅的饲养标准不统一[9],本试验得出粗蛋白质质量分数为16%的饲粮更适合雏鹅的生长发育,粗蛋白质含量过高不但不能促进雏鹅快速生长,反而会降低其生长性能。
3.2 饲粮粗蛋白水平对鹅血清生化指标的影响在动物体内,丙氨酸氨基转移酶、天冬氨酸氨基转移酶和乳酸脱氢酶等主要存在于肝脏细胞的线粒体内,在外周血液中的活性很低,当自由基破坏肝脏细胞膜的组成成分脂质时,脂质发生过氧化,细胞膜的完整性就会遭到破坏,大量丙氨酸氨基转移酶、天冬氨酸氨基转移酶和乳酸脱氢酶流入血液中,造成外周血中丙氨酸氨基转移酶、天冬氨酸氨基转移酶和乳酸脱氢酶活性明显增高。丙氨酸氨基转移酶、天冬氨酸氨基转移酶和乳酸脱氢酶活性是反映肝细胞受损程度比较灵敏的检测指标[10-11],C组鹅丙氨酸氨基转移酶、乳酸脱氢酶、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、碱性磷酸酶和谷氨酰转移酶活性高于A、B组,说明C组鹅肝功能开始出现异常。尿酸和尿素氮含量是反映肾功能的重要指标,当肾脏受损时,这些指标将发生变化,C组鹅尿酸和尿素氮含量显著高于A、B组,说明C组鹅的肾脏开始出现一定程度的损伤。这可能是由于C组鹅摄取过多的蛋白质,加重肝脏与肾脏的代谢负担,导致肝、肾代谢出现障碍和肝脏与肾脏组织损伤。
3.3 饲粮粗蛋白水平对鹅肝脏、肾脏组织的影响禽类缺乏精氨酸酶,不能像家畜那样把蛋白质代谢产生的氨通过鸟氨酸循环转变为尿素随尿液排出,而只能在体内合成嘌呤(主要在肝脏内合成),然后再转变为尿酸经过肾脏从尿液中排出[12]。在体内代谢过程中过量的蛋白质会产生大量尿酸盐,当尿酸含量超过肾脏能够排出的最大限度时,会导致肾功能衰退[13]。本试验C组鹅的肝脏细胞出现炎性浸润、水肿,细胞结构发生变化,肾脏出现肾小管空泡变性和肾小球萎缩,说明肝脏和肾脏已经出现病变,A组鹅的肝脏、肾脏组织完整,B组鹅的肝脏细胞有轻微的炎性浸润,可见雏鹅饲粮中粗蛋白质质量分数不宜超过20%。
3.4 饲粮粗蛋白水平对鹅肝脏、肾脏组织中细胞因子水平和黄嘌呤氧化酶活性的影响IL-1β参与全身或局部炎症的急性发作,也参与心肌梗塞或中风,痛风患者体内IL-1β含量会显著升高[14];IL-6是一种多功能的细胞因子,其调节免疫应答、造血、急性期反应和炎症等反应[15];IL-8也是一种公知的循环炎性细胞因子[16],巨噬细胞、上皮细胞,气管平滑肌细胞和内皮细胞等产生IL-8;黄嘌呤氧化酶是尿酸生成过程中一种重要的酶,当血清中尿酸含量增加时,黄嘌呤氧化酶活性也相应增加[17];TNF-α、TNF-β也是参与炎症反应的细胞因子[18]。本研究发现,C组鹅肝脏组织中的IL-1β和IL-8含量及黄嘌呤氧化酶活性显著高于A、B组,随着粗蛋白水平的增加,TNF-α、TNF-β、IL-6的含量呈上升趋势。C组肾脏中TNF-α含量显著高于A、B组,IL-6和TNF-β含量及黄嘌呤氧化酶活性随粗蛋白水平的增加而增加,A组和B组肾脏中IL-1β和IL-8的含量基本相同,均显著低于C组。试验进一步证明饲粮中粗蛋白质质量分数为24%时,肝脏、肾脏内出现炎症反应。与A组相比,C组鹅的黄嘌呤氧化酶活性显著升高,此时血清尿酸水平也显著升高,这可能是高蛋白质饲粮引发鹅痛风的关键性因素。
3.5 结论饲粮中粗蛋白质质量分数为16%时,雏鹅生长性能较好,各项生化指标正常;饲粮中粗蛋白质质量分数为24%时,雏鹅血清尿酸等生化指标发生明显变化,开始出现痛风症状,生长性能下降,鹅肝、肾组织出现炎症反应,功能出现异常。
| [1] |
许英民, 杨成勇. 肉仔鹅饲喂肉鸡料引发痛风病的报告[J]. 中国禽业导刊, 2006, 23(11): 25. (  0) 0) |
| [2] |
李涌. 家禽发生痛风病因和防治[J]. 农业开发与装备, 2017(5): 187. DOI:10.3969/j.issn.1673-9205.2017.05.160 (  0) 0) |
| [3] |
SINGH N, GHOSH R C. Pathology of gout induced by high protein diets in growing broilers[J]. Asian J Animal Sci, 2014, 9(2): 149-153. DOI:10.15740/HAS/TAJAS (  0) 0) |
| [4] |
费强. 一起笼养蛋鸡痛风病的诊治[J]. 家禽科学, 2015(9): 31-32. DOI:10.3969/j.issn.1673-1085.2015.09.010 (  0) 0) |
| [5] |
王铁良, 李永久, 马有为. 雏鸡痛风的原因及防治[J]. 中国畜牧兽医, 2010, 37(4): 229-231. (  0) 0) |
| [6] |
陈鲜鑫, 刘震坤. 浅析禽痛风的发病原因及防治方法[J]. 兽医导刊, 2017(6): 116. (  0) 0) |
| [7] |
常斌, 王润莲, 庞华琦, 等. 肉鹅营养需要研究进展[J]. 饲料工业, 2008, 29(13): 26-28. DOI:10.3969/j.issn.1001-991X.2008.13.008 (  0) 0) |
| [8] |
贺普霄. 家畜营养代谢病[M]. 北京: 中国农业出版社, 1994: 40-41.
(  0) 0) |
| [9] |
刘五岳. 鹅的饲养标准[J]. 畜禽业, 2003(10): 11. DOI:10.3969/j.issn.1008-0414.2003.10.004 (  0) 0) |
| [10] |
VAN BEEK J H, DE MOOR M H, DE GEUS E J, et al. The genetic architecture of liver enzyme levels: GGT, ALT and AST[J]. Behav Genet, 2013, 43(4): 329-339. DOI:10.1007/s10519-013-9593-y (  0) 0) |
| [11] |
HÜGLE T, KRENN V. Histopathophysiology of gout[J]. Ther Umsch, 2016, 73(3): 137-140. DOI:10.1024/0040-5930/a000769 (  0) 0) |
| [12] |
NASOORI A, PEDRAM B, KAMYABIMOGHADDAM Z, et al. Clinicopathologic characterization of visceral gout of various internal organs - a study of 2 cases from a venom and toxin research center[J]. Diagn Pathol, 2015, 10(1): 23. DOI:10.1186/s13000-015-0251-y (  0) 0) |
| [13] |
周伟, 谭云, 王小波. 鸡痛风的组织病理学观察[J]. 中国兽医杂志, 2017, 53(4): 42-44. (  0) 0) |
| [14] |
MARTINON F, PÉTRILLI V, MAYOR A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature, 2006, 440(7081): 237-241. DOI:10.1038/nature04516 (  0) 0) |
| [15] |
YEN D, CHEUNG J, SCHEERENS H, et al. IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6[J]. J Clin Invest, 2006, 116(5): 1310-1316. DOI:10.1172/JCI21404 (  0) 0) |
| [16] |
UELAND T, GULLESTAD L, NYMO S H, et al. Inflammatory cytokines as biomarkers in heart failure[J]. Clin Chim Acta, 2015, 443: 71-77. DOI:10.1016/j.cca.2014.09.001 (  0) 0) |
| [17] |
郭小权, 曹华斌, 黄克和, 等. 高钙日粮对青年蛋鸡肾脏中XOD基因mRNA表达的影响
[J]. 中国兽医学报, 2011, 31(11): 1663-1666. (  0) 0) |
| [18] |
黄继勇, 张艳. 痛风患者外周血中炎症因子IL-18, IL-1β, TNF-α的变化[J]. 中华全科医学, 2017, 15(9): 1487-1489. (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


