鸽Columba livia作为人类较早驯化的鸟类之一,在世界各地被广泛饲养。近年来,随着我国养鸽业的发展,鸽在我国已经成为继鸡、鸭、鹅之后第4大家禽[1]。截止到2013年底,我国年出栏乳鸽已经达到5亿多只,存栏种鸽约4 000万对[2]。除肉用外,鸽还具有观赏、竞翔以及用于建立疾病模型[3]、环境监测[4]以及运动生理动物模型等用途[5]。
骨骼肌卫星细胞是位于肌细胞膜和基膜之间的具有增殖和分化潜力的生肌干细胞,对于出生后骨骼肌的生长、再生修复和维持具有重要意义。1961年,Mauro[6]首次发现并分离出骨骼肌卫星细胞。骨骼肌卫星细胞在成年动物体内一般为静息状态,而在动物发育过程中肌肉组织生长以及受到运动创伤时骨骼肌卫星细胞则呈现激活状态;此时,骨骼肌卫星细胞两极形成细胞质突起,有丝分裂活动增强,质核比率升高和细胞内细胞器增多[7]。活化后,卫星细胞的分裂遵循干细胞的分裂模式,其中一类将作为细胞分裂源而保持原来的状态,而另一类则会进一步分化成为成熟的肌纤维。
目前已经有大量研究报道了人[8]、鼠[9]、牛[10]、羊[11]、鸡[12]、鸭[13]等物种的骨骼肌卫星细胞的分离和培养。而鸽骨骼肌卫星细胞的分离培养鲜见报道。与此同时,鸽肌肉发育机制的研究对于肉鸽及赛鸽的品种选育具有重要的指导意义。因此,本研究拟分离培养白羽王鸽骨骼肌卫星细胞,以期为今后研究鸽骨骼肌生长和发育调控机制提供细胞研究平台。
1 材料与方法 1.1 材料和试剂试验材料:16日龄白羽王鸽鸽胚,由四川省成都市大邑长青鸽舍提供。
主要试剂:DMEM高糖培养基购自Hyclone公司;胎牛血清(Fetal bovine serum, FBS)购自Natocor公司;青霉素、链霉素购自索莱宝公司;胶原蛋白酶IV型购自Sigma公司;CCK-8试剂盒购自碧云天生物技术研究所;RT-qPCR试剂盒及试剂购自TaKaRa公司;MyHC抗体(小鼠单克隆抗体)、FITC标记的山羊抗小鼠二抗购自Abcam公司;其他试剂均购自成都万科实业有限公司。
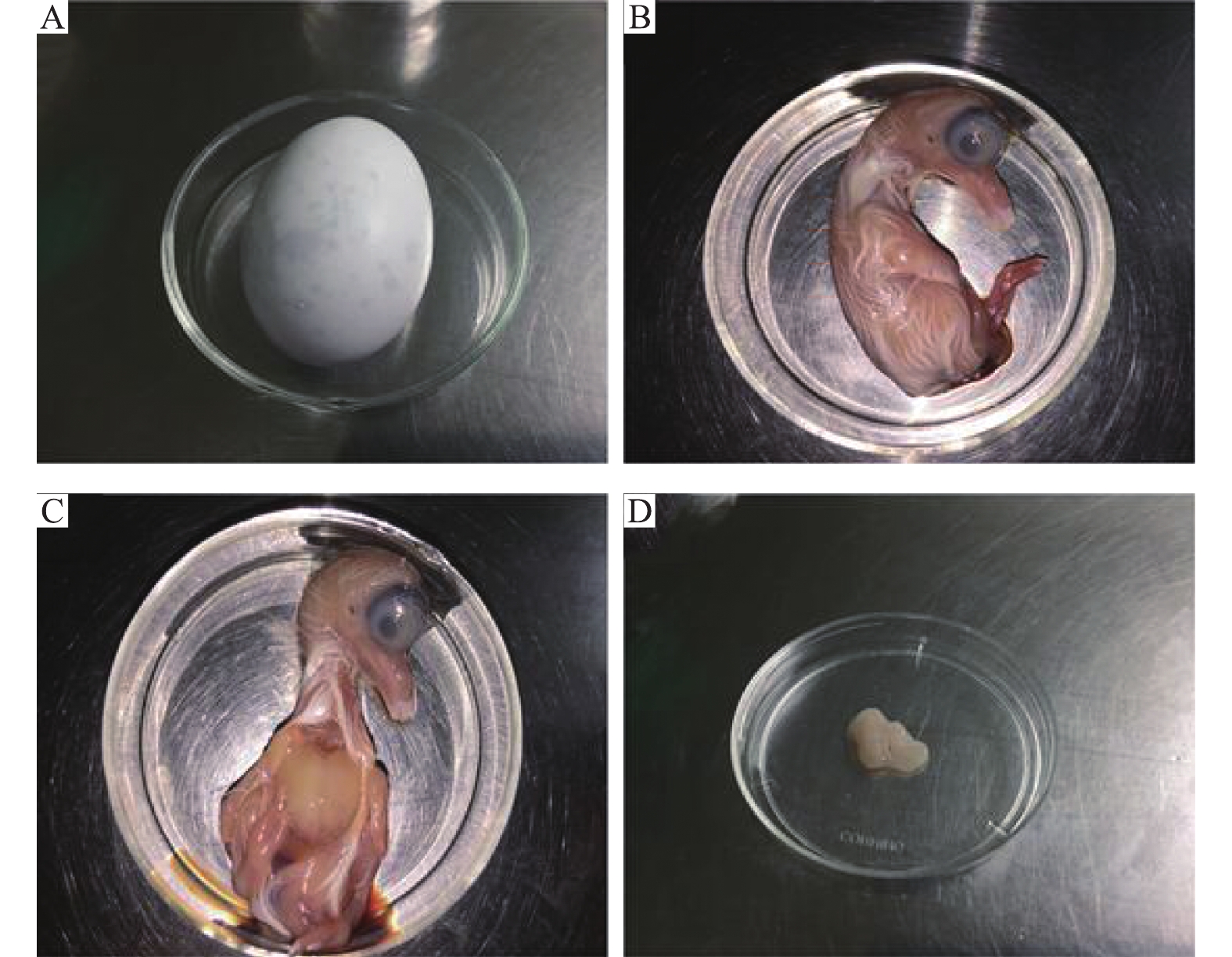
1.2 方法 1.2.1 组织块贴壁法分离骨骼肌卫星细胞取孵化16 d的鸽蛋(图1A),用体积分数为75%的乙醇溶液消毒后放置于无菌台上,取出鸽胚(图1B),轻轻撕开胸部皮肤(图1C),用手术刀分离鸽胚双侧胸肌(图1D),剪至1 mm3大小。倾斜细胞瓶,将组织块均匀贴入细胞瓶中,并吸出细胞瓶底部多余液体,慢慢翻转培养瓶,使有组织块的一面朝上,放入培养箱。8 h后,再翻转培养瓶,小心加入3 mL含体积分数为20% FBS的DMEM高糖培养液,继续放入37 ℃、CO2体积分数为5%的细胞培养箱培养。每3 d换液1次,每天在倒置显微镜下观察细胞的生长情况并拍照记录,连续观察7 d。
|
图 1 从孵化16 d的鸽胚中取出胸肌 Fig. 1 Dissection of pectoral muscle from a pigeon embryo after incubation for 16 days A:16日龄鸽蛋;B:鸽胚;C:胸肌位置;D:胸肌 A:16-day pigeon egg;B:Pigeon embryo;C:Position of pectoral muscle;D:Pectoral muscle |
将鸽胚胸肌分离后剪至苹果泥状,加入1 mg·mL–1的IV型胶原蛋白酶3 mL,放入37 ℃、CO2体积分数为5%的细胞培养箱中消化45~60 min,每隔15 min震荡1次,防止组织块沉积在底部,消化完成后使用40 μm网筛过滤2次,将过滤液1 500 r·min–1离心5 min,弃上清液,加入适量培养基,吹打混匀后将细胞悬液接种于25 cm2培养瓶或96孔培养板,放入37 ℃、CO2体积分数为5%的细胞培养箱进行培养,每3 d换液1次,每天在倒置显微镜下观察细胞的生长情况并拍照记录,连续观察7 d。
1.2.3 免疫荧光鉴定从培养箱中取出培养至第7天的鸽肌管细胞,使用体积分数为4%的多聚甲醛固定15 min,PBS缓冲液冲洗后用体积分数为0.5% 的TritonX-100处理20 min,山羊血清封闭30 min后以1∶500的体积比加入一抗MyHC(Abcam),并于4 ℃条件下孵育过夜;次日用PBS缓冲液冲洗后以1∶500的体积比加入FITC标记的山羊抗小鼠二抗(Abcam),暗室中孵育1 h,PBS缓冲液洗3次后,置于倒置荧光显微镜(Olympus IX51)下拍照。
1.2.4 RT-qPCR使用Triozl试剂提取消化法分离培养至第3天和第7天的细胞总RNA,并用TaKaRa逆转录试剂盒反转成cDNA,根据鸽Desmin、Pax7、MyoG、MyoD1、β-actin基因序列,使用NCBI-Primer设计引物(表1),并由四川擎科生物公司合成。采用10 μL PCR反应体系,含1 μL cDNA,1 μL上下游引物、5 μL SYBR premix Ex Taq II、3 μL DEPC水。RT-qPCR反应条件如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,进行40个循环,反应结束后进行熔解曲线绘制。Desmin、Pax7、MyoG和MyoD1基因的相对表达量使用2-ΔΔCt方法进行计算。
|
|
表 1 RT-qPCR引物设计 Table 1 Primers used for RT-qPCR |
使用胶原酶消化法分离的细胞按每孔2×103个接种于96孔板,接种时的时间记为0 d,每天选取5个细胞孔和3个空白对照孔加入20 μL CCK-8后放置于培养箱培养,1 h后取出,用酶标仪在450 nm的波长下测光密度值,重复测量3次,每隔24 h检测1次,连续检测7 d,以细胞培养时间为横坐标,光密度值为纵坐标绘制生长曲线。
1.2.6 统计学分析所有的数据均以平均值±标准误表示,采用SPSS 13.0软件分析,组间比较采用独立样本t检验。
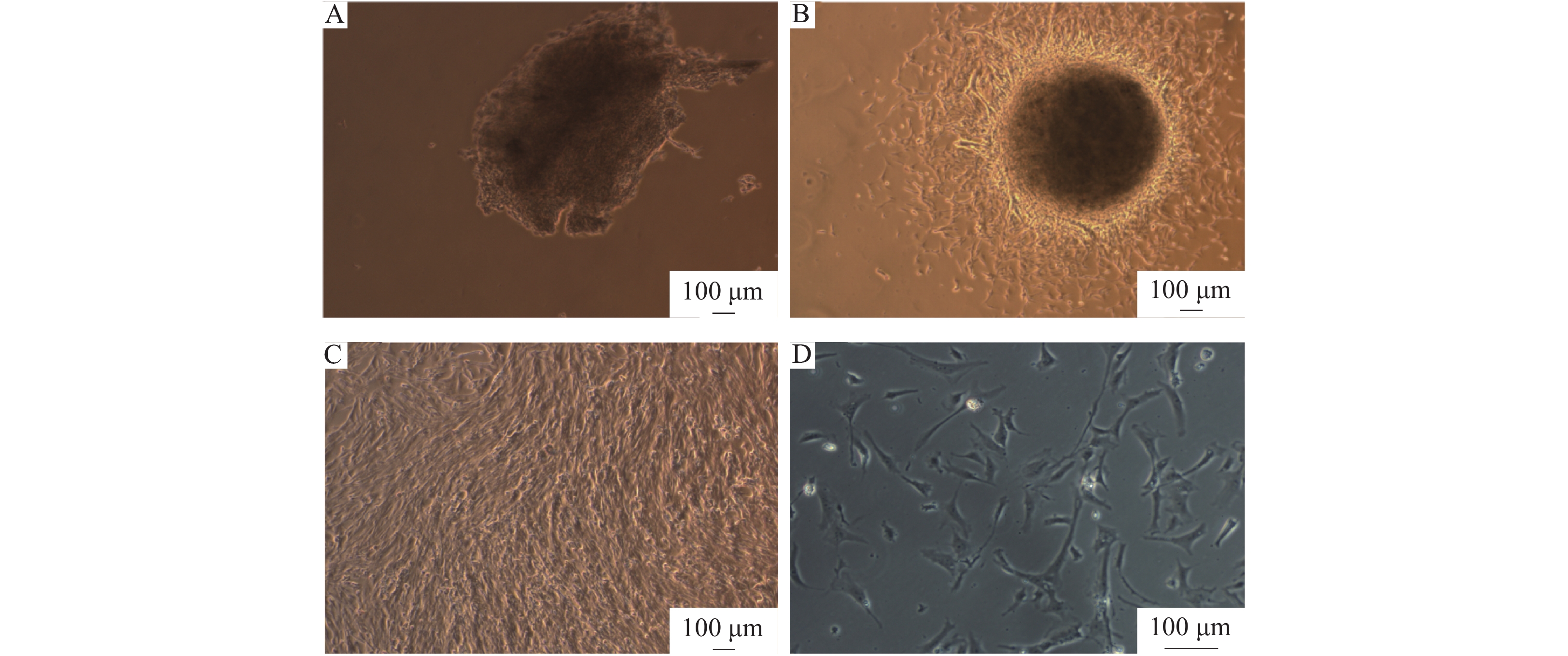
2 结果与分析 2.1 鸽骨骼肌卫星细胞的形态分别采用组织块贴壁法和胶原酶消化法对鸽骨骼肌卫星细胞进行分离培养。组织块经12 h贴壁即可贴附于细胞瓶底部(图2A),1 d后便有细胞从组织块中开始游出;培养3 d后大量细胞呈放射状聚集在组织块周围(图2B),细胞多为梭形或多角形。随着培养进程细胞密度不断增大,至第5天时,细胞密度达到90%以上(图2C)。采用胶原酶消化法获得的肌卫星细胞,在贴壁前呈圆形,贴壁后与组织块贴壁法获得的细胞形态相似,也多为短梭形、梭形或多角形(图2D);贴壁1 d后可观察到细胞增殖。
|
图 2 培养的鸽骨骼肌卫星细胞形态 Fig. 2 Morphology of cultured pigeon skeletal muscle satellite cells A:组织块贴壁1 d;B:组织块贴壁3 d后细胞;C:组织块贴壁5 d后细胞;D:贴壁1 d后胶原酶消化法分离细胞 A:Tissue explants after adherence for one day;B:Cells of the tissue explants after adherence for three days;C:Cells of the tissue explants after adherence for five days ;D:Cells isolated by collagenase digestion method after adherence for one day |
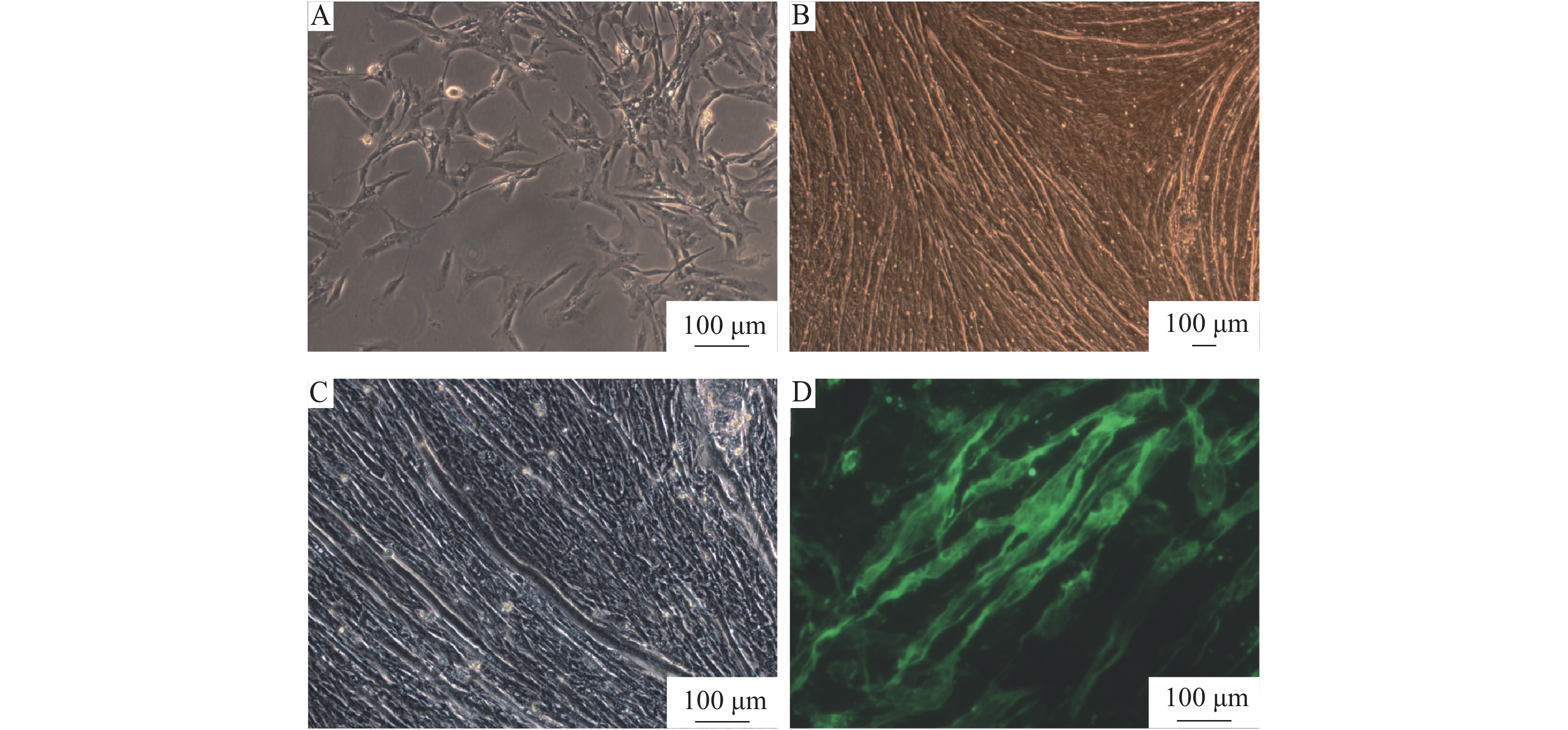
采用含体积分数为20%FBS的DMEM高糖培养体系对鸽骨骼肌卫星细胞(图3A)进行培养。在未采用血清饥饿分化诱导的情况下,当细胞培养至第7 天,可观察到大量骨骼肌卫星细胞之间相互融合,分化形成明显呈平行排列的肌管(图3B、3C);免疫荧光检测结果显示,MyHC在鸽肌管细胞中阳性表达(图3D)。上述结果表明本试验从家鸽胸肌中分离出的原代细胞为鸽骨骼肌卫星细胞,且该细胞在未使用马血清诱导的情况下,使用正常生长培养基可自行分化出肌管。
|
图 3 分化前后细胞形态及免疫荧光鉴定 Fig. 3 Cell morphology before and after differentiation and immunofluorescent identification A:分化前骨骼肌卫星细胞形态;B、C:分化后肌管形态;D:MyHC在肌管中阳性表达 A:Morphology of skeletal satellite cells before differentiation;B, C:Morphology of differentiated myotubes;D:Positive expression of MyHC in myotubes |
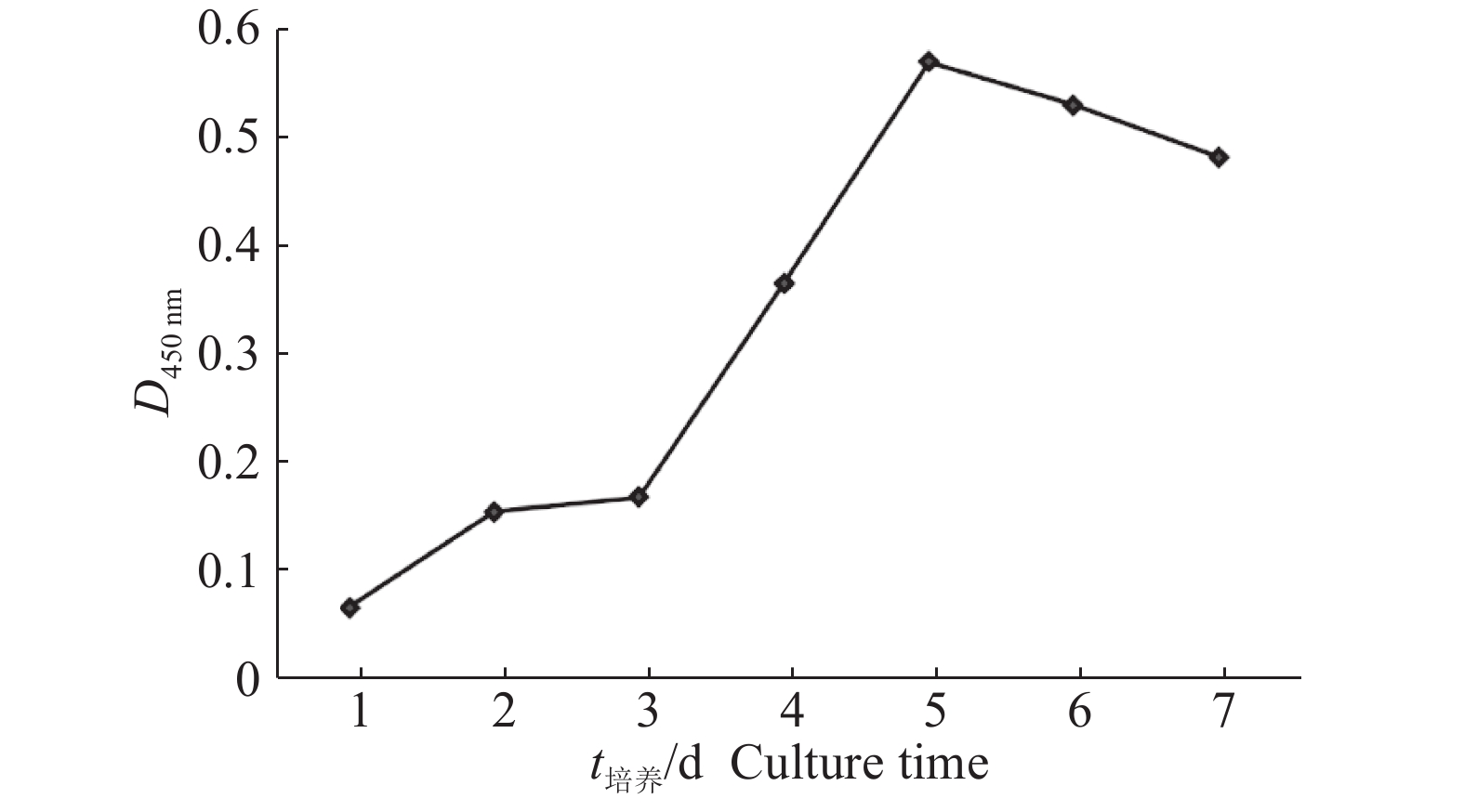
鸽骨骼肌卫星细胞生长曲线如图4所示,曲线呈“S”型。其中第1~3天为潜伏期,细胞增殖缓慢,第3~5天为对数增长期,第5天细胞数达到最大,第6天细胞发生接触抑制,部分细胞脱离培养瓶底部,细胞数减少。
|
图 4 鸽骨骼肌卫星细胞生长曲线 Fig. 4 Growth curve of pigeon skeletal muscle satellite cells |
除用形态学方法、免疫荧光法鉴定鸽骨骼肌卫星细胞分化形成肌管外,本试验还通过检测成肌相关基因(Desmin、Pax7、MyoD1、MyoG)的表达情况进一步确认鸽骨骼肌卫星细胞的分化。RT-qPCR结果如图5所示,分离出的鸽骨骼肌卫星细胞培养至第7天(分化后出现大量肌管),细胞中Pax7和MyoD1基因的相对表达量在分化后显著降低(P<0.05)(图5A、5B),其分化前的相对表达量是分化后的7.01和5.51倍;而培养至第7天时(分化后)细胞中Desmin和MyoG基因的相对表达量则显著高于第3天(分化前)(P<0.05)(图5C、5D),其分化后的相对表达量分别是分化前的5.68和10.38倍。
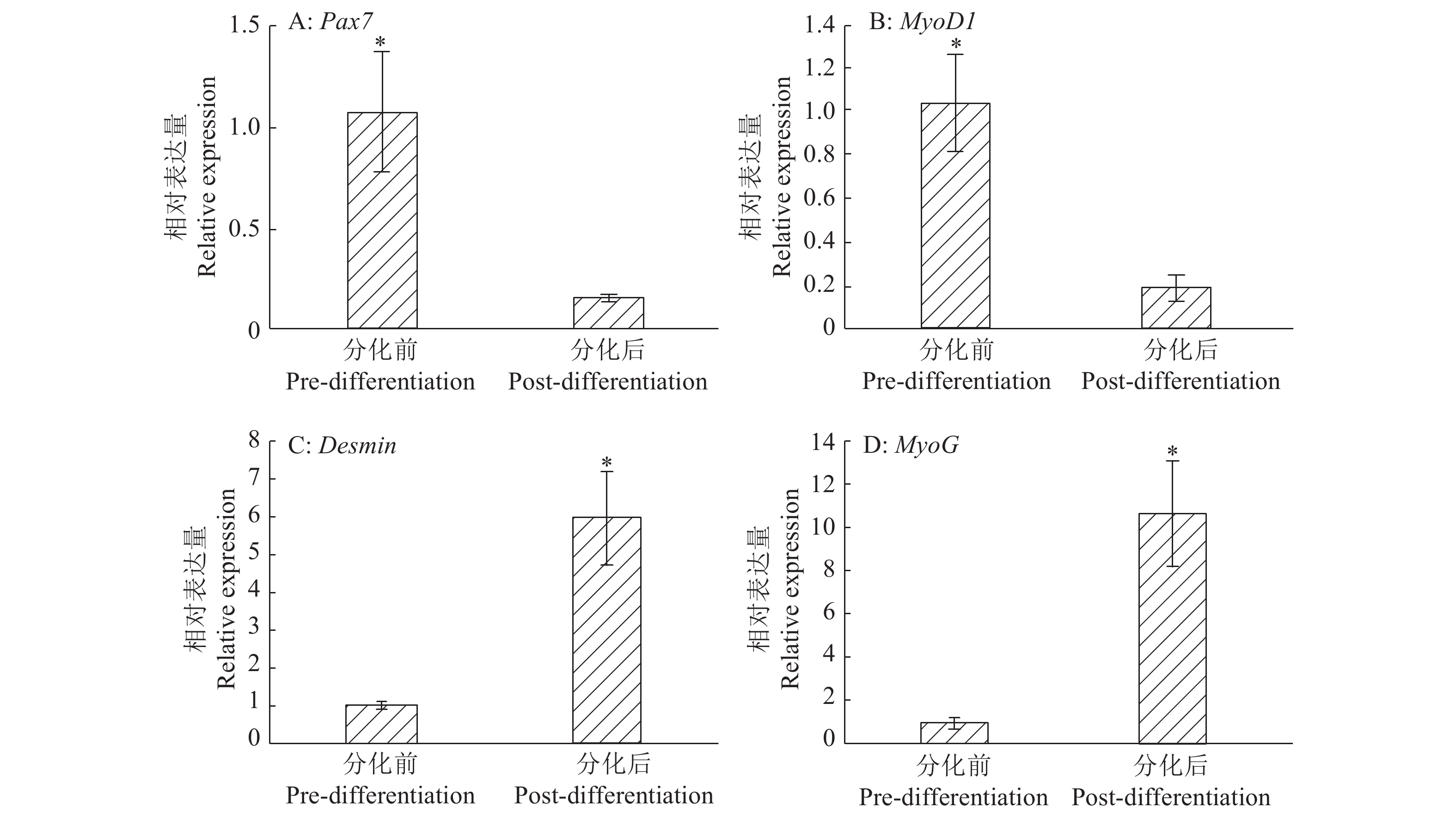
|
图 5 鸽骨骼肌卫星细胞分化前后的RT-qPCR基因定量结果 Fig. 5 RT-qPCR quantification results of genes in pigeon skeletal muscle satellite cells before and after differentiation 各图中“*”表示2组数据差异显著(P<0.05,t 检验) In each grach, “*” indicated significant difference between two data sets (P<0.05, t-test) |
原代细胞作为体外研究的重要细胞模型,目前已被广泛运用于分子育种[14]、病理[15]、生理[16]等多方面研究。骨骼肌卫星细胞在幼龄动物肌肉组织中占的比例很高,但随着日龄的增加其比例不断减少[17]。在以往禽类原代骨骼肌卫星细胞的分离研究中,鸡一般取15日龄左右的鸡胚[12]或者出壳后第4天的雏鸡[18],鸭以13日龄鸭胚[13]作为试验材料。在本试验中,选用16日龄的鸽胚作为材料,其原因主要是15日龄以前的鸽胚胸肌组织量少,而17~18日龄鸽胚胸肌中结缔组织增多,容易引入杂细胞,导致所分离的骨骼肌卫星细胞的比例降低。
大量的文献显示动物骨骼肌卫星细胞的诱导分化多采用血清饥饿或使用马血清的方法。代阳等[9]使用含体积分数为2%马血清的培养基对小鼠骨骼肌卫星细胞进行诱导分化;夏家红等[19]则采用无血清培养基对大鼠骨骼肌卫星细胞诱导分化;禽类肌卫星细胞的分化常用含体积分数为5%马血清或胎牛血清的分化培养液进行诱导[12, 20]。而本试验在使用含体积分数为20%胎牛血清的DMEM培养液正常培养鸽骨骼肌卫星细胞的过程中,在没有使用血清饥饿或使用马血清的情况下,意外地发现鸽骨骼肌卫星细胞可自行分化出肌管,经免疫荧光法检测成肌特异性标志MyHC蛋白,结果呈阳性,进一步证实了鸽骨骼肌卫星细胞自分化现象。该现象在其他动物同类细胞的研究中鲜见报道,有关鸽骨骼肌卫星细胞的自分化机制还有待于进一步研究。
结蛋白基因(Desmin)作为鉴定骨骼肌卫星细胞的标志基因之一,其在1976年首次被发现[21],本试验结果显示,分化后Desmin的相对表达量显著高于分化前细胞。陈永乐等[22]的研究发现在C2C12细胞向成熟肌细胞分化过程中,Desmin的表达逐渐增强,该结果与本试验结果一致。此外,肌分化因子(MyoD)为肌源性细胞特异性表达的一种转录因子,是成肌细胞增殖的标志[23]。MyoD作为主控基因启动生肌分化程序时,通过调节肌细胞特异性增强子结合因子2(Myocyte-specific enhancer-bindingfactor 2, Mef2)的转录激活,同时激活MAPK p38途径,一系列的信号级联导致最终的肌球蛋白重链(Myh3)基因的激活[23]。宋佳等[24]对C2C12细胞的研究表明,MyoD的表达在诱导分化后第2天开始上调,第3天达到最高峰,第4天开始下降。冯永强等[25]对大鼠骨骼肌卫星细胞的研究也显示,当分化至第2天,其表达量达到峰值,随后逐渐下降。在本试验中,培养至第3天的细胞MyoD1基因的相对表达量明显高于第7天,与上述报道结果基本一致。肌细胞生成素(MyoG)基因作为肌细胞终末端分化的关键基因[26],是细胞分化的标志[23],能控制成肌细胞的融合,使单核的成肌细胞转化为多核的肌纤维,MyoG基因的表达受MyoD和Myf5基因的调控,且与MyoD基因共同激活终端分化基因。Ling等[27]的研究结果显示MyoG基因在原代山羊肌卫星细胞成肌分化后显著上调, 与本试验结果一致。结合上述成肌相关基因在分化前后的表达特点、细胞自分化的形态学变化及免疫荧光鉴定结果,表明我们所分离培养的细胞为鸽骨骼肌卫星细胞。本试验建立了鸽原代骨骼肌卫星细胞的分离、培养体系,为后续开展鸽肌肉生长及发育机理的研究提供了细胞模型。
| [1] |
韩占兵, 张立恒, 黄炎坤. 我国肉鸽养殖现状与前景效益分析[J]. 河南畜牧兽医(市场版), 2016, 37(6): 22-23. (  0) 0) |
| [2] |
卜柱. 我国肉鸽产业发展现状及未来行情走势[J]. 中国禽业导刊, 2015(22): 24-27. (  0) 0) |
| [3] |
ANDERSON J L, TAYLOR RL JR, SMITH E C, et al. Differentially expressed genes in aortic smooth muscle cells from atherosclerosis-susceptible and atherosclerosis-resistant pigeons[J]. Poult Sci, 2012, 91(6): 1315-1325. DOI:10.3382/ps.2011-01975 (  0) 0) |
| [4] |
CUI J , HALBROOK R S , ZANG S , et al. Use of homing pigeons as biomonitors of atmospheric metal concentrations in Beijing and Guangzhou, China[J]. Ecotoxicology, 2016, 25(3): 439-446. DOI:10.1007/s10646-015-1601-y (  0) 0) |
| [5] |
ROBERTSON A M, BIEWENER A A. Muscle function during takeoff and landing flight in the pigeon (Columba livia)
[J]. J Exp Biol, 2012, 215(Pt23): 4104-4114. (  0) 0) |
| [6] |
MAURO A. Satellite cell of skeletal muscle fibers[J]. J Biophys Biochem Cytol, 1961, 9(2): 493-495. DOI:10.1083/jcb.9.2.493 (  0) 0) |
| [7] |
ASAKURA A, KOMAKI M, RUDNICKI M. Muscle satellite cells are multipotential stem cells that exhibit myogenic, osteogenic, and adipogenic differentiation[J]. Differentiation, 2001, 68(4/5): 245-253. DOI:10.1046/j.1432-0436.2001.680412.x (  0) 0) |
| [8] |
吕捷, 赵春礼, 李玉成, 等. 成人骨骼肌细胞原代培养[J]. 神经解剖学杂志, 2001, 17(1): 75-76. DOI:10.3969/j.issn.1000-7547.2001.01.018 (  0) 0) |
| [9] |
代阳, 王轶敏, 刘新峰, 等. 小鼠骨骼肌卫星细胞的分离培养和鉴定[J]. 天津农学院学报, 2014(1): 1-4. DOI:10.3969/j.issn.1008-5394.2014.01.001 (  0) 0) |
| [10] |
边艳超, 牧仁, 李向臣, 等. 鲁西黄牛胚胎骨骼肌卫星细胞分离培养及生物学特性[J]. 华中农业大学学报, 2013, 32(2): 90-96. DOI:10.3969/j.issn.1000-2421.2013.02.016 (  0) 0) |
| [11] |
郑琪, 睢梦华, 朱龙, 等. 安淮山羊骨骼肌卫星细胞的分离培养与鉴定[J]. 安徽农业大学学报, 2017, 44(2): 198-202. (  0) 0) |
| [12] |
李方华, 侯玲玲, 马月辉, 等. 北京油鸡骨骼肌卫星细胞的分离、培养、鉴定及成肌诱导分化的研究[J]. 中国农业科学, 2010, 43(22): 4725-4731. DOI:10.3864/j.issn.0578-1752.2010.22.021 (  0) 0) |
| [13] |
单艳菊, 束婧婷, 宋迟, 等. 鸭骨骼肌卫星细胞的分离培养与鉴定[J]. 江苏农业科学, 2012, 40(12): 26-28. DOI:10.3969/j.issn.1002-1302.2012.12.008 (  0) 0) |
| [14] |
樊廷俊, 徐晓辉, 姜国建, 等. 条斑星鲽连续性鳍细胞系的建立与鉴定[J]. 山东大学学报(理学版), 2010, 45(5): 22-27. (  0) 0) |
| [15] |
周海波, 蔡建庭, 李茂岚, 等. 白藜芦醇诱导人胃癌原代细胞裸鼠移植瘤凋亡的研究[J]. 中国病理生理杂志, 2005, 21(3): 528-532. DOI:10.3321/j.issn:1000-4718.2005.03.025 (  0) 0) |
| [16] |
庄鹏, 江元森, 马会慧, 等. 长期培养的大鼠原代肝细胞功能和形态学观察[J]. 中国病理生理杂志, 2005, 21(5): 1001-1005. DOI:10.3321/j.issn:1000-4718.2005.05.039 (  0) 0) |
| [17] |
李方华, 弓慧敏, 冯士彬, 等. 骨骼肌卫星细胞的研究进展[J]. 中国畜牧兽医, 2010, 37(10): 25-28. (  0) 0) |
| [18] |
陈岩, 王琨, 朱大海. 鸡骨骼肌卫星细胞的分离培养、鉴定及生物学特性研究[J]. 遗传, 2006, 28(3): 257-260. DOI:10.3321/j.issn:0253-9772.2006.03.002 (  0) 0) |
| [19] |
夏家红, 谢艾妮, 徐磊, 等. 大鼠骨骼肌卫星细胞体外培养的实验研究[J]. 中华实验外科杂志, 2005, 22(2): 214-215. DOI:10.3760/j.issn:1001-9030.2005.02.032 (  0) 0) |
| [20] |
TAKAYA T, NIHASHI Y, KOJIMA S, et al. Autonomous xenogenic cell fusion of murine and chick skeletal muscle myoblasts[J]. Anim Sci J, 2017, 88(11): 1880-1885. DOI:10.1111/asj.2017.88.issue-11 (  0) 0) |
| [21] |
LAZARIDES E, HUBBARD B D. Immunological characterization of the subunit of the 100 A filaments from muscle cells[J]. Proc Natl Acad Sci USA, 1976, 73(12): 4344-4348. DOI:10.1073/pnas.73.12.4344 (  0) 0) |
| [22] |
陈永乐, 周光前, 邓宇斌, 等. C2C12成肌细胞体外诱导分化为肌管的实验[J]. 中山大学学报(医学科学版), 2008, 29(1): 10-15. DOI:10.3321/j.issn:1672-3554.2008.01.003 (  0) 0) |
| [23] |
王静, 宋新磊, 崔焕先, 等. 骨骼肌卫星细胞的特性及其增殖与分化的调控[J]. 中国细胞生物学学报, 2007, 29(4): 497-502. DOI:10.3969/j.issn.1674-7666.2007.04.009 (  0) 0) |
| [24] |
宋佳, 曾缨, 郑民缨, 等. 肌肉特异性微小RNA和成肌调节因子在C2C12细胞成肌分化过程中的表达[J]. 中国组织工程研究, 2012, 16(32): 5999-6005. DOI:10.3969/j.issn.2095-4344.2012.32.021 (  0) 0) |
| [25] |
冯永强, 李峥, 褚万立, 等. 大鼠骨骼肌卫星细胞的原代培养鉴定和体外分化特点[J]. 中华医学杂志, 2016, 96(12): 971-974. DOI:10.3760/cma.j.issn.0376-2491.2016.12.013 (  0) 0) |
| [26] |
邱华玲, 于建兴, 陈宏权. MyoG基因结构与功能研究进展
[J]. 生物信息学, 2007, 5(4): 190-192. DOI:10.3969/j.issn.1672-5565.2007.04.016 (  0) 0) |
| [27] |
LING Y H, SUI M H, ZHENG Q, et al. miR-27b regulates myogenic proliferation and differentiation by targeting Pax3 in goat[J]. Sci Rep, 2018, 8: 3909. doi: 10.1038/s41598-018-22262-4.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


