2. 四川农业大学 动物医学院, 四川 成都 611130;
3. 四川省农业厅, 四川 成都 610041
2. College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Provincial Agricultural Department, Chengdu 610041, China
斑点叉尾鮰 Ietalurus punetaus原产于北美洲,于1984年引进并在国内开始大范围养殖。斑点叉尾鮰是一种大型淡水鱼类,具有生长快、适应性广、抗病力强、肉质上乘并且价格低廉等优点,深受消费者的喜爱。截止2015年,中国养殖的斑点叉尾鮰年产量达26.5万t,比原产地美国整整多了11万t[1],中国已成为斑点叉尾鮰养殖第1大国。
由于出现品种退化、过度追求高产量、药物滥用、养殖环境恶化等状况,斑点叉尾鮰疾病频发,暴发如细菌性败血症[2]、套肠病[3]、斑点叉尾鮰肠败血病[4]以及烂尾病、烂鳃病[5]和溃疡病[6]等。以溃疡为主要症状的疾病是斑点叉尾鮰最常见的病症之一[7-8],主要表现为体表皮肤以及肌肉的溃烂。有的溃疡病症还伴随出血,以及鳍条的断裂、嘴角出血溃烂等。研究表明,多种因素均可引起斑点叉尾鮰溃疡症,如碰撞、捕捞等机械损伤引起的出血溃烂;柱状黄杆菌 Flavobacterium cloumnare[9]、爱德华氏菌 Edwardsiella ictalur[10]、产气肠杆菌 Enterobacter aerogenes[11]、嗜水气单胞菌 Aeromonas hydrophila[12]等引起的细菌性溃疡,以及斑点叉尾鮰病毒 (Channel catfish virus,CCV)[13]引起的病毒性出血溃疡症等。目前,我国主要通过细菌学技术和PCR检测技术进行疾病的病因诊断。但由于皮肤溃疡形成后,水中大量其他杂菌寄居在溃烂组织处,极易干扰致病菌的分离,操作者的技术失误也可能导致分离到错误的细菌,且无法直观地了解病原感染的数量及在各组织器官中的分布情况。因此,需配合其他技术以提升诊断的准确性。病理学是研究生物体疾病发生的原因、发生机制、发展规律以及疾病过程中机体的形态结构、功能代谢变化和病变转归的一门基础科学。病理诊断技术早已在一些欧美及部分亚洲国家广泛应用于水产临床疾病诊断,且具有相当的权威性[14]。因此,在水产疾病诊断过程中将病理诊断技术与其他检测方法结合起来,将更有利于疾病诊断的准确性。
2017年4月,在四川省某斑点叉尾鮰养殖场养殖的斑点叉尾鮰出现暴发性死亡。病鱼初期表现为唇部出血发红,下颔、胸鳍基部发红,点状出血等,随着病情的发展出现皮肤圆形褪色斑,最后皮肤肌肉出血性溃烂,烂嘴和烂尾,食欲废绝死亡。发病率和死亡率均在80%以上。为确定该病的病因,本研究对患病鱼进行寄生虫学、细菌学和病毒学检查,结合病理学技术分析该病的疾病类型,推测其致病原因,明确该病症的病理损伤特征,为类似疾病的诊断提供参考借鉴。
1 材料与方法 1.1 试验动物具有明显体表出血和溃疡症状的斑点叉尾鮰濒死病鱼10尾,来源于四川省乐山市(时间:2017年4月9日,n=5)和眉山市(时间:2017年4月17日,n=5)斑点叉尾鮰养殖基地,送检时所有病鱼均成活。受检样本体长31.4~37.2 cm,体质量321.4~380.3 g,用于剖检观察、病料采集和病原菌分离。
1.2 剖检观察将患病斑点叉尾鮰用MS-222麻醉后,首先检查病鱼体表完整性及其他体表症状,之后打开口咽腔、围心腔、腹腔,依次观察各体腔黏膜情况及各内脏器官色泽、质地及形态变化,记录典型病变特点。
1.3 寄生虫检测检查病鱼体表、鳃部是否有异常着生物,并分别对送检病鱼进行鳃丝压片和体表黏液刮片,光学显微镜下观察有无寄生虫寄生。
1.4 细菌学检测 1.4.1 Diff Quick染色观察剖杀前无菌抽取待检鱼的尾静脉血液,制作血液涂片,剖检后取鱼的肝、脾、肾组织,制作组织触片。将所制备的血液涂片和组织触片自然晾干后进行Diff Quick (如吉生物科技,上海)染色,于1 000倍显微镜下观察细菌感染情况。
1.4.2 细菌的分离和纯化采用体积分数为75%的乙醇溶液进行体表消毒后,在无菌条件下分别从送检鱼的溃疡灶边缘、肝脏、脾脏、肾脏中用接种环接种至脑心浸液肉汤 (Brain heart infusion broth, BHI)培养基。将平板置于恒温箱中28 ℃条件下培养,连续观察1周,观察细菌的生长情况。
1.5 病毒检测从目前的报道来看,感染斑点叉尾鮰的病毒主要为斑点叉尾鮰病毒(Channel catfish virus, CCV)[13],故本次诊断重点对CCV进行了PCR特异性检测。采取具有明显患病症状的斑点叉尾鮰肝、脾、肾组织,混合匀浆后用DNA提取试剂盒(TaKaRa, 大连) 提取模板DNA,参考杜玉东等[15]根据CCVORF6基因序列设计的特异性引物 (上游序列为5′-CGCGCTCCTGACCCTACTGATG-3′, 下游序列为5′-AGCGCTGGTCTCCCGTGATTA-3′), 并进行PCR扩增,预计扩增片段大小为335 bp。反应条件为:94 ℃ 5 min;94 ℃ 45 s,55 ℃ l min,72 ℃ 1 min,循环32次。PCR产物经10 g·L–1琼脂糖凝胶电泳检测。
1.6 组织病理学观察取所有送检斑点叉尾鮰的皮肤肌肉、脑及心、肝、脾、肾、头肾、胃、肠道、鳃、鳔等组织,用体积分数为10%的中性缓冲福尔马林固定液固定,体积分数分别为75%、85%、95%、100%的乙醇溶液梯度脱水,二甲苯透明,石蜡包埋,切片,苏木精–伊红 (Hematoxylin-Eosin, HE)染色,中性树脂胶封片后,在Nikon电子显微镜 (Nikon, 日本)下观察,并拍照记录。
2 结果与分析 2.1 病史及临床症状患病斑点叉尾鮰养殖模式为池塘养殖并套养少量鲢鳙鱼。自2017年1月初起便陆续出现发病迹象,主要表现为体表出现圆形褪色斑以及鳍条基部肿胀充血等;随着病情的加重,斑点叉尾鮰体表开始溃烂,鳍条溃烂、出血,以及下颔至腹部皮肤大面积内出血;最终,皮肤肌肉穿孔,斑点叉尾鮰内部器官暴露,引发斑点叉尾鮰游泳失衡,导致斑点叉尾鮰死亡。发病水温18~21℃,部分养殖池塘累计死亡率已超过80%,每日死亡率稳定在8%及以上。
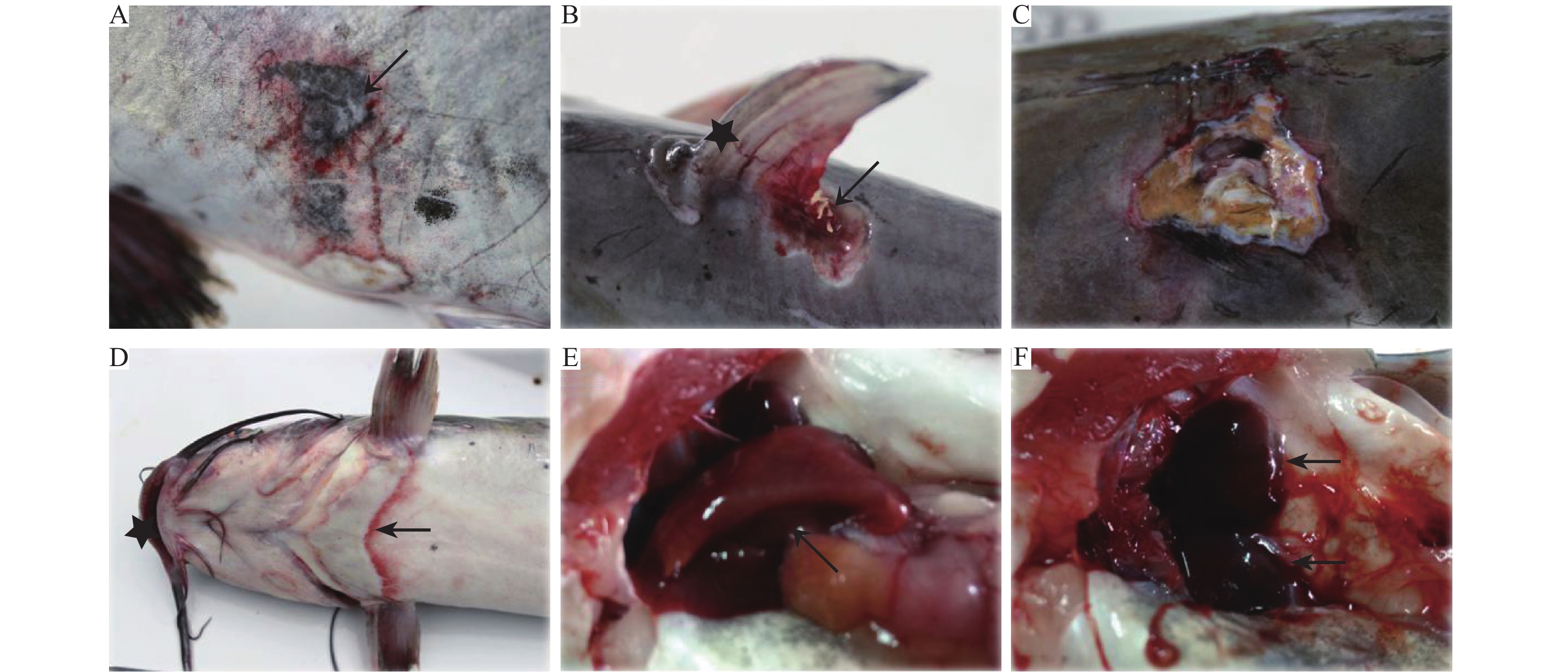
2.2 尸检及病理学肉眼初步观察患病斑点叉尾鮰主要表现为体表多处皮肤肌肉溃疡,特别在腹壁体侧、鳍条基部处皮肤肌肉严重溃烂(图1A、1B、1C)。病变较轻时,皮肤上出现直径约1 cm的圆形褪色斑,伴随边缘点状出血(图1A);病变严重时,表现为皮肤及皮下肌肉的溃烂、缺损(图1B),以及皮肤严重的充血、出血症状(图1D)。溃疡灶面积为(2.1±0.6) cm×(3.5±0.4) cm,边缘皮肤表现为渐变性皮肤发白及腐烂,最后肌肉溃烂穿孔(图1C),并暴露内脏器官。病鱼内脏器官大体病变亦较为明显,主要表现为肝肿胀、边缘钝化 (图1E),头肾极度肿胀(图1F)以及脾的轻微肿胀等;消化道内无食物或有少量黄色黏液内容物,肠壁轻微充血。其他脏器肉眼观察病变不明显。
|
图 1 病鱼病理症状表现 Fig. 1 General symptoms of diseased fish A:皮肤表面圆形褪色斑,边缘轻微出血(→);B:鳍条基部皮肤肌肉溃烂、出血(→),鳍条血管极度充血(★);C:皮肤肌肉溃烂、穿孔并暴露内部器官(→),溃疡灶边缘可见出血;D:下颔至腹部皮肤大面积出血(→),唇部出血发红(★);E:肝脏边缘钝化、肿胀(→);F:头肾极度肿胀(→) A: The fading circular dot on the skin surface with slight bleeding at the edge (→); B: Festering and bleeding at the base of the fin (→), strongly congesting fin vessels (★); C: Ulceration and perforation of skin and muscle with internal organs exposed (→), bleeding at the edge of the ulcer; D: The skin bleeding from the mandible to the abdomen (→), the lip bleeding (★); E: Passivation and swelling at the edge of the liver (→); F: The head kidney highly swelling (→) |
取患病斑点叉尾鮰的鳃丝以及体表黏液分别压片后置于低倍光学显微镜下观察,均未发现明显寄生虫寄生。
2.4 细菌学检测组织触片和血液涂片经Diff Quick染色后未发现细菌;在无菌条件下利用接种环从病鱼的溃疡灶边缘、肝、脾、肾中接种至BHI培养基,28 ℃恒温培养1周后,未见细菌生长。病理学检查结果亦未发现组织细胞间有细菌存在。
2.5 病毒检测将PCR扩增产物使用琼脂糖电泳检测后,结果中没有出现135 bp的目标条带,说明患病斑点叉尾鮰未感染CCV。
2.6 组织病理学检查经石蜡切片,HE 染色后观察发现,该病靶器官主要出现在脾脏、肝胰脏、肾脏、肠道以及皮肤肌肉,主要表现为严重的血管反应,实质细胞可见肿胀、变性、坏死,而胃、脑和心脏病变较轻,仅有轻微的炎症和血管反应,鳃丝、眼球和鳔等未见明显病变。所有的患病个体均不同程度出现中度至重度出血性坏死性脾炎、中度肾炎、轻度至中度坏死性肝胰腺炎、轻度至中度坏死性肠炎。所有脏器镜下未见到明显的细菌、寄生虫,仅在坏死脱落的皮肤肌肉处观察到少量真菌菌丝。
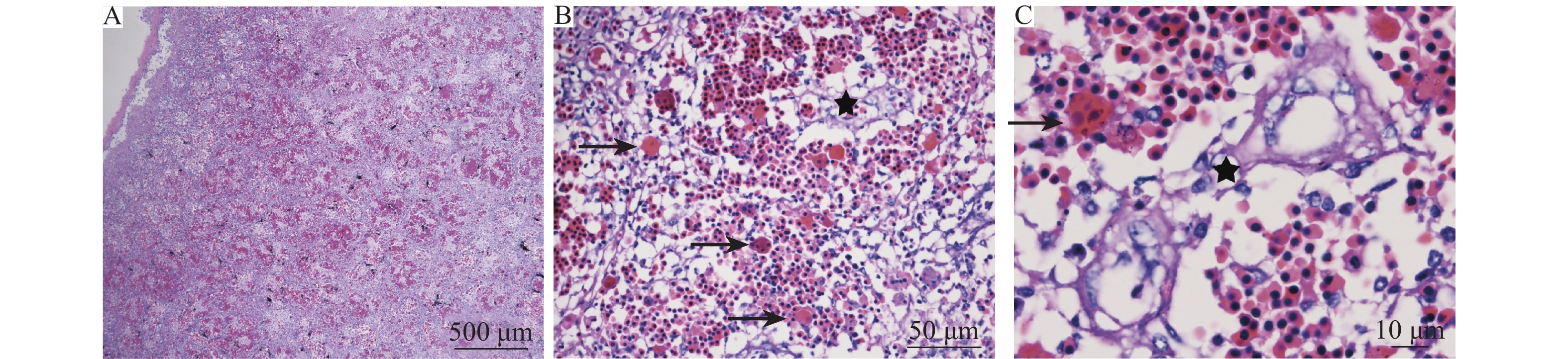
脾脏:从显微镜下可以看出,脾脏病理改变最为严重,推断为主要病变靶器官。主要表现为脾脏严重充、出血,红细胞弥漫,淋巴细胞大量减少 (图2A);在多个视野可见大量增加的噬红细胞现象 (图2B);血管系统出现明显的疏松、坏死,结构破坏 (图2C)。
|
图 2 脾脏组织病理学检测结果 Fig. 2 Histopathological detection of spleen A: 脾脏严重充血,淋巴细胞大量减少; B、C: 血管坏死(★), 噬红细胞现象(→) A: Severe congestion in the spleen, and lymphocytes substantially reduced; B, C: Vascular necrosis (★), erythrocytophagy (→) |
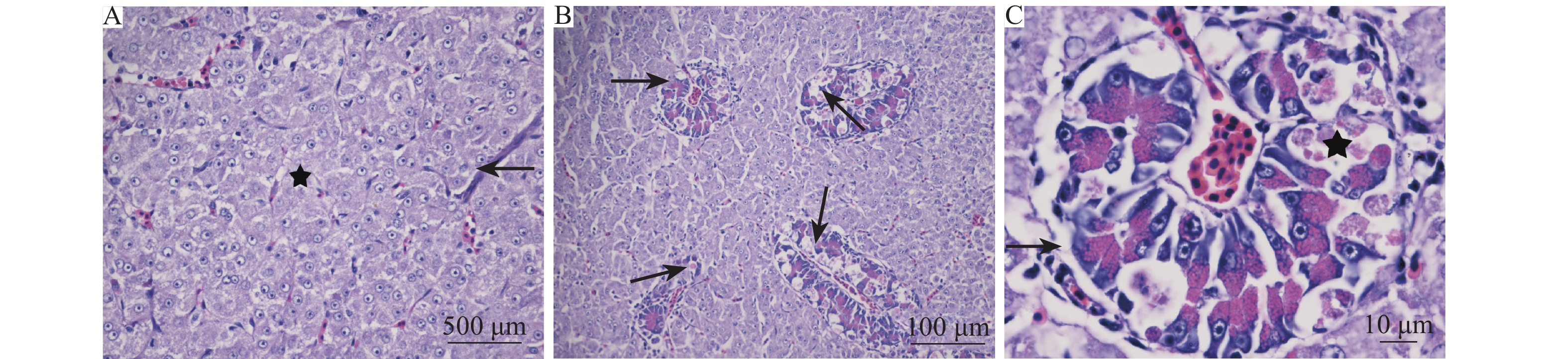
肝胰脏:肝胰脏中肝细胞病变较轻,表现为轻微的水肿,部分细胞可见轻度的溶解性坏死(图3A)。肝血窦扩张瘀血,红细胞弥漫,血窦内皮细胞坏死、消失,可观察到噬红细胞现象。分布于肝细胞间的胰腺细胞病变较为明显,呈现中度至重度的细胞坏死,以及间质轻微水肿 (图3B、3C)。
|
图 3 肝脏组织病理学检测结果 Fig. 3 Histopathological detection of liver A: 肝细胞溶解性坏死(★), 轻微水肿(→); B: 胰腺坏死(→); C: 胰腺细胞坏死(★), 轻微水肿(→) A: Hepatocyte lytic necrosis (★) with mild edema (→); B: Pancreatic necrosis (→); C: Pancreatic cell necrosis (★) with mild edema (→) |
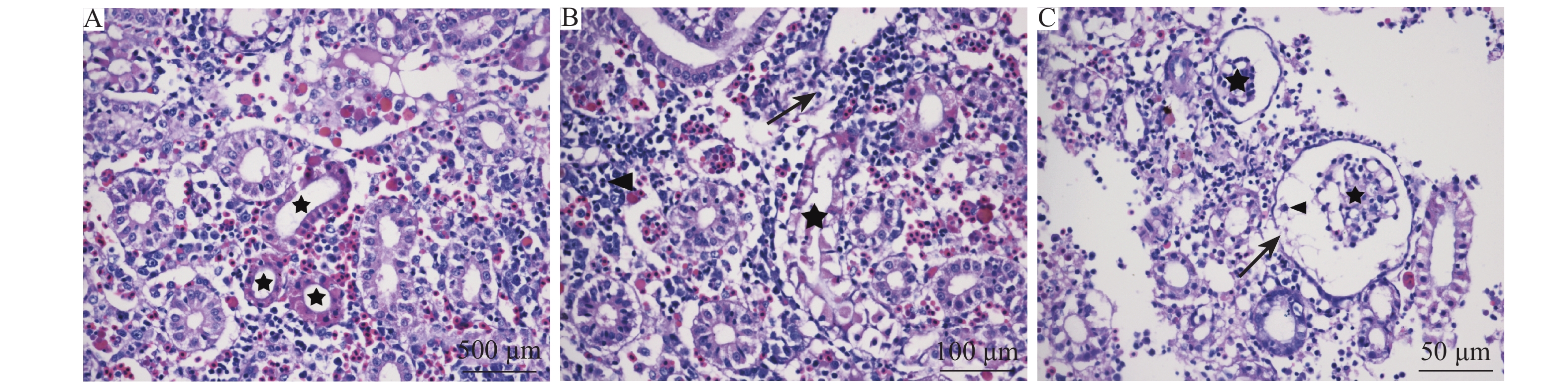
中肾:中肾实质部位病变严重,表现为严重的肾小管坏死 (图4A、4B),肾小囊不同程度地扩张,以及肾小球萎缩,肾小囊内可见坏死脱落的实质细胞 (图4C);肾间质细胞病变不明显,仅见轻微的间质细胞坏死以及炎性细胞浸润 (图4B);间质细胞间可见大量噬红细胞现象 (图4A)。
|
图 4 中肾组织病理学检测结果 Fig. 4 Histopathological detection of trunk kidney A: 肾小管坏死(★), 噬红细胞现象(→); B: 肾小管坏死(★), 炎性细胞浸润(▲), 肾间质细胞坏死(→); C: 肾小囊膨大(→), 肾小球萎缩(★), 肾小球细胞脱落(▲) A: Renal tubular necrosis (★), erythrocytophagy (→); B: Renal tubular necrosis (★), inflammatory cell infiltration (▲), renal interstitial cell necrosis (→); C: Renal capsule enlargement (→), glomerular atrophy (★), glomerular cell falling off (▲) |
头肾:头肾病变程度仅次于脾脏,血窦中可见有大量淤血 (图5A),可见明显坏死的血窦内皮细胞,细胞核浓缩、碎裂,但仍可见细胞形态 (图5B)。此外,还可见大量的噬红细胞现象,但造血母细胞病变较轻,仅见轻度细胞坏死 (图5C)。
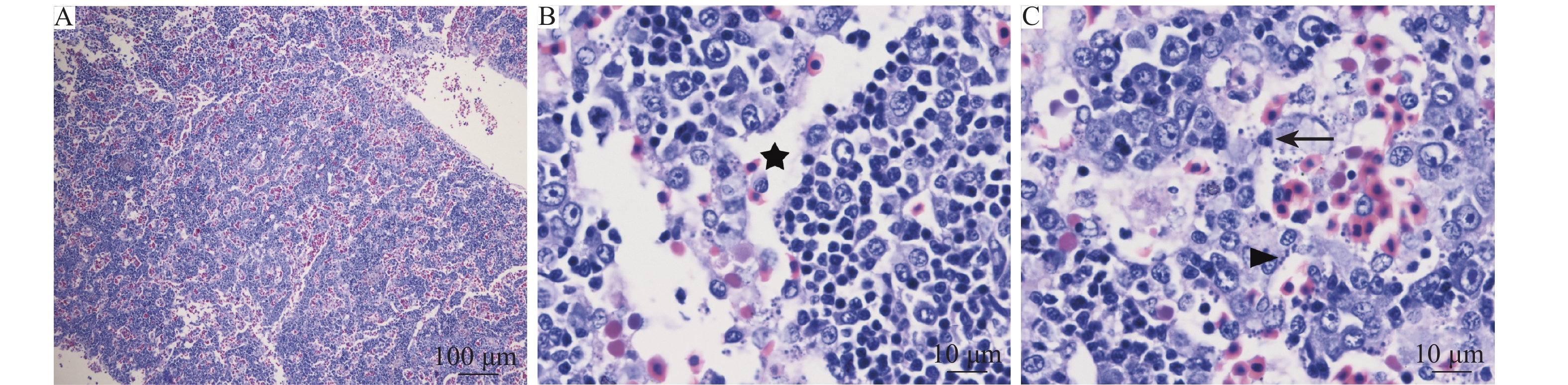
|
图 5 头肾组织病理学检测结果 Fig. 5 Histopathological detection of head kidney A: 血窦大量淤血; B: 血管上皮细胞坏死(★); C: 造血母细胞坏死(→), 血管上皮细胞坏死(▲) A: Massive congestion in the sinusoid; B: Vascular epithelial cells necrosis (★); C: Hematopoietic necrosis (→), vascular epithelial cell necrosis (▲) |
皮肤和肌肉:皮肤和肌肉相对于上述器官病变较轻,仅溃疡灶及边缘位置有明显病变,表现为溃疡灶边缘皮肤表皮层完全脱落,真皮层表面可见少量水霉寄生 (图6A);皮肤下肌肉可见肌纤维坏死、肌浆凝固,呈蜂窝状 (图6A、6B)。
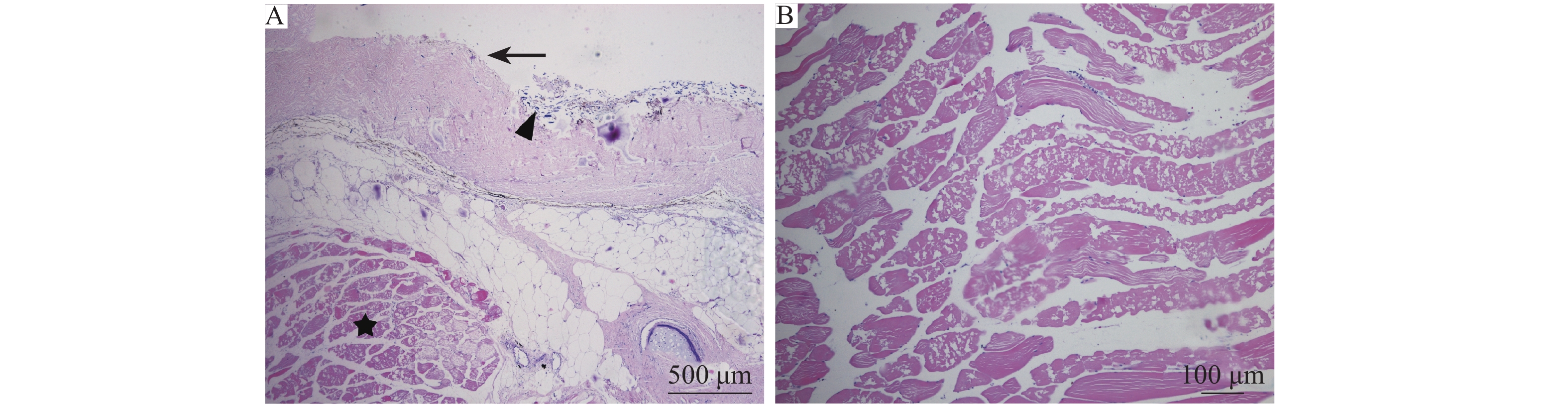
|
图 6 皮肤、肌肉组织病理检测结果 Fig. 6 Histopathological detection of skin and muscle A: 皮肤表皮层脱落(→), 真皮层可见少量水霉菌丝(▲), 肌纤维坏死(★); B: 肌纤维坏死, 呈蜂窝状 A: Skin epidermis falling off (→), a small amount of hyphae showing in the dermis layer (▲), muscle fiber necrosis (★); B: Muscle fiber necrosis with honeycomb appearance |
肠道:肠道有轻度肠炎,肠黏膜上皮细胞坏死、脱落 (图7A),部分区域固有层裸露,可见黏膜下层大量炎性细胞浸润以及轻度的黏膜细胞坏死 (图7B)。
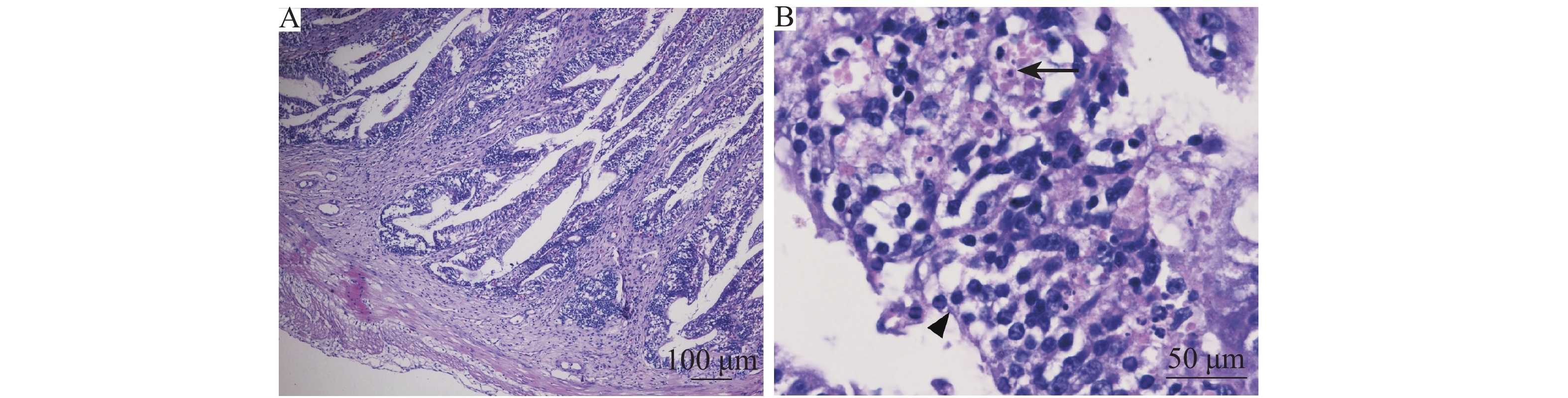
|
图 7 肠道组织病理学检测结果 Fig. 7 Histopathological detection of intestinal tissue A: 肠黏膜细胞增生, 黏膜脱落, 大量炎性细胞浸润; B: 细胞坏死(→), 炎性细胞浸润(▲) A: Intestinal mucosal cell proliferation, mucosal shedding, along with massive inflammatory cell infiltration; B: Cell necrosis (→), inflammatory cell infiltration (▲) |
除了以上器官组织具有较为典型的病变外,大脑、胃、心脏也有一定程度的病理变化。大脑具有轻微的脑膜炎,可见轻度毛细血管轻度充血;胃黏膜下有轻微炎性细胞浸润;心脏也有轻微的心外膜充血,以及少量的炎性细胞浸润。其他组织器官病变不明显。
3 致病原因分析经肉眼对病鱼进行观察发现,此次斑点叉尾鮰暴发性出血溃疡症病变位置主要为体表皮肤、肌肉溃烂、出血以及肝、脾和肾等多器官的肿大。组织病理学检测结果发现除皮肤、肌肉损伤明显外,还出现不同程度的出血性坏死性脾炎、肾炎,坏死性肝胰腺炎,坏死性肠炎,但在各病变明显的组织中并未发现细菌、寄生虫,仅在坏死脱落的皮肤肌肉处观察到少量真菌菌丝,但真菌菌丝明显仅分布于坏死皮肤病灶,未延展到肌肉组织深处及其他脏器,继发感染的可能性较大。提示机体可能由非以上病原导致的多组织器官严重病变,且病毒感染的可能性极大。从微生物检测结果来看,亦没有检测出寄生虫及细菌病原。由于CCV是斑点叉尾鮰中最常见的病毒,本实验设计特异性引物检测病鱼机体CCV感染情况。结果表明,CCV检测阴性,排除CCV感染的可能性。综合病鱼的剖检变化、组织病理学变化及微生物学检测,我们推测本病可能是由一种非CCV感染引起的疾病。具体是哪种病毒感染导致发病尚需要进一步深入研究。
4 讨论与结论随着斑点叉尾鮰的养殖密度和养殖规模的扩大,品种退化、药物滥用、养殖环境恶化等现象频发,斑点叉尾鮰疾病日益严重,其中以溃疡为主要症状的疾病是斑点叉尾鮰最常见的病症之一[7-8]。目前引起斑点叉尾鮰溃疡病的病原主要有柱状黄杆菌[9]、爱德华氏菌[10]、产气肠杆菌[11]、嗜水气单胞菌[12]等以及CCV[13]等。此次收检病例主要表现为体表皮肤和肌肉的出血性溃烂,鳍条溃烂和出血,以及唇部、下颔和腹部的点状出血等,属于典型的出血性溃疡症状。通过大体剖检及对寄生虫、细菌、CCV等进行检测,研究引起此次斑点叉尾鮰患病的病原,结果未发现患病斑点叉尾鮰有寄生虫寄生或细菌、CCV感染。组织病理学检测发现病鱼脾、肾、肝胰腺、肠道、皮肤肌肉等均出现明显的病理学改变,但未在组织中发现寄生虫、细菌的存在。综上推测,本病例可能是由一种非CCV感染引起的疾病,具体是哪种病毒感染导致发病尚需要进一步深入研究。
病理学检测结果显示,此次患病斑点叉尾鮰的病变靶器官主要为脾脏,其次为肾脏、肝胰腺、皮肤肌肉以及肠道,且对全身多个组织器官的血管系统损伤最为严重,不仅损伤了不同大小的血管,而且对红细胞也有不同程度的损伤,主要表现为严重的噬红细胞现象。大范围乃至全身性的噬红细胞是一种非常罕见的现象,常见为微生物引发的细胞因子风暴中的某个免疫环节,主要表现为机体感染微生物后,巨噬细胞过度活化,体内多种炎症因子迅速大量产生,并出现吞噬红细胞、白细胞、血小板的现象,引发噬红细胞现象的病因一般为菊酯类药物中毒[16]、寄生虫[17]、细菌[18]、病毒[19]感染等。以脾脏为主要病变靶器官的噬红细胞现象多见于病毒引发疾病[20-24]当中,如哺乳动物中,甲型H1N1病毒造成病人脾脏中明显的噬红细胞现象[20],牛白血病病毒(Bovine leukemia virus)导致日本黑牛淋巴肿瘤中出现的大量噬红细胞现象[22];在鱼类中,传染性鲑贫血病毒(Infectious salmon anaemia virus)导致大西洋鲑Salmo salar[23]和虹鳟Oncorhynchus mykiss[24]脾脏内大量噬红细胞现象等。本次检测结果中,观察到以脾脏为主的多实质器官均出现不同程度的噬红细胞现象,进一步佐证了本次对于斑点叉尾鮰暴发性疾病的疾病类型的推论。
本次疾病主要发生在春季气温变化较大的时候,温度可能是造成此次疾病暴发的条件诱因。温度升高导致水质变差,鱼体质下降,易感染疾病,加上环境微生物大量生长繁殖,毒力增强,更容易引发病害。故早春时期是该病暴发的重要时期,可利用病理学诊断方法,观察各器官病理表现,提前进行预防干预。
由于该病具有发病突然、传染快、流行广、死亡率高等特点,因此对该病的防治应根据发病特点及病原的特性有针对性地采取防控措施。根据以上诊断结果,提出相关防治建议:1) 加强饲养管理,改善水体环境条件,科学饲喂,在早春水温上升时注意防病,尽量减少环境应激的刺激;2) 对具有该病患病史的养殖池塘严格清塘和消毒,并在来年养殖中重点监护,及时隔离具有该病初期症状的患病鱼;3) 采用一些剌激性小的消毒泼洒剂和水质改良剂进行水体消毒,净化水质。此外,免疫预防是本病最有效最关键的预防措施,因此,确定该病病原种类以及针对性地研制疫苗,将在未来斑点叉尾鮰养殖中,对该病的预防控制起着重要作用。
| [1] |
钟立强, 王明华, 陈校辉, 等. 世界斑点叉尾鮰产业近况: Ⅰ: 美国斑点叉尾鮰产业现状与展望[J]. 水产养殖, 2017, 38(5): 1-5. DOI:10.3969/j.issn.1004-2091.2017.05.009 (  0) 0) |
| [2] |
PEATMAN E, BAOPRASERTKUL P, TERHUNE J, et al. Expression analysis of the acute phase response in channel catfish (Ictalurus punctatus) after infection with a Gram-negative bacterium
[J]. Dev Comp Immunol, 2007, 31(11): 1183-1196. DOI:10.1016/j.dci.2007.03.003 (  0) 0) |
| [3] |
刘金玉, 杨五名, 李爱华, 等. 斑点叉尾鮰套肠症的病原学初步研究[J]. 水生生物学报, 2008, 32(6): 824-831. (  0) 0) |
| [4] |
梁万文, 陈明, 余晓丽, 等. 斑点叉尾鮰肠败血症病原菌的分离与鉴定[J]. 西南农业学报, 2007, 20(5): 1124-1129. DOI:10.3969/j.issn.1001-4829.2007.05.056 (  0) 0) |
| [5] |
刘礼辉, 李宁求, 石存斌, 等. 斑点叉尾鮰烂鳃病病原柱状黄杆菌的分离及鉴定[J]. 安徽农业科学, 2008, 36(17): 7124-7126. DOI:10.3969/j.issn.0517-6611.2008.17.093 (  0) 0) |
| [6] |
杨移斌, 胥宁, 董靖, 等. 斑点叉尾鮰源杀鲑气单胞菌无色亚种分离鉴定及药敏特性[J]. 水生生物学报, 2017, 41(4): 787-792. (  0) 0) |
| [7] |
WAGNER B A, WISE D J, KHOO L H, et al. The epidemiology of bacterial diseases in food-size channel catfish[J]. J Aquat Anim Health, 2006, 18(4): 263-272. (  0) 0) |
| [8] |
田甜. 鱼源嗜水气单胞菌的分离鉴定及耐药性研究[D]. 武汉: 华中农业大学, 2010.
(  0) 0) |
| [9] |
SHOEMAKER C A, OLIVARES-FUSTER O, ARIAS C R, et al. Flavobacterium columnare genomovar influences mortality in channel catfish (Ictalurus punctatus)
[J]. Vet Microbiol, 2008, 127(3/4): 353-359. (  0) 0) |
| [10] |
吴杰, 汪开毓, 王均, 等. 斑点叉尾鮰出血性败血症病原分离、鉴定及组织病理学观察[C]//中国南方渔业论坛暨第二十九次学术会议论文集, 北海: 中国水产学会, 广西水产学会, 2013.
(  0) 0) |
| [11] |
CAO H, AN J, OU R, et al. Enterobacter aerogenes: An emerging pathogen for enteritis in farmed channel catfish Ictalurus punctatus
[J]. Isr J Aquacult-Bamid, 2017, 69: 1-7. (  0) 0) |
| [12] |
PRIDGEON J W, KLESIUS P H. Molecular identification and virulence of three Aeromonas hydrophila isolates cultured from infected channel catfish during a disease outbreak in west Alabama (USA) in 2009
[J]. Dis Aquat Organ, 2011, 94(3): 249-253. DOI:10.3354/dao02332 (  0) 0) |
| [13] |
WOLF K, DARLINGTON R W. Channel catfish virus: A new herpesvirus of ictalurid fish[J]. J Virol, 1971, 8(4): 525-533. (  0) 0) |
| [14] |
黄小丽, 汪开毓, 樊威, 等. 一例乌苏里拟鲿体表溃疡症的病理学诊断[J]. 南方水产科学, 2016, 12(3): 106-111. DOI:10.3969/j.issn.2095-0780.2016.03.014 (  0) 0) |
| [15] |
杜玉东, 陈孝煊, 吴志新, 等. 斑点叉尾鮰疱疹病毒PCR-ELISA检测方法的建立[J]. 华中农业大学学报, 2009, 28(5): 604-608. DOI:10.3321/j.issn:1000-2421.2009.05.020 (  0) 0) |
| [16] |
皇甫加清, 张耀光, 周传江, 等. 氯氰菊酯暴露对草鱼4种器官组织结构的影响[J]. 淡水渔业, 2011, 41(1): 53-57. DOI:10.3969/j.issn.1000-6907.2011.01.009 (  0) 0) |
| [17] |
张成旺. 全身性巴贝虫病: 噬红细胞综合症的又一原因[J]. 国外医学(寄生虫病分册), 1987(4): 190-191. (  0) 0) |
| [18] |
岑衍华. 布氏菌病患者因噬红细胞作用引起全血细胞减少四例报告[J]. 地方病译丛, 1985(4): 43-45. (  0) 0) |
| [19] |
(  0) 0) |
| [20] |
段雪晶. 新型甲型H1N1流感病理学变化及发病机制的初步研究[D]. 北京: 首都医科大学, 2012.
(  0) 0) |
| [21] |
张萍, 吴玉娥, 张钰, 等. 猴免疫缺陷病毒感染猕猴淋巴结和脾脏的病理学观察[J]. 实验动物与比较医学, 2012, 32(4): 265-269. DOI:10.3969/j.issn.1674-5817.2012.04.002 (  0) 0) |
| [22] |
ABE Y, SHOJI H, OTA K, et al. Immunohistochemical study of lymphomas of abdominal cavity origin in two cows with bovine leukemia virus[J]. Jarq-Jpn Agr Res Q, 2007, 41(2): 153-156. DOI:10.6090/jarq.41.153 (  0) 0) |
| [23] |
EVENSEN O, THORUD K E, OLSEN Y A. A morphological study of the gross and light microscopic lesions of infectious anaemia in Atlantic salmon (Salmo salar)
[J]. Res Vet Sci, 1991, 51(2): 215-222. DOI:10.1016/0034-5288(91)90017-I (  0) 0) |
| [24] |
MACWILLIAMS C, JOHNSON G, GROMAN D, et al. Morphologic description of infectious salmon anaemia virus (ISAV)-induced lesions in rainbow trout Oncorhynchus mykiss compared to Atlantic salmon Salmo salar
[J]. Dis Aquat Organ, 2007, 78(1): 1-12. (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


