肟菌酯(Trifloxystrobin),化学名称为甲基(E)−甲氧基亚胺基−{(E)−α−[1−(α,α,α−三氟间甲苯基)亚乙基氨基氧基]邻甲苯基}乙酸乙酯,化学分子式为C20H19F3N2O4,相对分子质量为408.37,属甲氧基丙烯酸酯类杀菌剂,是一种呼吸链抑制剂,杀菌谱广,活性高,对子囊菌亚门Ascomycotina、担子菌门Basidiomycota、半知菌纲Deuteromycetes和卵菌纲Oomycetes真菌都具有良好的活性[1]。植物吸收肟菌酯后,会被代谢为肟菌酸(Trifloxystrobin acid,编号为CGA321113),而肟菌酸毒性高于母体[2]。因此,有必要同时对其代谢物进行检测。美国规定,肟菌酯在咖啡豆中的农药最高残留限量(MRL)为0.02 mg·kg–1。我国暂未制定肟菌酯在咖啡中的MRL值。
目前,关于肟菌酯残留检测方法的报道较多,主要有液相色谱法[3-4]、气相色谱法[5-6]、液相色谱–串联质谱[7-8]及气相色谱–串联质谱法[9-10]等,也有关于同时检测肟菌酯和代谢物肟菌酸的研究[11-14]。但鲜见有同时检测咖啡中肟菌酯和代谢物肟菌酸的报道。本试验采用含φ为1%乙酸的乙腈超声提取,C18净化,液相色谱–质谱联用(LC-MS)测定,以期建立一种同时检测咖啡全果和咖啡豆样品中肟菌酯和代谢物肟菌酸残留的简便、快速、灵敏的分析方法。
1 材料与方法 1.1 材料肟菌酯标准品:纯度(φ)为98.7%,由Dr. Ehrenstorfer公司提供;肟菌酸标准品:纯度(φ)为99.6%,由Sigma-Aldich公司提供。
色谱级乙腈购自天津市富宇精细化工有限公司,分析级乙腈、C18净化剂和有机相针式尼龙过滤器(13 mm×0.22 μm)购自上海安谱实验科技股份有限公司。
Waters TS-Q三重四级杆质谱仪(美国Waters公司);JY2002T电子天平(上海衡平仪器仪表厂);KQ-500超声清洗仪(昆山超声仪器有限公司);SC-3612低速离心机(安徽中科中佳科学仪器有限公司);D1008E掌上离心机(大龙兴创实验仪器有限公司)。
1.2 方法 1.2.1 标准溶液和基质溶液的配制准确称取10.1 mg(精确至0.1 mg)肟菌酯和肟菌酸标准品,用乙腈定容至10 mL,配成质量浓度为10 000 mg·L–1的标准储备液,–20 ℃保存,备用。使用时用乙腈逐级稀释成50、10、5、1、0.5 μg·L–1系列质量浓度的标准工作溶液,–20 ℃下保存,备用。将10 000 mg·L–1的标准储备液用咖啡全果和咖啡豆空白基质分别稀释成50、10、5、1、0.5 μg·L–1系列质量浓度的标准工作溶液,–20 ℃保存,备用。
1.2.2 样品前处理准确称取5.0 g(精确至0.1 g)粉碎后的咖啡全果和咖啡豆样品,置50 mL离心管内,加入3 mL去离子水,再加入10 mLφ为1%乙酸的乙腈溶液,超声提取30 min;加1 g 氯化钠和2 g无水硫酸镁,超声溶解2 min,在3 500 r·min–1下离心3 min。取1 mL上清液置于预先装有20 mg C18的塑料离心管中,涡旋1 min,10 000 r·min–1离心1 min取上清液,经0.22 μm针式尼龙过滤器过滤,置于自动进样瓶中,上机检测。
1.2.3 液相色谱–质谱条件色谱柱:Acquity UPLC BEH C18,2.1 mm×50 mm×1.7 µm;柱温30 ℃,进样量5 μL,色谱流动相条件见表1。电离方式:ESI(+)电离,多反应监测(MRM)定量测定;离子喷雾电压1.0 kV;锥孔气:氮气,150 L·h–1;离子源温度150 ℃;干燥气体:氮气,650 L·h–1,温度350 ℃;碰撞气体:氩气,0.25 mL·min–1。外标法定量,其他质谱条件见表2。
|
|
表 1 色谱条件 Table 1 Chromatographic conditions |
|
|
表 2 肟菌酯和肟菌酸质谱条件 Table 2 Mass spectrometry conditions of trifloxystrobin and trifloxystrobin acid |
在咖啡全果空白样品中添加肟菌酯及其代谢物肟菌酸的标准溶液,添加的质量分数分别为0.01、0.05、0.50和2.00 mg·kg–1,每个水平重复5次;在咖啡豆空白样品中添加肟菌酯及其代谢物肟菌酸的标准溶液,添加的质量分数分别为0.01、0.05和0.50 mg·kg–1,每个水平重复5次,采用上述液相色谱−质谱联用分析方法测定回收率。在咖啡全果空白样品中添加质量分数为0.50和2.00 mg·kg–1时,因响应值超过线性范围,进样前分别稀释10和100倍;在咖啡豆空白样品中添加的质量分数为0.50 mg·kg–1时,因响应值超过线性范围,进样前稀释10倍。
2 结果与分析 2.1 液相色谱条件的优化采用梯度洗脱分离样品中的肟菌酯和肟菌酸,可以降低基质中杂质干扰,且可提高分离效果。通过比较甲醇−水、乙腈−水、甲醇−φ为0.2%甲酸水溶液、乙腈−φ为0.2%甲酸水溶液等不同的流动相,发现采用乙腈−φ为0.2%甲酸水溶液为流动相,进行梯度洗脱时,2种农药均有较高的的灵敏度和分辨率,因此选用流动相为乙腈–φ为0.2%甲酸水溶液。
2.2 提取条件的选择匀浆后的咖啡样品分别用甲醇、乙腈和丙酮作为溶剂进行提取,发现用甲醇和丙酮提取时,离心后分层不明显,上清液浑浊;用乙腈提取,离心后分层明显,且盐析效果好于前两者,有利于下一步的前处理,因此选择乙腈为提取溶剂。另外,由于肟菌酯在25 ℃中性和弱酸性条件下稳定,不易水解;在碱性条件下遇水转化成酸易离解成盐溶解于水中,且水解速率随pH的增加而增加[9]。故选择含有φ为1%乙酸的乙腈作为提取剂。在对样品进行超声提取时发现,肟菌酯和肟菌酸的提取率会随超声时间的延长而增加,但在超声30 min后,继续延长超声提取时间,肟菌酯和肟菌酸的提取率增长趋势并不明显,因此本试验选择30 min为超声提取时间。
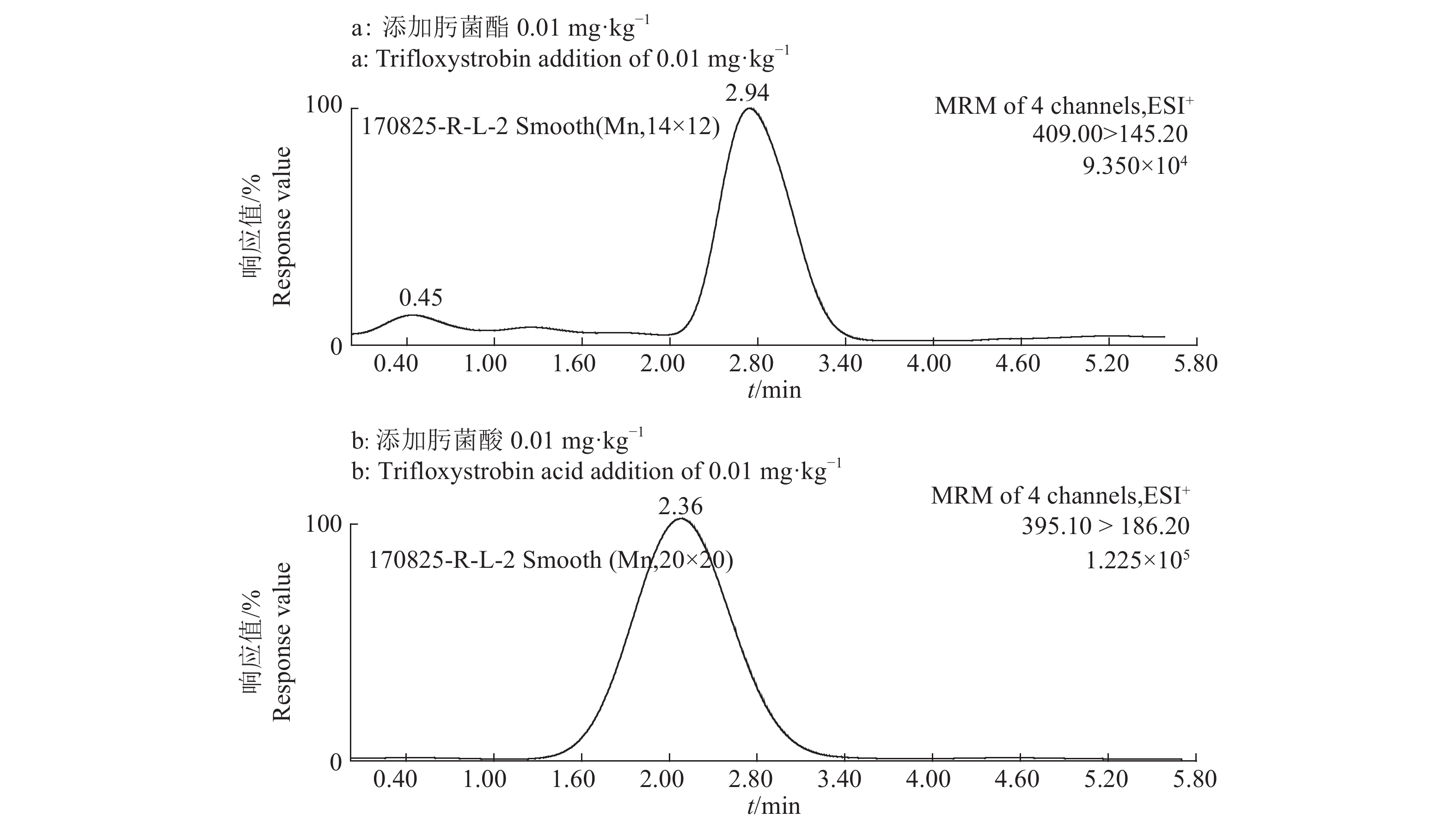
2.3 样品净化条件的选择咖啡中基质较复杂,且颗粒较细,油脂及色素等杂质含量较高[15]。本研究选用N–丙基乙二胺(PSA)、C18、石墨化碳黑粉(GCB)等净化剂进行试验,结果发现,PSA对目标物肟菌酸有较强的吸附作用;GCB对2种目标物均有较强的吸附作用,导致回收率偏低,达不到农药残留检测要求;而C18具有疏水作用,对非极性至中等极性的化合物具有吸附作用,且分离效果好,对pH具有较宽适应性。本试验采用C18作为净化剂,结果显示其具有良好的回收率(表3),咖啡豆中肟菌酯的添加回收率为83.2%~88.1%,肟菌酸的添加回收率为84.4%~105.2%。咖啡豆添加样品色谱图见图1,肟菌酯出峰时间为2.94 min,肟菌酸出峰时间为2.36 min。
|
图 1 肟菌酯和肟菌酸在咖啡豆样品中的液相色谱–质谱图 Fig. 1 Liquid chromatography-mass spectrometry maps of trifloxystrobin and trifloxystrobin acid in coffee bean samples |
在质量浓度为0.000 5~0.050 0 mg·L–1范围内,肟菌酯和肟菌酸的进样质量浓度(x)与色谱峰面积(y)之间呈较好的线性关系。肟菌酯的标准曲线为:y=60 000 000x+30 786,r=0.999 0;肟菌酸的标准曲线为:y=20 000 000x–3 732,r=0.999 8。肟菌酯在咖啡全果和咖啡豆中的保留时间分别为2.91和2.94 min;肟菌酸在咖啡全果和咖啡豆中的保留时间分别为2.31和2.36 min。
2.5 基质效应评价咖啡样品中的油脂、糖、蛋白质和色素等杂质,会影响目标峰的色谱信号,造成基质效应。可通过基质匹配校准曲线和溶剂标准曲线斜率的对比,来评估基质效应的大小。如果斜率为0~±20%,表明样品存在弱基质效应;斜率在±20%~±50之间,则存在中等基质效应;斜率超过±50%之间,则为强基质效应[16]。利用不含目标分析物的空白基质的提取液来配制标准溶液,从而消除和补偿基质效应[17]。基质效应计算公式为:基质效应=[(基质斜率/溶剂斜率)–1]×100%。由表4可见,肟菌酯在咖啡全果中基质效应为25.28%,说明咖啡全果对肟菌酯的色谱响应存在增强基质效应,肟菌酯在咖啡豆中基质效应为–36.30%,说明咖啡豆对肟菌酯的色谱响应存在减弱效应;肟菌酸在咖啡中基质效应为49.05%~144.48%,表明咖啡中的杂质对肟菌酸的色谱信号有明显的基质增强效应。因此,本试验采用基质标准曲线来消除基质效应,以使肟菌酯和肟菌酸的残留测定获得更准确的结果。
|
|
表 4 肟菌酯和肟菌酸的基质标准曲线和溶剂效应 Table 4 The matrix standard curve and solvent effect of trifloxystrobin and trifloxystrobin acid |
添加回收率试验结果(表3)表明,当咖啡全果中添加肟菌酯或肟菌酸为0.01~2.00 mg·kg–1时,肟菌酯的添加回收率为87.8%~106.7%,RSD为1.3%~5.8%;肟菌酸的添加回收率为71.5%~106.0%,RSD为1.0%~6.1%。当咖啡豆中添加肟菌酯或肟菌酸为0.01~0.50 mg·kg–1时,肟菌酯的添加回收率为83.2%~88.1%,RSD为2.0%~6.2%;肟菌酸的添加回收率为84.4%~105.2%,RSD为1.0%~5.2%。肟菌酯和肟菌酸的最小检出量均为2.5×10–12 g,最低检出限均为0.01 mg·kg–1。测定结果均达到农药残留试验准则(NY-T 788—2004)[18]的要求。
|
|
表 3 肟菌酯及肟菌酸在咖啡样品中的添加回收率 (RR) Table 3 The recovery rates (RR) of trifloxystrobin and trifloxystrobin acid in coffee samples % |
本研究采用分散固相萃取净化–液质联用技术,建立了同时测定咖啡中肟菌酯及其代谢物肟菌酸残留的方法。样品用含φ为1%乙酸的乙腈超声提取,氯化钠和无水硫酸镁盐析后,C18吸附剂净化,液相色谱–质谱联用检测。该方法优化了样品前处理及LC-MS检测条件,整个检测过程仅需5 min,大大缩短检测时间。本方法采用基质标准曲线定量,在0.01~2.00 mg·kg–1添加水平下,肟菌酯及代谢物肟菌酸的添加回收率为71.5%~106.7%之间,RSD为1.0%~6.1%,最小检出量均为2.5×10–12 g,最低检出限均为0.01 mg·kg–1,各项指标均符合农药残留检测的要求。本方法适用于咖啡样品中肟菌酯和肟菌酸残留的分析。本文中提取和净化条件仅在单因素试验上被优化,并未考虑各因素之间的交叉作用对试验结果的影响,所以可以采用正交试验或响应面试验进一步综合优化。
| [1] |
余露. 拜耳推出新型杀菌剂: 肟菌酯[J]. 农药市场信息, 2010(10): 41. (  0) 0) |
| [2] |
WANG L, LI W, LI P, et al. Residues and dissipation of trifloxystrobin and its metabolite in tomatoes and soil[J]. Environ Monit Assess, 2014, 186(11): 7793-7799. DOI:10.1007/s10661-014-3967-3 (  0) 0) |
| [3] |
ZHU J, DAI X J, FANG J J, et al. Simultaneous detection and degradation patterns of kresoxim-methyl and trifloxystrobin residues in citrus fruits by HPLC combined with QuEChERS[J]. J Environ Sci Heal B, 2013, 48(6): 470-476. DOI:10.1080/03601234.2013.761877 (  0) 0) |
| [4] |
LIKAS D T, TSIROPOULOS N G. Residue screening in apple, grape and wine food samples for seven new pesticides using HPLC with UV detection: An application to trifloxystrobin dissipation in grape and wine[J]. Intern J Environ Anal Chem, 2009, 89: 857-869. DOI:10.1080/03067310902756615 (  0) 0) |
| [5] |
周凤霞, 陈存. 气相色谱法同时测定蔬菜中醚菌酯和肟菌酯残留量的方法研究[J]. 农业环境与发展, 2009(4): 81-84. DOI:10.3969/j.issn.1005-4944.2009.04.024 (  0) 0) |
| [6] |
钱训, 陈勇达, 张少军. 固相萃取–气相色谱测定马铃薯中肟菌酯残留量[J]. 食品安全质量检测学报, 2016, 14(2): 535-539. (  0) 0) |
| [7] |
CHEN J, LOO B, RAY C. Determination of trifloxystrobin and its metabolites in Hawaii soils by ASE-LC-MS/MS[J]. J Agric Food Chem, 2008, 56(6): 1829-1837. DOI:10.1021/jf071527z (  0) 0) |
| [8] |
SANNINO A, BOLZONI L, BANDINI M. Application of liquid chromatography with electrospray tandem mass spectrometry to the determination of a new generation of pesticides in processed fruits and vegetables[J]. J Chromatogr A, 2004, 1036(2): 161-169. DOI:10.1016/j.chroma.2004.02.078 (  0) 0) |
| [9] |
MOHAPATRA S. Residue levels and dissipation behaviors for trifloxystrobin and tebuconazole in mango fruit and soil[J]. Environ Monit Assess, 2015, 187(3): 95. (  0) 0) |
| [10] |
CAO M, LI S, WANG Q, et al. Track of fate and primary metabolism of trifloxystrobin in rice paddy ecosystem[J]. Sci Total Environ, 2015, 518/519: 417-423. DOI:10.1016/j.scitotenv.2015.03.028 (  0) 0) |
| [11] |
陈莉, 贾春虹, 朱晓丹, 等. 超高效液相色谱–电喷雾串联质谱法测定戊唑醇、肟菌酯及代谢物肟菌酸在西瓜和土壤中的残留[J]. 农药, 2013, 52(2): 119-121. (  0) 0) |
| [12] |
王林. 肟菌酯及其代谢物在水稻和稻田中的残留研究[D]. 郑州: 河南农业大学, 2014.
(  0) 0) |
| [13] |
WANG L, LI W, LI P, et al. Residues and dissipation of trifloxystrobin and its metabolite in tomatoes and soil[J]. Environ Monit Assess, 2014, 186(11): 7793-7799. DOI:10.1007/s10661-014-3967-3 (  0) 0) |
| [14] |
CHEN X X, XU J, LIU X G, et al. Simultaneous determination of trifloxystrobin and trifloxystrobin acid residue in rice and soil by a modified quick, easy, cheap, effective, rugged, and safe method using ultra high performance liquid chromatography with tandem mass spectrometry[J]. J Sep Sci, 2014, 37(13): 1640-1647. DOI:10.1002/jssc.201400157 (  0) 0) |
| [15] |
陈祎平, 林昭华, 梁振益, 等. 咖啡渣油脂的提取及其脂肪酸组成研究[J]. 食品科技, 2005(12): 84-86. DOI:10.3969/j.issn.1005-9989.2005.12.027 (  0) 0) |
| [16] |
FOTOPOULOU A. Matrix effect in gas chromatographic determination of insecticides and fungicides in vegetables[J]. Int J Environ An Ch, 2004, 84(1/2/3): 15-27. (  0) 0) |
| [17] |
方旭元, 夏高峰, 石巧巧, 等. QuEChERS-GC-MS法检测当归中9种除草剂残留[J]. 华南农业大学学报, 2017, 38(6): 79-83. (  0) 0) |
| [18] |
中华人民共和国农业部. 农药残留试验准则: NY/T 788—2004[S]. 北京: 中国农业出版社, 2004: 5.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


