2. 广西果蔬保鲜和深加工人才小高地,广西 贺州 542899
2. Guangxi Talent Highland of Preservation and Deep Processing Research in Fruit and Vegetables, Hezhou 542899, China
荸荠Eleocharis tuberosa别名马蹄、地栗、乌芋等,是非常受欢迎的莎草科水生蔬菜[1]。荸荠的肉质球茎去皮后可食用,肉质清甜,口感爽脆。荸荠皮比较坚硬,洗净和削皮不易,因此卫生、方便的鲜切荸荠产品更易被消费者接受。然而,荸荠去皮后出现的黄化现象,严重影响了鲜切荸荠的品质[2]。鲜切荸荠表面黄化与传统的果蔬褐变不同,黄色物质主要由苯丙烷代谢中间产物柚皮素和圣草酚组成,而不是醌类物质[3]。因此,控制鲜切荸荠贮藏过程中的苯丙烷代谢是控制其黄化的关键。苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL)位于苯丙烷代谢途径的入口,是该代谢途径重要的限速酶,与植物组织中黄酮类物质的积累密切相关[4]。鉴于此,从荸荠中克隆PAL基因,分析其结构特征、功能及其在荸荠不同组织中的表达特征,对研究鲜切荸荠黄化机制有重要意义。
PAL最早在大麦幼苗中被分离得到[5]。随后的大量研究表明PAL活性的提高与果蔬黄酮类物质积累密切相关,同时参与了对干旱、强光、冷害、病害、机械损伤等逆境的响应,在水杨酸和乙烯信号转导途径中受到复杂的调控[6-7]。果蔬机械损伤后,受伤组织的PAL活性会迅速升高,促进伤口的木质化及愈合[8-9]。机械伤诱导PAL酶活力很可能是通过调控其编码基因合成新酶实现的。伤害信号可诱导生菜PAL基因表达,增加酶的合成量,导致其酶活力的提高,从而导致酚类物质的积累[10]。Campos等[11]研究发现,机械伤可诱导莴苣PAL1基因表达上调,热处理抑制PAL活性是通过抑制其编码基因的表达实现的,认为机械伤信号通过转录水平的调控来影响PAL活性。在组织培养过程中,切割伤害也可诱导PAL基因表达,从而导致叶片外植体的黄化[12-13]。因此,鲜切荸荠黄化可能与机械伤诱导对PAL基因转录水平的调控密切相关。目前,PAL基因已经从龙眼[14]、水稻[15]、甘蔗[16]、黄瓜[17]和南瓜[18]等植物中克隆得到,并对其表达特性进行了分析,但尚未在荸荠中克隆得到PAL基因。
PAL是苯丙烷代谢的限速酶,在鲜切荸荠黄化过程中可能起到关键作用,但荸荠中尚未见PAL基因的相关研究报道。本研究通过克隆荸荠PAL基因全长,并对其蛋白结构和功能进行生物信息学预测分析,运用荧光定量PCR分析其在荸荠不同组织及其在鲜切荸荠贮藏过程中的表达特征,为后续该基因的功能机制研究和鲜切荸荠黄化机理研究提供理论依据。
1 材料与方法 1.1 试验材料荸荠在2016年12月10日购于广西壮族自治区贺州市八步区农产品市场。原料运回实验室经清洗,挑选大小均一和无机械损伤、无病虫害的果实,去皮后横切成厚度为0.5 cm的圆片,然后用10 g·L–1次氯酸钠溶液杀菌10 min,样品分成2组,对照组在清水中浸泡10 min,处理组在10 mmol·L–1水杨酸水溶液中浸泡10 min,样品晾干后置于塑料托盘中用0.02 mm聚乙烯保鲜膜包装,于10 ℃条件下贮藏。在贮藏0(处理前)、2、4、6、8、10、12 d后分别取样,将样品放入–80 ℃超低温冰箱保存,用于后续基因克隆和表达分析。另取未做处理的健康荸荠植株的根、叶、皮和肉各组织样品用液氮速冻,置于–80 ℃条件下保存备用。
1.2 试验方法 1.2.1 荸荠总RNA提取采用华越洋植物RNA提取试剂盒提取荸荠果肉总RNA,具体方法按照说明书进行。得到RNA后通过10 g·L–1琼脂糖凝胶电泳和K5600超微量分光光度计(北京凯奥科技发展有限公司)测定其纯度和含量,RNA样品保存于–80 ℃超低温冰箱中,用于反转录等后续试验。
1.2.2 荸荠果肉PAL基因克隆3′ RACE-cDNA和5′ RACE-cDNA的合成具体操作按照SMARTer RACE 5′/3′ Kit RACE(TaKaRa)试剂盒说明书进行。根据之前从荸荠转录组数据中得到的PAL基因片段设计3′ RACE引物(5′-AGTTAATGACAATCCTCTGATCGATG-3′)和5′ RACE引物(5′-TTGTAGAAATCATTGACAAGCTCAGA-3′)。PCR反应程序为:94 ℃预变性1.5 min;94 ℃变性30 s,68 ℃退火45 s,72 ℃延伸2.5 min,25个循环;72 ℃延伸10 min,产物于4 ℃条件下保存。PCR产物经回收、连接(pRACE vector)、转化(Stellar 感受态细胞)、重组子筛选及菌液PCR鉴定后,测序委托华大基因科技股份有限公司进行。测序结果应用DNAMAN软件和NCBI在线工具对荸荠PAL基因进行序列基本结构和特征分析。
根据拼接得到的基因全长核苷酸序列设计全长PAL基因正向引物5′-CATCGCCGCTAAATTAGTTTACAA-3′,反向引物5′-AAACAAGAAAGGAATTTATTCTA-3′。以反转录cDNA为模板,进行PCR扩增,经检测和测序获得全长序列。
1.2.3 荸荠PAL基因生物信息学分析采用NCBI中的BLASTn和BLASTp程序进行核苷酸及氨基酸序列的比对;采用NCBI ORF finder程序寻找开放阅读框;利用ProtParam Tool分析蛋白质理化性质;采用NCBI的Conserved Domains和BLASTp分析氨基酸序列的保守区域;采用TargetP 1.1 Server进行氨基酸序列导肽的分析;采用SignalP 4.0 Server 预测蛋白的信号肽;采用TMHMM Server v.2.0分析氨基酸跨膜结构域;采用Post Prediction和WOLF PSORT进行蛋白亚细胞定位信号预测;ProtScale以Hphob./Kyte& Doolittle算法进行亲疏水性预测;使用NetPhos 2.0 Server预测蛋白质序列的磷酸化位点;使用Motif Scan软件分析蛋白质功能结构域;使用ExPaSy-SOPMA软件分析蛋白质的二级结构;使用Clustal X软件进行多重比对分析;采用Mega 5软件进行系统进化树构建;采用SWISS-MODEL预测蛋白质三级结构。
1.2.4 荸荠PAL基因的表达分析根据获得的荸荠PAL基因序列利用Primer 5.0设计Q-PCR正向引物5′-AGTTAATGACAATCCTCTGATCGATG-3′和Q-PCR反向引物5′-TTGTAGAAATCATTGACAAGCTCAGA-3′。采用PrimeScriptTM RT reagent Kit去除基因组和反转录试剂盒(TaKaRa)合成各样品Q-PCR的模板cDNA,操作方法见说明书。参考TaKaRa公司的SYBR Green qPCR Master Mix说明书进行Real-time PCR扩增。以18s rRNA(登录号:MG742686)为内参。利用2–△△Ct方法计算鲜切荸荠PAL基因在贮藏过程中的相对表达量。各样品的基因相对表达量均为3次生物重复的平均值。
1.2.5 数据分析利用SPSS23软件Duncan’s法对数据进行差异显著性分析,利用Origin8.5.1进行图表制作。
2 结果与分析 2.1 荸荠PAL基因全长cDNA的克隆在荸荠转录组数据库中筛选得到与其他植物PAL基因相似性较高的荸荠序列片段642 bp。利用NCBI的BLASTn进行比对,结果显示,该序列与其他植物PAL基因序列的相似度较高,其中与芭蕉Musa acuminata(KF594428.1)的相似度最高,为81%。因此,初步判断该序列为荸荠PAL基因的片段。
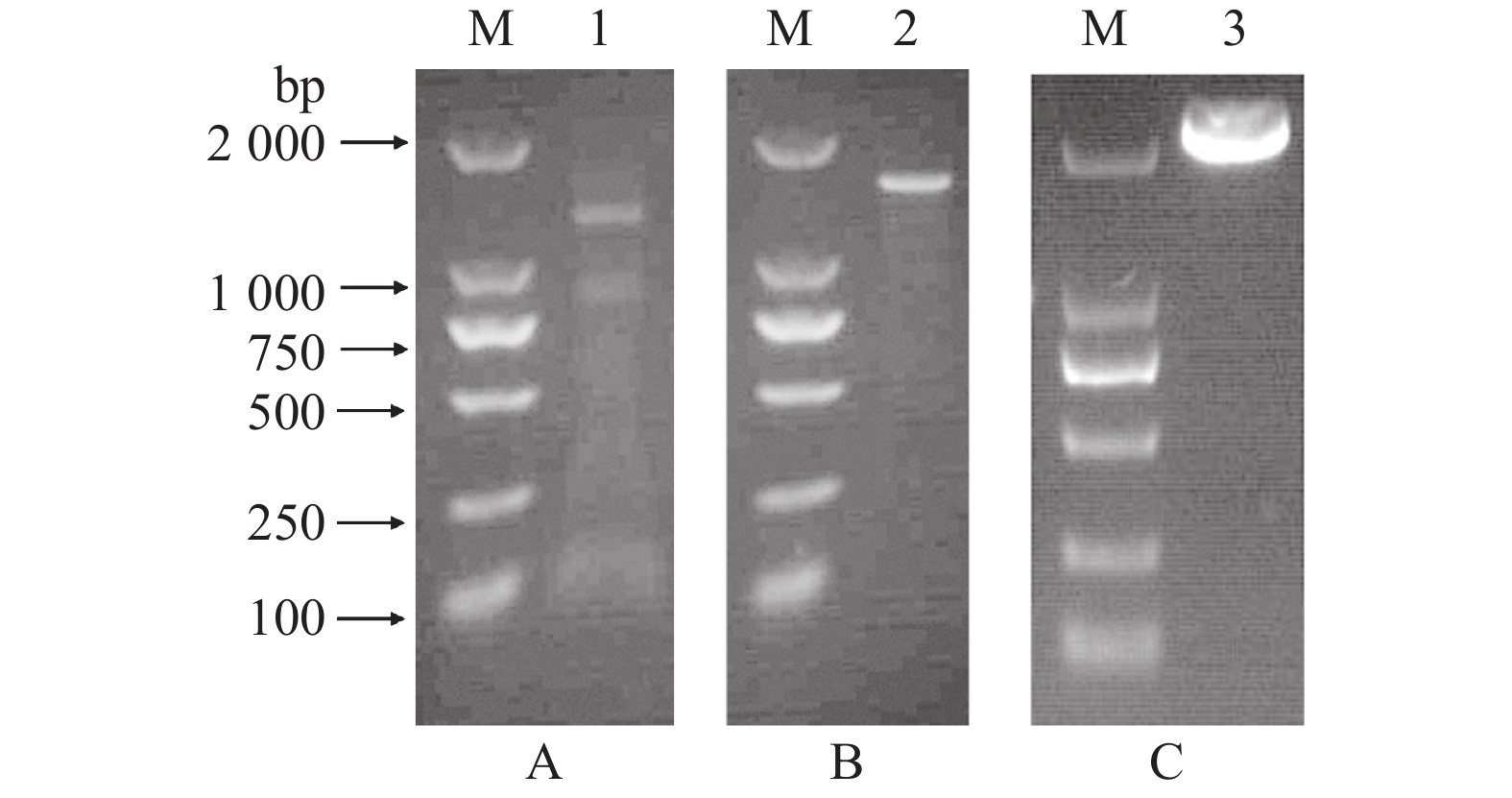
根据上述片段设计3′RACE和5′RACE引物,以荸荠果肉总RNA反转录的cDNA为模板进行PCR。PCR产物经琼脂糖凝胶电泳鉴定,获得了3′RACE产物约1 400 bp(图1A),5′ RACE产物约1 600 bp(图1B)。将片段回收并进行测序分析发现3′端序列长度为1 224 bp,包含了3′非翻译区(3′ UTR)及poly A结构;5′端序列长度为1 429 bp包含了5′非翻译区(5′ UTR)。将3′和5′端序列拼接后得到基因全长序列,在拼接序列的5′端和3′端设计引物扩增PAL的全长序列(图1C),测序结果显示,该序列与拼接结果一致。
|
图 1 荸荠果肉CwPAL基因序列扩增产物的电泳图 Fig. 1 Electrophoresis of amplified products of CwPAL gene sequence from Eleocharis tuberosa pulp M:DL2000 DNA marker;1:3′-RACE产物;2:5′-RACE产物;3:全长序列 M: DL2000 DNA marker; 1: 3′-RACE product; 2: 5′-RACE product; 3: full-length product |
利用ORF Finder软件对克隆得到的全长序列进行分析。该序列长度为2 485 bp,含有1个2 142 bp的最大开放阅读框(ORF)、131 bp的5′ UTR区、184 bp的3′UTR区及28 bp的polyA结构。序列的起始密码子ATG位于第132~134位,终止密码子为TAG,其终止密码子之后有保守序列AATAAA,为链的切断和多聚腺苷酸化提供信号。将该基因编码区全长序列在NCBI上进行比对,发现该序列与海枣Phoenix dactylifera(XM_008787032.2, XM_008806995.2)、芭蕉M. acuminata(EU856393.1)和菠萝Ananas comosus(XM_020257858.1)的PAL基因相似度较高,均大于73%。因此,可证明已经克隆获得荸荠PAL基因,将此基因命名为CwPAL,在GenBank上的登录号为MG719236。
2.2 CwPAL蛋白的生物信息学分析 2.2.1 CwPAL蛋白的理化性质CwPAL基因编码的蛋白由713个氨基酸组成。利用ProtParam在线软件预测CwPAL蛋白的理论等电点为5.97,相对分子量为78 079,总原子数为10 987个,分子式为C3437H5514N944O1058S34。组成蛋白质所用的氨基酸占比较高的为亮氨酸(Leu)、丙氨酸(Ala)、丝氨酸(Ser)和谷氨酸(Glu),分别占比为10.4%、8.1%、7.9% 和7.6%。蛋白的亲水性平均系数为–0.187,脂溶指数为89.19。
2.2.2 CwPAL蛋白的功能结构域CwPAL基因编码氨基酸序列包含PLN02457、PAL-HAL结构域,属于Lyase_I_Like超家族。CwPAL蛋白含有苯丙氨酸和组氨酸解氨酶的酶活中心,位于195~211 aa,序列为GTITASGDLVPLSYIAG。此外,还含有9个酪蛋白激酶Ⅱ识别位点,位于11~14、18~21、35~38、82~85、140~143、377~380、600~603、417~620和677~680 aa,10个蛋白激酶C识别位点位于18~20、51~53、82~84、115~117、140~142、214~216、302~304、494~496、532~534和633~635 aa,12个N–豆蔻酰化位点位于106~111、136~141、195~200、211~216、239~244、258~263、310~315、395~400、435~440、454~459、470~475和491~496 aa,以及2个糖基化位点位于257~260和439~442 aa。利用TMHMM Server 2.0预测显示CwPAL没有跨膜区域,为非跨膜蛋白。
2.2.3 CwPAL蛋白的磷酸化位点蛋白质的磷酸化是一种重要的蛋白翻译后修饰方式。利用NetPhos软件预测CwPAL蛋白的磷酸化位点。结果显示,CwPAL蛋白以丝氨酸磷酸化占主导地位,共有25个丝氨酸(Ser)、12个苏氨酸(Thr)和7个酪氨酸(Tyr)磷酸化位点,其中S18预测得分最高,为0.996。
2.2.4 CwPAL蛋白导肽、信号肽及亚细胞定位预测结果显示,CwPAL属于非分泌蛋白,其中不含有叶绿体转运肽、线粒体目标肽及分泌途径信号肽。利用WOLF PSORT和Post Prediction对CwPAL进行亚细胞定位预测,发现CwPAL蛋白定位于内质网和细胞质的可能性最大。
2.2.5 CwPAL蛋白的二级和三级结构预测CwPAL蛋白的二级结构中最主要的结构是α–螺旋占48.11%,其分散于整个蛋白质中。其他结构中无规则卷曲占28.75%,延伸链占13.46%,β–折叠占9.68%。利用Swiss-model对CwPAL蛋白的三级结构进行预测,CwPAL蛋白三级结构由软件自动匹配以香芹Petroselinum crispum的PcPAL蛋白(PDB No. 1W27.1)为参照进行构建,与参考模版相似性为80.65%。CwPAL蛋白的三级结构具有典型的“海马状”结构,包含MIO domain、Core domain和Shielding domain 3个结构域。
2.2.6 CwPAL蛋白的多重比对和系统进化树的构建通过与其他植物CwPAL蛋白比对发现不同PAL蛋白功能区域的氨基酸序列较为保守,酶活性中心位点序列高度保守,均为GTITASGDLVPLSYIAG。可见苯丙氨酸解氨酶作为植物苯丙烷类化合物生物合成途径中的限速酶,在进化的过程中保持了较高的遗传稳定性。为了了解CwPAL蛋白与其他植物PAL蛋白的进化关系,用ClastalX软件进行氨基酸序列比对,采用MEGA 5软件的Neighbor-Joining法构建系统进化树(图2)。结果表明,CwPAL蛋白与海枣(XP_008805217.1)和菠萝(OAY76951.1)的PAL蛋白亲缘关系较近。

|
图 2 CwPAL蛋白与其他植物PAL蛋白的系统进化树 Fig. 2 Phylogenetic tree of CwPAL protein and PAL proteins from other plants |
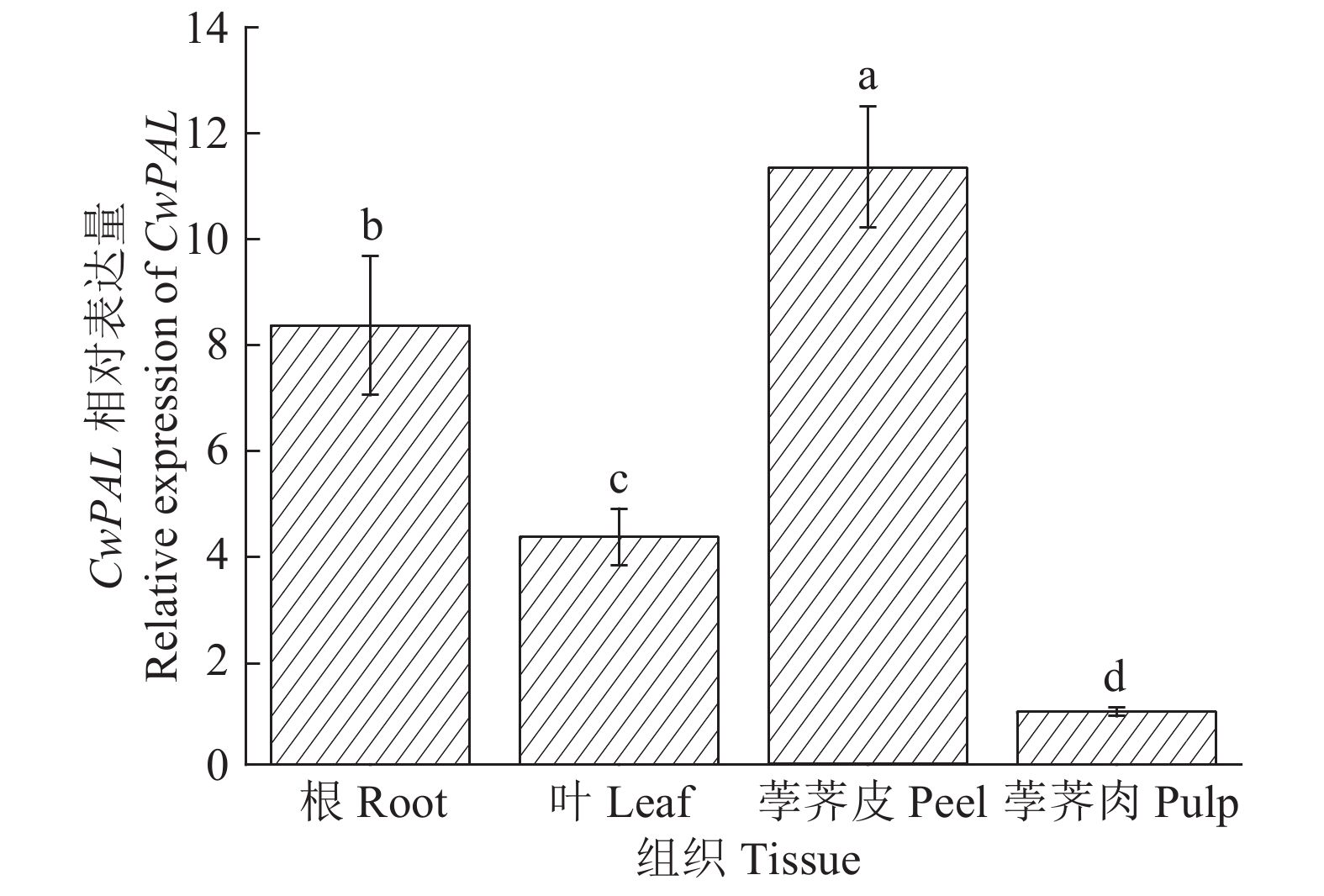
采用荧光定量PCR技术分析CwPAL基因在根、叶、荸荠皮和荸荠肉中的表达特征。结果表明,CwPAL基因在4个组织中均有表达,但表达量有显著差异(P<0.05),其中荸荠皮中的表达水平最高,其次是根,而在荸荠肉的表达最低(图3)。
|
图 3 CwPAL基因在荸荠中的组织特异性表达 Fig. 3 Tissue-specific expression of CwPAL gene in Eleocharis tuberosa 图中数据为3次重复的平均值±标准差,柱子上不同小写字母表示差异显著(P<0.05, Duncan’s法) The data were |
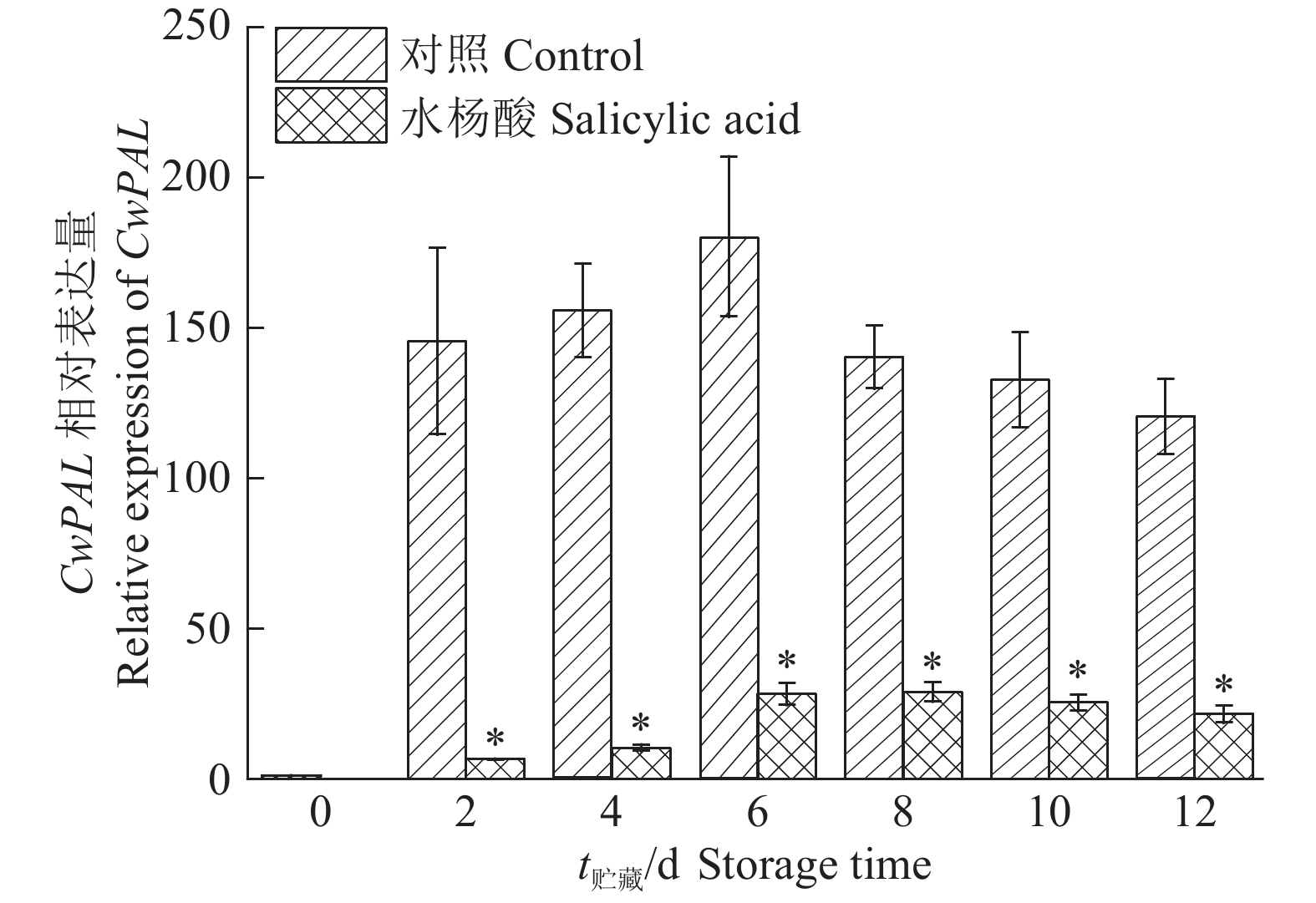
鲜切荸荠在贮藏过程中,对照组CwPAL基因在贮藏2 d后比贮藏0 d的表达量提高了145.6倍,之后表达量继续升高,贮藏6 d后表达量逐渐下降,但在12 d后CwPAL基因的表达水平仍显著高于0 d(P<0.05)(图4)。10 mmol·L–1水杨酸处理能够显著抑制荸荠黄化,通过表达分析发现,水杨酸处理组CwPAL基因的表达量在贮藏过程中呈先上升后下降的趋势,在贮藏过程中各时间点均显著低于对照组(P<0.05)(图4)。
|
图 4 鲜切荸荠在贮藏过程中CwPAL基因表达的变化
Fig. 4 Changes of CwPAL gene expression during the storage process of fresh-cut Eleocharis tuberosa 图中数据为3次重复的平均值±标准差,“*” 表示与相同贮藏时间的对照差异显著(P<0.05,t检验) The data were |
表面黄化是影响鲜切荸荠贮藏品质的关键因素。鲜切荸荠的黄化现象与传统多酚氧化酶(Polyphenol oxidase, PPO)、过氧化物酶(Peroxidase, POD)参与的酶促褐变不同,苯丙烷代谢途径中间产物柚皮素和圣草酚的积累可能是导致鲜切荸荠黄化的原因[3]。苯丙氨酸解氨酶(PAL)是苯丙烷代谢的关键酶,其活性的高低直接影响下游黄酮类物质的合成[19]。但在荸荠中对PAL的研究主要集中在不同处理对鲜切荸荠贮藏过程中PAL酶活性的影响,未见有荸荠PAL基因全长克隆及其表达特性研究的报道。本研究在荸荠转录组数据库发现了1个与其他植物中PAL相似性较高的基因片段,通过比对初步推测其为荸荠的PAL基因,随后通过RACE技术从荸荠中克隆得到了PAL全长序列。该序列全长为2 485 bp,含有1个2 142 bp的ORF,可编码713个氨基酸,相对分子质量为78 079,将其命名为CwPAL。其编码的氨基酸长度与尾叶桉[20]、象草[21]相似,而明显长于南瓜中的PAL蛋白[18]。PAL基因在高等植物中多以基因家族形式出现,淫羊藿中有3个PAL基因,分别涉及木质素、花青素和黄酮的合成[22]。拟南芥中的4个PAL基因在不同器官中的表达量不同[23]。然而,在象草中只克隆得到了1个PAL基因[21]。本研究在荸荠转录组数据中只筛选得到了1个PAL基因片段,因此,荸荠中是否也存在PAL基因家族,仍需进一步研究。
对CwPAL编码蛋白进行生物信息学分析发现其含有苯丙氨酸和组氨酸解氨酶的保守酶活性位点(GTITASGDLVPLSYIAG),此外还含有9个酪蛋白激酶Ⅱ识别位点,10个蛋白激酶C识别位点,12个N–豆蔻酰化位点,及2个糖基化位点。CwPAL蛋白中这些保守位点及其分布情况与甘蔗[16]和玉米[24]的PAL非常相似。CwPAL同源建模结果与Calabrese等[25]利用射线晶体分析法得到的PAL三维结构相似,均为四聚体结构,形成典型“海马状”结构。植物的PAL为同源四聚体,每个亚基与另外2个亚基头尾相连,增强了邻近亚基的相互作用[26]。蛋白多重比对结果显示,荸荠CwPAL编码的氨基酸序列与其他物种PAL蛋白具有较高的相似性,特别是苯丙氨酸解氨酶和组氨酸解氨酶标签序列有高度的保守性。进化树分析发现,CwPAL与菠萝和海枣PAL蛋白亲缘关系最近,同时发现不同植物的PAL间也有很高的相似性,表明PAL作为苯丙烷代谢途径的第1个关键酶在进化过程中保持了较高的遗传稳定性。
PAL基因在植物中的表达水平与木质素的合成和黄酮类物质的积累密切相关。本试验利用荧光定量分析CwPAL基因在不同组织中的表达特性发现,其在荸荠皮中的的表达量最高,而在荸荠肉中的表达量最低。荸荠皮中含有大量的黄酮类物质,如柚皮素、圣草酚、木犀草素等[27]。因此,推测CwPAL可能参与了荸荠皮中黄酮类物质的合成过程。本试验发现,经切分处理后PAL基因的表达量迅速提高,与荸荠表面黄化表现出了明显的相关性。这表明切分处理可能快速诱导PAL基因的表达,从而增加了PAL新酶的合成,导致苯丙烷代谢途径下游黄色产物的积累。以往研究发现,红花在损伤3 h后即可诱导CtPAL的表达[28]。PAL基因对伤害信号的响应在鸭梨[8]、甜瓜[29]和萝卜[30]等植物的研究中也得到证实。水杨酸(Salicylic acid, SA)可以诱导植物苯丙烷途径中PAL和C4H等关键酶编码基因的表达和激发新酶合成,提高果蔬抗性[31]。然而,在采后竹笋[32]、菠萝[33]和石榴[34]的研究中发现外源施用水杨酸可以抑制PAL活性的上升和酚类物质的积累,并延缓褐变的发生。因此,水杨酸对植物PAL酶活的影响较为复杂。Peng等[35]利用水杨酸处理有效地抑制了鲜切荸荠贮藏过程中的PAL酶活力上升和表面黄化,但并不清楚水杨酸抑制PAL酶活力的机理。本试验发现,10 mmol·L–1水杨酸处理显著抑制了鲜切荸荠的黄化和贮藏过程中CwPAL基因的表达。可见,切分处理造成的机械损伤诱导PAL基因表达可能是鲜切荸荠黄化的主要原因。
| [1] |
潘永贵, 陈维信. 鲜切荸荠中黄化物质研究[J]. 食品研究与开发, 2008, 29(2): 33-36. DOI:10.3969/j.issn.1005-6521.2008.02.011 (  0) 0) |
| [2] |
PENG L T, JIANG Y M. Effects of chitosan coating on shelf life and quality of fresh-cut Chinese water chestnut[J]. LWT-Food Sci Technol, 2003, 36(3): 359-364. DOI:10.1016/S0023-6438(03)00024-0 (  0) 0) |
| [3] |
PAN Y G, Li Y X, YUAN M Q. Isolation, purification and identification of etiolation substrate from fresh-cut Chinese water-chestnut (Eleocharis tuberosa)
[J]. Food Chem, 2015, 186: 119-122. DOI:10.1016/j.foodchem.2015.03.070 (  0) 0) |
| [4] |
HUANG J, GU M, LAI Z, et al. Functional analysis of the Arabidopsis PAL gene family in plant growth, development, and response to environmental stress
[J]. Plant Physiol, 2010, 153(4): 1526-1538. DOI:10.1104/pp.110.157370 (  0) 0) |
| [5] |
KOUKOL J, CONNE E. The metabolism of aromatic compounds in higher plants[J]. J Bio Chem, 1961, 236(10): 2692-2698. (  0) 0) |
| [6] |
ZHANG X, LIU C J. Multifaceted regulations of gateway enzyme phenylalanine ammonia-lyase in the biosynthesis of phenylpropanoids[J]. Mol Plant, 2015, 8(1): 17-27. DOI:10.1016/j.molp.2014.11.001 (  0) 0) |
| [7] |
DIXONR A, PAIVAN L. Stress-induced phenylpropanoid metabolism[J]. Plant Cell, 1995, 7(7): 1085-1097. DOI:10.1105/tpc.7.7.1085 (  0) 0) |
| [8] |
闫洪波, 程玉豆, 何近刚, 等. 鸭梨PAL克隆及其在果实发育和机械伤害过程中的表达
[J]. 中国农业科学, 2014, 47(21): 4341-4348. DOI:10.3864/j.issn.0578-1752.2014.21.019 (  0) 0) |
| [9] |
SALTVEITM E. Wound induced changes in phenolic metabolism and tissue browning are altered by heat shock[J]. Postharvest Biol Tec, 2000, 21(1): 61-69. DOI:10.1016/S0925-5214(00)00165-4 (  0) 0) |
| [10] |
LOPEZ G, SALTVEITM E, CANTWELL M. Wound-induced phenylalanine ammonia lyase activity: Factors affecting it induction and correlation with the quality of minimally processed lettuce[J]. Postharvest Biol Tec, 1996, 9(2): 223-233. DOI:10.1016/S0925-5214(96)00050-6 (  0) 0) |
| [11] |
CAMPOS-VARGAS R, NONOGAKI H, SUSLOW T, et al. Heat shock treatments delay the increase in wound-induced phenylalanine ammonia-lyase activity by altering its expression, not its induction in Romaine lettuce (Lactuca sativa) tissue
[J]. Physiol Plantarum, 2005, 123(1): 82-91. DOI:10.1111/ppl.2005.123.issue-1 (  0) 0) |
| [12] |
RU Z W, LAI Y Y, XU C J, et al. Polyphenol oxidase (PPO) in early stage of browning of phalaenopsis leaf explants[J]. J Agr Sci, 2013, 5(9): 57-64. (  0) 0) |
| [13] |
许传俊, 李红, 李玲. 蝴蝶兰叶片外植体褐变过程中PAL基因的表达变化
[J]. 热带亚热带植物学报, 2007, 15(1): 50-54. DOI:10.3969/j.issn.1005-3395.2007.01.009 (  0) 0) |
| [14] |
郑洁红, 邱栋梁. 龙眼叶片PAL基因的克隆与表达研究[J]. 热带作物学报, 2012, 33(1): 79-83. DOI:10.3969/j.issn.1000-2561.2012.01.017 (  0) 0) |
| [15] |
GIBERTI S, BERTEA C M, NARAYANA R, et al. Two phenylalanine ammonia lyase isoforms are involved in the elicitor-induced response of rice to the fungal pathogen Magnaporthe oryzae
[J]. J Plant Physiol, 2012, 169(3): 249-254. DOI:10.1016/j.jplph.2011.10.008 (  0) 0) |
| [16] |
宋修鹏, 黄杏, 莫凤连, 等. 甘蔗苯丙氨酸解氨酶基因(PAL)的克隆和表达分析
[J]. 中国农业科学, 2013, 46(14): 2856-2868. DOI:10.3864/j.issn.0578-1752.2013.14.002 (  0) 0) |
| [17] |
SHANG Q M, LI L, DONG C J. Multiple tandem duplication of the phenylalanine ammonia-lyase genes in Cucumis sativus, L
[J]. Planta, 2012, 236(4): 1093-1105. DOI:10.1007/s00425-012-1659-1 (  0) 0) |
| [18] |
刘佳, 徐秉良, 薛应钰, 等. 美洲南瓜(Cucurbita pepo)种皮苯丙氨酸解氨酶基因克隆与表达分析
[J]. 中国农业科学, 2014, 47(6): 1216-1226. DOI:10.3864/j.issn.0578-1752.2014.06.019 (  0) 0) |
| [19] |
YIN R, MESSNER B, FAUSKESSLER T, et al. Feedback inhibition of the general phenylpropanoid and flavonol biosynthetic pathways upon a compromised flavonol-3-O-glycosylation[J]. J Exp Bot, 2012, 63(7): 2465-2478. DOI:10.1093/jxb/err416 (  0) 0) |
| [20] |
潘文, 张卫华, 杨会肖, 等. 尾叶桉苯丙氨酸解氨酶基因的克隆、表达与单核苷酸多态性分析[J]. 华南农业大学学报, 2018, 39(2): 89-94. (  0) 0) |
| [21] |
陈卫卫, 唐然, 吴昱煜, 等. 象草PAL基因克隆及其蛋白质结构与功能预测[J]. 草地学报, 2016, 24(1): 137-145. (  0) 0) |
| [22] |
郭新红, 喻达时, 王婕, 等. 6种植物中木质纤维素含量的比较研究[J]. 湖南大学学报(自科版), 2008, 35(9): 76-78. (  0) 0) |
| [23] |
COCHRANEF C, DAVINL B, LEWISN G. The Arabidopsis phenylalanine ammonia lyase gene family: Kinetic characterization of the four PAL isoforms
[J]. Phytochemistry, 2004, 65(11): 1557-1564. DOI:10.1016/j.phytochem.2004.05.006 (  0) 0) |
| [24] |
RÖSLER J, SCHMID J. Maize phenylalanine ammonia-lyase has tyrosine ammonia-lyase activity[J]. Plant Physiol, 1997, 113(1): 175-179. DOI:10.1104/pp.113.1.175 (  0) 0) |
| [25] |
CALABRESEJ C, JORDAN D B, BOODHOO A, et al. Crystal structure of phenylalanine ammonia lyase: Multiple helix dipoles implicated incatalysis[J]. Biochemistry, 2004, 43(36): 11403-11416. DOI:10.1021/bi049053+ (  0) 0) |
| [26] |
RITTER H, SCHULZG E. Structural basis for the entrance into the phenylpropanoid metabolism catalyzed by phenylalanine ammonia-lyase[J]. Plant Cell, 2004, 16(12): 3426-3436. DOI:10.1105/tpc.104.025288 (  0) 0) |
| [27] |
LUO Y, LI X, HE J, et al. Isolation, characterisation, and antioxidant activities of flavonoids from chufa (Eleocharis tuberosa) peels
[J]. Food Chem, 2014, 164(3): 30-35. (  0) 0) |
| [28] |
DEHGHAN S, SADEGHI M, PÖPPEL A, et al. Differential inductions of phenylalanine ammonia-lyase and chalcone synthase during wounding, salicylic acid treatment, and salinity stress in safflower, Carthamus tinctorius
[J]. Bioscience Rep, 2014, 34(3): 689-699. (  0) 0) |
| [29] |
DIALLINAS G, KANELLIS A K. A phenylalanine ammonia-lyase gene from melon fruit: cDNA cloning, sequence and expression in response to development and wounding[J]. Plant Mol Biol, 1994, 26(1): 473-479. DOI:10.1007/BF00039557 (  0) 0) |
| [30] |
BECERRA-MORENO A, REDONDO-GIL M, BENAVIDES J, et al. Combined effect of water loss and wounding stress on gene activation of metabolic pathways associated with phenolic biosynthesis in carrot[J]. Front Plant Sci, 2015, 6: 836-837. (  0) 0) |
| [31] |
CHEN J Y, WEN P F, KONG W F, et al. Effect of salicylic acid on phenylpropanoids and phenylalanine ammonia-lyase in harvested grape berries[J]. Postharvest Biol Tech, 2006, 40(1): 64-72. DOI:10.1016/j.postharvbio.2005.12.017 (  0) 0) |
| [32] |
LUO Z, WU X, XIE Y, et al. Alleviation of chilling injury and browning of postharvest bamboo shoot by salicylic acid treatment[J]. Food Chem, 2012, 131(2): 456-461. DOI:10.1016/j.foodchem.2011.09.007 (  0) 0) |
| [33] |
LU X, SUN D, LI Y, et al. Pre- and post-harvest salicylic acid treatments alleviate internal browning and maintain quality of winter pineapple fruit[J]. Sci Hortic-Amsterdam, 2011, 130(1): 97-101. DOI:10.1016/j.scienta.2011.06.017 (  0) 0) |
| [34] |
SAYYARI M, BABALAR M, KALANTARI S, et al. Effect of salicylic acid treatment on reducing chilling injury in stored pomegranates[J]. Postharvest Biol Tec, 2009, 53(3): 152-154. DOI:10.1016/j.postharvbio.2009.03.005 (  0) 0) |
| [35] |
PENG L T, JIANG Y M. Exogenous salicylic acid inhibits browning of fresh-cut Chinese water chestnut[J]. Food Chem, 2006, 94(4): 535-540. DOI:10.1016/j.foodchem.2004.11.047 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


