2. 中国科学技术大学 生命科学学院,安徽 合肥 230026
2. School of Life Sciences,University of Science and Technology of China, Hefei 230026, China
我国是农业大国,有着丰富的稻秆资源。但稻秆纤维素结构复杂、难降解,农业实践中大多采用就地燃烧的方式还田,资源利用不充分,并且对环境造成巨大污染。目前,利用生物学手段开发清洁的新能源已成为世界各国解决环境污染和资源利用矛盾的重要方式之一[1]。稻秆中富含营养元素,其降解还田有利于土壤有机质的提高,稻秆的原位还田能够增加土壤肥力,有效提高农作物的质量和产量[2-4]。还田稻秆的生物降解主要由土壤微生物产生的一系列水解酶完成,然而稻秆表面具有一层蜡质,且其结构复杂,使一般的微生物降解纤维素十分困难,纤维素的分解利用效率不高[5-6]。因此需要对稻秆进行预处理,目前该研究主要集中在稻秆的预处理手段方面,其主要有物理、化学和生物途径。但是我国的稻秆预处理研究还相对较少,研究层面较浅,预处理的基础方法不够成熟,还不能大规模地、高效地应用到农业生产中去[7]。找到合适有效的秸秆处理方法且大规模地在田间推广应用,是推动我国秸秆资源综合利用发展的重要课题。常用的化学预处理法是利用化学试剂对作物秸秆进行作用,使细胞壁中纤维素和木质素之间的联系不再紧密,从而使秸秆消化率得到提高。化学处理中常用碱化处理法,氢氧化钠处理稻秆效果较好,也比较实用,因此在化学处理运用中较为普遍[8-9]。然而,化学处理稻秆成本较高,在大田生产中广泛应用可能性较小。更多的研究表明,稻秆还田时配施秸秆腐解菌剂(即含有高效降解秸秆能力的微生物),可以降低稻秆还田的不利影响,提高腐解效率[10-12]。
本研究从芜湖地区林下土壤中筛选纤维素分解菌,对其进行分离鉴定,利用产生的纤维素酶降解稻秆,探究菌株产生的纤维素酶的特性,测定不同条件下的稻秆降解率,利用该菌株在实验室条件下降解稻秆后的发酵液探究其对小麦幼苗生长的影响。
1 材料与方法 1.1 土壤来源2016年6月于安徽省芜湖市神山公园林下采取土样。拂去表面落叶层,取地表下5~10 cm层土壤。
1.2 培养基及配方稻秆粉培养基:配方参考Yao等[13]略作改动。KH2PO4 1.00 g,MgSO4·7H2O 0.40 g,CaCl2 0.10 g,FeCl3 0.01 g,NaCl 0.20 g,(NH4)2SO4 3.00 g,稻秆粉 20 g,琼脂 18 g,蒸馏水定容至1 000 mL。
刚果红−羧甲基纤维素钠培养基:配方参考张超等[14]。
LB固体培养基:蛋白胨10.00 g,酵母膏5.00 g,NaCl 10.00 g,琼脂12.00 g,蒸馏水定容至1 000 mL。
液体发酵产酶培养基:取2.50 g烘干成恒质量的稻秆段(长度2~3 cm),加120 mL营养液。营养液配方:KH2PO4 1.00 g,MgSO4·7H2O 0.40 g,CaCl2 0.10 g,FeCl3 0.01 g,NaCl 0.20 g,(NH4)2 SO4 3.00 g,蒸馏水定容至1 000 mL。
滤纸条崩解培养基:KH2PO4 1.00 g,MgSO4·7H2O 0.40 g,(NH4)2SO4 3.00 g,酵母膏0.10 g,蒸馏水定容至1 000 mL。
Mandels营养液:配方参考Kang等[15]。
以上培养基的pH控制在7.2~7.5,121 ℃条件下高温湿热灭菌30 min。
1.3 菌株的筛选取8 g土样,加3 g稻秆段及100 mL蒸馏水,160 r·min–1摇瓶震荡富集10 d,取1 mL土样溶液稀释成10–3、10–4、10–5和10–6共 4个梯度,再依次取100 μL涂布于稻秆粉培养基平板上,37 ℃条件下培养约2 d,挑选长势较好的单菌落,反复划线培养。再将效果较好的菌株转接到刚果红−羧甲基纤维素钠培养基上进行复筛,参考菌株在平板上水解圈直径(D)与菌落直径(d)的比值,选取效果最好的菌株作为研究对象[16]。
1.4 菌株鉴定 1.4.1 形态学鉴定观察其菌落与菌体形态,并进行革兰氏染色镜检。
1.4.2 分子鉴定使用细菌基因组DNA提取试剂盒,提取该菌株的基因组DNA,送至上海派森诺生物科技股份有限公司进行16S rDNA 测序分析,运用NCBI Blast分析工具对测序结果进行相似性比对,鉴定菌株。
1.5 菌株生长曲线和纤维素酶活力变化曲线测定试验过程中,菌株的接种量(
将活化后的菌株接种到LB液体培养基,每隔2 h取样,测定D600 nm值。
1.5.2 纤维素酶活力变化曲线测定将菌株接种到液体发酵产酶培养基中,160 r·min–1摇床培养15 d,每隔24 h取样,4 000 r·min–1离心10 min,留上清液作为粗酶液[17]。纤维素酶活力测定:以1 mg·mL–1 葡萄糖标准溶液作为底物,通过D540 nm值测定得到标准曲线,具体原理参考DNS法[18-19]。在50 ℃、pH 4.6 条件下,每分钟催化水解纤维素生产1 μg 葡萄糖所需要的酶量定义为1个酶活力单位(U)。
1.6 不同反应条件下的纤维素酶活力测定将菌株接种到液体发酵产酶培养基中,160 r·min–1摇床培养5 d,离心获得粗酶液,用于纤维素酶特性的研究。纤维素酶活力测定的具体原理方法和步骤参考DNS法[18-19]。一方面,在50 ℃条件下,分别以质量浓度为0.01 g·mL–1的CMC-Na溶液、滤纸条和稻秆粉为底物测定纤维素酶活力,另一方面,以稻秆粉为底物,测定并比较不同温度条件下的纤维素酶活力。
1.6.1 以CMC-Na溶液为底物测定酶活力取1.5 mL质量浓度为0.01 g·mL–1的CMC-Na溶液,50℃预热。试验组添加1 mL粗酶液,对照组添加1 mL沸水浴灭活的粗酶液,测定酶活力。
1.6.2 以滤纸条为底物测定酶活力取2条1 cm×4 cm的滤纸条,添加0.1 mol·L–1的醋酸−醋酸钠缓冲液(pH 4.6) 1.5 mL ,测定酶活力。
1.6.3 以稻秆粉为底物测定酶活力以0.20 g稻秆粉为底物,加入0.1 mol·L–1的醋酸−醋酸钠缓冲液(pH 4.6) 1.5 mL,测定酶活力。
1.6.4 不同温度条件下的纤维素酶活力测定以0.20 g稻秆粉为底物,分别测定40、45、50、55、60和65 ℃梯度反应条件下的纤维素酶活力。
1.7 菌株高效降解纤维素特性的检验 1.7.1 稻秆残渣中纤维素含量检测分别将摇床培养发酵5、10和15 d的对照组和试验组降解后稻秆的残渣烘干至恒质量,剪碎。分别取0.1 g稻秆残渣,测定纤维素含量,并计算出纤维素的降解率[20]。
纤维素降解率=(M1−M2)/M1×100%,其中M1为对照组稻秆残渣中纤维素的含量,M2为试验组稻秆残渣中纤维素的含量。
1.7.2 滤纸条崩解试验将活化后的菌株接种到滤纸条崩解培养基,每个三角瓶中放3条1 cm×6 cm的滤纸条,37 ℃条件下130 r·min–1摇瓶培养,以未加菌株的试验为对照,定期观察滤纸条崩解情况。
1.7.3 土培降解试验活化后的菌株接种到LB液体培养基,培养18 h,取6.0 g烘干成恒质量的稻秆段(长度2~3 cm)装在40目尼龙纱网袋中,将网袋放入内置 5.0 kg 土壤的花盆内,每个处理加入Mandels 营养液30 mL和菌液15 mL,覆土约5 cm,适量浇水浸透土壤。对照组用等量蒸馏水代替菌液。所有花盆随机摆放于温室中,环境温度在 20~25 ℃。分别将降解10、20、30和40 d 后剩余残渣取出,洗净,烘干至恒质量,测定稻秆质量变化动态,计算稻秆相对降解率(RDR)[21]。
RDR=(m1−m2)/m1×100%,其中,m1为对照组残渣的质量,m2为试验组残渣的质量。
1.8 检验菌株耐高温生长特性菌株活化扩增后,取1 mL菌液于EP管中,65 ℃水浴处理5 d,吸取100 μL于刚果红–纤维素平板上,涂布均匀,45 ℃条件下培养约2 d,观察菌株的生长和透明圈情况[22]。
1.9 菌株与化学物质组合降解稻秆用质量浓度为0.05 g·mL–1的NaOH溶液浸泡稻秆段(长度约3 cm),处理24 h后清洗并烘干。对照组稻秆用蒸馏水浸泡处理相同时间。用上述处理后的稻秆配制液体发酵产酶培养基,添加筛选到的菌株,分别在160 r·min–1摇床培养7和14 d时,取出稻秆残渣,清洗并烘干,计算稻秆质量损失率。
1.10 稻秆降解后发酵液对植物生长的影响在农业生产中,筛选纤维素高效降解菌并制作菌剂的目的是加快稻秆降解,使稻秆中的营养物质原位还田,促进农作物生长,减少化肥的使用。因此,在本研究中设计相关试验,探究在实验室条件下稻秆降解后的发酵液对小麦幼苗生长的影响[23]。设置4组试验。A组:将Hoagland's营养液作为植物培养液;B组:蒸馏水浸泡处理稻秆段24 h,洗净、烘干后作为原料,配制液体发酵产酶培养基,不添加菌株;C组:菌株接种量(φ)为3%,其余处理同B组;D组:质量浓度为0.05 g·mL–1的NaOH溶液处理稻秆段24 h,其余处理同C组。
160 r·min–1摇瓶培养9 d,发酵液4 000 r·min–1离心10 min,留上清液。避免发酵液浓度过高,上清液与蒸馏水按体积比1︰3混合。培养皿底部铺1层薄的、均匀的脱脂棉,再覆盖1张滤纸,每个培养皿中播种小麦种子20粒,分别加入Hoagland's营养液或相应的植物培养液20 mL。置于25 ℃光照培养箱中培养12 d,期间每天中午、晚上分别添加相应的培养液5 mL。
1.11 数据分析与处理数据处理使用Excel 2010程序和SPSS 19.0等统计分析软件。采用生物统计学最小显著差数法(LSD法)对试验数据结果进行多重比较。
2 结果与分析 2.1 菌株的筛选与鉴定选取在刚果红−羧甲基纤维素钠培养基平板上长势最好的菌株作为研究对象,命名为CX1。以菌株在羧甲基纤维素钠平板上D/d作为标准判断其纤维素降解能力,一般情况下D/d越大说明对纤维素的分解能力更强[24]。在平板上D为水解圈直径,d为菌落直径;d菌落直径一般不变,D水解圈越大,即D/d越大,表明菌株产纤维素酶能力越强,降解纤维素能力越强。如图1所示,菌株CX1在平板上长势较好,D/d为5,说明菌株CX1能较好地降解纤维素。

|
图 1 菌株CX1在刚果红−纤维素平板上的透明圈 Fig. 1 Transparent circle of strain CX1 on Congo red-cellulose plate |
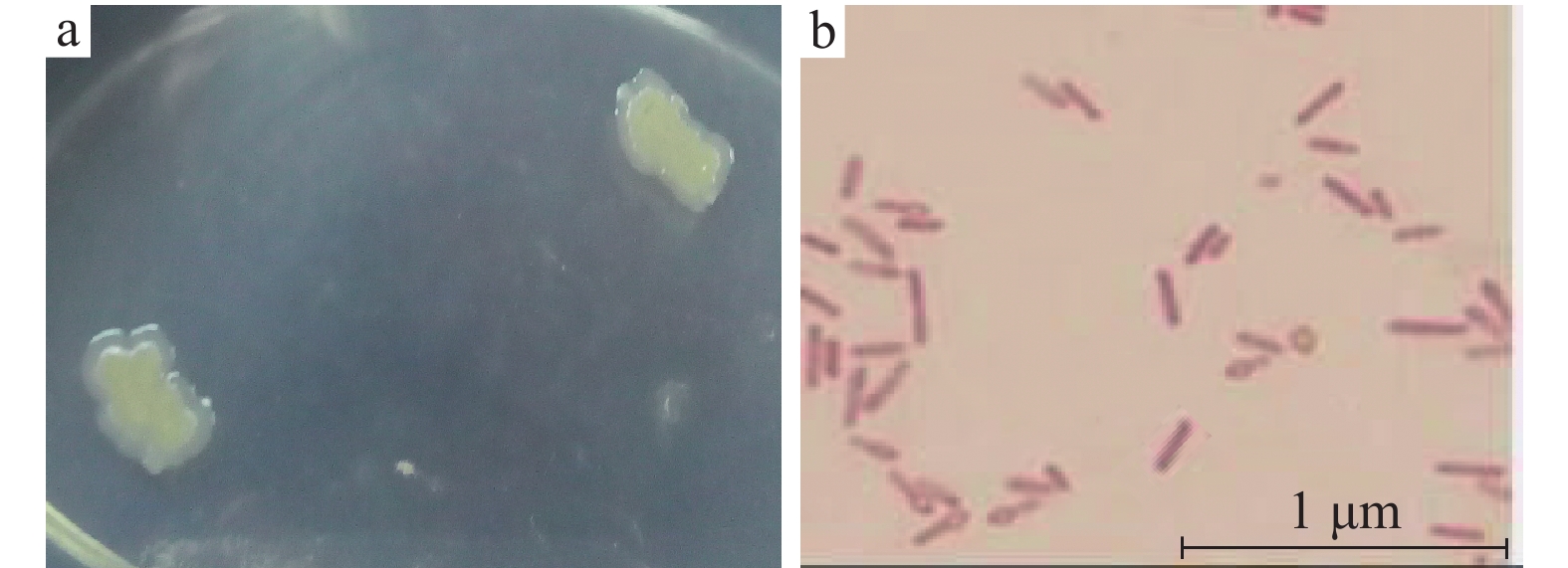
如图2a所示,在LB培养基上CX1菌落呈淡黄色,表面湿润,形状不规则。如图2b所示,光学显微镜下细菌形态呈杆状,有芽孢,染色鉴定为革兰阳性菌。
|
图 2 菌株CX1的形态特征 Fig. 2 Morphological characteristics of strain CX1 a:菌落形态;b:菌体的显微形态 a: Colony morphology; b: Thalli micromorphology |
国内外研究学者普遍认可,16S rDNA序列相似性超过97%,可以当作属内的同种[25]。通过NCBI Blast对16S rDNA测序结果进行相似性比对,得到与菌株CX1序列相似性最大的菌种信息(相似性达99%),因此,菌株CX1确定为高温嗜热芽孢杆菌Thermophilic Bacillus sp.。
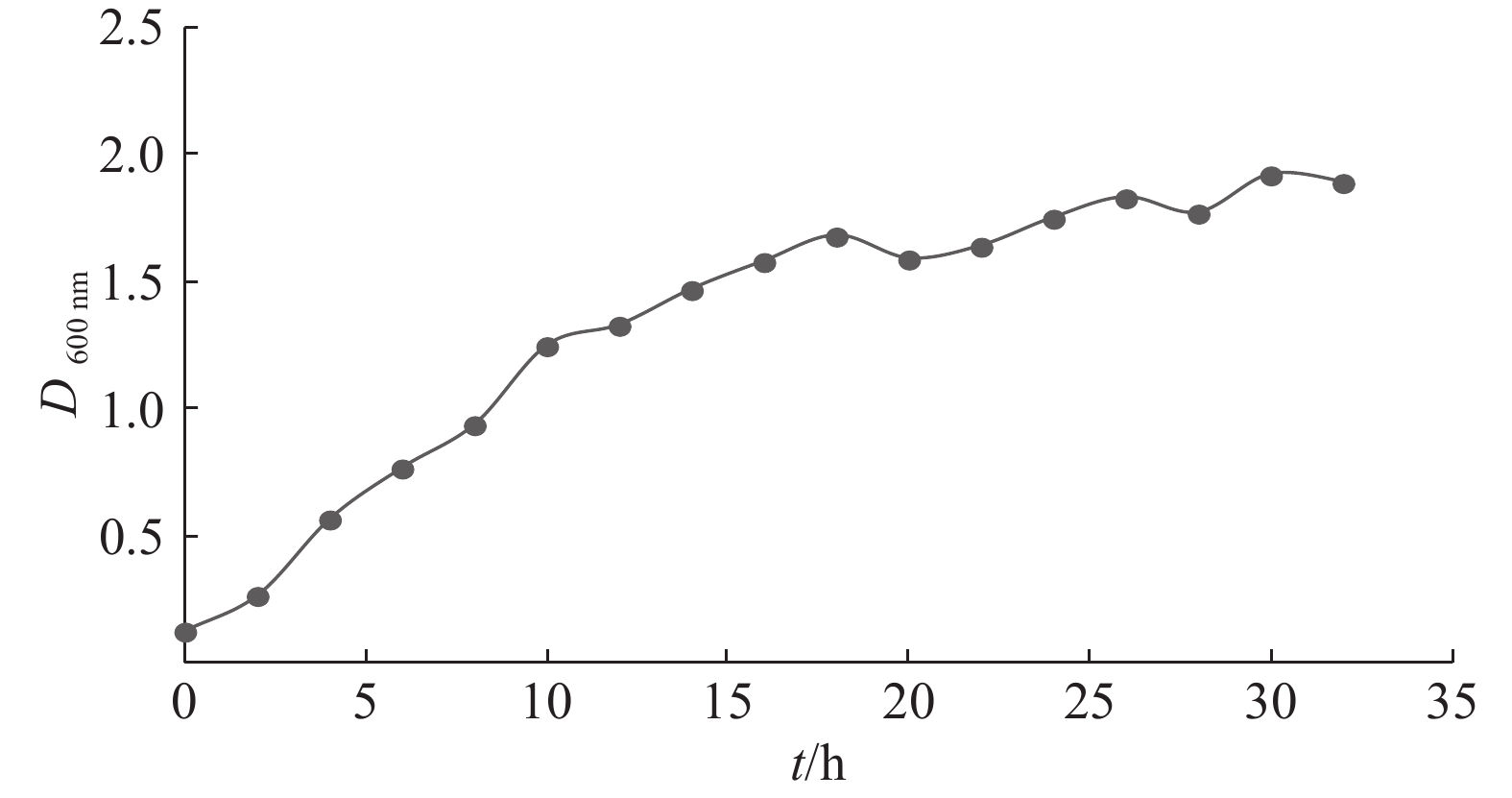
2.2 菌株CX1生长曲线和纤维素酶活力变化曲线由图3可以看出,摇床培养前18 h细菌接近直线增长,生长速率较快,所以选择培养18 h的菌株CX1接入液体发酵产酶培养基降解稻秆较为合适。
|
图 3 菌株CX1的生长曲线 Fig. 3 The growth curve of strain CX1 |
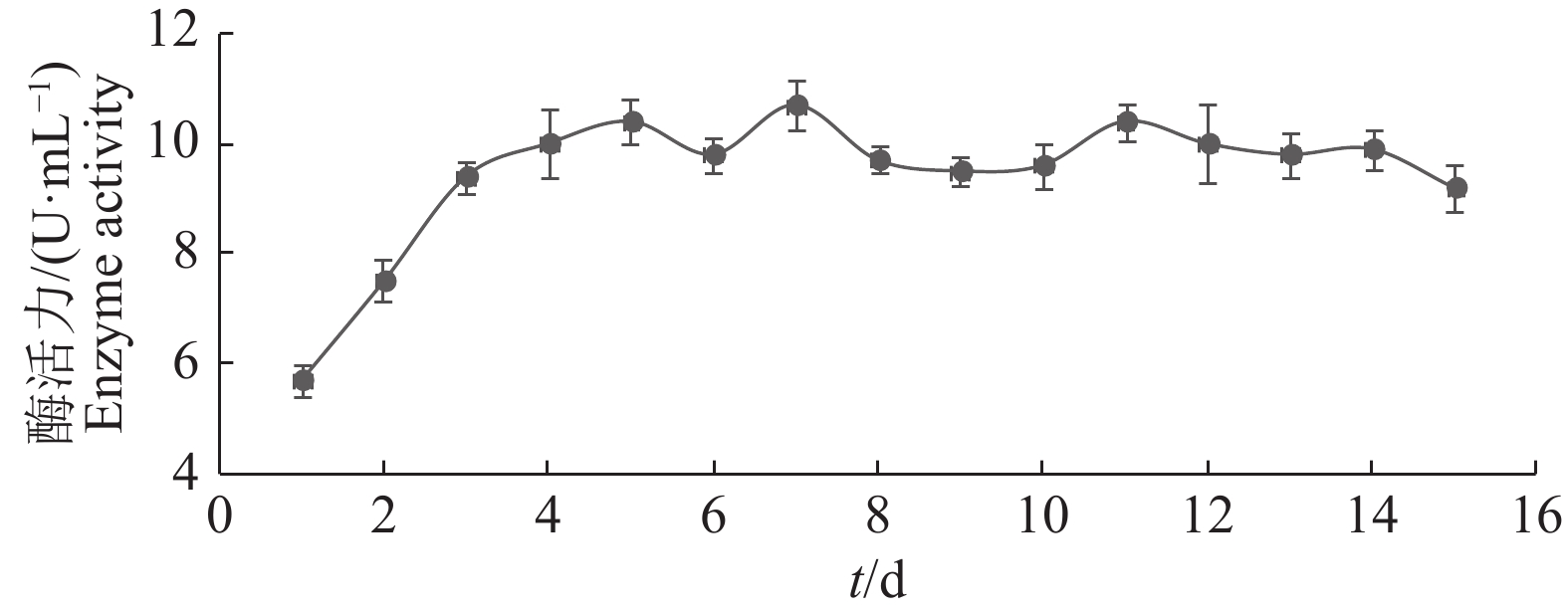
以1 mg·mL–1 葡萄糖标准溶液作为底物,测定D540 nm,绘制标准曲线。曲线方程为:y=0.697 7x−0.052 4(R2=0.993 3),式中,x代表葡萄糖含量,y代表D540 nm。纤维素酶活力变化曲线如图4所示,摇床培养前5 d,酶活力均呈上升趋势,此后略有波动,逐渐稳定。测得第7天时纤维素酶活力最大,为10.7 U·mL–1。
|
图 4 纤维素酶活力变化曲线 Fig. 4 Change in cellulase activity |
微生物对不同的底物会表现出差异的酶活力,对真实底物的降解最能反映它在实际应用中的潜力[26]。以滤纸和稻秆粉为底物测得的酶活力(分别为12.32和13.94 U·mL–1)大于以0.01 g·mL–1的 CMC-Na溶液为底物测定的酶活力(10.38 U·mL–1),说明在测定菌株CX1所产纤维素酶的活力时以稻秆粉或滤纸为底物更适宜。
2.3.2 不同反应温度下的纤维素酶活力不同反应温度下纤维素酶活力是不同的,反应温度在50和55 ℃时测得酶活力分别为13.87和13.45 U·mL–1。在50~65 ℃范围内酶活力总体呈下降趋势,但在65 ℃时,酶活力仍能达到9.73 U·mL–1,体现了菌株CX1所产纤维素酶耐高温的特性。
2.4 菌株CX1降解纤维素的特性 2.4.1 稻秆残渣中纤维素的含量由于稻秆中纤维素被木质素包裹,降解前期效果不明显,纤维素降解率较低。经测定,第5~15天的10 d内,稻秆的纤维素降解率增加了27.17%,到第15天腐解结束时,菌株CX1对稻秆纤维素降解率达到了52.55%。
2.4.2 滤纸条的崩解和土培降解稻秆由图5可以看出,加入菌株CX1培养4 d后,滤纸条完全崩解;而不添加菌株的对照组,滤纸条仍大量存在、呈片状堆积。

|
图 5 滤纸条的崩解 Fig. 5 The disintegration of filter paper a:对照;b:添加菌株CX1培养4 d后,滤纸条完全崩解 a: Control; b: Filter paper was completely disintegrated after 4 days of culture with strain CX1 |
如图6所示,经菌株CX1处理后,土培 10、20、30和40 d 的稻秆相对降解率随时间呈现上升趋势。稻秆自身结构复杂,导致降解过程缓慢,细菌在后期降解速率增加较快,在土培40 d后相对降解率达到25.38%。

|
图 6 稻秆土培降解试验结果 Fig. 6 The experimental result of rice straw degradation in soil |
由图7可见,菌株CX1经65 ℃水浴处理5 d后,仍能在纤维素平板上正常生长,并出现明显的透明圈。说明菌株CX1能够耐受高温生长。

|
图 7 高温处理后的菌株CX1在刚果红−纤维素平板上的生长 Fig. 7 Strain CX1 treated with high temperature grew on a Congo red-cellulose plate |
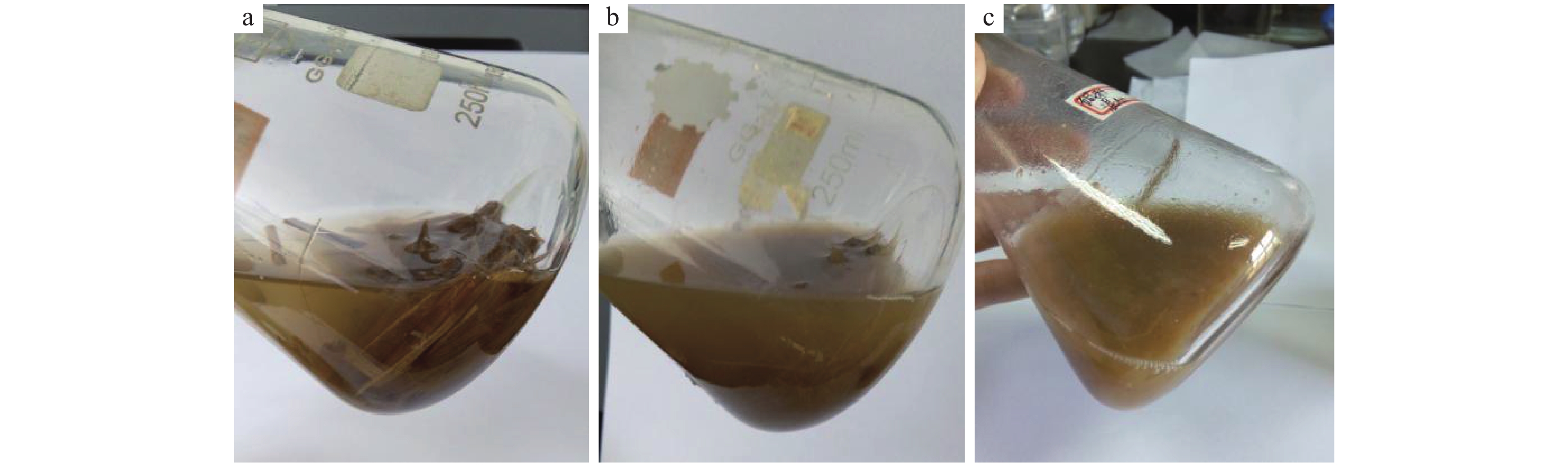
由图8可见,与用蒸馏水浸泡处理的稻秆相比,经质量浓度为0.05 g·mL–1的NaOH溶液浸泡处理的稻秆降解效果更加明显。摇瓶培养14 d时,不添加菌株CX1的三角瓶中溶液清澈,稻秆呈段状(图8a);用蒸馏水浸泡处理的稻秆配制的培养基中添加菌株CX1发酵结束后溶液比较浑浊,部分稻秆已碎,沉积在瓶底部(图8b);用0.05 g·mL–1的NaOH溶液浸泡处理的稻秆配制的培养基中添加菌株CX1,发酵结束后溶液浑浊、黏稠,在瓶底部稻秆呈碎末状堆积(图8c)。
|
图 8 菌株CX1与NaOH溶液协同降解稻秆 Fig. 8 Synergistic degradation of rice straw by strain CX1 and NaOH solution a:蒸馏水浸泡处理的稻秆,不添加菌株CX1;b:蒸馏水浸泡处理的稻秆,添加菌株CX1;c:质量浓度为0.05 g·mL–1的NaOH溶液浸泡处理的稻秆,添加菌株CX1 a: Rice straw immersed with distilled water, no added CX1; b: Rice straw immersed with distilled water, adding CX1; c: Rice straw immersed with 0.05 g·mL–1 NaOH solution, adding CX1 |
腐解14 d时,经质量浓度为0.05 g·mL–1的NaOH溶液浸泡处理的稻秆质量损失率达到47.25%,与用蒸馏水浸泡处理的稻秆相比,质量损失率增加了6.69%。表明在生物降解稻秆之前运用化学手段对稻秆进行预处理,会使稻秆降解更加快速,可提高降解率。
2.7 菌株CX1降解稻秆后的发酵液对小麦生长的影响由图9和表1数据可知,添加菌剂后小麦的生长指标与A组(添加完全培养液)相比差距不大,表明使用菌剂CX1的发酵液对小麦幼苗生长具有明显的促进作用。B、C两组相比,添加菌剂后,小麦生长的各项指标均有明显提高,小麦的出苗率、苗高、根鲜质量和苗鲜质量分别提高了9.66%、55.55%、59.71%和118.84%。C、D两组相比,0.05 g·mL–1 NaOH溶液处理后,小麦的出苗率提高了2.86%,苗高、根鲜质量和苗鲜质量分别降低了25.40%、13.76%和42.23%。

|
图 9 不同处理组小麦幼苗的生长情况 Fig. 9 Growth of wheat seedlings under different treatment conditions a:A组,Hoagland's营养液培养;b:B组,蒸馏水浸泡处理稻秆,不加菌剂CX1;c:C组,蒸馏水浸泡处理稻秆,添加菌剂CX1;d:D组,质量浓度为0.05 g·mL–1的NaOH溶液处理稻秆,添加菌剂CX1 a: Group A was cultured using Hoagland's nutrient solution; b: Group B was treated with distilled water soaking rice straw, no added CX1; c:Group C was treated with distilled water soaking rice straw, adding CX1;d: Group D was treated with 0.05 g·mL–1 NaOH solution soaking rice straw, adding CX1 |
|
|
表 1 菌株CX1降解稻秆后的发酵液对小麦幼苗生长的影响1) Table 1 Effects of fermentation broth from rice straw degradation with strain CX1 on growth of wheat seedlings |
试验结果表明,在实验室条件下,菌剂CX1的添加确实对小麦作物的重要生理指标产生积极的影响。另外,经0.05 g·mL–1 NaOH溶液处理后的稻秆发酵产生的植物培养液对小麦生长的促进作用要弱于C组(蒸馏水处理的稻秆),原因可能是碱液的预处理使稻秆表面结构遭到一定的破坏,部分营养物质流失。
3 讨论与结论本研究从芜湖地区林下腐殖土中分离筛选出纤维素分解效果较好的菌株CX1,通过形态学和16S rDNA序列相似性比对,确定菌株CX1是1株革兰阳性菌,属于高温嗜热芽孢杆菌。以稻秆为材料探究了其所产纤维素酶的特性,通过测定稻秆降解残渣中纤维素的降解率、滤纸条崩解试验和土培降解稻秆试验,进一步验证了菌剂CX1降解纤维素的高效性。
稻秆在堆肥腐解过程中产生较高温度,对多数微生物的纤维素酶活力会产生不利影响[27-28]。因此设计了相关试验验证CX1对高温的耐受性,试验发现,在65 ℃条件下菌株CX1仍具有较好的生长特性和纤维素降解能力,这也是菌株CX1作为稻秆腐解菌剂自身具有的巨大优势。纤维素高效降解菌的筛选和特性研究是近些年国内外学者的研究热点,但在腐解菌剂作用下秸秆还田后会对农作物产生何种影响一直不清楚,同时,生物方法与物理化学手段协同处理秸秆提高降解率也鲜有报道。本研究初步尝试探究ThermophilicBacillus sp. CX1与化学物质组合协同降解稻秆的作用效果,结果表明,碱液的预处理会使稻秆降解更加快速,明显提高降解率。在实验室条件下,探究稻秆降解后发酵液对植物生长的影响,发现菌株CX1的添加能对小麦幼苗的生长产生积极的影响,为菌剂CX1用于实际农业生产中稻秆的原位还田起到一定的指导作用。
本研究以CX1单菌株为研究对象,相比目前已发现的细菌而言,对稻秆的腐解效果较好。与韦中等[21]筛选的细菌ZJA-6相比,CX1在土培降解试验中相同时间下相对降解率提高了14.78%;菌株CX1产生的纤维素酶活力高达13.87 U·mL–1,也远高于Kazeem等[29]筛选的细菌Bacillus licheniformis 2D55产生的纤维素酶活力。由于,稻秆化学结构比较复杂,单一的微生物产生水解酶的种类和量有限,因此对稻秆的降解能力也有限。随着近年来对纤维素降解菌的深入研究,人们发现多种微生物和酶的协同作用会显著促进稻秆降解过程[30-31]。而复合菌系的建立恰好可以满足这一需求,在今后的研究中可以探究CX1和其他具有高效降解纤维素能力的微生物之间的协同关系,进一步构建降解高效、性质稳定的稻秆降解复合菌系。
| [1] |
林艳梅, 生吉萍, 申琳, 等. 适冷纤维素降解微生物研究进展[J]. 生物技术, 2010, 20(2): 95-97. (  0) 0) |
| [2] |
王文明. 微生物降解秸秆原理简析[J]. 南方农业, 2018, 12(4): 38-40. (  0) 0) |
| [3] |
YAN D Z, WANG D J, YANG L Z. Long-term effect of chemical fertilizer, straw, and manure on labile organic matter fractions in a paddy soil[J]. Biol Fertil Soil, 2007, 44(1): 93-101. DOI:10.1007/s00374-007-0183-0 (  0) 0) |
| [4] |
张蕴琦, 徐凤花, 张书敏, 等. 水稻秸秆降解菌系的筛选及其菌群组成分析[J]. 江苏农业科学, 2017, 45(8): 257-260. (  0) 0) |
| [5] |
陈小华, 朱洪光. 农作物秸秆产沼气研究进展与展望[J]. 农业工程学报, 2007, 23(3): 279-283. DOI:10.3321/j.issn:1002-6819.2007.03.054 (  0) 0) |
| [6] |
LI P P, WANG X J, YUAN X F, et al. Screening of a composite microbial system and its characteristics of wheat straw degradation[J]. Agric Sci China, 2011, 10(10): 1586-1594. DOI:10.1016/S1671-2927(11)60155-7 (  0) 0) |
| [7] |
焦翔翔, 靳红燕, 王明明. 我国秸秆沼气预处理技术的研究与应用进展[J]. 中国沼气, 2011, 29(1): 45-50. (  0) 0) |
| [8] |
杨兴华. 预处理对小麦秸秆糖化及沼气发酵[D]. 杨凌: 西北农林科技大学, 2012.
(  0) 0) |
| [9] |
刘思颖. 纤维素降解菌的筛选及其在秸秆干发酵产沼气中的应用[D]. 武汉: 湖北工业大学, 2011.
(  0) 0) |
| [10] |
冯炘, 裴宇航, 周晓飞, 等. 纤维素降解菌的筛选与高效混合菌群的构建[J]. 西北农林科技大学学报(自然科学版), 2012, 40(4): 155-160. (  0) 0) |
| [11] |
雷湘兰, 孙倩, 沈振国, 等. 纤维素降解菌复合菌系的构建及产酶研究[J]. 农业与技术, 2018, 38(3): 6-7, 20. (  0) 0) |
| [12] |
宋云皓, 满都拉, 段开红, 等. 玉米秸秆纤维素降解菌的筛选及复合菌系的构建[J]. 饲料工业, 2017, 38(19): 33-37. (  0) 0) |
| [13] |
YAO M Y, LIU X F, YUAN Y X, et al. Isolation of a fungus with selective delignification and its degradation of corn stalk[J]. Chin J Appl Environ Biol, 2009, 15(3): 427-431. (  0) 0) |
| [14] |
张超, 李艳宾, 张磊, 等. 真菌产纤维素酶培养基中刚果红转移机理研究[J]. 微生物学通报, 2006, 33(6): 12-16. DOI:10.3969/j.issn.0253-2654.2006.06.003 (  0) 0) |
| [15] |
KANG S W, PARK Y S, LEE J S, et al. Production of cellulases and hemicellulases by Aspergillus niger KK2 from lignocellulosic biomass[J]. Bioresour Technol, 2004, 91(2): 153-156. DOI:10.1016/S0960-8524(03)00172-X (  0) 0) |
| [16] |
陈亚玲, 陈立志, 程鹏, 等. 高效稻秆降解菌的分离鉴定[J]. 广东农业科学, 2017, 44(5): 72-77. (  0) 0) |
| [17] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006.
(  0) 0) |
| [18] |
WEI G F, PAN I, DU H M, et al. ERIC-PCR fingerprinting-based community DNA hybridization to pinpoint genome-specific fragments as molecular markers to identify and track populations common to healthy human guts[J]. J Microbiol Methods, 2004, 59(1): 91-108. DOI:10.1016/j.mimet.2004.06.007 (  0) 0) |
| [19] |
李慧君. 秸秆纤维素降解菌的筛选及其利用研究[D]. 杨凌: 西北农林科技大学, 2010.
(  0) 0) |
| [20] |
王金主, 王元秀, 李峰, 等. 玉米秸秆中纤维素、半纤维素和木质素的测定[J]. 山东食品发酵, 2010, 158(3): 44-47. (  0) 0) |
| [21] |
韦中, 徐春淼, 郑海平, 等. " 挂壁”法筛选常温稻秆腐解菌及其降解能力研究[J]. 农业环境科学学报, 2015, 34(10): 2027-2031. DOI:10.11654/jaes.2015.10.027 (  0) 0) |
| [22] |
任世英, 邵奎, 李雯, 等. 一株耐高温纤维素酶产生菌的分离和鉴定[J]. 工业微生物, 2016, 46(4): 19-24. DOI:10.3969/j.issn.1001-6678.2016.04.004 (  0) 0) |
| [23] |
王友保. 生态学实验[M]. 芜湖: 安徽师范大学出版社, 2010.
(  0) 0) |
| [24] |
李晓秀. 玉米秸秆复合降解菌ZFX-1的构建及降解效果的初探[D]. 哈尔滨: 东北农业大学, 2017.
(  0) 0) |
| [25] |
韩梦颖, 王雨桐, 高丽, 等. 降解秸秆微生物及秸秆腐熟剂的研究进展[J]. 南方农业学报, 2017, 48(6): 1024-1030. DOI:10.3969/j.issn.2095-1191.2017.06.14 (  0) 0) |
| [26] |
王海滨, 韩立荣, 冯俊涛, 等. 高效纤维素降解菌的筛选及复合菌系的构建[J]. 农业生物技术学报, 2015, 23(4): 421-431. DOI:10.3969/j.issn.1674-7968.2015.04.001 (  0) 0) |
| [27] |
胡丽娟, 薛高尚, 卢向阳, 等. 响应面法优化芽孢杆菌25-2产纤维素酶发酵条件[J]. 酿酒科技, 2012, 214(4): 21-26. (  0) 0) |
| [28] |
王晓林, 张西玉, 白方文, 等. 高效降解秸秆纤维素菌株的筛选鉴定及产酶条件优化[J]. 四川师范大学学报(自然科学版), 2011, 34(1): 105-109. DOI:10.3969/j.issn.1001-8395.2011.01.022 (  0) 0) |
| [29] |
KAZEEM M O, SHAH U K M, BAHARUDDIN A S, et al. Prospecting agro-waste cocktail: Supplementation for cellulase production by a newly isolated thermophilic Bacillus licheniformis 2D55
[J]. Appl Biochem Biotechnol, 2017, 182(4): 1318-1340. DOI:10.1007/s12010-017-2401-z (  0) 0) |
| [30] |
LIAO H, XU C, TAN S, et al. Production and characterization of acidophilic xylanolytic enzymes from Penicillium oxalicum GZ-2
[J]. Bioresour Technol, 2012, 123(21): 117-124. (  0) 0) |
| [31] |
CHANG A J, FAN J Y, WEN X H. Screening of fungi capable of highly selective degradation of lignin in rice straw[J]. Int Biodeter Biodegr, 2012, 72(7): 26-30. (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


