2. 安徽农业大学 微生物防治安徽省重点实验室,安徽 合肥 230036;
3. 安徽工业大学 建筑工程学院,安徽 马鞍山 243002
2. Anhui Province Key Laboratory of Microbial Control, Anhui Agricultural University, Hefei 230036, China;
3. School of Civil Engineering and Architecture, Anhui University of Technology, Ma’anshan 243002, China
白僵菌属Beauveria Vuill. 为全球分布的最常见的土栖虫生真菌,包含球孢白僵菌B. bassiana和布氏白僵菌B. brongniartii 2个重要种类。在害虫生物防治领域最受关注的是球孢白僵菌,该菌寄主范围很广,已记载的寄主包括15目149科700余种昆虫以及蜱螨目的6科10余种螨和蜱[1]。在许多国家,球孢白僵菌被广泛运用于农业和林业害虫的生物防治,且效果显著[2]。自20世纪70年代以来,我国利用球孢白僵菌制剂防治松毛虫Dendrolimus punctatus和亚洲玉米螟Ostrinia furnacalis,其应用面积达上百万公顷,成为世界上最大和最成功的生物防治案例之一[3]。由于球孢白僵菌寄主多样,地理分布极为广泛,不同菌株的侵染力[4]、传播力、产孢潜力、抗逆性[5]及对寄主昆虫的毒力存在较大差异,因此自然群体具有较大异质性和较高遗传多样性。最早开始研究球孢白僵菌群体变异的是美国康奈尔大学的Leger等[6],他们通过等位酶分析将146株来自世界各地的白僵菌划分为47个独特基因型,其中球孢白僵菌复合种存在3个世界广布的优势基因型,而且不同基因型菌株间的染色体重组十分罕见。近年来相关的研究主要有:Fernandes等[7]利用多位点酶电泳(MLEE)、AFLP和ITS位点对来自巴西和美国的白僵菌群体进行分析;Garrido-Jurado等[8]利用28S内含子和EF1-a对西班牙的球孢白僵菌群体的联合分析;Prabhukarthikeyan等[9]采用RAPD技术对印度地区的球孢白僵菌群体的研究等。国内由王成树等[10]率先开展了球孢白僵菌群体遗传变异的调查,特别是近期有研究团队对我国北方和南方不同省份的球孢白僵菌种群分别进行了遗传多样性和种群异质性研究,基本明确了大部分地区球孢白僵菌种群的遗传结构特征[11-12]。然而我国南方广东省的球孢白僵菌只有20株,来自鼎湖山国家级自然保护区的菌株更只有5株,尚未得到系统深入的研究。2011年Meyling等[13]通过rDNA序列和简单重复序列(Simple sequence repeat, SSR)技术对丹麦Bakke garden地区附近耕地和田边篱的白僵菌进行分子系统发育和遗传变异分析。2012年,Meyling等[14]继续采用SSR标记研究来自瑞士花粉甲虫Meligethes aeneus的白僵菌群体,进一步揭示了群内菌株的基因型多样性。研究表明SSR标记应用于白僵菌的生态学研究,可显示其他标记不能反映的大量多态性水平,为识别种内变异、判定种群遗传结构和异质性奠定基础,加深人们对群体生态系中发生变化和机制的理解。
虽然国内外研究球孢白僵菌遗传多样性的报道多见,但对我国华南地区特别是广东省白僵菌的研究较少,同时采用技术新和重复性好的SSR标记来研究白僵菌群体遗传变异在国内也很少有人涉足。鼎湖山国家级自然保护区位于广东省肇庆市鼎湖区,属南亚热带季风湿润型气候,面积1 155 hm2,森林覆盖率达78.8%,阳光充足,雨量充沛,地理环境十分优越。本研究选择鼎湖山作为中国广东省代表,检测球孢白僵菌群体的遗传多样性,通过SSR标记对该地区球孢白僵菌种群进行聚类分析,进而考察种群的遗传分化和基因流,从分子生态学角度评估种群菌株的分布和遗传变异情况。
1 材料与方法 1.1 样品及分离在广东省鼎湖山国家自然保护区(简称DHS)采集僵虫或土样,使用燕麦选择性培养基分离样品,SDAY培养基纯化[15],记录菌落的色泽、形态和生长速度等宏观特征。PDA平板培养后,在显微形态初步鉴定出白僵菌的基础上,利用Bloc-DGGE分型联合EF位点的序列测定进行准确判定,共有81株白僵菌菌株确定为狭义球孢白僵菌[16]。所有菌株保藏于安徽农业大学微生物防治安徽省重点实验室,具体信息见表1。
|
|
表 1 鼎湖山球孢白僵菌菌株的分离基质和采集时间 Table 1 Isolation medium and collecting time of Beauveria bassiana isolates in Dinghu Mountain |
将上述供试菌株制成孢子悬浮液,取0.2 mL转接于加铺玻璃纸的SDAY培养基平板上,恒温培养箱中(25±1) ℃条件下培养3~5 d,将长满全皿且未大量产孢的菌丝在无菌条件下取出,置于1.5 mL已灭菌的Eppendorf管中,冷冻干燥后于–20 ℃保存备用。采用改良的氯化苄法提取纯化基因组DNA[16]。
1.3 SSR-PCR 扩增根据Meyling等[13]综合使用的8对引物对菌株进行PCR扩增,引物基本信息见表2。
|
|
表 2 SSR-PCR使用的引物 Table 2 Primers for SSR-PCR |
PCR循环程序为95 ℃预变性2 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,以上3步35个循环;然后72 ℃延伸10 min,5 ℃保存。通过琼脂糖凝胶电泳检测扩增产物质量。选取条带单一清晰的样品进行测序胶(PAGE)电泳,检测不同微卫星引物的扩增效果及其特异性。
1.4 SSR-PCR产物测序胶电泳参照蒲顺昌等[17]的方法,将SSR-PCR产物在Sequi-Gen® GT Nucleic Acid Electrophoresis Cell测序胶电泳仪上电泳,并通过硝酸银染色检测结果。
1.5 电泳图谱统计对SSR标记按共显性标记进行数据统计,根据SSR条带的迁移率不同识别多态性条带。对扫描后的电泳图谱进行人工读带,各泳道中迁移率相同的条带视为相同基因型,迁移率不同的条带视为不同基因型,将迁移率相同的菌株分别合并后进行下一轮电泳。在最终测序胶板中,分别统计每种条带包含菌株的数量。最后利用Bandscan V5.0软件和人工读带相结合的方法将图谱数据转化成0,1矩阵(“1”为有条带,代表显性基因;“0”为无条带,代表隐性基因)。
1.6 数据分析利用Popgene 32软件包计算DHS球孢白僵菌种群的观测等位基因数(Na)、有效等位基因数(Ne)、Nei’s基因多样性指数(h)、Shannon信息指数(Is)、多态位点比率(P)、种群内基因多样度(Hs)、总基因多样度(Ht)等指标,并分析群体的遗传分化系数(Gst)、基因流(Nm)、遗传距离(D)和遗传一致度(I)等指标[18]。在此基础上使用NTSYSpc 2.1通过非加权法(UPGMA)对数据矩阵进行聚类分析,根据遗传相似系数将群体菌株分为不同的亚种群,检测群体菌株的遗传相似度和异质性。
2 结果与分析 2.1 SSR引物多态性分析8个引物扩增81个菌株共扩增出58个位点,其中多态位点数也是58个,多态位点比率(P)为100%,单个引物的扩增位点数6~10个,平均7.25个。其中,引物Ba12扩增位点数最多,为10个,扩增位点数最少的引物是Ba13、Ba16和Ba21,扩增位点数均为6个。Nei’s基因多样性指数(h)范围为0.169 1(Ba12)~0.259 0(Ba16),平均为0.212 6;Shannon信息指数(Is)范围为0.291 8(Ba12)~0.417 0(Ba16),平均为0.348 7(表3)。部分菌株的电泳图谱见图1。
|
|
表 3 SSR引物多态性指数 Table 3 Polymorphic indexes of SSR primers |
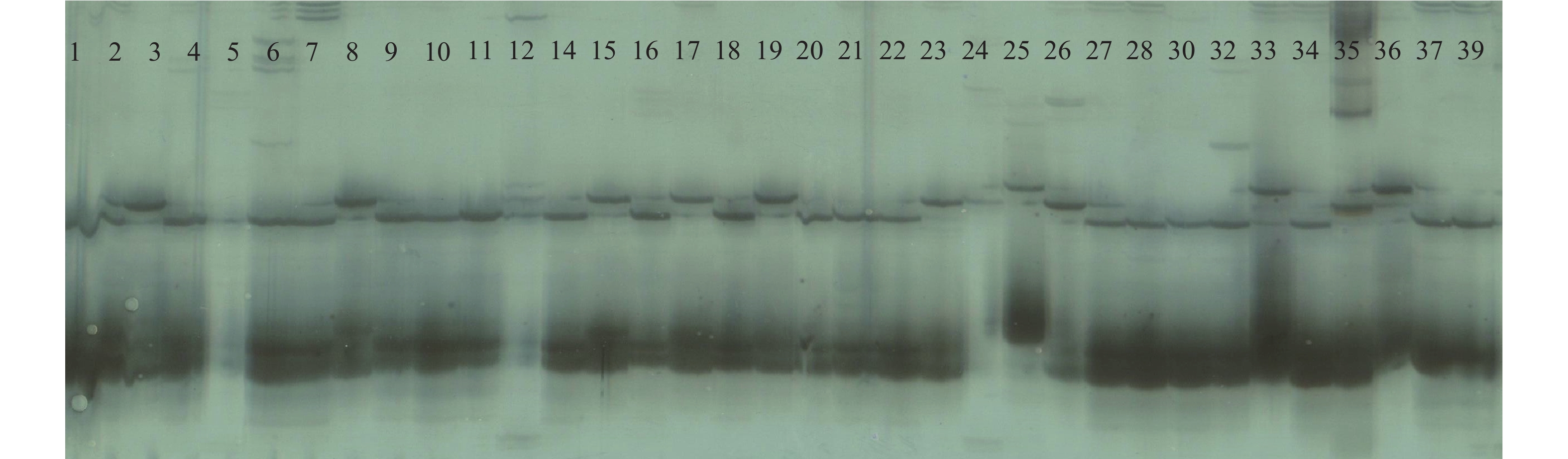
|
图 1 引物Ba22扩增建立的SSR指纹图谱(样品1~39) Fig. 1 SSR fingerprint amplified by primer Ba22 (Strains 1-39) |
对鼎湖山国家级自然保护区81株球孢白僵菌作为整体进行遗传多样性分析,结果表明,h为0.212 6,Is为0.348 7,P为100%,说明鼎湖山球孢白僵菌群体具有较高的遗传多样性。由于多态位点比率不能确定扩增条带在频率上的均匀程度,同时受到样本大小和条带总数的影响,只是衡量种群遗传多样性的一个粗略估计值,在此情况下h和Is作为衡量指标更加可靠。
2.2.2 基于寄主和土壤亚种群的遗传多样性和遗传分化分析将鼎湖山国家级自然保护区球孢白僵菌种群按分离基质(寄主和土壤)划分为不同的亚群进行分析,结果显示,各亚种群遗传多样性指标均低于整体水平(表4),且指标h、Is和P的变化趋势一致。寄主亚群的h为0.176 9,Is为0.278 3,P为68.97%,均低于土壤亚群,土壤亚群的h为0.192 5,Is为0.309 9,P为77.59%,意味着从土壤分离出的菌株遗传多样性相对较高。总体上看,鼎湖山地区球孢白僵菌寄主和土壤亚群多样性水平存在差异但并不明显,意味着不同基质对球孢白僵菌群体遗传多样性产生的影响较小。
|
|
表 4 鼎湖山不同分离基质球孢白僵菌亚种群的遗传多样性 Table 4 Genetic diversity of Beauveria bassiana subpopulations isolated from different medium in Dinghu mountain |
研究寄主和土壤亚种群的遗传分化和基因流发现,鼎湖山群体总基因多样度(Ht)=0.212 5,群内基因多样度(Hs)=0.184 7,基因流(Nm)=1.662 9,遗传分化系数(Gst)=0.130 7。种群Nm大于阈值1,表明亚群体间的基因交流明显,来自寄主和土壤的菌株并不是孤立的,而是相互影响的。根据群体分化的划分标准[19],种群表现为中度分化(0.05>Gst>0.15),其总变异只有13.07%来自种群间,而86.93%的变异存在于种群内,表明来自不同基质的球孢白僵菌遗传分化程度较弱,这可能与种群微生态环境的差异较小有关。
鼎湖山球孢白僵菌亚种群间遗传一致度和遗传距离的研究结果显示,不同分离基质亚种群的遗传一致度(I)为0.931 9,遗传距离(D)为0.070 5,与种群遗传分化的结果基本一致。由于种群间的基因流较高,导致遗传一致度高,减少了不同亚群体间因遗传漂变引起的遗传分化。
2.2.3 基于不同寄主目亚种群的遗传多样性和遗传分化分析将40株球孢白僵菌按寄主目划分为6个亚群,分析不同亚群体的遗传多样性水平(表5)。种群总体h和Is分别为0.176 9和0.278 3,与按不同分离基质计算所得的指标一致。各亚群P范围在34.48%(半翅目)~58.62%(鞘翅目),均低于整体水平(68.97%)。h为0.137 9(半翅目)~0.180 0(鳞翅目),Is为0.202 9(半翅目)~0.268 1(鳞翅目)。各亚种群遗传多样性指标由高至低依次为鳞翅目、同翅目、鞘翅目、膜翅目、半翅目和直翅目。
|
|
表 5 鼎湖山不同寄主球孢白僵菌亚种群的遗传多样性 Table 5 Genetic diversity of Beauveria bassiana subpopulations from different insect orders in Dinghu mountain |
进一步研究不同寄主目亚种群间的遗传分化情况,结果表明各群体Ht平均值为0.182,Hs平均值为0.134,由表6可知,Gst范围在0.023(鞘翅目/鳞翅目)~0.568(半翅目/直翅目),Nm范围在0.191(半翅目/直翅目)~10.445(鞘翅目/鳞翅目)。除直翅目亚种群外的其他亚群间的Nm大于1,表明球孢白僵菌在各寄主间的基因交流流畅,导致分离自各目寄主的菌株遗传分化水平较低。除直翅目外的亚种群Gst最大值为0.089(同翅目/半翅目)仅表现为中度分化,而鞘翅目/鳞翅目、鞘翅目/膜翅目、鞘翅目/同翅目以及鳞翅目/同翅目亚种群的遗传分化系数低于分化阈值0.05,表明各群体间不存在分化。综上所述,鼎湖山地区球孢白僵菌不同寄主群体间的遗传分化较小,各亚种群间基因交流流畅。
|
|
表 6 鼎湖山不同寄主划分的球孢白僵菌亚种群间的遗传分化和基因流1) Table 6 Genetic differentiation and gene flow among Beauveria bassiana subpopulations from different insect orders in Dinghu mountain |
采用UPGMA法对鼎湖山球孢白僵菌群体进行基于遗传相似系数的聚类分析,结果表明,遗传相似系数在0.77处,81株球孢白僵菌可明显聚为3个分支,其中有49株属于分支I,占总数的60.49%,分支II和III分别包含5株和27株。由图2可知,位于不同分支的菌株分别来自于寄主或土壤,分支I中的土壤菌株较多(32株),分支III中的寄主菌株较多(23株),而分支II中的5株球孢白僵菌均来自土壤。种群遗传相似系数范围在0.73~1.00,所有菌株在遗传相似系数小于0.8时聚为不同分支,而分支I中(优势类群)的菌株数低于总数的70%,表明鼎湖山地区球孢白僵菌种群的优势性低异质性高,暗示着较高的遗传多样性。总体上看,鼎湖山球孢白僵菌群体并未表现出按分离基质聚类的趋势,来自寄主和土壤的菌株在各分支中随机分布。
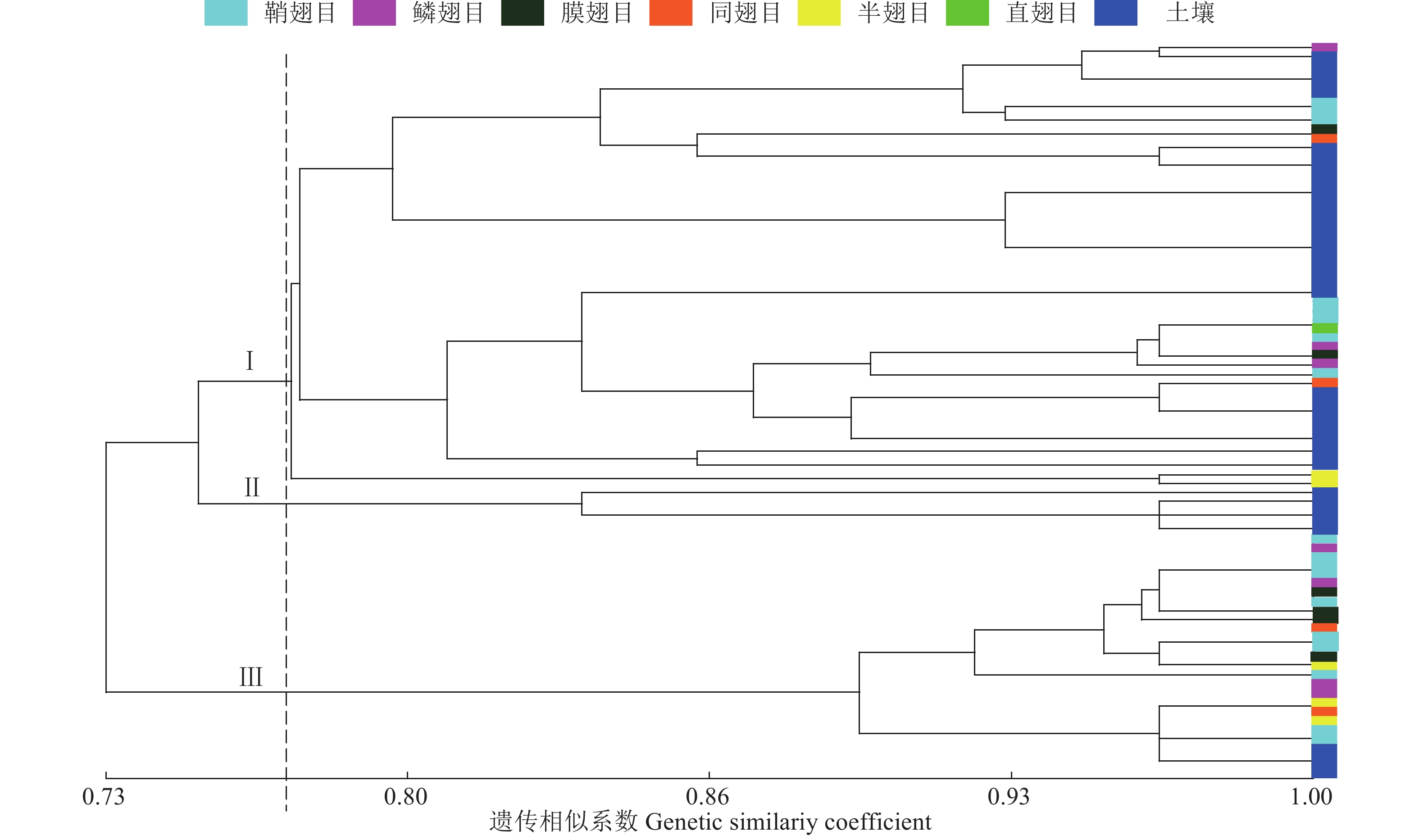
|
图 2 基于遗传相似系数的鼎湖山81株球孢白僵菌UPGMA聚类图 Fig. 2 UPGMA dendrogram of 81 isolates in Dinghu Mountain based on genetic similariy coefficient |
进一步考察各分支中菌株的寄主类型发现(图2),分支I中有7株寄主为鞘翅目,4株为鳞翅目,2株为膜翅目,2株为同翅目,来自半翅目和直翅目的各有1株;分支III中来自鞘翅目寄主的菌株为9株,鳞翅目4株,膜翅目4株,半翅目3株,同翅目2株。不同寄主的菌株在2个分支中均有分布,从聚类图来看,寄主群体并未表现为按不同目进行聚类的趋势,表明鼎湖山地区球孢白僵菌对以上寄主无明显偏好,寄主专化性较弱。
3 讨论与结论在球孢白僵菌遗传多样性的研究中,张正坤等[20]利用10个锚定简单重复序列(Inter SSR, ISSR)引物扩增吉林省49个菌株,共扩增出90个位点,其中多态位点数86个,占比95.56%,扩增产物长度在200~1 500 bp。Prabhukarthikeyan等[9]使用15对引物用于RAPD分析,其中6对引物多态性为100%,其他引物为50.00%~88.89%,而产物片段大小在100~2 500 bp。由此可见,由于SSR标记采用了特异性的双向引物,扩增片段一般小于500 bp,具有多态性高、稳定性好和检测高效等优点,为球孢白僵菌群体遗传结构和群内基因型变异的调查提供了更合理的技术方法和途径。Meyling等[14]认为并非所有的SSR标记都适用于表征白僵菌群体的多样性,但筛选的SSR标记在白僵菌分支中能检测到最高水平的遗传变异,且一致性最高。今后在涉及白僵菌遗传结构的研究时,提前将群体按照某种要素划分后再进一步分析较为稳妥。
基于SSR标记的广东省鼎湖山国家级自然保护区球孢白僵菌遗传多样性分析表明,使用8对引物扩增81个菌株共扩增出58个位点,其中多态位点数也是58个,多态位点比率(P)为100%。群体Nei’s基因多样性指数(h)为0.212 6,Shannon信息指数(Is)为0.348 7,遗传多样性水平较高。胡晓磊等[11]利用ISSR标记对我国南方地区球孢白僵菌种群进行遗传多样性分析,结果表明南方地区球孢白僵菌的遗传多样性水平较高,种群异质性较强,且变异主要由不同采集地以及采集地内部不同微生境间的差异造成。因此以上结果可能与外部生态环境形成的选择性压力和不同生境下的物种多样性有关[21]。
依据不同分离基质(寄主和土壤)将鼎湖山81株球孢白僵菌划分为不同的亚种群进行分析,发现土壤亚群多样性水平指标(h为0.192 5,Is为0.309 9)略高于寄主亚种群(h为0.176 9,Is为0.278 3),种群基因流(Nm)为1.662 9,遗传分化系数(Gst)为0.130 7,意味着86.93%的变异存在于种群内,亚群体间基因交流明显,种群遗传分化程度较弱。这可能是由于自然保护区内球孢白僵菌群体微生态环境差异较小,影响了其携带的球孢白僵菌群体间的遗传分化。李旻等[22]应用ISSR标记对安徽大别山地区的球孢白僵菌遗传多样性进行了研究,结果表明遗传变异主要来自居群内,各居群间的群体遗传变异较小,与本研究结果基本一致。有研究表明,由真菌孢子扩散与传播而导致的基因流在很大程度上影响着真菌群体的遗传结构[23],更重要的是球孢白僵菌的生活史是腐生和寄主交替进行,该特征在某一地区寄主零星分布时对菌株的存活非常有利[24]。在球孢白僵菌流行时菌株可通过介质的流动而进入土壤中宿存,等待时机继续侵染不同寄主昆虫以延续自身的传播和流行。同时土壤中本身就存在一定数量稳定的球孢白僵菌群体,例如存在于根际的球孢白僵菌等,在综合作用下很可能导致土壤亚群表现出相对较高的多样性水平。
本研究将来自寄主的40株球孢白僵菌根据不同寄主目划分为6个亚群体进行遗传多样性分析,结果表明鳞翅目、同翅目和鞘翅目亚种群的多样性水平较高,而半翅目亚种群多样性水平最低。进一步考察球孢白僵菌不同寄主目亚群体间的遗传分化,发现不同寄主目亚群间的遗传分化程度较弱。不同亚群间的基因流造成整个群体的遗传一致度高,减少了不同亚群体间因遗传漂变引起的遗传分化。Luan等[25]通过ISSR标记对中国安徽引起螳螂流行病的球孢白僵菌群体进行了遗传结构分析,结果显示这些菌株被划分为5个致病型,且来自不同螳螂种的球孢白僵菌分离株间存在明显的基因流,表明这些菌株缺乏寄主专化性。这一结果支持球孢白僵菌不是寄主专性的种类,而是世界广布、寄主谱广的机会性昆虫病原的观点。基于遗传相似系数的UPGMA聚类分析结果表明,鼎湖山球孢白僵菌群体并未表现按不同分离基质聚类的趋势,来自寄主和土壤的菌株在各分支中随机分布。同时整个群体表现为优势性低异质性高,意味着群体遗传多样性较高。将聚类分析中的菌株进一步具体到寄主目,发现不同寄主目菌株在含有寄主的2分支中均有分布,这2分支中的菌株也并未按照不同寄主目分别聚在不同的分支,这表明球孢白僵菌对上述寄主无明显偏好,寄主专化性较弱。
综上所述,不同生态环境、分离基质和寄主类型的影响共同维持了鼎湖山自然保护区球孢白僵菌种群遗传变异的多样性,防止近交衰退。本研究结果有助于对鼎湖山自然保护区球孢白僵菌群体遗传结构、基因流和遗传分化有更全面地认识,通过理解不同影响因素在球孢白僵菌群体遗传变异中的作用,为筛选优良的生产菌株提供充足的种质资源。
| [1] |
李增智. 球孢白僵菌的昆虫寄主名录[J]. 中国虫生真菌研究与应用, 1988, 1(1): 240-255. (  0) 0) |
| [2] |
MEYLING N V, EILENBERG J. Ecology of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae in temperate agroecosystems: Potential for conservation biological control
[J]. Biol Control, 2007, 43(2): 145-155. DOI:10.1016/j.biocontrol.2007.07.007 (  0) 0) |
| [3] |
李增智. 我国利用真菌防治害虫的历史、进展及现状[J]. 中国生物防治学报, 2015, 31(5): 699-711. (  0) 0) |
| [4] |
RODRIGUEZ-GONZÁLEZ Á, MAYO S, GONZÁLEZ-LÓPEZ Ó, et al. Inhibitory activity of Beauveria bassiana and Trichoderma spp. on the insect pests Xylotrechus arvicola (Coleoptera: Cerambycidae) and Acanthoscelides obtectus (Coleoptera: Chrisomelidae: Bruchinae)
[J]. Environ Monit Assess, 2017, 189(12): 1-8. (  0) 0) |
| [5] |
李鸿文, 冯明光. 球孢白僵菌不同菌株分生孢子的耐热能力[J]. 浙江大学学报(农业与生命科学版), 2008, 34(2): 158-162. (  0) 0) |
| [6] |
ST LEGER R J, ALLEE L L, MAY B, et al. World-wide distribution of genetic variation among isolates of Beauveria spp.
[J]. Mycol Res, 1992, 96(12): 1007-1015. DOI:10.1016/S0953-7562(09)80108-1 (  0) 0) |
| [7] |
FERNANDES E K K, MORAES A M L, PACHECO R S, et al. Genetic diversity among Brazilian isolates of Beauveria bassiana: Comparisons with non-Brazilian isolates and other Beauveria species
[J]. J Appl Microbiol, 2009, 107(3): 760-774. DOI:10.1111/jam.2009.107.issue-3 (  0) 0) |
| [8] |
GARRIDO-JURADO I, MARQUEZ M, ORTIZ-URQUIZA A, et al. Genetic analyses place most Spanish isolates of Beauveria bassiana in a molecular group with word-wide distribution
[J]. BMC Microbiol, 2011, 11(1): 84. DOI:10.1186/1471-2180-11-84 (  0) 0) |
| [9] |
PRABHUKARTHIKEYAN S R, KEERTHANA U, ARCHANA S, et al. Analysis of genetic diversity among different isolates of Beauveria bassiana by RAPD PCR[J/OL]. J Biol Control, 2017, 31 (1). https://doi.org/10.18311/jbc/2017/15581.
(  0) 0) |
| [10] |
WANG C, SHAH F A, PATEL N, et al. Molecular investigation on strain genetic relatedness and population structure of Beauveria bassiana
[J]. Environ Microbiol, 2003, 5(10): 908-915. DOI:10.1046/j.1462-2920.2003.00485.x (  0) 0) |
| [11] |
胡晓磊, 何玲敏, 陈雪, 等. 中国南方球孢白僵菌的遗传多样性和种群遗传结构[J]. 中国生物防治学报, 2013, 29(1): 31-41. DOI:10.3969/j.issn.2095-039X.2013.01.005 (  0) 0) |
| [12] |
何玲敏, 胡晓磊, 陈雪, 等. 中国北方球孢白僵菌的遗传多样性和种群遗传结构[J]. 应用生态学报, 2012, 23(11): 3087-3095. (  0) 0) |
| [13] |
MEYLING N V, LUBECK M, BUCKLEY E P, et al. Community composition, host range and genetic structure of the fungal entomopathogen Beauveria in adjoining agricultural and seminatural habitats
[J]. Mol Ecol, 2009, 18(6): 1282-1293. DOI:10.1111/mec.2009.18.issue-6 (  0) 0) |
| [14] |
MEYLING N V, PILZ C, KELLER S, et al. Diversity of Beauveria spp. isolates from pollen beetles Meligethes aeneus in Switzerland
[J]. J Invert Pathol, 2012, 109(1): 76-82. DOI:10.1016/j.jip.2011.10.001 (  0) 0) |
| [15] |
王滨, 樊美珍, 李增智. 球孢白僵菌选择性培养基的筛选[J]. 安徽农业大学学报, 2000, 27(1): 23-28. DOI:10.3969/j.issn.1672-352X.2000.01.006 (  0) 0) |
| [16] |
蔡悦. 球孢白僵菌的繁殖与自然群体交配型关系的研究 [D]. 合肥: 安徽农业大学, 2012.
(  0) 0) |
| [17] |
蒲顺昌, 秦丽, 陈名君, 等. 马尾松林中球孢白僵菌寄主转移和专化性的SSR 标记分析[J]. 菌物学报, 2013, 32(4): 698-709. (  0) 0) |
| [18] |
盖红梅, 任民. SSR数据处理宏程序DataTrans 1.0[J/OL]. 分子植物育种(网络版), 2011, 9 (48): 1359-1365. http://mpb.chinese.sophiapublisher.com. doi: 10.5376/mpb.cn.2011.09.0048
(  0) 0) |
| [19] |
TAKAHATA N, NEI M. Fst and Gst Statistics in the finite island model[J]. Genetics, 1984, 107(3): 501-504. (  0) 0) |
| [20] |
张正坤, 孟鑫睿, 张佳诗, 等. 吉林省球孢白僵菌遗传多样性与亚洲玉米螟化性相关性分析[J]. 中国生物防治学报, 2015, 31(6): 836-844. (  0) 0) |
| [21] |
AMOS W, HARWOOD J. Factors affecting levels of genetic diversity in natural populations[J]. Philos Transe R Soc B: Biol Sci, 1998, 353(1366): 177-186. DOI:10.1098/rstb.1998.0200 (  0) 0) |
| [22] |
李旻, 王四宝, 樊美珍, 等. 森林生态系中球孢白僵菌遗传多样性的ISSR分析[J]. 遗传, 2006, 28(8): 977-983. DOI:10.3321/j.issn:0253-9772.2006.08.013 (  0) 0) |
| [23] |
陈雪娇, 李云飞, 孙娟娟, 等. 利用ISSR标记分析红脂大小蠹微生境中球孢白僵菌遗传多样性[J]. 菌物学报, 2014, 33(5): 1015-1024. (  0) 0) |
| [24] |
BIDOCHKA M, MENZIES F, KAMP A. Genetic groups of the insect-pathogenic fungus Beauveria bassiana are associated with habitat and thermal growth preferences
[J]. Arch Microbiol, 2002, 178(6): 531-537. DOI:10.1007/s00203-002-0490-7 (  0) 0) |
| [25] |
LUAN F, ZHANG S, CAI Y, et al. Identification of the molecular origin and development of a panzootic caused by Beauveria bassiana in praying mantis populations in eastern China
[J]. J Invert Pathol, 2011, 108: 98-105. DOI:10.1016/j.jip.2011.06.006 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


