2. 台山市红岭种子园,广东 江门,529223
2. Taishan Hongling Seed Orchard, Jiangmen 529223, China
湿地松Pinus elliottii原产于美国东南部[1],具有速生、干形通直、适应性强、抗旱耐瘠薄、松脂产量高且品质好等优点[2-3],其在原产地高可达30 m,胸径90 cm。20世纪30年代引进我国,经不断改良和推广种植,目前湿地松在我国的种植面积达到300 万hm2,是中国南方主要的材脂两用树种之一[4]。以湿地松为母本,加勒比松P. caribaea为父本的杂交后代湿加松P. elliottii×P. caribaea杂种优势明显,生长和产脂量均优于母本湿地松,是华南地区经济效益较高的人工林树种之一[5]。
在松树繁殖方面,传统的种子繁殖存在育种周期长、杂合度高、种子萌发率低等难题;而现有扦插繁殖方法存在受季节限制、需定期更换采穗母株、苗圃占地面积大等不足之处,致使优良的家系和无性系不能规模化生产[6]。体细胞胚胎发生是植物体细胞在人工控制的培养条件下分化产生体细胞胚胎(体胚),按照类似合子胚的形态发生完成形态建成的过程[7],其与传统的种子繁殖和其他无性繁殖技术相比,具有遗传稳定性高、繁殖效率高、同步化水平高等优点[8]。在松树中,影响体胚发生及植株再生的主要因素有外植体基因型、合子胚成熟度、培养基组成等[9]。通过前人试验研究,湿地松、海岸松P. pinaster、火炬松P. taeda及其与刚松P. rigida杂种均已突破体胚发生技术并获得再生植株[10]。但湿地松体胚发生仍面临以下问题:1)大部分外植体的基因型未经遗传改良;2)前人研究湿地松体胚发生,增殖培养基多为原诱导培养基[6],未考虑胚性愈伤组织在增殖阶段所需矿质元素及生长调节剂的特异性,其愈伤组织的胚性可能受到影响,不利于愈伤组织的增殖、成熟及萌发。本研究以广东改良湿地松及其杂交种为对象,进一步优化其体细胞胚胎发生及植株再生方法,为改良湿地松品种及其杂交种繁殖提供参考。
1 材料与方法 1.1 试验材料试验选取广东省台山市红岭种子园内生长良好、无病虫害的4个改良湿地松及其杂交种:EE1、EE2为湿地松自由授粉家系,EH为湿地松与洪都拉斯加勒比松P. elliottii×P. caribaea var. hondurensis杂交F2代,EC为湿地松与古巴加勒比松P. elliottii×P. caribaea var. caribaea杂交F1代,其中,EC母本是EE2,每个家系3株。分别于2016年6月16、23、26和30日采集球果,每次每株树采集3~5个球果,在冰盒中低温保存带回实验室,放在4 ℃条件下的冰箱里冷藏,用于胚的发育阶段观察及体胚发生试验。
1.2 试验方法 1.2.1 合子胚成熟度的显微观察将采集的球果对半切开,逆种鳞拨开,将种子取出,除去外种皮,得到含合子胚及胚乳的外植体。再将所取外植体移至体视显微镜下,剥离胚乳,在20×显微镜下观察合子胚的形态,拍照记录合子胚的发育情况,参照Pullman等[11]的方法,将合子胚发育划分为8个阶段,统计各家系在不同球果采集时间各发育阶段的比例。
1.2.2 培养基的准备2014—2015年通过比较DCR、LP等5种培养基的胚性愈伤组织的诱导效果,筛选出3个适宜参试材料的诱导培养基。在此基础上,本试验于2016年进一步对合子胚的愈伤组织诱导、增殖、成熟、萌发,试验采用相应的3个系列培养基配方,具体如下:
系列1采用Pullman等[10]的火炬松培养基配方。诱导培养基(T1)采用2212配方,激素及部分添加物做了调整:NH4NO3调整为603.8 mg·L–1;CuSO4为0.173 mg·L–1;FeSO4·7H2O和Na2EDTA调整为原来的1/2;蔗糖为30.0 g·L–1;肌醇为0.5 g·L–1;生长调节剂ABA为5.0 mg·L–1;激动素Kinetin为0.61 mg·L–1。同时添加:6-BA 0.63 mg·L–1;油菜素内脂0.048 mg·L–1;NAA 2.0 mg·L–1。增殖培养基(T1M)采用2212配方;成熟培养基(T1S)采用1562配方;萌发培养基(T1G)采用397配方。
系列2采用Klimaszewska等[12]北美乔松P. strobus培养基配方。诱导培养基(T2)采用MLV配方,添加:6-BA 0.5 mg·L–1,油菜素内脂0.048 mg·L–1,2,4-D 0.5 mg·L–1;增殖培养基(T2M)、成熟培养基(T2)和萌发培养基(T2G)配方与文献[12]相同。
系列3采用ArborGen公司[13]的针叶树体胚专利配方。诱导培养基(T3)激素及部分添加物做调整:麦芽糖调整为15 g·L–1;ABA为5.0 mg·L–1;添加:6-BA 0.5 mg·L–1,油菜素内脂0.048 mg·L–1,NAA 2.0 mg·L–1。其余步骤采用文献[10]的火炬松培养基配方,增殖培养基(T3M)采用2212配方;成熟培养基(T3S)采用1562配方;萌发培养基(T3G)采用397配方。
1.2.3 外植体表面消毒及诱导接种以带有胚乳的胚为外植体,按照“1.2.1”的方法将外植体从球果中挑出,在超净工作台转移至灭菌的空瓶内,倒入φ为75%的乙醇,处理45 s后纱布过滤,用无菌水冲洗5次;再倒入1.0 g·L–1的HgCl2,处理15~20 min,再用无菌水冲洗5次。处理后的外植体每次取10粒放到灭菌碟上,剥离内外种皮后,得到类似米粒状的外植体(半透明或乳白色),分别接种于T1、T2和T3诱导培养基上,(24±1) ℃条件下暗培养。
1.2.4 胚性愈伤组织的鉴别与增殖维持利用光学显微镜对诱导形成的愈伤组织进行胚性鉴别。用解剖刀片剥下2~5 mm愈伤组织,放载玻片上,加若干滴20.0 g·L–1醋酸洋红染色,打散愈伤组织,稍微加热,盖上盖玻片,清洗压片2~3次后,再用5.0 g·L–1伊文思蓝染色30 s,清洗2~3次后拍照。这种情况下胚性愈伤组织的胚柄细胞染成蓝色,胚团染成红色;非胚性愈伤组织只显示伊文思蓝染成的蓝色细胞[14]。选取诱导形成的胚性愈伤组织,转移至T1M、T2M和T3M增殖培养基上进行暗培养,(24±1) ℃条件下每间隔14 d继代1次。
1.2.5 体胚的成熟培养将增殖培养的200 mg胚性愈伤组织悬浮于20 mL无激素液体成熟培养基中,震荡以形成良好的悬浮体系,获得成熟悬浮液;再用移液器吸取3 mL成熟悬浮液,放在装有定性滤纸的布氏漏斗上,使用真空泵短、低脉冲(5 s,4.6 kPa)真空抽滤,得到吸附有薄薄一层胚团的滤纸,将滤纸放在配制好的T1S、T2S和T3S成熟培养基上进行成熟培养,培养温度为(24±1) ℃,每天光照16 h,采用LED光源(红蓝光比例为4∶1),5 μmol·m–2·s–1微弱光照,直至愈伤组织上陆续长出子叶张开的子叶胚。
1.2.6 成熟胚的萌发及移栽将子叶胚接种至T1G、T2G和T3G萌发培养皿,先在微弱光强下(1.6 μmol·m–2·s–1)培养1周,而后转到更高光强下(47 μmol·m–2·s–1)继续培养,(25±1) ℃条件下,每天光照16 h。待萌发出子叶与根的胚插入新鲜萌发培养基中以后,继续培养,培养条件与高光强培养条件相同,出现上胚轴与根系发育的植株,即为萌发。将萌发植株转移到V(泥炭)∶V(蛭石)=3∶1的混合基质中,移至人工气候室炼苗,光强为170 μmol·m–2·s–1,温度为(25±1) ℃,起始湿度为80%,每天光照16 h。逐步降至自然环境湿度,2~4周后,转移至黄心土盆栽,即可得到再生植株。2周后,统计再生植株的成活率。
1.3 数据计算与统计分析愈伤组织诱导率=诱导出愈伤组织的外植体数/接种的外植体数×100%;胚性愈伤组织比率=诱导出胚性愈伤组织的外植体数/诱导出愈伤组织的外植体数×100%;胚性愈伤组织诱导率=诱导出胚性愈伤组织的外植体数/接种的外植体数×100%;成熟效率=胚性愈伤组织产生的子叶胚数/体胚成熟前胚性愈伤组织的鲜质量;萌发率=萌发出上胚轴与根的植株数量/接种的子叶胚数量×100%;移栽成活率=移栽2周后恢复生长的植株数量/移栽的植株总数×100%。
数据统计分析采用SAS9.3软件进行,调用GLM进行方差分析,使用Excel 2013进行作图。
2 结果与分析 2.1 球果合子胚成熟度的显微观察用解剖刀小心切开雌配子体,可以观察到胚,合子胚发育早期较难观察到,中期较为明显,可用解剖针小心挑出,在体视显微镜下观察和拍照,后期直接切开已经可以见到子叶的形态(图1)。
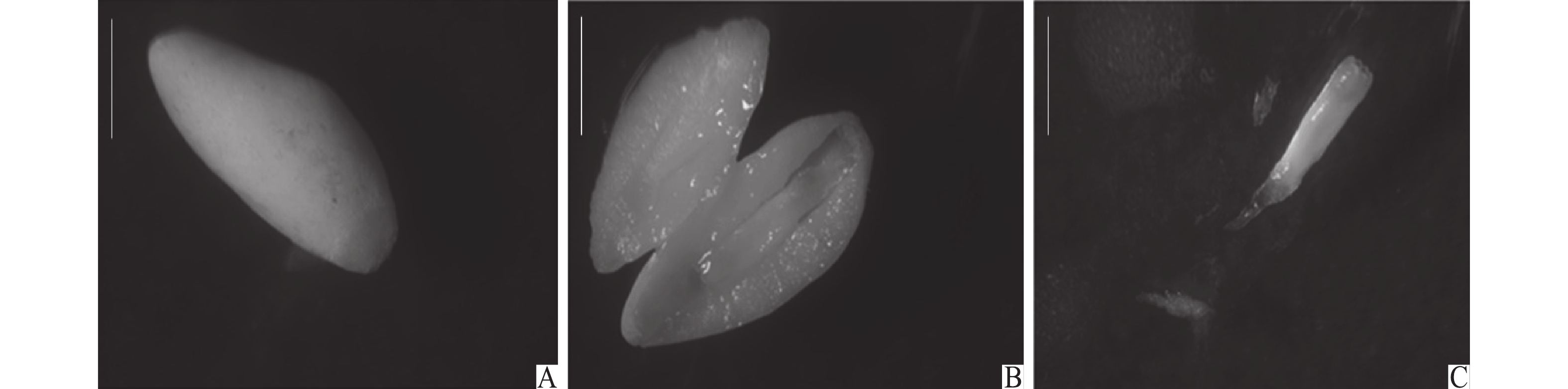
|
图 1 湿地松及其杂种雌配子体与相应的胚 Fig. 1 The megagametophytes and corresponding embryos of Pinus elliottii and hybrids A:米粒状雌配子体外观;B:切开的米粒状雌配子体;C:取出的胚;标尺=1 mm A:Appearance of grain-shape megagametophyte;B:The internal structure of grain-shape megagametophyte;C:Embryo taken out;Bar=1 mm |
根据前人对松属合子胚发育阶段划分标准[6, 11, 15],将本试验湿地松及其杂种合子胚发育划分为8个阶段。阶段Ⅰ:胚柄细胞为长形,且高度液泡化透明细胞(图2A);阶段Ⅱ:多个胚明显发育,胚体仍较为透明(图2B);阶段Ⅲ:胚头清晰,胚体渐变为不透明(图2C);阶段Ⅳ:胚头发育成圆形,胚体整体在显微镜下清晰可见(图2D);阶段Ⅴ:胚头呈圆状,胚体由头至下开始出现乳白色(图2E);阶段Ⅵ:胚头开始子叶组织的发育,圆状消失,胚体一半呈乳白色(图2F);阶段Ⅶ:胚体超过2/3为乳白色,出现合子胚子叶(图2G);阶段Ⅷ:合子胚子叶进一步张开、伸长,高过顶端分生组织(图2H)。显微观察显示,6月16日,采集的球果合子胚均处于阶段Ⅰ~Ⅱ;6月23日,家系EC最早出现阶段Ⅲ合子胚,其余家系仍处于阶段Ⅰ~Ⅱ;6月26日,家系EE2的合子胚发育阶段分布最广,包含阶段I~V;6月30日,家系EH的合子胚处于阶段Ⅲ(图3D)。前人研究指出,针叶树中未成熟合子胚诱导成功率优于成熟合子胚[16],其中阶段Ⅰ胚龄较小;阶段Ⅱ、Ⅲ为未成熟胚,阶段Ⅳ以后为成熟胚,胚龄过大。本试验选择多数合子胚处于阶段Ⅱ、Ⅲ的6月23—30日大量采摘球果,并进行体胚诱导。
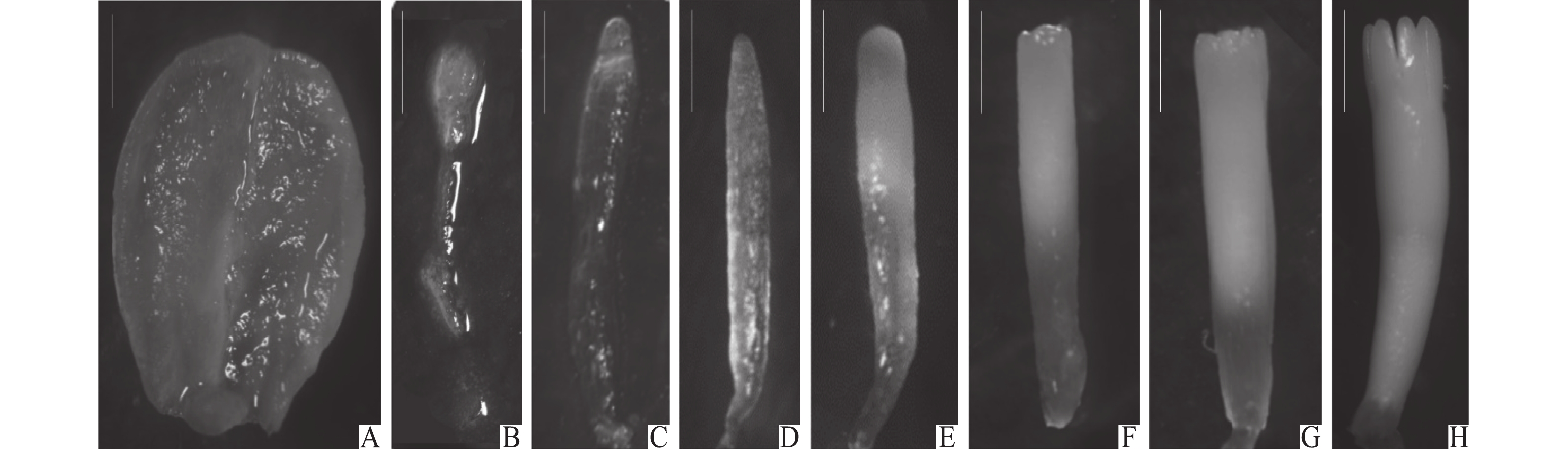
|
图 2 湿地松及其杂种球果种子不同生长阶段的合子胚 Fig. 2 The zygotic embryos of Pinus elliottii and hybrids at different development stages A:阶段Ⅰ;B:阶段Ⅱ;C:阶段Ⅲ;D:阶段Ⅳ;E:阶段Ⅴ;F:阶段Ⅵ;G:阶段Ⅶ;H:阶段Ⅷ;标尺=500 μm A:Stage Ⅰ;B:Stage Ⅱ;C:Stage Ⅲ;D:Stage Ⅳ;E:Stage Ⅴ;F:Stage Ⅵ;G:Stage Ⅶ;H:Stage Ⅷ;Bar=500 μm |
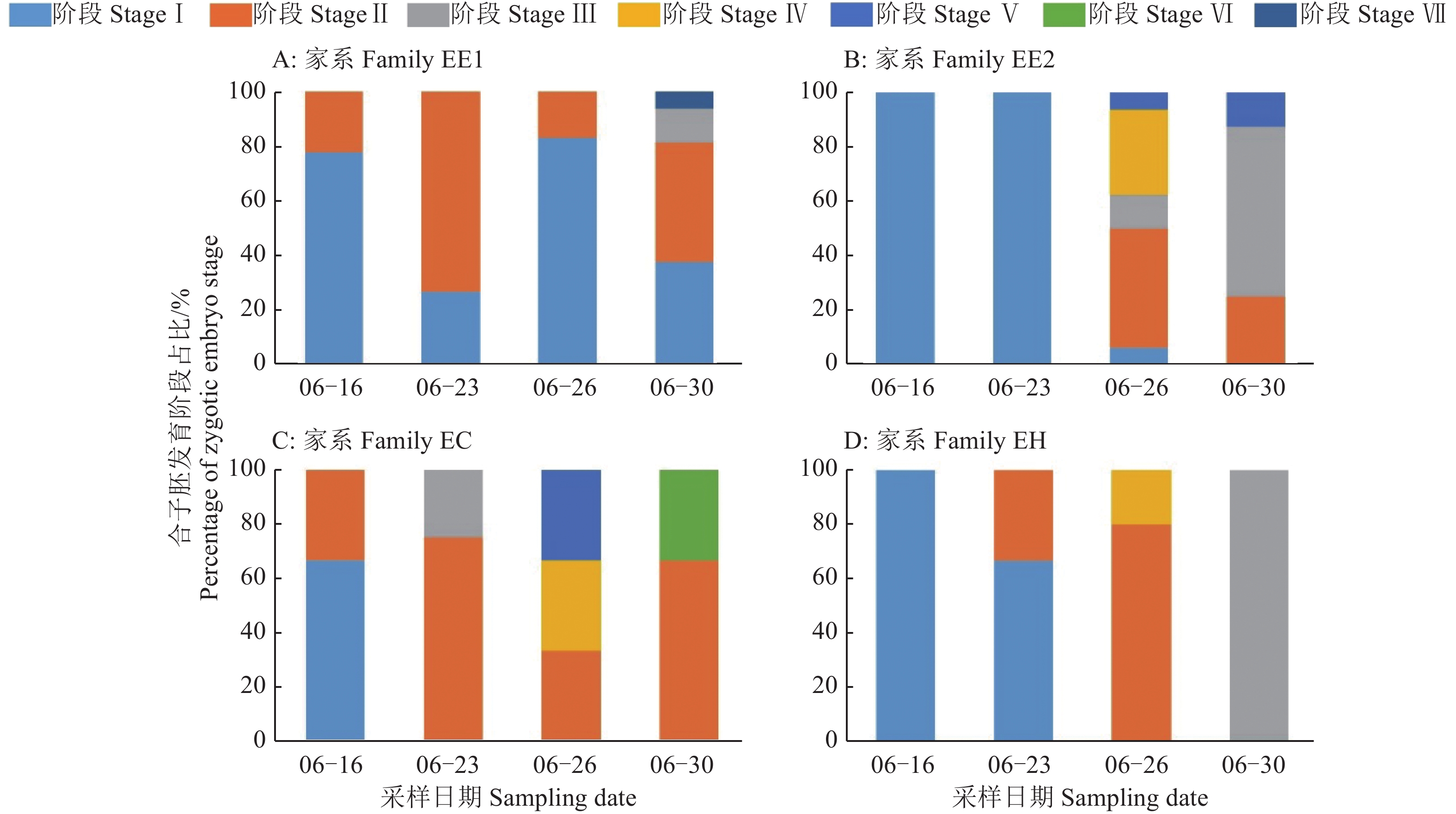
|
图 3 不同采球果时间各家系合子胚成熟情况 Fig. 3 The maturation conditions of zygotic embryos of each family on different sampling dates |
外植体诱导培养2~4周后开始膨大,通过胚性鉴定发现存在2种类型的愈伤组织。在显微镜下能观测到愈伤组织内有排列紧密的胚头和长条形细胞组成的胚性胚柄团(ESM)结构(图4A),非胚性愈伤组织则无ESM结构(图4B)。继续培养2~4周,具有ESM结构的愈伤组织发育成透明银耳状黏性愈伤组织,可继续增长;无ESM结构的愈伤组织逐渐呈褐色,质感较硬,生长缓慢,直至停止生长。
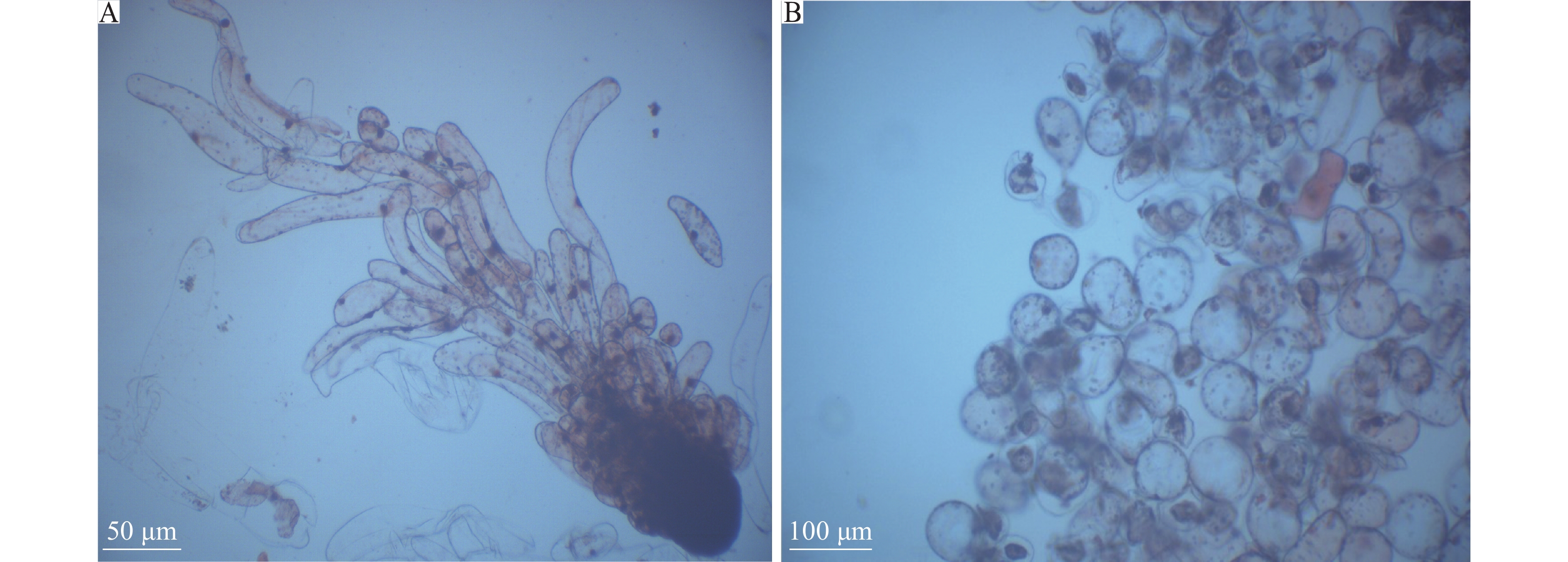
|
图 4 湿地松及其杂种的胚性及非胚性愈伤组织 Fig. 4 The embryonic and non-embryonic callus of Pinus elliottii and hybrids A:胚性胚柄团(ESM)结构;B:非ESM结构 A:Structure of embryonal-suspensor mass(ESM) ; B: Structure of non-ESM |
不同诱导培养基上形成的愈伤组织及其胚性愈伤所占比例存在较大差异 (表1)。其中,T1培养基上愈伤组织的诱导率相对最高,为49.0%,但胚性愈伤组织占比相对最小;T2培养基上接种1 634个外植体,仅产生223个愈伤组织,胚性愈伤组织占22.4%。不同培养基配方对家系诱导率的影响各异(表2),EH未能在T1培养基中形成胚性愈伤组织;T2培养基对不同家系的诱导率具有显著影响,该配方对家系EE2、EH无诱导作用;家系EE1、EC在该配方中诱导率均高于其在其他配方中的诱导率,且EE1的诱导率最高,达5.82%。参试的湿地松及其杂种在T3培养基中均能诱导成功,平均诱导率最高,为3.75%。
|
|
表 1 各培养基上胚性愈伤组织的鉴别情况 Table 1 The identification result of embryogenic callus in each medium |
|
|
表 2 不同培养基配方对湿地松及其杂种诱导率的影响1) Table 2 The effects of different culture mediums on embryogenic induction rates of Pinus elliottiiand its hybrids |
不同采集时间的外植体愈伤组织诱导结果(图5)显示,家系EE1、EH随采样时间延后,诱导率逐渐增加,其中,EE1在6月30日采摘球果诱导率达到最高,为5.99%,明显高于其他家系,EH平均诱导率最小,6月23日诱导率为0。家系EE2、EC则相反,体胚诱导率随采样时间延后逐渐降低。体胚诱导率与合子发育阶段基本一致,家系EE1、EH的阶段Ⅲ合子胚均出现较晚,EE2、EC则出现较早。
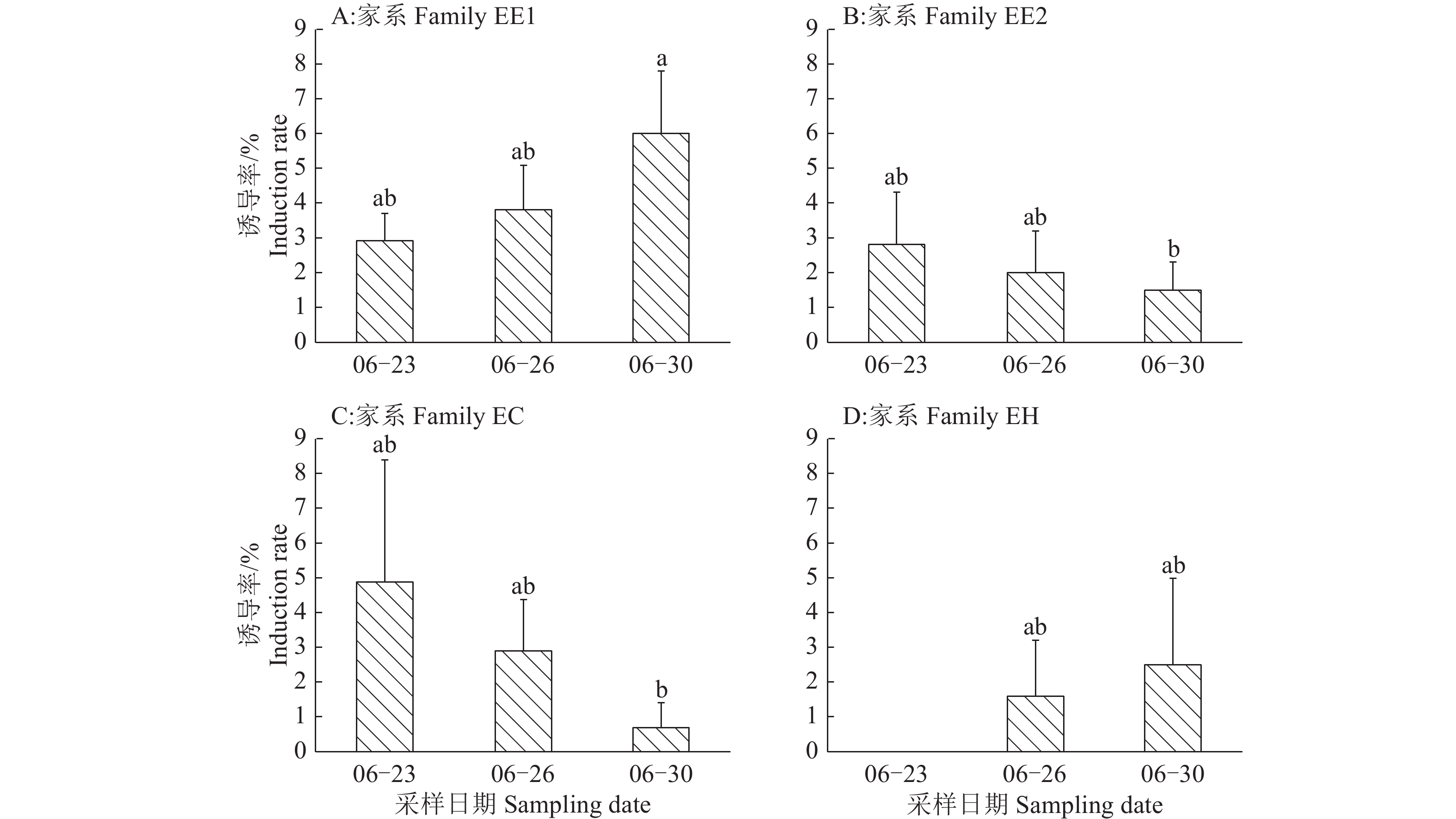
|
图 5 不同采样时间的湿地松及其杂种的诱导率 Fig. 5 The somatic embryo induction rates of Pinus elliottii and hybrids on different sampling dates 各图中, 柱子上方的不同小写字母表示差异显著(P<0.05, Tukey 法) In each figure, different lowercase letters on the bars indicated significant difference(P<0.05, Tukey test) |
选取诱导产生的胚性愈伤组织进行增殖培养,增殖过程产生的愈伤组织包括2种:一种位于愈伤体的外侧,呈透明银耳状,可用于继代增殖;另一种位于愈伤体的内侧,呈褐色,胚性低,不适宜继代。继代24次后,愈伤体内侧褐化严重,外侧透明银耳状失去(图6B),胚活性逐渐降低。
成熟培养3周后,吸附在滤纸上薄薄一层胚体积增大(图6C);继续在成熟培养基培养6周,即可得到子叶张开的胚(图6D)。每克T1S成熟培养基平均成熟23.3个子叶胚,每克T3S成熟培养基平均成熟15.9个子叶胚。
2.4 成熟子叶胚的萌发及移栽成熟培养获得形态正常的子叶胚(图6D)在萌发培养基6~8 d,可得到萌发出子叶与根的胚,转移至新鲜萌发培养基中继续培养6~8周,出现具上胚轴、根系发育的植株(图6E),萌发率为32.1%。将萌发植株转移到混合基质中炼苗(图6F),最后转移至黄心土盆栽,即可得到再生植株。移栽2周后,再生植株的存活率为47.8%,本试验共移植23株,存活11株。

|
图 6 湿地松及其杂种体胚发生过程 Fig. 6 The somatic embryogenesis stages of Pinus elliottii and hybrids A:外植体在诱导培养基T3上培养6周后;B:胚性组织继代24次后;C:胚性愈伤组织在成熟培养基T3S上培养3周后;D:产生子叶胚;E:体胚苗在萌发培养基上培养6周后;F:体胚苗移栽至黄心土1周后生长情况 A:Megasporophylls after six weeks’ culture on the initiation medium T3; B:Embryogenic tissue after 23 cycles of subculture; C:Embryogenic tissue after three weeks of growth on the maturation medium T3S; D: The cotyledon of somatic embryos came out; E: Somatic embryos after six weeks’ culture on the germination medium; F: Somatic seedlings after one week of growth in the yellow soil |
利用体细胞胚胎发生体系进行种苗繁殖具有快速、高效、不受季节等自然条件制约等优点,是林木优良基因型大规模繁殖的一种有效技术[17]。体胚诱导是体胚发生植株再生最重要的环节[18],研究表明,利用合子胚作为外植体诱导体胚的最直接因素是合子胚的发育阶段[19],同一类型外植体发育的不同阶段对体胚形成有显著影响[20]。丛建民等[21]研究发现,水曲柳体胚发生最适宜的外植体发育阶段是刚进入子叶期的幼嫩合子胚。前人选取2个湿地松家系比较了其在5个球果采样时间的体胚诱导率,结果发现,2个家系以处于Ⅱ、Ⅲ、Ⅳ发育阶段的未成熟合子胚诱导率最高[6]。本试验中,6月16日,采集的球果合子胚均处于阶段Ⅰ~Ⅱ,胚龄过小,参试家系均未诱导成功;6月23日以后,家系EC开始出现阶段Ⅲ合子胚,诱导率在所有家系中最高,为4.90%,家系EE1、EH在6月30日出现阶段Ⅲ合子胚,诱导率也达到最高。家系EE2在6月26、30日也有阶段Ⅲ合子胚出现,但诱导率不高,可能与该采样时间出现阶段Ⅳ及Ⅴ合子胚、合子胚已成熟有关,湿地松及其杂种胚龄过小或过大的合子胚的诱导率均较低,甚至诱导不出胚性愈伤组织,阶段Ⅲ合子胚为体胚发生最佳诱导阶段。
此外,外植体的基因型是影响其体胚诱导的关键因素之一。徐春香等[22]报道了香蕉“大矮蕉”品种Musa AAA cv. Grande Naine的体胚发生植株再生。同时,该研究团队的另一试验指出不同香蕉品种,建立胚性细胞悬浮系的难易程度有所不同,并且,基因组类型为AAB或ABB的香蕉品种未能获得胚性愈伤组织[23]。前人研究了10个火炬松半同胞家系的体胚诱导过程,发现起始愈伤组织最高诱导率为33%,最低仅为3.3%,诱导出的愈伤组织家系平均存活率为0~40%[24]。本试验中,参试的4个家系在3种诱导培养基的平均诱导率存在明显差异,EE1诱导率显著高于EH,EE2与EC的诱导率接近,EE1、EE2、EC和EH的诱导率分别为4.24%、2.10%、2.82%和1.38%。培养基成分中的激素和生长调节剂、矿质营养等是影响体胚发生的另外一关键因素[25],前人以湿地松与洪都拉斯加勒比松杂种为试验材料,基于DCR培养基[26]、MLV配方[27],添加不同种类、浓度的激素,设置6种诱导培养基,诱导率最高的是添加BAP(4.5 μmol·L–1)和2,4−D (9.0 μmol·L–1)的MLV配方,诱导率达到10.22%;诱导率最低的是添加了吡效隆(CPPU)(4 μmol·L–1)的DCR培养基,诱导率为1.67%[28]。本试验选取的3种培养基中,T3对参试的湿地松及其杂种均能诱导成功,且平均诱导率最高,说明T3培养基具有广泛适应性。
有研究指出,植物的胚性愈伤也像其他生命体,存在着衰老的过程[29]。本试验中,继代24次以后,胚活性逐渐降低。产生胚活性降低的原因可能是: 一方面继代次数过多,导致胚体的基因缺失或者发生变异,细胞的全能性受损;另一方面,由于长期处于外界供给的激素及营养条件下,胚体自身的内源激素动态平衡被打破,再分化困难[30]。当前有效保持细胞胚性的主要措施为超低温保存胚性愈伤[31]。
前人报道, 湿地松的离体再生存在较大难度,尽管对湿地松体胚发生体系研究报道较多,但只有少量报道实现了植株再生[32]。Jain等[33]基于DCR培养基培养未成熟合子胚首次实现湿地松体胚发生植株再生。唐巍等[34]报道了不同基因型及胚发育时期的湿地松体胚发生植株再生。然而,湿地松选择未成熟胚作为外植体时,普遍诱导率低,且受到基因型特异性控制。近年来,湿地松与加勒比松杂种也突破体胚发生形成再生植株[28]。前期的研究结果表明,DCR、LP常用配方对广东改良湿地松家系诱导效果不理想,而改良MLV也不能成功诱导家系EE2、EH,本研究利用系列3配方,成功诱导4个家系。成熟阶段中发现,每克T1S、T3S培养基能平均成熟23.3、15.9个子叶胚,均大于前人研究的湿地松杂种的最小成熟效率(每克培养基平均成熟9.95个子叶胚),但与最大成熟效率(每克培养基平均成熟320.90子叶胚)存在一定的差距[28],成熟培养基可能需要做进一步改良。本研究最终获得23株再生植株,其中,11株健康苗木移栽至苗圃。利用体胚发生实现良种湿地松及杂种的规模化生产仍需突破产业化技术。
| [1] |
李彦杰, 栾启福, 沈丹玉, 等. 湿地松自由授粉家系松脂组分遗传变异研究[J]. 林业科学研究, 2012, 25(6): 773-779. DOI:10.3969/j.issn.1001-1498.2012.06.016 (  0) 0) |
| [2] |
WEN X, KUANG Y, SHI M, et al. Biology of Hylobitelus xiaoi(Coleoptera: Curculionidae), a new pest of slash pine, Pinus elliottii
[J]. J Econ Entomol, 2004, 97(6): 1958-1964. DOI:10.1093/jee/97.6.1958 (  0) 0) |
| [3] |
MEANS D B, PALIS J G, BAGGETT M. Effects of slash pine silviculture on a florida population of flatwoods salamander[J]. Conserv Biol, 1996, 10(2): 426-437. DOI:10.1046/j.1523-1739.1996.10020426.x (  0) 0) |
| [4] |
张帅楠. 湿地松材性测定技术研究与多性状联合选择[D]. 北京: 中国林业科学研究院, 2017.
(  0) 0) |
| [5] |
宗亦臣, 郑勇奇, 马锡权, 等. 湿加松良种‘中林1号’[J]. 湖南林业科技, 2017, 44(1): 76-77. DOI:10.3969/j.issn.1003-5710.2017.01.015 (  0) 0) |
| [6] |
吴丽君. 湿地松、火炬松离体培养植株再生技术的研究[D]. 南京: 南京林业大学, 2008.
(  0) 0) |
| [7] |
姜福星, 魏丕伟, 寇亚平, 等. 探析植物体胚发生的关键基因[J]. 分子植物育种, 2017, 15(4): 1304-1311. (  0) 0) |
| [8] |
QUIROZ-FIGUEROA F R, ROJAS-HERRERA R, GALAZ-AVALOS R M, et al. Embryo production through somatic embryogenesis can be used to study cell differentiation in plants[J]. Plant Cell Tissue Organ Cult, 2006, 86(3): 285-301. DOI:10.1007/s11240-006-9139-6 (  0) 0) |
| [9] |
KIM Y W, MOON H K. Enhancement of somatic embryogenesis and plant regeneration in Japanese red pine (Pinus densiflora)
[J]. Plant Biotechnol Rep, 2014, 8(3): 259-266. DOI:10.1007/s11816-014-0319-2 (  0) 0) |
| [10] |
PULLMAN G S, BUCALO K. Plant embryo culture[M]. New York: Humana Press, 2011: 267-291.
(  0) 0) |
| [11] |
PULLMAN G S, MEIN J, JOHNSON S, et al. Gibberellin inhibitors improve embryogenic tissue initiation in conifers[J]. Plant Cell Rep, 2005, 23(9): 596-605. DOI:10.1007/s00299-004-0880-1 (  0) 0) |
| [12] |
BONGA J M, PARK Y S, OVERTON C, et al. Optimized somatic embryogenesis in Pinus strobus L.
[J]. In Vitro Cell Dev Biol Plant, 2013, 37(3): 392-399. (  0) 0) |
| [13] |
BECWAR M, CLARK J, SWINTON L S, et al. Liquid-based method for producing plant embryos: US 8313946B2[P]. 2012-11-20.
(  0) 0) |
| [14] |
GUPTA P K, HOLMSTROM D. Protocol for somatic embryogenesis in woody plants[M]. Dordrecht: Springer, 2005: 573-575.
(  0) 0) |
| [15] |
李清清, 叶建仁, 吴小芹. 黑松合子胚和体细胞胚发育阶段的形态特征比较[J]. 林业科技开发, 2012, 26(5): 21-23. DOI:10.3969/j.issn.1000-8101.2012.05.005 (  0) 0) |
| [16] |
LIAO Y K, AMERSON H V. Slash pine (Pinus elliottii Engelm.) somatic embryogenesis: I: Initiation of embryogenic cultures from immature zygotic embryos
[J]. New Forest, 1995, 10(2): 145-163. (  0) 0) |
| [17] |
吴涛, 陈少瑜, 陈芳, 等. 云南松合子胚发育及形态特征[J]. 西北林学院学报, 2008, 23(6): 91-93. (  0) 0) |
| [18] |
吕守芳, 张守攻, 齐力旺, 等. 日本落叶松体细胞胚胎发生的研究[J]. 林业科学, 2005, 41(2): 48-52. DOI:10.3321/j.issn:1001-7488.2005.02.008 (  0) 0) |
| [19] |
张建伟, 王军辉, 李青粉, 等. 云杉未成熟合子胚诱导体细胞胚胎发生[J]. 林业科学, 2014, 50(4): 39-46. (  0) 0) |
| [20] |
RAMAROSANDRATANA A V, STADEN J V. Tissue position, explant orientation and naphtha aleneacetic acid (NAA) affect initiation of somatic embryos and callus proliferation in Norway spruce (Picea abies)
[J]. Plant Cell Tissue Organ Cult, 2003, 74(3): 249-255. DOI:10.1023/A:1024022226381 (  0) 0) |
| [21] |
丛建民, 沈海龙, 李玉花, 等. 水曲柳体胚发生过程中不同状态类型外植体的生理生化状态[J]. 华南农业大学学报, 2012, 33(1): 48-52. DOI:10.3969/j.issn.1001-411X.2012.01.010 (  0) 0) |
| [22] |
徐春香, PANIS B, STROSSE H, 等. 体胚发生途径‘大矮蕉’植株的再生[J]. 华南农业大学学报, 2004, 25(2): 63-66. DOI:10.3969/j.issn.1001-411X.2004.02.017 (  0) 0) |
| [23] |
徐春香, PANIS B, STROSSE H, 等. 香蕉胚性愈伤组织的诱导及胚性细胞悬浮系的建立[J]. 华南农业大学学报, 2004, 25(1): 70-73. DOI:10.3969/j.issn.1001-411X.2004.01.019 (  0) 0) |
| [24] |
PULLMAN G S, NAMJOSHI K, ZHANG Y. Somatic embryogenesis in loblolly pine (Pinus taeda L.): Improving culture initiation with abscisic acid and silver nitrate
[J]. Plant Cell Rep, 2003, 22(2): 85-95. DOI:10.1007/s00299-003-0673-y (  0) 0) |
| [25] |
PULLMAN G S, BUCALO K. Pine somatic embryogenesis: analyses of seed tissue and medium to improve protocol development[J]. New Forest, 2014, 45(3): 353-377. DOI:10.1007/s11056-014-9407-y (  0) 0) |
| [26] |
GUPTA P K, DURZAN D J. Shoot multiplication from mature trees of douglas-fir (Pseudotsuga menziesii) and sugar pine (Pinus lambertiana)
[J]. Plant Cell Rep, 1985, 4(4): 177-179. DOI:10.1007/BF00269282 (  0) 0) |
| [27] |
LITVAY J D, VERMA D C, JOHNSON M A. Influence of a loblolly pine (Pinus taeda L.) culture medium and its components on growth and somatic embryogenesis of the wild carrot (Daucus carota L.)
[J]. Plant Cell Rep, 1985, 4(6): 325-328. DOI:10.1007/BF00269890 (  0) 0) |
| [28] |
NUNES S, MARUM L, FARINHA N, et al. Somatic embryogenesis of hybrid Pinus elliottii var. elliottii×P. caribaea var. hondurensis and ploidy assessment of somatic plants
[J]. Plant Cell Tissue Organ Cult, 2018, 132(1): 71-84. DOI:10.1007/s11240-017-1311-7 (  0) 0) |
| [29] |
陈金慧, 施季森, 诸葛强, 等. 植物体细胞胚胎发生机理的研究进展[J]. 南京林业大学学报(自然科学版), 2003, 27(1): 75-80. DOI:10.3969/j.issn.1000-2006.2003.01.018 (  0) 0) |
| [30] |
杨玲. 花楸种子生物学和体细胞胚发生体系研究[D]. 哈尔滨: 东北林业大学, 2007.
(  0) 0) |
| [31] |
王高. 红松体细胞胚胎发生及超低温保存技术研究[D]. 上海: 上海交通大学, 2009.
(  0) 0) |
| [32] |
NEWTON R J, TANG W, JAIN S M. Slash pine (Pinus elliottii Engelm.)[M]. Berlin Heidelberg: Springer, 2005: 1-10.
(  0) 0) |
| [33] |
JAIN S M, DONG N, NEWTON R J. Somatic embryogenesis in slash pine (Pinus elliottii) from immature embryos cultured in vitro
[J]. Plant Sci, 1989, 65(2): 233-241. DOI:10.1016/0168-9452(89)90070-8 (  0) 0) |
| [34] |
唐巍, 欧阳藩, 郭仲琛. 湿地松体细胞胚胎发生和植株再生[J]. 植物资源与环境学报, 1997, 6(2): 8-11. (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


