2. 广东第二师范学院 生物与食品工程学院/广东高校应用生态工程技术开发中心,广东 广州 510303
2. Biology and Food Engineering Institute, Guangdong University of Education/Guangdong Development Center of Applied Ecology and Ecological Engineering in Universities, Guangzhou 510303, China
产前损失是指子宫容量和胎盘大小造成胚胎或胎儿不能正常分娩,母猪的产前损失大约为30%~50%[1],在附植期胚胎死亡率可达25%[2],其中妊娠第11至12天由于妊娠识别失败而导致的胚胎死亡率大概为20%,甚至达到40%~50%[3-4]。妊娠第11至12天(GD11~GD12)胚胎因妊娠识别失败而导致的胚胎死亡是母猪产前损失的主要来源,也是制约母猪窝产仔数的最主要因素,因此提高胚胎存活率是提高母猪繁殖力的关键。二花脸猪(Erhualian, ER)是我国以低胚胎死亡率、高产仔数而世界闻名的优质猪种,二花脸初产母猪的平均窝产仔数为12头,经产母猪的窝产活仔数可超过16头[5],而外来猪种如大白猪和长白猪的窝产仔数一般在11头左右,一般情况下,引进猪种比我国地方种猪平均窝产仔数少2~3头。二花脸猪高产仔性能是受多个基因综合作用的结果,而且可能主要受子宫内基因表达水平的影响[6]。研究发现,在猪附植期子宫内膜中,LPAR3为差异表达基因,且可能是影响不同猪种GD11~GD12胚胎存活率进而造成不同猪种差异窝产仔数的主效基因[7-8],然而LPAR3mRNA结构信息尚不完整,也鲜见对猪LPAR3启动子活性及其在子宫内膜表达的报道,完善LPAR3 mRNA结构信息并进行启动子转录活性研究,可以深入揭示LPAR3基因在不同猪附植期子宫内膜中差异表达的原因,为母猪早期胚胎死亡机制研究提供一定参考,从而为提高母猪产仔数的分子育种积累科学资料。
溶血磷脂酸(Lysophosphatidic acid,LPA)主要是由活化的血小板产生,或由磷酸二酯酶(Ectonucleotide pyrophosphatase/phosphodiesterase 2,ENPP2)催化水解膜磷脂形成溶血磷脂,溶血磷脂再被溶血磷脂酶D水解转化而成,LPA形成后被释放到细胞外的体液[9-10]。LPA受体缺陷小鼠表明LPA通过G蛋白偶联受体(LPAR1~LPAR6)参与精子发生、受精、早期胚胎发育、胚胎植入、维持胚胎间距、蜕膜化、妊娠维持和分娩等生殖过程,揭示LPA及受体在脊椎动物繁殖活动中的作用具有重要意义[11]。LPA受体(Lysophosphatidic acid receptor 3,LPAR3)与雌性生殖系统密切相关[12-13],LPAR3参与子宫内膜容受性过程,子宫内膜容受性受到前列腺素、肽类激素等调节从而发生改变,进而影响胚胎植入率和妊娠率。小鼠LPAR3主要分布在子宫内膜上皮、腺上皮和部分基质细胞的胞质[14],在小鼠胚胎围着床期的第3天开始LPAR3mRNA和蛋白能够在雌激素下调孕酮水平的诱导下开始表达;敲除LPAR3基因后会出现小鼠胚胎附植延迟、胚胎间距的异常、窝产子数减少,以及子宫内膜环氧合酶−2(Cyclooxygenase-2, COX-2)、前列腺素E2(Prostaglandin E2,PGE2)表达水平的降低,而激素水平的降低会导致孕酮信号传导或雌激素信号传导比率增加[15-17]以及蜕膜反应的减弱[18],不利于妊娠的建立和维持。Ye等[19]研究发现LPAR3通过COX-2(合成前列腺素的限速酶)产生前列腺素E2和前列腺素I2,促进胚胎植入以及保持适当的胚胎间距。在人体上使用GnRHa/FSH/HCG进行超促排卵过程中发现,通过调节LPAR3表达水平和时间可以影响人子宫内膜的容受性[20],使子宫内膜和胚胎的发育不同步,造成妊娠率下降。
猪LPAR3基因在妊娠早期起到重要作用[21],猪LPAR3基因定位6号染色体q2.6~3.2区段,开放阅读框为1 065 bp,编码蛋白质的相对分子量为40 400。研究发现,胚胎植入的猪子宫内膜中的LPAR3mRNA表达水平显著高于无胚胎植入或未孕猪子宫内膜的表达水平,且LPAR3mRNA表达水平在胚胎发育至囊胚阶段和胚胎植入前达到高峰,提示LPAR3参与子宫容受性的建立,并且其在猪子宫内膜的表达升高可能受胚胎、分泌因子和信号分子的调控[22]。妊娠第11至12天的猪胚胎正处于围附植期,胚胎形态发生了巨大的变化,胚胎快速延伸,胚体滋养层开始合成并分泌一系列的激素、生长因子等物质,引发子宫内环境的改变,使得子宫内膜保持良好的容受性,启动母体的妊娠识别[23]。雌激素在母猪妊娠第12天和第15天达到高峰,并发挥主要作用[24]。雌激素使子宫内膜合成的前列腺素F2α(Prostaglandin F2α, PGF2α)减少,并且阻止其进入子宫静脉,使黄体持续分泌孕酮,此时子宫内膜在胚胎合成和雌激素的刺激下产生LPAR3,LPAR3在妊娠第12天时在猪子宫腔上皮和腺上皮达到表达高峰。LPAR3可与LPA结合进而激活cAMP, 促进细胞分裂−相关蛋白激酶(Mitogen-associated protein kinases, MAPK)、磷脂酶C和Ca2+信号途径,诱导子宫内膜前列腺素内过氧化物酶2(Prostaglandin-endoperoxide 2, PTGS2)的表达,调节子宫内膜前列腺素F2(Prostaglandin F2, PGF2)和前列腺素E2(Prostaglandin E2,PGE2)的产生,促进胚胎种植和母体对胚胎的识别[25],从而提高母猪的产仔数。这些结果都表明,猪LPAR3基因的表达在胚胎植入及妊娠建立中起关键作用。
鉴于LPAR3为影响妊娠第11至12天猪胚胎存活率的主效基因及其在繁殖过程中的重要作用,本研究通过RACE技术获取LPAR3完整的mRNA序列;随后克隆LPAR3的 5'调控区并利用生物信息学在线预测转录5'调控区潜在转录因子结合位点及CpG岛;构建9个不同长度的启动子缺失片段,分析启动子活性;实时荧光定量PCR分析LPAR3基因在妊娠第12天二花脸猪和长大二元猪(Landrace×Large White,LL)子宫内膜的差异表达,子宫内膜DNA经过亚硫酸氢盐修饰后测序分析LPAR3基因的甲基化。对猪LPAR3启动子及在妊娠第12天二花脸猪和长大二元猪子宫内膜的差异表达进行研究,期望探析我国地方良种猪产仔数高于外来猪种产仔数的原因。
1 材料与方法 1.1 材料猪耳、心、肝、脾、肺、肾、子宫内膜上皮组织等组织样采集于妊娠第12天(GD12)的第3胎纯种二花脸猪(GD12 ER)和长大二元猪(GD12 LL),GD12 ER来源于温氏集团良洞猪场,GD12 LL来源于阳江市阳东县广东源丰农业有限公司。子宫内膜上皮细胞的采集来源于屠宰场收集的卵泡期子宫。
第1链cDNA反转录试剂盒、TRIzol、PrimeScript® 1st Strand cDNA Synthesis Kit、荧光定量SYBR®Premix Ex TaqTM试剂盒、大肠埃希菌菌株DH5α、pMD-20T Vector、5'-Full RACE kit试剂盒购于TaKaRa公司;无内毒素质粒小提试剂盒购于OMEGA公司;双荧光素酶检测试剂盒、pGL-3 Basic Vector、pRL-TK Vector购于Promega公司;普通质粒提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒购于Thermo scientific公司;胎牛血清、低糖DMEM购于Invitrogen公司;引物由广州英骏生物公司合成。
1.2 方法 1.2.1 RACE技术克隆LPAR3 mRNA完整序列根据GenBank和Ensembl数据库中提供的LPAR3基因参考序列(GenBank登录号:100113360)设计引物(表1)扩增5'UTR序列。扩增PCR片段用10 g·L–1琼脂糖凝胶分离并纯化,回收目的片段送广州英骏生物公司测序(下同)。利用5'-Full RACE kit试剂盒获得LPAR3 mRNA的5'UTR,主要步骤包括去磷酸化处理、去帽子反应、连接5'RACE Adaptor、反转录反应、Outer PCR反应、Inner PCR反应。使用3'-Full RACE kit试剂盒经过反转录反应和巢式PCR反应获得LPAR3mRNA的3'UTR,使用SYBR®Premix Ex TaqTM试剂盒进行巢式PCR的Outer PCR和Inner PCR反应。电泳分析5'RACE和3'RACE产物,克隆至pMD20-T Vector载体后送测序。将获得的5'UTR和3'UTR序列进行拼接,获得完整的mRNA序列,提交GenBank,获得基因序列号。
1.2.2 LPAR3基因5'调控区的扩增及生物信息学预测以常规酚氯仿抽提法提取猪耳样DNA, 以获得的LPAR3基因完整mRNA序列为基础,设计LPAR3-P引物扩增5'调控序列(表1)。目的片段回收纯化后加“A”尾,连接至pMD20-T Vector载体后转化大肠埃希菌DH5α感受态细胞,涂布氨苄青霉素琼脂平板,37 ℃条件下过夜培养;挑取单克隆菌落于LA培养液中培养,选阳性克隆菌液送公司测序;测序鉴定正确的质粒命名为T-LPAR3-P。将获得LPAR3基因5'调控区序列通过在线软件(http://www.genomatix.de及http://www.cbrc.jp/research/db/TFSEARCH.html)预测潜在转录因子结合位点;通过在线网站(http://www.urogene.org/methprimer/index1.html)分析启动子以及潜在CpG岛(CpG islands, CpGs)。
1.2.3 构建LPAR3基因启动子报告基因重组体及双荧光素酶活性检测参照获得的LPAR3基因完整mRNA序列及5'调控区序列设计7对引物(p1~p7)(表1);通过在线软件发现5'调控区–190/–84和–44/+651 bp处存在2个潜在的CpG岛,设计引物p8、p9(表1)探究CpG对LPAR3基因启动子活性的影响。以p1~p9引物、T-LPAR3-P质粒为模板,扩增猪LPAR3基因不同的启动子片段。各PCR扩增片段回收纯化后用MluI和XhoI限制性内切酶进行双酶切,同时对pGL3-basic载体进行酶切。酶切体系为:PCR产物或pGL3-basic Vector 50 μL,10×FastDigest Green Buffer 20 μL,MluI 5 μL,XhoI 5 μL,ddH2O 20 μL,37 ℃条件下水浴3 h。各双酶切产物回收纯化后连至pGL3-basic载体,连接反应体系为:1 μL Ligation Buffer,2 μL pGL3-basic载体双酶切产物,6.8 μL各个缺失片段双酶切回收的目的片段,0.2 μLT4 DNA连接酶,22 ℃条件下连接2 h。将连接产物转化大肠埃希菌DH5α感受态细胞,涂板并在37 ℃条件下过夜培养,挑取单克隆进行测序。将阳性克隆经过双酶切鉴定正确的各重组质粒分别命名为P1(–1 878/+80 bp)、P2(–1 355/+80 bp)、P3(–967/+80 bp)、P4(–454/+80 bp)、P5(–271/+80 bp)、P6(–123/+80 bp)、P7(–16/+80 bp)、P8(–271/–54 bp) 和P9(–271/+650 bp),并利用OMEGA无内毒素试剂盒提取重组质粒P1~P9。
分离猪卵泡期的子宫内膜上皮组织并建立子宫内膜上皮细胞体外培养体系[26],用阳离子脂质体法将荧光素酶报告载体与内对照pRL-TK质粒共转染子宫内膜上皮细胞,操作步骤按照LipofectamineTM LTX and PLUSTM试剂盒说明书进行。检测双荧光素酶报告基因Luciferase活性,应用统计学方法,分析多次独立试验比值,分别计算其
按Trizol法提取GD12 ER各组织及GD12 LL子宫内膜的总RNA,利用第1链cDNA反转录试剂盒逆转录合成cDNA。以GADPH为内参基因,引物为p-GADPH (表1),利用荧光定量SYBR®Premix Ex TaqTM试剂盒检测LPAR3基因表达,引物为pLPAR3 (表1)在GD12 ER各组织及GD12 LL子宫内膜的表达。样品设置相同的阈值线,采用2-ΔΔCt法计算LPAR3基因的相对表达量,CFX Manager软件输出扩增的Ct值,分析LPAR3在不同组织及猪中的表达是否存在差异。
1.2.5 猪LPAR3基因启动子甲基化检测参考在线网站(http://www.urogene.org/methprimer/index1.html)设计扩增CpGs的甲基化特异性引物LPAR3-BSP1、LPAR3-BSP2,以亚硫酸修饰后的GD12 ER和GD12 LL的子宫内膜上皮组织DNA为模板, 进行亚硫酸氢盐PCR(bisulfite sequencing PCR, BSP-PCR)扩增。BSP-PCR产物经过回收纯化、连接、转化后,挑取阳性克隆送公司测序。根据甲基化的胞嘧啶C在亚硫酸氢盐处理后不被转化胸腺嘧啶T的原理,统计CpG甲基化位点及比例,并运用BiQ Analyzer软件分析启动子的甲基化状态。
1.2.6 主要分子生物学软件与数据库基因序列查询:GenBank:http://www.ncbi.nlm.nih.gov;Ensembl:http://asia.ensembl.org/index.html;转录因子结合位点分析:MatIspector:http://www.genomatix.de/,TFSEARCH:http://www.cbrc.jp/research/db/TFSEARCH.html;预测CpG岛:http://www.uragene.org/methprimer/index1.html;PCR引物设计的软件:Primer primer5.0;核酸序列比对、拼接的软件:DNASTAR。
2 结果与分析 2.1 猪LPAR3 mRNA克隆及5'调控区的扩增以二花脸cDNA为模板扩增获得867 bp的LPAR3部分片段(图1A),测序后发现与Ensemble数据库预测mRNA序列存在2个碱基的突变,其他序列完全相同。利用RACE试剂盒进行巢式PCR(Outer PCR和Inner PCR)后电泳,分别获得5'UTR 192 bp(图1B、1C)的单一目的条带。将目的条带连接载体后测序并与已知mRNA序列比对,拼接后得到202 bp的5'UTR。同样方法获得3'UTR 948 bp(图1D)的单一目的条带,拼接后获得860 bp的3'UTR。将5'RACE试验获得的mRNA序列的第1个碱基确定为+1,根据GeneBank的基因信息和RACE试验结果设计引物,PCR扩增后获得了猪LPAR3长为3 080 bp(–2430/+650 bp)的5'调控序列(图1E)。将完整的LPAR3 mRNA提交至GenBank,获得的基因序列号为MH885288。

|
图 1 猪LPAR3完整mRNA序列的RACE结果及5'调控序列扩增结果 Fig. 1 RACE results of the complete mRNA sequence of pig LPAR3 gene and amplification results of the 5' regulatory sequence M1为DL2000 marker,从上到下依次为:2 000、1 000、750、500、250和100 bp,M2为DL5000 marker,从上到下依次为5 000、3 000、2 000、1 500、1 000、750、500、250、100 bp;1:LPAR3基因5'UTR扩增条带;2和3分别为5'RACE Outer和Inner引物扩增特异性条带;4和5分别为3'RACE Inner和Outer引物扩增特异性条带;6:LPAR3基因5'调控区的扩增条带 M1: DL2000 marker,from up to bottom: 2 000, 1 000, 750, 500, 250, and 100 bp; M2: DL5000 marker,from up to bottom: 5 000, 3 000, 2 000, 1 500, 1 000, 750, 500, 250 and 100 bp; 1: Products of LPAR3 5'UTR amplification; 2 and 3: The specific bands of 5'RACE with Outer and Inner primers; 4 and 5: The specific bands of 3'RACE with Outer and Inner primers; 6: Products of LPAR3 5' regulatory sequence |
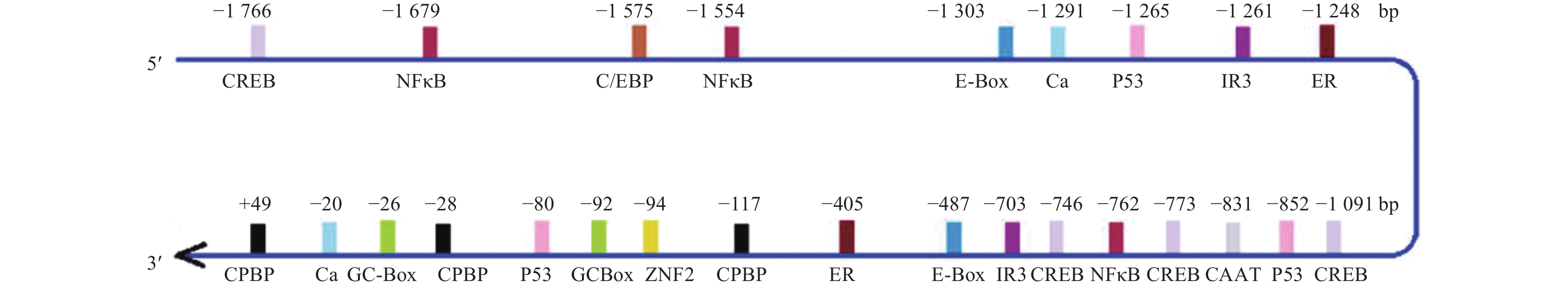
将猪LPAR3基因5'调控序列序列通过在线生物学软件进行分析,结果显示LPAR3基因5'调控序列不存在TATA box,存在GC-box、CPBP(Core promoter-binding protein)结合元件以及cAMP应答元件结合蛋白(cAMP-response element binding protein, CREB)、CCAAT增强子结合蛋白(CCAAT/enhancer binding protein, C/EBP)、E-box结合因子(E-box binding factors)、核因子κB(nuclear factor κB, NFκB)、糖皮质激素受体(Glucocorticoid receptor IR3)等多个潜在转录因子结合位点(图2)。在LPAR3基因5'调控区的–190/–84和–44/+651 bp处存在2个CpG岛,长度分别为107和695 bp,CpG 1岛有10个CpG位点,CpG 2岛有61个CpG位点。
|
图 2 猪LPAR3基因5'调控区重要调控元件与转录因子结合位点预测结果 Fig. 2 Predicted results of important regulatory elements and binding sites of transcription factors in the 5' regulatory region of pig LPAR3 gene |
根据在线预测结果,扩增9个不同长度的启动子缺失片段(大小见表1),并成功构建9个不同长度的缺失片段荧光素酶报告基因重组质粒,启动子各缺失片段扩增及重组质粒鉴定结果见图3。
|
|
表 1 猪LPAR3基因mRNA克隆及启动子扩增所需引物信息 Table 1 The primers for cloning the mRNA and promoter of porcine LPAR3 gene |

|
图 3 猪LPAR3基因启动子各缺失片段扩增(A)及双酶切鉴定(B) Fig. 3 Amplification of the deletion fragments of pig LPAR3 gene promoter (A) and double enzyme digestion (B) M:DL5000 marker;P1~P9片段大小分别约为1 958、1 435、1 047、534、351、203、96、218和921 bp M: DL5000 marker; The lengths of P1-P9 were 1 958, 1 435, 1 047, 534, 351, 203, 96, 218 and 921 bp, respectively |
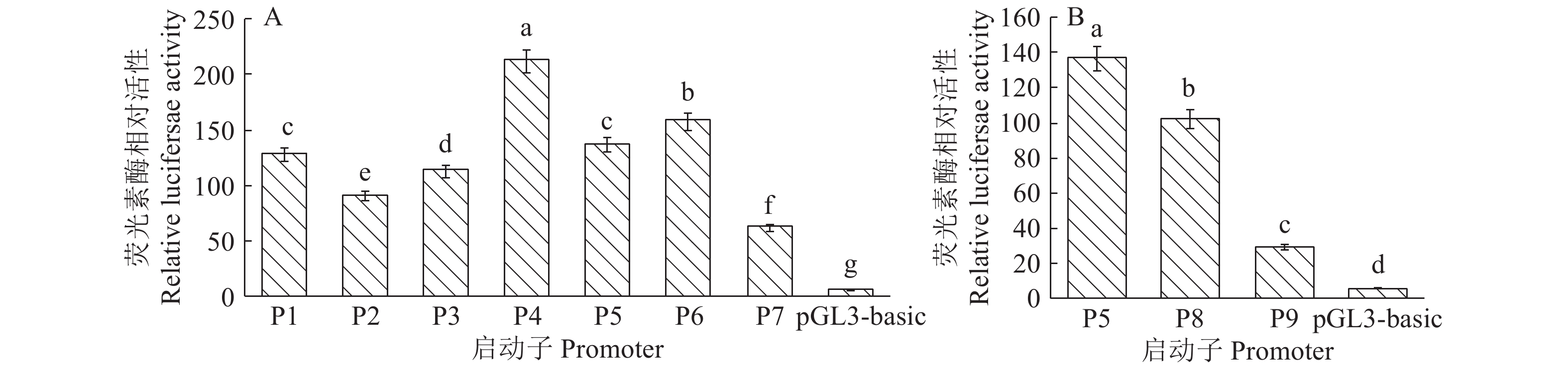
启动子片段活性检测结果如图4所示,图4A结果表明:启动子P4的活性最高,其次是P6、P5、P1、P3、P2、P7,推测在–1 878/–1 355、–454/–271和–123/–16 bp区域可能为激活转录的正调控区;P6位于转录起始位点附近,因此P6区域可能是LPAR3基因的核心启动子区域;–1 355/–967、–967/–454和–271/–123 bp这3个区域为负调控区。生物信息学CpG岛预测结果显示LPAR3基因5'调控区的–190/–84和–44/+651 bp处存在2个CpGs岛,设计启动子P8、P9验证CpG岛是否与转录活性有关。图4B结果显示P5活性显著高于P8和P9,P8活性显著高于P9,说明CpG岛的存在可能影响了转录水平。
|
图 4 猪LPAR3基因各启动子缺失片段转录活性 Fig. 4 Luciferase activities of LPAR3 promoter deletion fragments 各图中,柱子上的不同小写字母表示差异显著(P<0.05, Duncan’s 法) In each gragh, different lowercase letters on the bars indicate significant difference(P<0.05, Duncan’s test) |
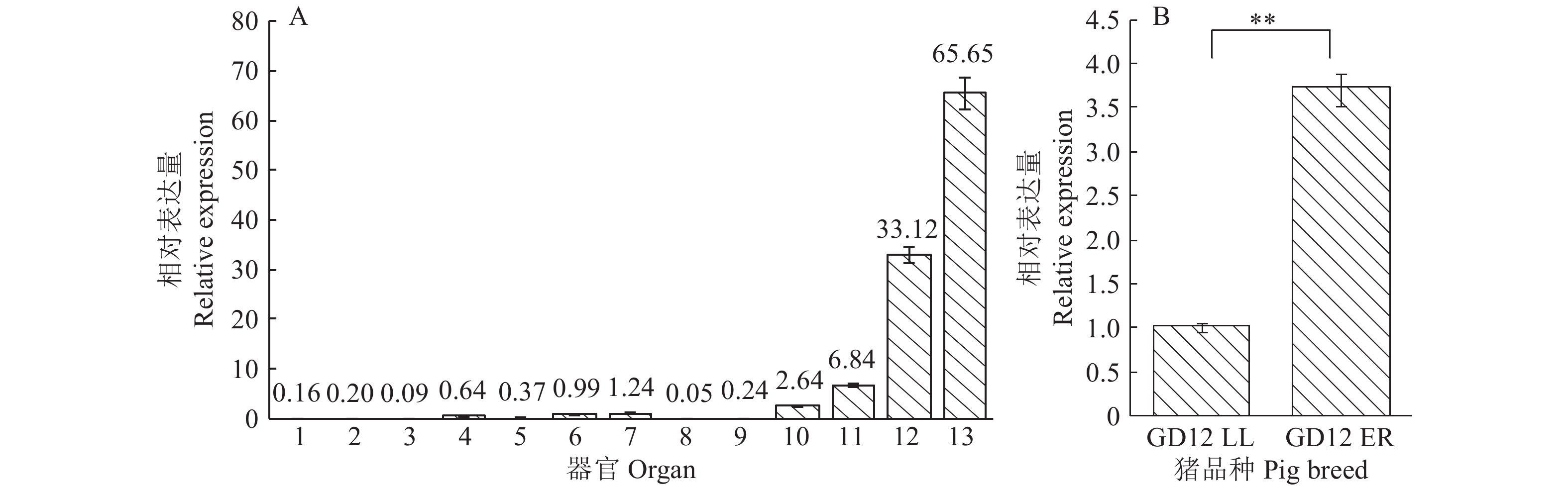
在GD12 ER各种组织中,LPAR3基因在子宫内膜中的表达量最高,胃次之,小肠和下丘脑少量表达,而心、肝、脾、背最长肌和垂体几乎不表达(图5A)。另外LPAR3基因在GD12 ER子宫内膜中的表达量极显著地高于其在GD12 LL子宫内膜中的表达量(图5B)。
|
图 5 猪LPAR3 mRNA的组织表达谱 Fig. 5 Gene expression profile of pig LPAR3 mRNA A图中,横坐标上的数字1~13分别表示心、肝、脾、肺、肾、大脑、小脑、肌肉、垂体、下丘脑、小肠、胃和子宫内膜;B图中,“**”表示差异显著(P<0.01,t 检验) In graph A, the numbers of 1~13 along the abscissa axis represented heart, liver, spleen, lung, kidney, brain, cerebellum, muscle, pituitary, hypothalamus, small intestine, stomach and endometrium respectively; In graph B, “**” indicates significant difference (P<0.01, t test) |
提取GD12 ER和GD12 LL的子宫内膜组织DNA, 经过亚硫酸氢盐修饰后用引物LPAR3-BSP1、LPAR3-BSP2扩增并测序,结果显示:在GD12 ER和GD12 LL的子宫内膜组织中,LPAR3启动子甲基化水平均较低(图6)。t检验结果表明2个猪种的子宫内膜LPAR3甲基化程度差异不显著(P=0.673 3)。

|
图 6 GF12 ER和GD12 LL猪LPAR3基因甲基化检测结果 Fig. 6 Detection results of methylation status of LPAR3gene in GF12 ER and GD12 LL pigs A、B、C为GD12 ER LPAR3基因甲基化状态;D、E、F为GD12 LL LPAR3基因甲基化状态;每行代表1个克隆,黑色点表示甲基化的CpG位点,白色点表示未被甲基化的CpG位点,黑框表示碱基错配 A, B, C: Methylation status of GD12 ER LPAR3; D, E, F: Methylation status of GD12 LL LPAR3; Each row represents one clone, black dots indicate methylated CpG sites, white dot indicates non-methylated CpG sites, black boxes indicate base mismatches |
大量研究发现LPAR3基因与猪早期妊娠有关[21],转录组测序结果也发现LPAR3基因可能是影响不同猪种GD11~GD12胚胎存活率进而造成窝产仔数差异的主效基因[8],推测LPAR3基因在子宫内膜中对母猪妊娠和胚胎发育起调控作用,进而影响母猪产仔数。本研究通过RACE技术获得2 127 bp的猪LPAR3完整mRNA序列,将猪的LPAR3基因结构与人、鼠的LPAR3基因结构对比,发现3个物种的LPAR3基因均由3个外显子和2个内含子组成,猪LPAR3的第3个外显子长度的变异较大,可能是受转录后可变剪接的影响。
生物信息学预测发现,猪LPAR3基因启动子上存在潜在的雌激素受体元件IR3结合位点、雌激素受体α结合位点、NFκB等结合位点。在雌激素受体IR3和雌激素受体α中间还有1个核心启动子元件—果蝇启动子结构单元(Drosophila initiator motifs)的结合位点,该激活元件可作用于没有TATA box的启动子区域参与启动子的激活。在猪围附植期,胚胎延伸过程中释放雌激素信号可能作用于雌激素受体,雌激素上调雌激素受体和孕激素受体表达水平,雌激素受体和孕激素受体维持恰当的比例,使得LPAR3在子宫的腔上皮和腺上皮表达达到高峰并成功识别[27],推测这些区域很有可能是雌激素及其受体与LPAR3基因5'调控区相互作用以影响LPAR3表达的关键位点,这需要深入的研究。
根据获得的mRNA完整序列设计引物扩增LPAR3基因的5'调控区,获得3 080 bp的5'调控区序列。利用在线软件预测LPAR3基因启动子转录因子结合位点及CpG岛,并且构建9个不同缺失长度的启动子双荧光素酶报告载体。双荧光活性检测结果显示,P4(–454/+80 bp)启动子活性最高,其次是P6(–123/+80 bp)、P5(–271/+80 bp)、P1(–1 878/+80 bp)、P3(–967/+80 bp)、P2(–1 355/+80 bp)和P7(–16/+80 bp),提示在–1 878/–1 355、–454/–271和–123/–16 bp区域可能为激活转录的正调控元件,在–1 355/–967、–967/–454和–271/–123 bp这3个区域为负调控元件;另外P6位于转录起始位点附近,因此P6区域有可能为LPAR3基因的核心启动子区。研究发现,启动子区存在的CpG岛的甲基化会影响转录因子的结合,进而抑制基因的转录[28]。P5活性下降,且在P5区域存在一个较长的CpG岛,推测P5区域的CpG岛影响着启动子的活性,因此设计引物扩增P8(–271/–54 bp)、P9(–271/+650 bp)片段,分析CpG岛与启动子活性的关系。结果显示P8、P9活性显著低于P5活性,而P8活性显著高于P9活性,说明CpG岛的存在影响了LPAR3基因启动子的强度。至于是哪一个CpG岛影响了启动子的强度,还需要进一步分析。
实时荧光定量PCR结果表明,GD12 ER猪子宫内膜的LPAR3基因的相对表达明显高于其他组织,且极显著高于LPAR3基因在LL猪子宫内膜的表达,这与前人的研究结果一致[25-29]。
DNA甲基化可以通过影响染色质结构、DNA构象、稳定性以及蛋白质相互作用等方式调控基因表达。已有大量研究发现,DNA甲基化影响基因差异表达[30-31],并与生长、繁殖等性状相关联[32-33]。苏涛等[34]研究发现,妊娠第18天及第32天大白猪及梅山猪子宫内膜组织中大量基因具有差异甲基化,提示了基因甲基化的差异可能是两猪品种产仔数差异的重要原因。为了进一步研究二花脸猪和长大二元猪子宫内膜LPAR3基因差异表达的表观遗传学机制,本文利用子宫内膜DNA作为模板进行亚硫酸氢盐修饰后测序法检测CpG岛的甲基化,结果表明,ER猪和LL猪子宫内膜LPAR3基因均处于低甲基化水平,且没有显著差异,因此LPAR3基因甲基化差异不是造成LPAR3基因在ER和LL子宫内膜表达差异的原因,因此也并非影响产仔数的原因。
本研究获得LPAR3基因的全长mRNA和5'调控区,启动子–454/+80和–123/+80 bp区转录活性最高;LPAR3基因在妊娠第12天ER子宫内膜表达量极显著高于LL,但2个品种子宫内膜LPAR3的平均甲基化较低且没有显著差异,甲基化不是LPAR3基因在2个猪种差异表达的关键因素。
| [1] |
TAYADE C, FANG Y, CROY B A. A review of gene expression in porcine endometrial lymphocytes, endothelium and trophoblast during pregnancy success and failure[J]. J Reprod Dev, 2007, 53(3): 455-463. DOI:10.1262/jrd.18170 (  0) 0) |
| [2] |
洪林君. 影响猪胚胎附植及胎盘褶皱发育相关基因的鉴定[D]. 武汉: 华中农业大学, 2016.
(  0) 0) |
| [3] |
BENNETT G L, LEYMASTER K A. Integration of ovulation rate, potential embryonic viability and uterine capacity into a model of litter size in swine[J]. J Anim Sci, 1989, 67(5): 1230-1241. DOI:10.2527/jas1989.6751230x (  0) 0) |
| [4] |
FOXCROFT G R, DIXON W T, NOVAK S, et al. The biological basis for prenatal programming of postnatal performance in pigs[J]. J Anim Sci, 2006, 84(Suppl): E105-E112. (  0) 0) |
| [5] |
葛云山, 徐金友, 刘明智, 等. 二花脸猪繁殖性能的观察[J]. 江苏农业科学, 1982(4): 40-43. (  0) 0) |
| [6] |
杜红丽, 陈静, 张玉山, 等. 二花脸与杜洛克猪繁殖相关基因表达差异[J]. 华南农业大学学报, 2008, 29(2): 99-103. DOI:10.3969/j.issn.1672-0202.2008.02.017 (  0) 0) |
| [7] |
KIM M, SEO H, CHOI Y, et al. Microarray analysis of gene expression in the uterine endometrium during the implantation period in pigs[J]. Asian-australas J Anim Sci, 2012, 25(8): 1102-1116. DOI:10.5713/ajas.2012.12076 (  0) 0) |
| [8] |
王首奇. 母猪怀孕11-12天子宫内膜差异表达基因的筛选与分析[D]. 广州: 华南农业大学, 2011.
(  0) 0) |
| [9] |
SEO H, CHOI Y, SHIM J, et al. Analysis of the lysophosphatidic acid-generating enzyme ENPP2 in the uterus during pregnancy in pigs[J]. Biol Reprod, 2012, 87(4): 77. DOI:10.1095/biolreprod.112.099564 (  0) 0) |
| [10] |
MAUCO G, CHAP H, SIMON M F, et al. Phosphatidic and lysophosphatidic acid production in phospholipase C-and thrombin-treated platelets: Possible involvement of a platelet lipase[J]. Biochimie, 1978, 60(6/7): 653-661. (  0) 0) |
| [11] |
YE X, CHUN J. Lysophosphatidic acid (LPA) signaling in vertebrate reproduction[J]. Trends Endocrinol Metab, 2010, 21(1): 17-24. DOI:10.1016/j.tem.2009.08.003 (  0) 0) |
| [12] |
王溦. LPAR3、COX-2和VEGF蛋白在反复移植失败患者着床期子宫内膜表达的研究[D]. 郑州: 郑州大学, 2014.
(  0) 0) |
| [13] |
CHA J, SUN X, DEY S K. Mechanisms of implantation: Strategies for successful pregnancy[J]. Nat Med, 2012, 18(12): 1754-1767. DOI:10.1038/nm.3012 (  0) 0) |
| [14] |
郭燕红, 张雷, 邵素霞, 等. 溶血磷脂酸受体3在小鼠胚胎围着床期子宫内膜的表达及意义[J]. 解剖学报, 2009, 40(1): 141-145. DOI:10.3969/j.issn.0529-1356.2009.01.029 (  0) 0) |
| [15] |
SHAH B H, CATT K J. Roles of LPA3 and COX-2 in implantation[J]. Trends Endocrinol Metab, 2005, 16(9): 397-399. DOI:10.1016/j.tem.2005.09.009 (  0) 0) |
| [16] |
DIAO H, LI R, EI ZOWALATY A E, et al. Deletion of lysophosphatidic acid receptor 3 (Lpar3) disrupts fine local balance of progesterone and estrogen signaling in mouse uterus during implantation
[J]. Biol Reprod, 2015, 93(5): 123. DOI:10.1095/biolreprod.115.131110 (  0) 0) |
| [17] |
HAMA K, AOKI J, INOUE A, et al. Embryo spacing and implantation timing are differentially regulated by LPA3-mediated lysophosphatidic acid signaling in mice[J]. Biol Reprod, 2007, 77(6): 954-959. DOI:10.1095/biolreprod.107.060293 (  0) 0) |
| [18] |
AIKAWA S, KANO K, INOUE A, et al. Autotaxin-lysophosphatidic acid-LPA3 signaling at the embryo-epithelial boundary controls decidualization pathways[J]. Embo J, 2017, 36(14): 2146-2160. DOI:10.15252/embj.201696290 (  0) 0) |
| [19] |
YE X, HAMA K, CONTOS J J, et al. LPA3-mediated lysophosphatidic acid signaling in embryo implantation and spacing[J]. Nature, 2005, 435(7038): 104-108. DOI:10.1038/nature03505 (  0) 0) |
| [20] |
李巍巍, 秦伟, 耿爱华, 等. LPAR3、HOXA-11在IVF患者子宫内膜种植窗期的表达及意义[J]. 中国妇幼保健, 2014, 29(12): 1922-1926. DOI:10.7620/zgfybj.j.issn.1001-4411.2014.12.45 (  0) 0) |
| [21] |
SHEN J, ZHOU C, ZHU S, et al. Comparative transcriptome analysis reveals early pregnancy-specific genes expressed in peripheral blood of pregnant sows[J]. PLoS One, 2014, 9(12): e114036. DOI:10.1371/journal.pone.0114036 (  0) 0) |
| [22] |
KAMINSKA K, WASIELAK M, BOGACKA, et al. Quantitative expression of lysophosphatidic acid receptor 3 gene in porcine endometrium during the periimplantation period and estrous cycle[J]. Prostag Oth Lipid M, 2008, 85(1/2): 26-32. (  0) 0) |
| [23] |
DEGRELLE S A, BLOMBERG L A, GARRETT W M, et al. Comparative proteomic and regulatory network analyses of the elongating pig conceptus[J]. Proteomics, 2009, 9(10): 2678-2694. DOI:10.1002/pmic.v9:10 (  0) 0) |
| [24] |
KNIGHT J W. Aspects of placental estrogen synthesis in the pig[J]. Exp Clin Endocrinol, 1994, 102(3): 175-184. (  0) 0) |
| [25] |
SEO H, HIM M, CHOI Y, et al. Analysis of lysophosphatidic acid (LPA) receptor and LPA-induced endometrial prostaglandin-endoperoxide synthase 2 expression in the porcine uterus[J]. Endocrinology, 2008, 149(12): 6166-6175. DOI:10.1210/en.2008-0354 (  0) 0) |
| [26] |
高萍, 钟玉宜, 张爱玲. 母猪卵巢颗粒细胞的分离培养及鉴定[J]. 广东农业科学, 2014, 41(4): 131-135. DOI:10.3969/j.issn.1004-874X.2014.04.033 (  0) 0) |
| [27] |
徐慧颖, 李娜, 张云山. 胚胎植入: 子宫内膜容受性是关键[J]. 生殖医学杂志, 2014, 23(3): 198-202. DOI:10.3969/j.issn.1004-3845.2014.03.006 (  0) 0) |
| [28] |
BOYES J, BIRD A. Repression of genes by DNA methylation depends on CpG density and promoter strength: Evidence for involvement of a methyl-CpG binding protein[J]. Embo J, 1992, 11(1): 327-333. DOI:10.1002/embj.1992.11.issue-1 (  0) 0) |
| [29] |
KIM M, SEO H, CHOI Y, et al. , Analysis of stage-specific gene expression profiles in the uterine endometrium during pregnancy in pigs[J]. PLoS One, 2015, 10(11): e0143436. DOI:10.1371/journal.pone.0143436 (  0) 0) |
| [30] |
NAMOUS H, PEÑAGARICANO F, DEL CORVO M, et al. Integrative analysis of methylomic and transcriptomic data in fetal sheep muscle tissues in response to maternal diet during pregnancy[J]. BMC Genomics, 2018, 19(1): 123. DOI:10.1186/s12864-018-4509-0 (  0) 0) |
| [31] |
辛鹏慧, 岳永莉, 李燕, 等. 牛4种组织中ZAR1基因表达及DNA甲基化修饰
[J]. 畜牧与兽医, 2009, 41(10): 40-42. (  0) 0) |
| [32] |
张永宏. 三个地方品种鸡肌肉组织基因组DNA甲基化分析[D]. 长春: 吉林大学, 2014.
(  0) 0) |
| [33] |
蒋曹德, 邓昌彦, 熊远著. DNA甲基化差异对猪生长性状的影响[J]. 畜牧兽医学报, 2005, 36(2): 105-110. DOI:10.3321/j.issn:0366-6964.2005.02.001 (  0) 0) |
| [34] |
苏涛, 刘敏, 侯斌, 等. 大白猪与梅山猪子宫内膜转录组及甲基化分析[C]//中国生理学会生殖科学专业委员会.中国动物学会生殖生物学分会第2次联合学术年会暨" 生殖科学专业委员会第2次学术交流会”和" 生殖生物学分会第16次学术年会”论文集. 北京: 中国生理学会, 2017.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


