2. 广东省中医院,广东 广州 510120;
3. 中国科学院 南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室/广东省海洋药物重点实验室,广东 广州 510301
2. Guangdong Provincial Hospital of Chinese Medicine, Guangzhou 510120, China;
3. Chinese Academy of Sciences Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences/Guangdong Key Laboratory of Marine Materia Medica, Guangzhou 510301, China
脂肪酶是一种重要的工业用酶,可催化水相中酯水解、有机相中的转酯和酯化等反应[1]。由于脂肪酶来源广泛,并且具有特异的催化活性[2],脂肪酶被广泛地应用于制药、精细化工和食品等诸多工业应用领域[1, 3-4]。由于脂肪酶等工业酶在工业中还是相对昂贵的生物催化剂,如果一批脂肪酶催化剂只用于一次反应过程,将极大地增加工业制造的成本。通过使用工业酶的固定化技术,可以增加工业酶的使用次数,从而降低工业酶的使用成本。同时固定化工业酶的使用进一步促进了产品生产线的自动化,从而降低了目标产物分离纯化等成本[5]。因此脂肪酶等工业用酶的固定化技术具有极高的工业应用价值。
HPD系列树脂是苯乙烯型大孔吸附树脂,具有不同的极性,目前已广泛应用于目标产物吸附分离提取等研究[6]。本文筛选出中等极性大孔树脂HPD750作为脂肪酶的吸附树脂进行固定研究,并使用了新型环氧交联剂聚乙二醇二缩水甘油醚[Poly (ethylene glycol) diglycidyl ether]对大孔树脂吸附的脂肪酶进行交联,为基于大孔树脂吸附和环氧交联剂交联法固定化脂肪酶等工业用酶奠定良好工作基础。
1 材料与方法 1.1 酶与主要试剂CAS# 9001-62-1脂肪酶,合肥博美生物科技有限责任公司;树脂HPD750,郑州勤实科技有限公司;大孔树脂D 101,西安蓝晓科技新材料股份有限公司;大孔树脂AB-8、DA-201、H103、D4020 和NKA-9,天津南开和成科技有限公司;戊二醛(体积分数为25%),天津市福晨化学试剂厂;乙二醇缩水甘油醚、聚乙二醇二缩水甘油醚和新戊二醇二缩水甘油醚均购自上海麦克林生化科技有限公司;异辛烷,天津市富宇精细化工有限公司;磷酸二氢钠和磷酸氢二钠均购自上海捷瑞生物工程有限公司。
1.2 仪器与设备Infinite M200 Pro多功能酶标仪,瑞士Tecan;MIX-1振荡器,上海托莫斯科学仪器有限公司;TL5R立式低速冷冻离心机,湖南赫西仪器装备有限公司;OJS-2012R温控摇床,上海世平实验设备有限公司。
1.3 大孔树脂的预处理大孔树脂用体积分数为95%的乙醇溶液浸泡12 h,不时搅拌,使其溶胀充分,然后用蒸馏水不断清洗至流出液在试管中用水稀释不浑浊或者无明显乙醇气味为止。预处理完的树脂密封,4 ℃冷藏柜储藏备用[7]。
1.4 脂肪酶的预处理用PBS缓冲液配制所需浓度的酶液,4 ℃条件下,3 000 r·min–1离心10 min,取上清待用。
1.5 脂肪酶的吸附固定化 1.5.1 吸附过程参考文献[8-10],结合预试验结果,确定脂肪酶的固定化操作流程如下:准确称取预处理的湿载体1.0 g,加入用50.0 mmol·L–1的pH为7.0的PBS缓冲液处理完的含酶量为100 mg的上清液10 mL,在温控摇床上40 ℃、200 r·min–1振荡吸附4 h。吸附完成,过滤并用PBS缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃烘干4 h,置于 4 ℃冷藏柜冷藏备用。采用改进铜皂−分光光度法[11]的试验条件和反应体系测定固定化酶活力。
1.5.2 大孔树脂载体筛选准确称取湿载体HPD 750、AB-8、D 101、DA-201、H 103、D 4020、NKA-9各1.0 g,其余操作同“1.5.1”。
1.5.3 温度对吸附固定化的影响选取“1.5.2”筛选出的载体,设置摇床温度分别为35、40、45、50和60 ℃,其余操作同“1.5.1”。
1.5.4 缓冲液pH对吸附固定化的影响选取上述步骤筛选出的载体和温度,用pH分别为4.5、5.0、5.5、6.0、6.5、7.0和7.5的PBS缓冲液处理脂肪酶,其余操作同“1.5.1”。
1.5.5 给酶量对吸附固定化的影响选取上述步骤筛选出的适宜载体、温度和pH,加入含酶量分别为10、20、40、60、80、100和120 mg的上清液10.0 mL,其余操作同“1.5.1”。
1.6 脂肪酶的交联固定化 1.6.1 交联过程参考文献[10, 12],确定脂肪酶的交联试验操作流程如下:向上述吸附完成的体系中加入体积分数为0.5%的交联剂,40 ℃条件下在温控摇床上200 r·min–1振荡交联4 h。交联完成,过滤并用PBS缓冲液洗涤,即得固定化酶,晾干12 h,40 ℃条件下烘干4 h,置于4 ℃冷藏柜冷藏备用。按一定的方法,测定各自的酶活力。
1.6.2 交联剂筛选以空白组为对照,在吸附完成后的体系中分别立即加入戊二醛、乙二醇二缩水甘油醚、聚乙二醇二缩水甘油醚和新戊二醇二缩水甘油醚,每种交联剂设置0.5%和1.0% 2个体积分数梯度,每组设置3个平行组。其余操作同“1.6.1”。
1.6.3 温度对交联固定化的影响选取“1.6.2”筛选出的交联剂及浓度,设置温控摇床温度分别为25、30、35、40、45、50和55 ℃。其余操作同“1.6.1”。
1.6.4 时间对交联固定化的影响选取上述步骤筛选出交联剂及其浓度和温度,设置交联反应时间分别为10、11、12、13、14和24 h。其余操作同“1.6.1”。
1.6.5 交联剂用量对交联固定化的影响选取上述步骤筛选出的交联剂、温度和时间,设置交联剂体积分数分别为0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%。其余操作同“1.6.1”。
1.7 响应面法优化固定化条件 1.7.1 Plackett-Burman(PB)法筛选主要影响因子在前期试验对给酶量、吸附温度、pH、交联时间、交联温度及交联剂浓度等6个因素进行优化的基础上,通过PB试验[7]筛选吸附–交联固定化脂肪酶的主要影响因子,PB试验因素水平设计如表1。
|
|
表 1 Plackett-Burman试验因素和水平 Table 1 Plackett-Burman experimental factors and levels |
参考文献[7],在PB试验的基础上,采用Box-Behnken设计原理,对吸附温度、交联时间、交联温度、pH进行四因素三水平的响应面分析试验,进一步探讨四因素对固定化脂肪酶活力的影响,并确定最优的固定化条件,每组做3次平行。
1.8 分析方法 1.8.1 脂肪酶活力测定以乳化橄榄油为底物,在测定条件下(40 ℃,pH7.0),1 min内催化底物水解产生1 μmol脂肪酸所需的酶量定义为1个脂肪酶活力单位(U)。精确称取0.1 g游离脂肪酶或固定化脂肪酶,采用改进铜皂−分光光度法[12]的试验条件和反应体系,使用Infinite M 200 Pro多功能酶标仪测量其光密度。
1.8.2 固定化脂肪酶回收率的计算固定化脂肪酶回收率的计算公式为:
| $ {{{A}}_{\rm{1}}}{\rm{ = }}\frac{{{{{W}}_{\rm{1}}}{\rm{ - }}{{{W}}_{\rm{2}}}}}{{{{{W}}_{\rm{1}}}}},\;\;\;\;\;{{{A}}_{\rm{0}}}{\rm{ = }}\frac{{{{{W}}_{\rm{0}}}}}{{{{{W}}_{\rm{1}}}{\rm{ - }}{{{W}}_{\rm{2}}}}}, $ |
式中:A1为脂肪酶吸附率,A0为固定化酶回收率;W0为固定化酶活力,W1为加入的游离酶总活力,W2为离心后上清液酶活力。
1.8.3 相对酶活力以试验中所测定的酶活力最大值为100%,该组试验其他条件下测定的酶活力与最大值的比值称为相对酶活力。
2 结果与分析 2.1 吸附试验的条件优化 2.1.1 固定化载体吸附固定化载体筛选结果如表2所示。综合考虑固定化酶活力和脂肪酶吸附率,选择大孔树脂HPD750为吸附固定化载体。
|
|
表 2 不同大孔树脂吸附固定化效果 Table 2 Absorption and immobilization effect of different macroporous resins |
如图1a所示,吸附温度为45 ℃时,固定化酶有最好的固定化效果。酶的固定化是一个吸热的过程[13],在25~45 ℃范围内,固定化酶活力随着温度升高而增加,温度达到50 ℃时,固定化酶活力有所降低。
2.1.3 pH如图1b所示,固定化酶在pH为6.0时有最好的固定化效果。溶剂的酸碱性对酶活性影响较大,强酸强碱甚至会导致蛋白质变性和失活。pH范围为4.5~6.0时,随着pH升高,固定化酶活力升高;pH超过6.0时,固定化酶活力随着pH升高而逐渐降低,因此确定pH6.0为最佳pH。
2.1.4 给酶量如图1c所示,10~60 mg·g–1范围内,随着给酶量的增加,酶与载体结合越来越多,固定化酶活力也越来越高,酶活力回收率随之降低。随着吸附量增加,空间位阻效应增强,脂肪酶难以再吸附到载体表面。给酶量达到60 mg·g–1后,树脂吸附接近饱和,随着给酶量增加,树脂吸附增加,回收率却持续降低。从经济角度考虑,选择给酶量为60 mg·g–1比较合适。
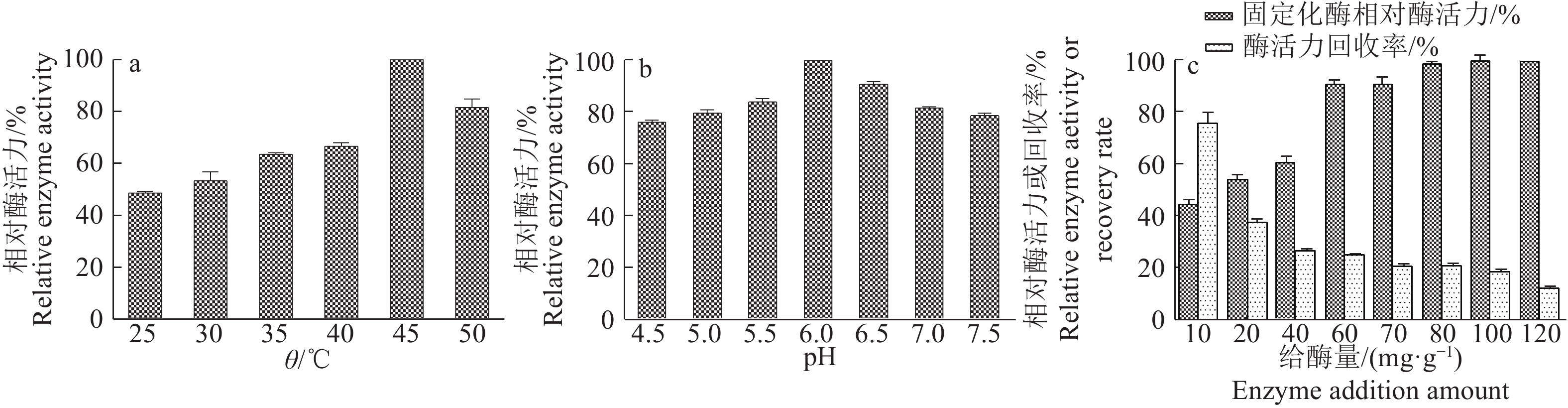
|
图 1 各因素对脂肪酶吸附固定化的影响 Fig. 1 Influence of various factors on the adsorption immobilization of lipase |
如图2所示,体积分数为0.5%和1.0%时,和其他交联剂相比,环氧交联剂聚乙二醇二缩水甘油醚均具有最好的交联效果,且低浓度时,交联剂均有利于酶的固定化,因此选择聚乙二醇二缩水甘油醚作为固定化的交联试剂进一步研究。
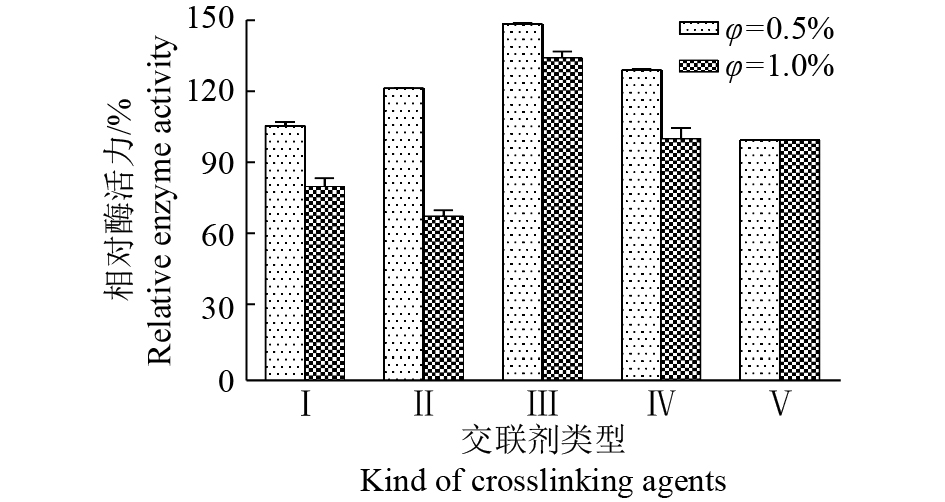
|
图 2 不同交联剂的交联效果 Fig. 2 The crosslinking effect of different crosslinker Ⅰ:戊二醛,Ⅱ:乙二醇二缩水甘油醚,Ⅲ:聚乙二醇二缩水甘油醚,Ⅳ:新戊二醇二缩水甘油醚,Ⅴ:空白对照 Ⅰ: Glutaric dialdehyde, Ⅱ: Ethylene glycol diglycidyl ether, Ⅲ: Poly(ethylene glycol) diglycidyl ether, Ⅳ: Neopentyl glycol diglycidyl ether, Ⅴ: Blank control |
如图3a所示,当聚乙二醇二缩水甘油醚的体积分数为0.7%时,固定化效果最好。当聚乙二醇二缩水甘油醚的含量较低时,较少的脂肪酶参与交联,树脂吸附不牢固。当聚乙二醇二缩水甘油醚的含量过高时,过量的聚乙二醇二缩水甘油醚可能会发生分子内交联,影响酶的固定化。当聚乙二醇二缩水甘油醚体积分数由0.7%增加到1.0%时,固定化酶活力下降近50%,说明过量的交联剂对酶固定化不利影响较大。
2.2.3 交联时间如图3b所示。当聚乙二醇二缩水甘油醚交联时间为12 h时,固定化酶活力达到最大值。交联时间不足12 h时,脂肪酶与聚乙二醇二缩水甘油醚反应不充分,连接不牢固。交联时间超过12 h,固定化酶活力有下降趋势。
2.2.4 交联温度如图3c所示,当聚乙二醇二缩水甘油醚交联温度为30 ℃时,固定化酶活力达到最大值。交联温度超过30 ℃时,固定化酶活力有下降趋势,温度达到55 ℃时,固定化酶活力仅为30 ℃时酶活力的23%。
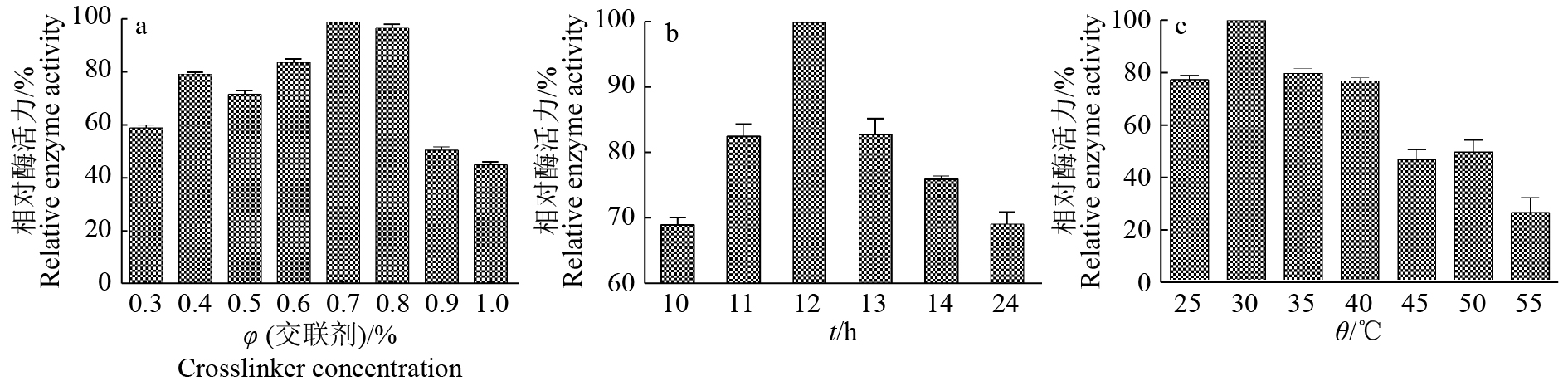
|
图 3 各因素对脂肪酶交联固定化的影响 Fig. 3 Influence of various factors on the crosslinking immobilization of lipase |
吸附–交联固定化试验主要影响因素通过PB试验筛选,PB试验设计及结果如表3所示。
|
|
表 3 Plackett-Burman试验设计及结果 Table 3 Plackett-Burman experimental design and result |
用Design-Expert V 8.0.6数据分析软件对数据进行分析,数据处理结果如表4所示。由表4可知,吸附温度、交联温度、交联时间、pH 4个因素的P<0.05,为显著因素,因此确定这4个因素为固定化条件中的主要影响因素。
|
|
表 4 Plackett-Burman试验结果方差分析1) Table 4 Analysis of variance for Plackett-Burman experimental result |
在PB试验的基础上,采用Box-Behnken设计原理,对吸附温度(A)、pH(B)、交联温度(C)、交联时间(D)进行四因素三水平的响应面分析试验,试验设计及结果见表5。
|
|
表 5 Box-Behnken试验设计及结果1) Table 5 Box-Behnken experimental design and result |
用Design-Expert V8.0.6数据分析软件对数据进行回归分析,数据处理结果如表6所示。失拟项P=0.107 4>0.05,表明该模型的失拟项不显著。综上,该模型能较好地解释固定化酶活力(Y)的变化,该模型给出的回归方程对数据具有较好的拟合,二次多项式回归方程为:
| $\begin{aligned} Y =& {\rm{ }}469.77{\rm{ }} - {\rm{ }}28.04A - {\rm{ }}38.67B + {\rm{ }}23.34C + {\rm{ }}20.97D - \\&{\rm{ }}41.31AB - 12.17AC + {\rm{ }}29.18AD + {\rm{ }}48.07BC - \\ &{\rm{ }}26.51BD - {\rm{ }}16.43CD - 73.51{A^2} - {\rm{ }}64.79{B^2} - \\ &47.76{C^2} - {\rm{ }}69.90{D^2}{\text{。}} \end{aligned}$ |
由表6可知,4个因素对环氧树脂固定化脂肪酶的影响由大到小依次为:pH>吸附温度>交联温度>交联时间,其中pH和吸附温度有极显著影响,而交联温度和交联时间对固定化有显著影响。
用Design-Expert V8.0.6数据分析软件进行分析,各因素的交互作用对固定化酶活力的影响如图4所示。结合表6结果可知,吸附温度(A)和pH(B),以及交联温度(C)和pH(B)间的交互作用对固定化有较大的影响。
|
|
表 6 Box-Behnken模型方差分析1) Table 6 Analysis of variance for Box-Behnken model |
对回归方程求导得到极值点,得到的理论最佳吸附温度为44.57 ℃,pH为6.36,交联温度为30.44 ℃,交联时间为12.35 h。为操作简便,选定吸附时间8 h,吸附温度45 ℃,给酶量60 mg·g–1,交联温度30 ℃,交联时间12.5 h,pH6.36,交联剂体积分数为0.7%,由此测定的吸附–交联固定化酶活力为565.31 U·g–1,固定化酶活力回收率为32.16%。
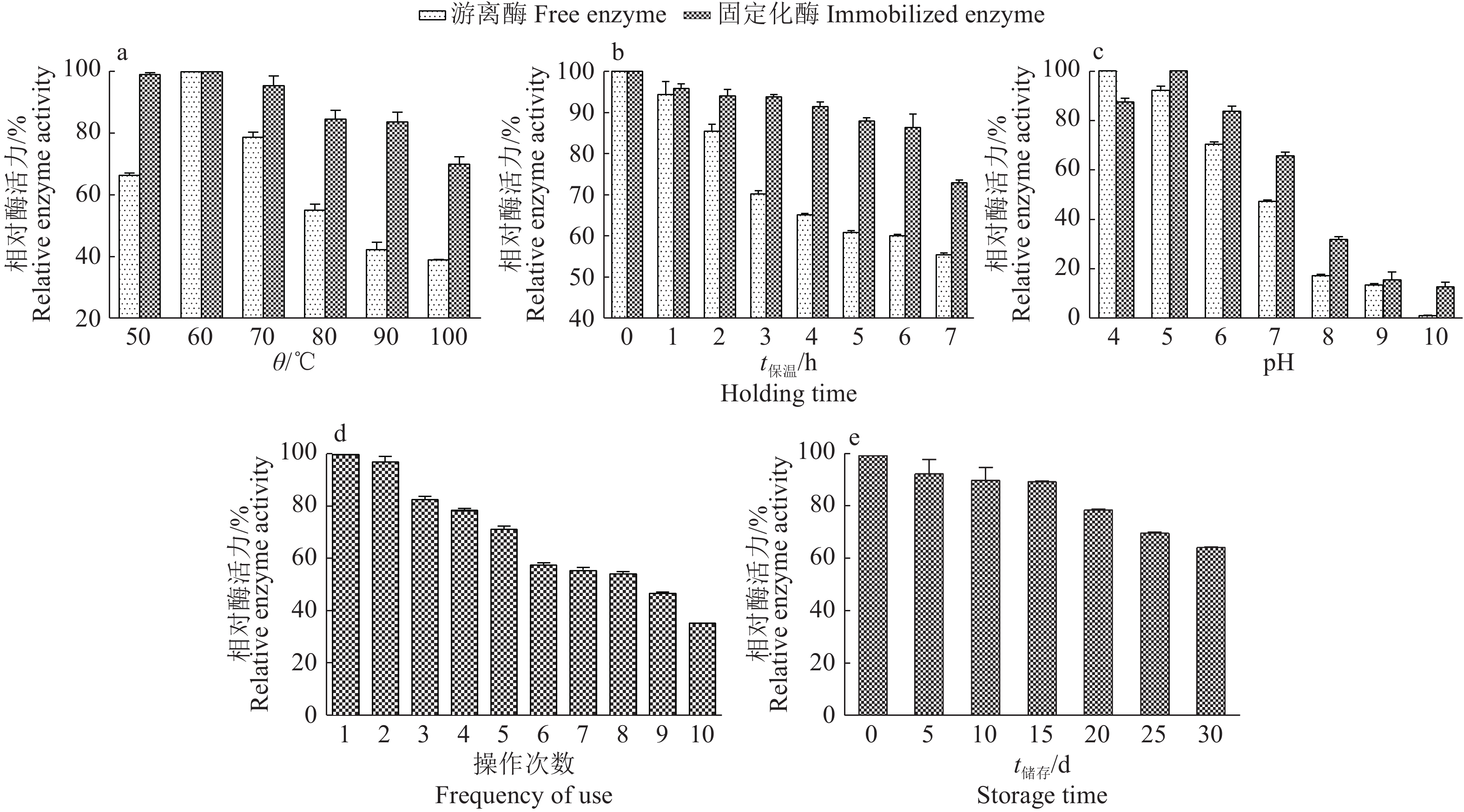
2.4 固定化脂肪酶的稳定性 2.4.1 热稳定性由图5a可知,游离酶及固定化酶的最适反应温度均为60 ℃。温度由60 ℃升高至100 ℃时,两者酶活力均下降,但是游离酶活力下降较快。100 ℃时,固定化酶活力仍保留71.2%以上,而游离酶活力仅为60 ℃时的38.75%。因此,固定化过程大大提高了脂肪酶的热稳定性。
由图5b可知,随着保温时间的延长,固定化酶和游离酶的酶活力呈下降的趋势,但是后者降低幅度明显大于前者。60 ℃保温7 h,固定化酶活力保留约72.94%,而游离酶活力保留55.47%。结合图4a可知,固定化酶的热稳定性明显优于游离酶。
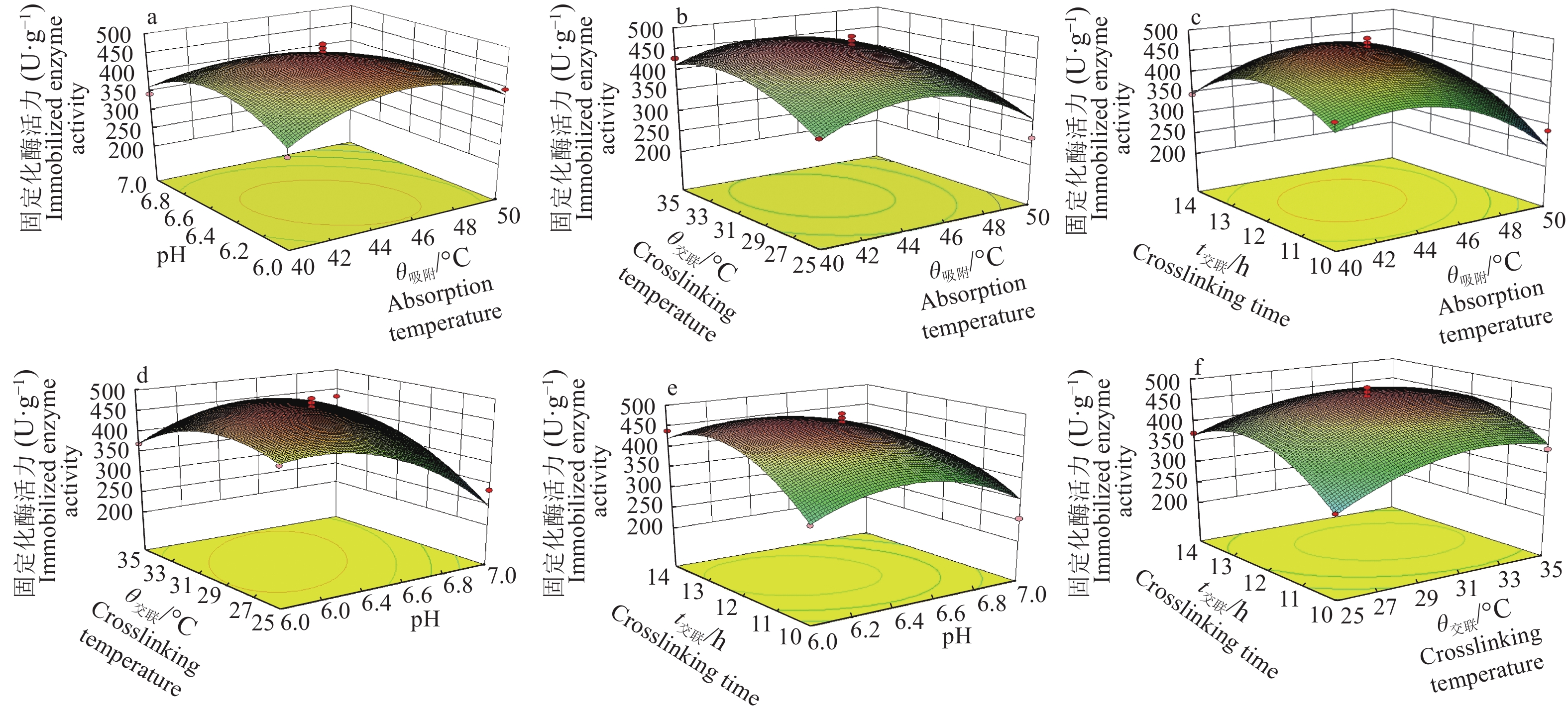
|
图 4 各因素对固定化酶活力影响的响应面三维图 Fig. 4 3D response surface plots of the effects of various factors on immobilized enzyme activity |
如图5c所示,游离酶反应的最适pH为4,而固定化酶为5;在pH大于5的环境中,酶活力均随着pH增加而降低,但是同一pH下,固定化酶活力保留均高于游离酶。因此,固定化酶的酸碱稳定性优于游离酶。
2.4.3 操作稳定性如图5d所示,随着使用次数的增加,固定化酶活力逐渐降低。连续使用10次后,固定化酶活力仍保留初始酶活力的34.86%,相比较,游离酶在使用1次后就不能再回收使用。
2.4.4 储存稳定性如图5e所示,储存30 d,固定化酶活力保留64.81%,因此,所制备的固定化脂肪酶具有较好的储存稳定性。
|
图 5 固定化酶的稳定性 Fig. 5 The stability of immobilized enzyme |
目前采用吸附法固定化脂肪酶所使用的载体包括传统的无机载体、有机载体以及新型载体[14]。传统无机载体具有来源方便和机械强度高等优点,但传统无机载体的结构不易调整,影响反应传质且键合酶的能力差。合成的有机载体由于其化学和物理性能都有很大的可变性,从理论上来讲,可以作为任何一种酶的固定化载体,而且它们较耐微生物腐蚀。聚苯乙烯类材料是世界上第1个被用作固定化酶载体材料的合成有机材料,它主要通过吸附作用固定化酶。在使用过程中,科学家们发现在材料的表面进行化学修饰,可以在很大程度上改变基体材料的表面性质[15],再与合适的交联剂联合使用,可以取得良好的固定化效果。
脂肪酶固定化过程中,使用较广泛的交联剂为戊二醛和京尼平。然而戊二醛因与酶反应剧烈易损害酶活力,同时含戊二醛的固定化酶在储存和使用过程中会对操作者带来毒害[16];而京尼平的价格较为昂贵,极大地限制了这2种交联剂的使用。本研究尝试使用相对廉价易得的新型环氧交联剂聚乙二醇二缩水甘油醚进行交联试验[17],聚乙二醇二缩水甘油醚含有2个末端环氧基团,与酶反应相对比较温和。结果表明本次试验中采用HPD750树脂对脂肪酶进行吸附,而后使用聚乙二醇二缩水甘油醚进行交联,得到的吸附–交联固定化酶具有很好的温度和pH稳定性,同时也具有较好的操作和储存稳定性。本研究为基于有机树脂吸附和环氧交联剂交联的固定化酶制剂工艺奠定了良好的工作基础。后续试验中将继续探究新型吸附树脂和新型环氧交联剂的使用方法及适用范围,为工业酶的吸附–交联固定化工艺提供更多选择。
| [1] |
VENDITTI I, PALOCCI C, CHRONOPOULOU L, et al. Candida rugosa lipase immobilization on hydrophilic charged gold nanoparticles as promising biocatalysts: Activity and stability investigations[J]. Colloids Surf B Biointerfaces, 2015, 131: 93-101. DOI:10.1016/j.colsurfb.2015.04.046 (  0) 0) |
| [2] |
WU Z, QI W, WANG M, et al. Lipase immobilized on novel ceramic supporter with Ni activation for efficient cinnamyl acetate synthesis[J]. J Mol Catal B: Enzym, 2014, 110: 32-38. DOI:10.1016/j.molcatb.2014.09.010 (  0) 0) |
| [3] |
LI Y, WANG W, HAN P. Immobilization of Candida, sp.99-125 lipase onto silanized SBA-15 mesoporous materials by physical adsorption[J]. Korean J Chem Eng, 2014, 31(1): 98-103. DOI:10.1007/s11814-013-0198-1 (  0) 0) |
| [4] |
ARAVINDAN R, ANBUMATHI P, VIRUTHAGIRI T. Lipase applications in food industry[J]. Indian J Biotechnol, 2007, 6(2): 141-158. (  0) 0) |
| [5] |
SHELDON R A. Enzyme immobilization: The quest for optimum performance[J]. Adv Synth Catal, 2007, 349(8/9): 1289-1307. (  0) 0) |
| [6] |
贾存勤, 李阳春, 屠鹏飞, 等. HPD系列大孔吸附树脂预处理方法研究[J]. 中国中药杂志, 2005, 30(18): 1425-1427. DOI:10.3321/j.issn:1001-5302.2005.18.010 (  0) 0) |
| [7] |
LI C, ZHANG G, LIU N, et al. Preparation and properties of rhizopus oryzae lipase immobilized using an adsorption-crosslinking method[J]. Int J Food Prop, 2016, 19(8): 1776-1785. DOI:10.1080/10942912.2015.1107732 (  0) 0) |
| [8] |
KILINC A, TEKE M, ONAL S, et al. Immobilization of pancreatic lipase on chitin and chitosan[J]. Prep Biochem Biotechnol, 2006, 36(2): 153-163. DOI:10.1080/10826060500533976 (  0) 0) |
| [9] |
DOSANJH N S, KAUR J. Immobilization, stability and esterification studies of a lipase from a Bacillus sp.
[J]. Biotechnol Appl Biochem, 2002, 36: 7-12. DOI:10.1042/BA20010070 (  0) 0) |
| [10] |
SCHOEVAART R, WOLBERS M W, GOLUBOVIC M, et al. Preparation, optimization, and structures of cross-linked enzyme aggregates (CLEAs)[J]. Biotechnol Bioeng, 2004, 87(6): 754-762. DOI:10.1002/(ISSN)1097-0290 (  0) 0) |
| [11] |
ALNOCH R, RODRIGUES DE MELO R, PALOMO J, et al. New tailor-made alkyl-aldehyde bifunctional supports for lipase immobilization[J]. Catalysts, 2016, 6(12): 191. DOI:10.3390/catal6120191 (  0) 0) |
| [12] |
侯爱军, 徐冰斌, 梁亮, 等. 改进铜皂−分光光度法测定脂肪酶活力[J]. 皮革科学与工程, 2011, 21(1): 22-27. DOI:10.3969/j.issn.1004-7964.2011.01.005 (  0) 0) |
| [13] |
LEI L, BAI Y, LI Y, et al. Study on immobilization of lipase onto magnetic microspheres with epoxy groups[J]. J Magn Magn Mater, 2009, 321(4): 252-258. DOI:10.1016/j.jmmm.2008.08.047 (  0) 0) |
| [14] |
HASAN F, SHAH A A, HAMEED A. Industrial applications of microbial lipases[J]. Enzyme Microb Technol, 2006, 39(2): 235-251. DOI:10.1016/j.enzmictec.2005.10.016 (  0) 0) |
| [15] |
JE H H, NOH S, HONG S G, et al. Cellulose nanofibers for magnetically-separable and highly loaded enzyme immobilization[J]. Chem Eng J, 2017, 323(1): 425-433. (  0) 0) |
| [16] |
徐珊, 李任强, 郑振华, 等. 脂肪酶的包埋和交联固定化研究[J]. 云南农业大学学报(自然科学版), 2017, 32(6): 1-9. (  0) 0) |
| [17] |
钱明华. 一种经济、高效环氧树脂及交联剂固定化脂肪酶的研究[D]. 广州: 暨南大学, 2018.
(  0) 0) |
 2019, Vol. 40
2019, Vol. 40


