体内脂肪过度沉积对人体健康和动物胴体品质有不良影响[1],降低体内脂肪沉积可改善动物胴体品质[2-3],提高人体健康。钙作为机体必需元素,参与脂肪沉积调控[4-5],但其具体作用及调节机制尚不完全清楚。因此,研究钙对动物机体脂肪沉积的影响及机制,对于提高动物胴体品质及人体健康具有重要意义。
肠道菌群数量众多,作用广泛,对机体健康具有重要意义[6]。肠道菌群和肥胖的关系是现在研究的热点之一。有研究报道,肥胖与肠道细菌分布有关,厚壁菌门Firmicutes多于拟杆菌门Bacteroidetes导致肠道更有效吸收食物中的热量从而导致肥胖[7]。但目前的研究中,有关钙离子是否通过改变肠道菌群来调控肥胖的报道却较少。因此,研究钙离子对肠道菌群的影响有利于进一步深入了解钙离子调控脂肪沉积的机制。
本试验以C57BL小鼠为试验对象,研究饮水添加氯化钙对高脂日粮饲喂小鼠的脂肪沉积的影响,同时分析钙离子对肠道菌群的影响,以及肠道菌群与脂肪沉积可能的关联,旨在为提高动物胴体品质和人体健康提供理论依据。
1 材料与方法 1.1 试验动物与试验设计选用27只4周龄C57BL雄性小鼠(购于广东省医学实验动物中心),试验用的高脂日粮(High-fat diet, HFD)购于广东省医学实验动物中心,氯化钙购于Sigma公司。预饲小鼠正常日粮1周后,根据体质量随机分为2组:高脂组(HFD组),n=15,饲喂高脂日粮,脂肪提供60%的能量;高脂日粮+饮水添加氯化钙组(HFD+Ca2+组),n=12,饲喂高脂日粮,脂肪提供60%的能量,饮水中添加16.647 g/L的氯化钙。将小鼠分笼饲养,自由采食和饮水;每天光照与黑暗各12 h,环境温度控制在(25±1) ℃,湿度(60±5)%。饲养13周后,通过颈部脱臼方式处死小鼠,采集小鼠附睾脂肪、皮下脂肪组织并称质量。并在小鼠饲养至10~12周时采集小鼠的新鲜粪便样,于–80 ℃条件下进行保存。
1.2 测定指标及方法饲养期间每周测定小鼠体质量和体内脂肪含量,体内脂肪含量通过核磁共振成像仪(上海纽迈科技有限公司,MesoQMR23-060H型)进行测定。样品采样后测定小鼠附睾脂肪、皮下脂肪质量。粪便样菌群送公司(上海微基生物科技有限公司)进行16S rRNA高通量测序,测定指标包括菌群丰度,菌群多样性。
1.3 统计分析数据结果用平均值±标准误表示,统计分析采用SigmaPlot 12.5软件分析,采用t检验比较不同分组的统计差异。
2 结果与分析 2.1 饮水添加氯化钙对高脂日粮饲喂小鼠体质量和脂肪沉积的影响本研究中,与高脂组相比,饮水添加氯化钙使小鼠的体质量(图1A)、体脂含量(图1B)、皮下脂肪指数(图1C)和附睾脂肪指数(图1D)分别下降了12.85%、32.69%、26.65%和18.60%,差异均显著。
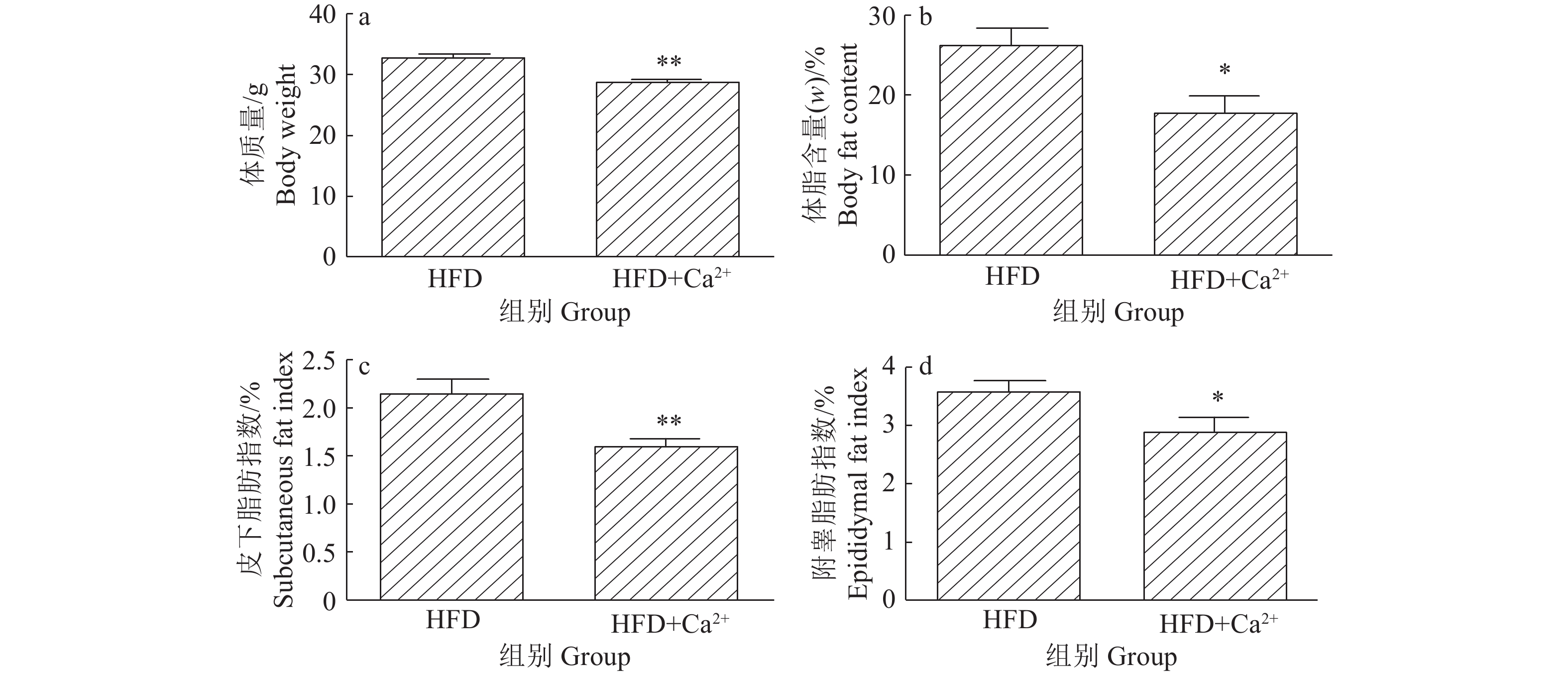
|
图 1 饮水添加氯化钙对高脂日粮饲喂小鼠体质量(a)、体脂含量(b)、皮下脂肪指数(c)和附睾脂肪指数(d)的影响 Fig. 1 Effects of calcium chloride supplementation in drinking water on body weight (a), body fat content (b), subcutaneous fat index (c) and epididymal fat index (d) of mice fed high-fat diet “*” 和 “**” 分别表示与HFD组差异达到0.05和0.01的显著水平(t检验) “*” and “**” indicate the significant difference between HFD and HFD+Ca2+ at 0.05 and 0.01 levels, respectively (t test) |
利用16S rRNA高通量测序方法,得到了粪便菌群的菌群多样性和菌群丰度。香农指数显示,饮水添加氯化钙可提高小鼠的粪便菌群群落多样性(图2A)。Chao指数显示,饮水添加氯化钙能提高小鼠的粪便菌群丰度(图2B)。
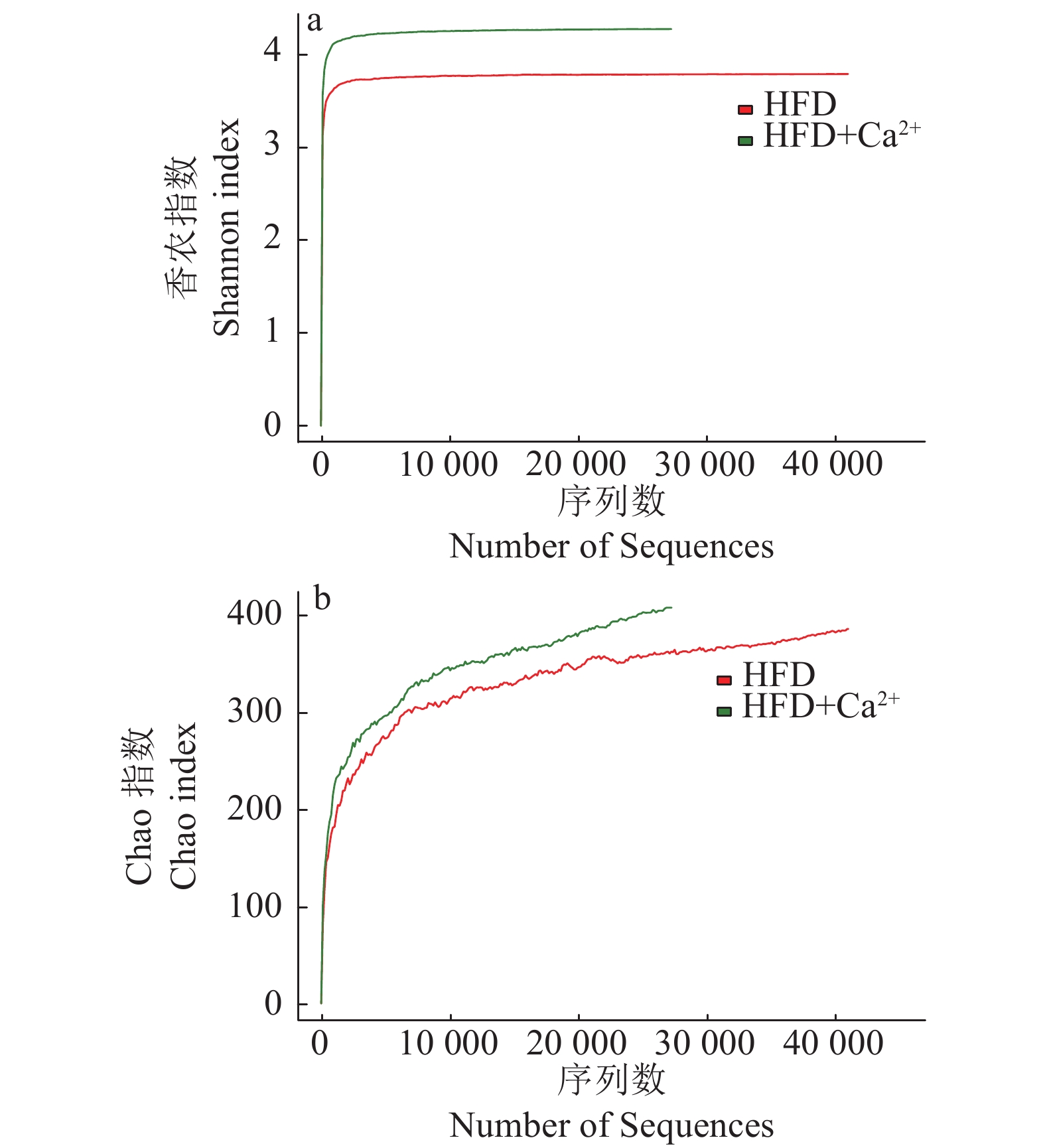
|
图 2 饮水添加氯化钙对高脂日粮饲喂小鼠粪便菌群的香农指数(a)及Chao指数(b)的影响 Fig. 2 Effects of calcium chloride supplementation in drinking water on Shannon index (a) and Chao index (b) of mice fed high-fat diet |
PCA结果显示,高脂组的菌群聚集与饮水添加氯化钙组的菌群聚集有明显的分离情况(图3)。
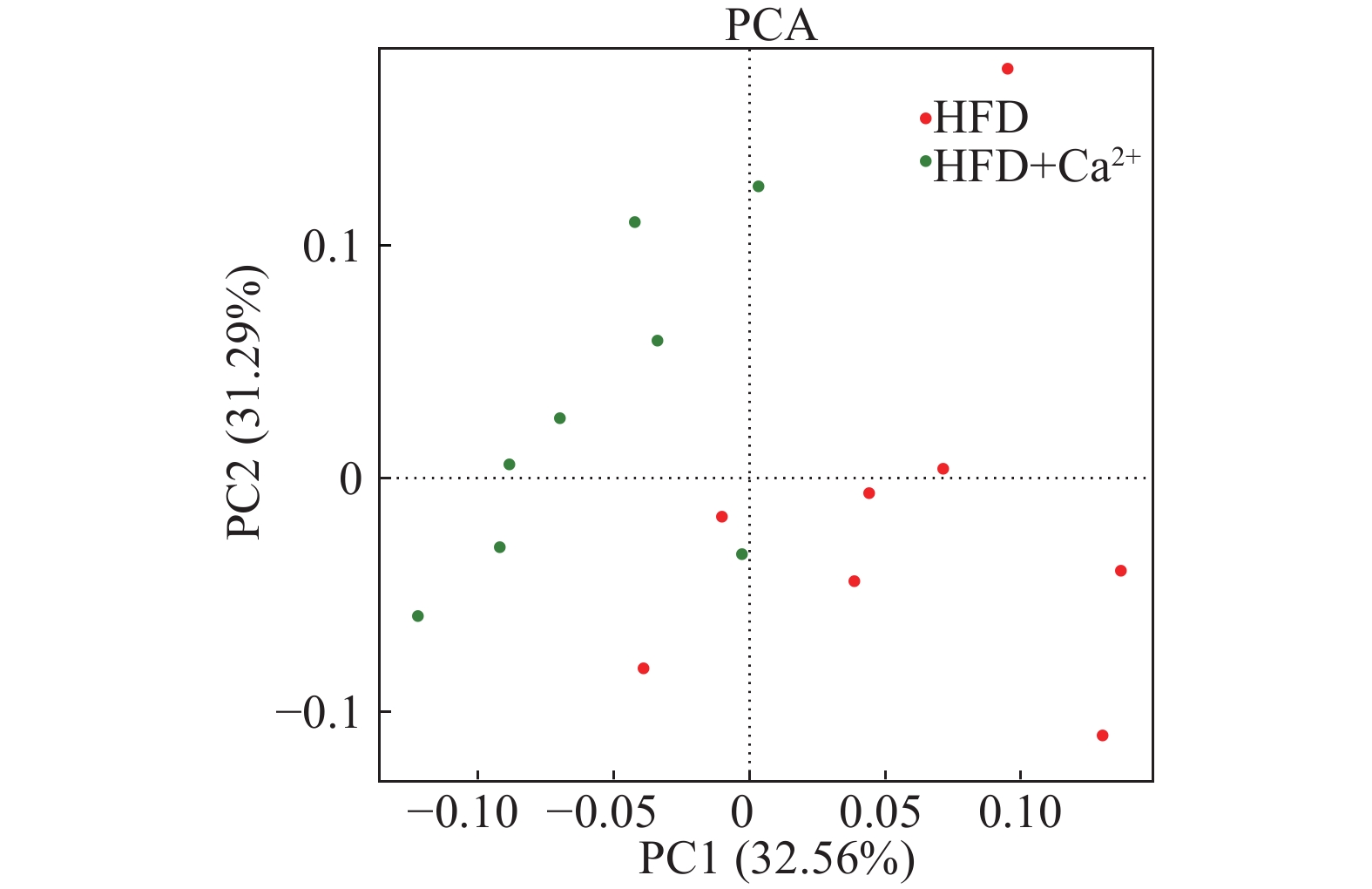
|
图 3 饮水添加氯化钙对高脂日粮饲喂小鼠粪便菌群的影响的主成分分析 Fig. 3 Principal component analysis (PCA) of the effect of calcium chloride supplementation in drinking water on fecal flora of mice fed high-fat diet |
16S rRNA测序结果表明,粪便菌群主要由6个细菌门构成:拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形菌门Proteobacteria、脱铁杆菌门Deferribacteres、放线菌门Actinobacteria、软壁菌门Tenericutes,其中拟杆菌门和厚壁菌门为主要优势菌群。在门水平下,高脂饲喂小鼠粪便中的拟杆菌门、脱铁杆菌门、放线菌门的相对丰度较高,饮水添加氯化钙饲喂小鼠粪便中的厚壁菌门、变形菌门、软壁菌门的相对丰度较高。但这6种菌门的丰度在2个处理组的差异不显著。
在纲水平下,与高脂组相比,饮水添加氯化钙可显著降低丹毒丝菌纲Erysipelotrichia和放线菌纲Actinobacteria的相对丰度,并且显著提高与胆汁酸代谢相关的梭菌纲Clostridia的相对丰度,Negativicoccus只存在高脂组中。
在目水平下,与高脂组相比,饮水添加氯化钙可显著降低丹毒丝菌目Erysipelotrichia和放线菌目Coriobacteriaceae的相对丰度,并且显著提高梭菌目Clostridia的相对丰度。
在科水平下,与高脂组相比,饮水添加氯化钙可显著降低丹毒丝菌科Erysipelotrichia的相对丰度,并且显著提高瘤胃菌科Ruminococcaceae、优干菌科Eubacteriaceae、消化链球菌科Peptostreptococcaceae的相对丰度。动球菌科Planococcaceae、短杆菌科Brevibacteriaceae、肉杆菌科Carnobacteriaceae只存在于饮水添加氯化钙组。韦荣氏杆菌科Veillonellaceae只存在于高脂组。
在属水平下,与高脂组相比,饮水添加氯化钙能显著降低Allobaculum的相对丰度。与高脂组相比,饮水添加氯化钙能显著提高紫单胞菌属Parabacteroides、Anaerofustis的相对丰度。但土壤芽胞杆菌属Solibacillus、短杆菌属Brevibacterium、Turicibacter、Desemzia只存在于饮水添加氯化钙中。其中,微生物Turicibacter已被证明与抗炎表型相关[8]。
3 讨论与结论 3.1 饮水添加氯化钙对高脂日粮饲喂小鼠脂肪沉积的影响有文献报道,高钙源的摄入可以显著减少肥胖病人的腹部脂肪[9],降低肥胖小鼠体内皮下和附睾脂肪含量[10]。与以上报道相一致的是,本研究结果表明,饮水添加氯化钙显著减少高脂日粮饲喂小鼠体质量,减少体内皮下和附睾脂肪含量。但也有研究发现,高钙饮食并不能起到减轻肥胖的作用[11],这可能与添加钙的浓度、动物品种和动物个体差异的因素有关。因此,钙的摄入对动物和人的体质量及肥胖具有一定的调控作用。
本研究结果表明,虽然本试验钙的饮水添加方式与膳食钙的添加方式不同,但是也起到了降低肥胖的作用。机体的低钙水平会对正常的生理活动造成影响,而过高剂量的钙摄入对机体也会造成损伤,尤其是对心血管、肾和肝组织损伤明显。有研究报道,高钙饲料(钙质量分数为3%)的摄入未对大鼠肝肾脏造成损伤[12],而本研究添加的氯化钙质量浓度为16.647 g/L,因此,本研究添加的剂量应该对小鼠机体健康无明显影响。
3.2 饮水添加氯化钙对高脂日粮饲喂小鼠粪便菌群的影响本试验中,香农指数和Chao指数显示,饮水添加氯化钙可提高高脂日粮饲喂小鼠粪便菌群群落多样性和菌群丰度。样品组成越相似,反映在PCA图中的距离越近。本试验中,通过PCA分析可知,饮水添加氯化钙已经影响高脂日粮饲喂小鼠粪便菌群样本的组成。Duncan等[13]研究表明使肥胖受试者体质量减轻的饮食可显著改变肠道微生物群的物种组成,但没有发现粪便细菌中拟杆菌和厚壁菌的比例在人类肥胖中起作用的证据。我们的研究结果发现饮水添加氯化钙显著降低体质量,其饲喂小鼠粪便中的厚壁菌门相对丰度增加,拟杆菌门相对丰度减少。但Ley等[14]发现肥胖人群粪便菌群里的厚壁菌门和拟杆菌门比值高于正常体质量人群,给予肥胖志愿者低脂饮食1年后,其体质量出现下降,而体内的厚壁菌门比例有了下降,拟杆菌门的比例则上升,这与本研究的结果不一致。但这一观点受到后续研究的挑战。最近的研究表明,肥胖与微生物多样性或丰度降低相关[15]。也有文献报道,随着身体质量指数(Body mass index, BMI)大小上升,肠道菌群多样性与丰富度呈下降趋势[16]。因此,饮水添加氯化钙可能是通过改变高脂日粮饲喂小鼠粪便菌群物种丰度与群落多样性来减少脂肪沉积。
肠道菌群虽然有很大的个体差异,但也有一定的共性[17]。有研究表明,粪便菌群和盲肠内容物的菌群变化趋势是相似的[18]。Nadeem等[18]报道,高钙饮食能提高盲肠内容物里的瘤胃菌科水平,降低盲肠内容物丹毒丝菌科水平。这与本试验的饮水添加氯化钙组能提高粪便菌群里的瘤胃菌科相对丰度和降低丹毒丝菌科相对丰度结果一致。
胆汁酸在脂质代谢中起重要的调节作用。胆汁酸不仅参与胆固醇的调节,而且在三酰甘油的代谢中也发挥着重要作用[19]。肠道微生物群通过促进初代胆汁酸的去共轭、脱氢和脱羟基作用对胆汁酸代谢具有深远的影响[20]。胆汁盐脱羧由胆汁盐水解酶催化。这种酶存在于各种肠细菌中,包括:梭菌属、拟杆菌属、乳杆菌属、双歧杆菌属和肠球菌属[21]。在饮水添加氯化钙的高脂日粮饲喂小鼠中梭菌属显著增加,说明饮水添加氯化钙可能影响小鼠粪便菌群中胆汁酸在脂质代谢方面的作用,从而显著减少高脂日粮饲喂小鼠的脂肪含量。
综上所述,饮水添加氯化钙能缓解高脂日粮诱导的肥胖,降低体质量和体内脂肪含量,而这可能与饮水添加氯化钙提高小鼠粪便菌群多样性和特定菌群丰度有关。研究结果为深入了解钙离子调节机体脂肪沉积机制以及提高动物胴体品质和人体健康具有重要意义。
| [1] |
马衍旋. 肌内脂肪对猪肉品质的影响及肌内脂滴的成脂调控[D]. 杨凌:西北农林科技大学, 2018.
(  0) 0) |
| [2] |
肖传禄. 提高生猪胴体品质和肉质特性研究进展综述[J]. 中国畜禽种业, 2006, 2(4): 40-43. DOI:10.3969/j.issn.1673-4556.2006.04.032 (  0) 0) |
| [3] |
何若钢, 黄伟杰, 李秀宝. 不同日粮水平对新美系长白猪40~70 kg阶段生长性能及胴体品质的影响[J]. 饲料工业, 2009, 30(23): 14-17. DOI:10.3969/j.issn.1001-991X.2009.23.005 (  0) 0) |
| [4] |
刘佳瑞, 郑瑞茂. 钙循环−米色脂肪产热新机制[J]. 生理科学进展, 2018, 49(1): 34. (  0) 0) |
| [5] |
罗楠, 秦锐. 膳食钙对高脂饮食大鼠肥胖形成的影响[J]. 江苏医药, 2007, 33(2): 162-164. DOI:10.3969/j.issn.0253-3685.2007.02.020 (  0) 0) |
| [6] |
BROWN J M. Eating to boost gut microbial diversity[J]. Sci Transl Med, 2016, 8(369): 198. DOI:10.1126/scitranslmed.aal3696 (  0) 0) |
| [7] |
袁坤, 林涅, 陈宏. 肠道菌群与肥胖发病机制的关系[J]. 医学综述, 2018, 24(21): 4166-4171. DOI:10.3969/j.issn.1006-2084.2018.21.002 (  0) 0) |
| [8] |
GOMES J M, COSTA J A, ALFENAS R C. Could the beneficial effects of dietary calcium on obesity and diabetes control be mediated by changes in intestinal microbiota and integrity?[J]. Brit J Nutr, 2015, 114(11): 1756-1765. DOI:10.1017/S0007114515003608 (  0) 0) |
| [9] |
ROSENBLUM J L, CASTRO V M, MOORE C E, et al. Calcium and vitamin D supplementation is associated with decreased abdominal visceral adipose tissue in overweight and obese adults[J]. Am J Clin Nutr, 2012, 95(1): 101-108. DOI:10.3945/ajcn.111.019489 (  0) 0) |
| [10] |
SUN C, WANG L, YAN J, et al. Calcium ameliorates obesity induced by high-fat diet and its potential correlation with p38 MAPK pathway[J]. Mol Biol Rep, 2012, 39(2): 1755-1763. DOI:10.1007/s11033-011-0916-x (  0) 0) |
| [11] |
LORENZEN J K, MOLGAARD C, MICHAELSEN K F, et al. Calcium supplementation for 1 y does not reduce body weight or fat mass in young girls[J]. Am J Clin Nutr, 2006, 83(1): 18-23. DOI:10.1093/ajcn/83.1.18 (  0) 0) |
| [12] |
徐姝迪, 张克远, 王忠, 等. 高钙饲料喂养初断乳大鼠对成年期高脂形成肥胖的影响[J]. 营养学报, 2013, 35(2): 154-157. (  0) 0) |
| [13] |
DUNCAN S H, LOBLEY G E, HOLTROP G, et al. Human colonic microbiota associated with diet, obesity and weight loss[J]. Int J Obesity, 2008, 32(11): 1720-1724. DOI:10.1038/ijo.2008.155 (  0) 0) |
| [14] |
LEY R E, TURNBAUGH P J, KLEIN S, et al. Microbial ecology: Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a (  0) 0) |
| [15] |
XIAO L, SONNE S B, FENG Q, et al. High-fat feeding rather than obesity drives taxonomical and functional changes in the gut microbiota in mice[J]. Microbiome, 2017, 5: 43. doi: 10.1186/s40168-017-0258-6.
(  0) 0) |
| [16] |
王洋, 周礼红. 肥胖人群肠道菌群多样性研究[J]. 贵州大学学报(自然科学版), 2018, 35(4): 47-53. (  0) 0) |
| [17] |
刘伟伟, 严敏, 周丽萍. 肥胖与肠道菌群的相关性[J]. 生命的化学, 2009, 29(6): 928-932. (  0) 0) |
| [18] |
NADEEM ASLAM M, BASSIS C M, ZHANG L, et al. Calcium reduces liver injury in mice on a high-fat diet: Alterations in microbial and bile acid profiles[J]. PLoS One, 2016, 11(11): e0166178. DOI:10.1371/journal.pone.0166178.eCollection2016 (  0) 0) |
| [19] |
张柳, 牛尚梅, 马慧娟. 胆汁酸与代谢综合征的研究进展[J]. 医学综述, 2016, 22(5): 964-967. DOI:10.3969/j.issn.1006-2084.2016.05.037 (  0) 0) |
| [20] |
SUN L J, MA L J, MA Y B, et al. Insights into the role of gut microbiota in obesity: Pathogenesis, mechanisms, and therapeutic perspectives[J]. Protein Cell, 2018, 9(5): 397-403. DOI:10.1007/s13238-018-0546-3 (  0) 0) |
| [21] |
KASKA L, SLEDZINSKI T, CHOMICZEWSKA A, et al. Improved glucose metabolism following bariatric surgery is associated with increased circulating bile acid concentrations and remodeling of the gut microbiome[J]. World J Gastroentero, 2016, 22(39): 8698-8719. DOI:10.3748/wjg.v22.i39.8698 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


