印度丽蘑Calocybe indica,属真菌界、担子菌门、层菌纲、伞菌目、离褶伞科、丽蘑属,又名奶白蘑菇,是一种原产于印度的热带食用菌。生长于孟加拉国和印度西孟加拉邦炎热的夏季[1],之后逐步引种至其他国家如马来西亚、新加坡等进行栽培[2]。印度丽蘑的生长需要30~35 ℃的高温以及85%~90%的相对湿度[3],是典型的夏季食用菌,其菌肉肥嫩、味道鲜美、营养丰富,具有较高的经济价值和药用价值。同时,印度丽蘑子实体硕大、产量可持续、外观乳白色[4-6]。与其他栽培的食用菌品种相比,印度丽蘑在室温的保质期为5~7 d,更利于运输和储存,易引起商人和种植户的兴趣,成为印度继平菇和草菇之后第3种商业化种植的食用菌[7],具有良好的市场价值和广阔的前景。印度丽蘑是一种草腐生真菌,有时也会与椰树、糖棕的根系共生,形成外生菌根,因此印度丽蘑在种植过程中需要覆土栽培以利于菌丝生长[8]。研究表明,印度丽蘑生长最适温度在30~35 ℃,温度低于25 ℃或超过38 ℃时菌丝基本不生长[9-11],覆土材料就可以起到保温隔热的作用。Vijaykumar等[12]采用麦秸、稻草、大豆秸秆、椰子壳、棉籽壳及甘蔗渣等材料栽培印度丽蘑,发现麦秸是最好的栽培基质,其次是水稻秸秆。Singh等[13]研究表明,不同水稻品种的秸秆对印度丽蘑子实体的产量有影响。赵嘉菱等[14]研究了不同培养料添加物对印度丽蘑子实体产量及农艺性状的影响,发现在杏鲍菇菌渣中添加质量分数为30%的玉米粉产量最高。Alam等[15]的研究表明,水稻秸秆添加质量分数为30%的玉米粉最适合用于印度丽蘑的栽培。覆土是蘑菇属食用菌栽培的一个重要环节,是子实体形成的必要条件[16-17]。覆土材料的化学、物理性质和营养成分对子实体的形成皆有影响。Noble等[18]认为,覆土的作用之一是能破坏蘑菇挥发性代谢物质,以避免挥发性代谢物质对菌丝生长造成的影响。Egerhummel等[19]认为食用菌生长环境中的CO2浓度梯度能够刺激子实体的分化。Nair等[20]在进行不同覆土材料对子实体生长的影响试验中指出,覆土材料的透气性对子实体的生长有影响。同时,覆土材料还应该具有良好的持水性,其pH应处于中性或偏碱性[21]。食用菌菌丝体可溶性蛋白质电泳图谱具有种的特征性,对菌株间的鉴定有一定参考价值[22-23]。顾雅君等[24]研究发现胞外酶和食用菌的生长分化具有密切的相关性。食用菌的胞外酶系主要包括纤维素酶、半纤维素酶、木质素分解酶、淀粉酶、果胶酶和蛋白酶等。这些酶可以分解基质使多糖、蛋白质、核酸等高分子物质水解成菌丝便于吸收的小分子物质,为食用菌菌丝生长、原基形成、子实体生长发育提供基本的营养保障。
广西是典型的亚热带季风气候,水热充足,适合印度丽蘑的栽培。覆土是印度丽蘑栽培过程中一个必不可少的重要环节。覆土材料的选择对子实体的生长有一定的影响,本研究选择广西地区容易获得的几种材料进行处理,作为印度丽蘑栽培的覆土材料,探索不同覆土材料对印度丽蘑子实体生长的影响,同时测定印度丽蘑的胞外酶活性,了解其在整个生长发育阶段酶活性的产生、变化规律,有助于阐明培养基质组分降解的特点,也可为选择最适覆土材料提供一定的依据。最终选择最经济有效的覆土材料,应用于生产。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株印度丽蘑菌种由广西大学食用菌研究所提供。
1.1.2 培养基和栽培配方液体菌种培养基组成及质量分数:黄豆粉2%,玉米粉2%,葡萄糖2%,磷酸二氢钾0.2%,硫酸镁0.1%,麦麸0.2%,维生素0.01%。栽培配方及各组分质量分数:棉籽壳50%,麦麸17%,玉米粉30%(添加剂),石膏1%,石灰2%。
1.1.3 覆土材料田土取自广西大学农学院试验田;牛粪、菌渣(杏鲍菇菌渣)和沙子由广西大学食用菌研究所提供。
1.2 试验方法 1.2.1 菌袋制作按栽培配方称取棉籽壳、麦麸、玉米粉、石膏和石灰,依次加入并混匀后加水进行充分搅拌。含水量以用手紧握,恰能从指缝渗出为准。将栽培料堆积起来,用薄膜盖住,隔日进行装袋,塑料袋选用17 cm×33 cm的聚丙烯塑料袋。共设4种覆土材料处理,包括田土(对照)、菌渣、田土+牛粪(体积比为3∶1)、田土+沙子(体积比为3∶1)处理,每处理3次重复,每个重复10袋。
1.2.2 液体菌种培养以1 L水为溶剂在发酵罐中制备液体菌种培养基,121 ℃灭菌30 min,温度降至30 ℃以下时接入印度丽蘑菌种,置于磁力搅拌器上于28 ℃、120 r/min培养5 d,备用。
1.2.3 接种菌袋在126 ℃高压灭菌2 h,冷却后在接种箱中进行接种,每袋接25 mL液体菌种。接种完毕后,转入培养房进行发菌。
1.2.4 发菌管理保持菇房干净、透气,调节温度在30~35 ℃之间,相对湿度在80%以上。
1.2.5 覆土材料处理取覆土材料在阳光下暴晒,并用石灰控制pH在8.0~9.0之间,含水量20%左右,判断标准为用手抓可以成团,松开后不粘手为宜[8]。搅拌均匀后备用。待到菌丝长满袋,将要出现原基时进行覆土,覆土厚度大约3 cm。覆土完成后将菌包移至菇房进行常规管理,保持30 ℃以上温度、80%以上的相对湿度、适度的光照和透气性。
1.2.6 子实体产量构成因子的测定观察记录第1、2潮菇现蕾时间和子实体数量,子实体成熟后采收,采收时用电子天平称量产量和单菇质量,并用直尺测量子实体的菌柄直径、菌柄长、菌盖直径和菌盖厚度。
1.2.7 菌丝体可溶性蛋白含量和胞外酶的测定分别在印度丽蘑生长的2个潮期测定数据。生长时期分为第1潮菇期,包括菌丝(A1)、原基(B1)、幼菇(C1)、成熟期(D1)和间期(E1),以及第2潮菇期,包括原基(B2)、幼菇(C2)、成熟期(D2)和间期(E2)。
粗酶液的制备:在菌丝生长和子实体发育的不同阶段,从3个菌袋中取覆土层下发菌料充分混匀,然后取其10 g加蒸馏水50 mL,20 ℃条件下浸提4 h,过滤后,4 000 r/min离心5 min,上清液即为粗酶液。
可溶性蛋白含量和胞外酶的测定:
1)参照Carlsson等[25]的方法进行可溶性蛋白含量的测定。
2)参照邵伟等[26]的方法进行多酚氧化酶(Polyphenol oxidase, PPO)活性的测定。1个酶活力单位(U)为每分钟D415 nm变化0.001所需要的酶量。
3)参照张志良[27]的方法测定过氧化物酶(Peroxidase,POD)活性。1 U为每分钟D470 nm变化0.001所需要的酶量。
4)参照曾璐漫等[28]的方法测定漆酶活性。1 U为每分钟D460 nm变化0.001所需要的酶量。
5)参考王玉万等[29]的方法测定淀粉酶活性。在试管中加入5 g/L的可溶性淀粉溶液0.5 mL,再加入0.5 mL粗酶液,均匀混合后放入38 ℃恒温水浴锅水浴30 min,随后拿出加入3,5−二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)试剂1.5 mL,对照管中加入DNS后再加入0.5 mL酶液,沸水浴5 min,待到冷却后添加21.5 mL蒸馏水,混合均匀后测定D550 nm。1 U为每分钟催化水解淀粉生产1 μg葡萄糖所需要的酶量。
6)参照Shamala等[30]的方法测定半纤维素酶活性,1 U定义为:每分钟催化水解纤维素生产1 μg木糖所需要的酶量。
7)参照王玉万等[29]的方法测定果胶酶活性,1 U为每分钟催化水解果胶生产1 μg半乳糖醛酸所需要的酶量。
8)参考吕春鹤等[31]的方法测定羧甲基纤维素酶(Carboxymenthel cellulase, CMC)活性。在试管中加入5 g/L的CMC-Na溶液0.75 mL,在样品管中添加0.25 mL粗酶液,50 ℃水浴30 min,取出后加0.75 mL DNS试剂;对照管中加入DNS后再加入0.25 mL酶液,沸水浴10 min,取出冷却。加入10 mL蒸馏水,混匀后测定D550 nm,1 U为每分钟催化水解纤维素生产1 μg葡萄糖所需要的酶量。
1.3 统计分析用Microsoft Excel 2013对试验数据进行汇总并完成图表制作,使用SPSS 20.0对不同处理印度丽蘑的产量构成因子进行单因素方差分析,并通过邓肯新复极差法分析各处理间的差异显著性。
2 结果与分析 2.1 不同覆土材料对印度丽蘑产量构成因子的影响 2.1.1 对产量和单菇质量的影响由表1可知,不同覆土材料对印度丽蘑的产量影响差异显著。其中,田土+牛粪处理的产量最高,达2 078.50 g,比田土对照的产量提高32.49%,其次是菌渣处理,其产量也显著高于对照组。田土+沙子处理产量最低,仅为1 209.50 g,显著低于对照组,说明该覆土材料不利于印度丽蘑产量的提高。此外,不同覆土材料对印度丽蘑单菇质量的影响也存在一些差异。以菌渣为覆土材料单菇质量最大,田土+牛粪处理次之,这2个处理的单菇质量均显著高于对照组。而田土+沙子处理的单菇质量仅为85.95 g,显著低于对照组的97.17 g。
|
|
表 1 不同覆土材料对印度丽蘑产量构成因子的影响 Table 1 Effect of different casing materials on the yield-contributing characteristics of Calocybe indica |
由表1可知,田土+牛粪处理现蕾最早,仅为7.67 d,且显著早于对照组(9.50 d),说明该覆土材料能明显促进印度丽蘑子实体的形成,田土+沙子处理现蕾时间为10.00 d,与对照组差异不显著;以菌渣为覆土材料现蕾最晚,长达22.67 d,显著迟于对照组。
2.1.3 对菌柄和菌盖的影响由表1可知,与对照组相比,3种覆土材料均有利于菌柄直径和菌柄长的增加,其中田土+牛粪处理的菌柄最长,达24.70 cm。就对菌盖的影响来看,田土+牛粪和菌渣处理的菌盖直径和菌盖厚度均大于对照组,表明这2种覆土材料有利于印度丽蘑菌盖的发育,而田土+沙子处理的菌盖直径为7.20 cm,小于对照组,菌盖厚度大于对照组,差异均不显著。
2.1.4 对出菇密度的影响4种覆土材料中,田土+牛粪处理的出菇密度最高,对照组和菌渣处理次之,田土+沙子处理后出菇密度最低。
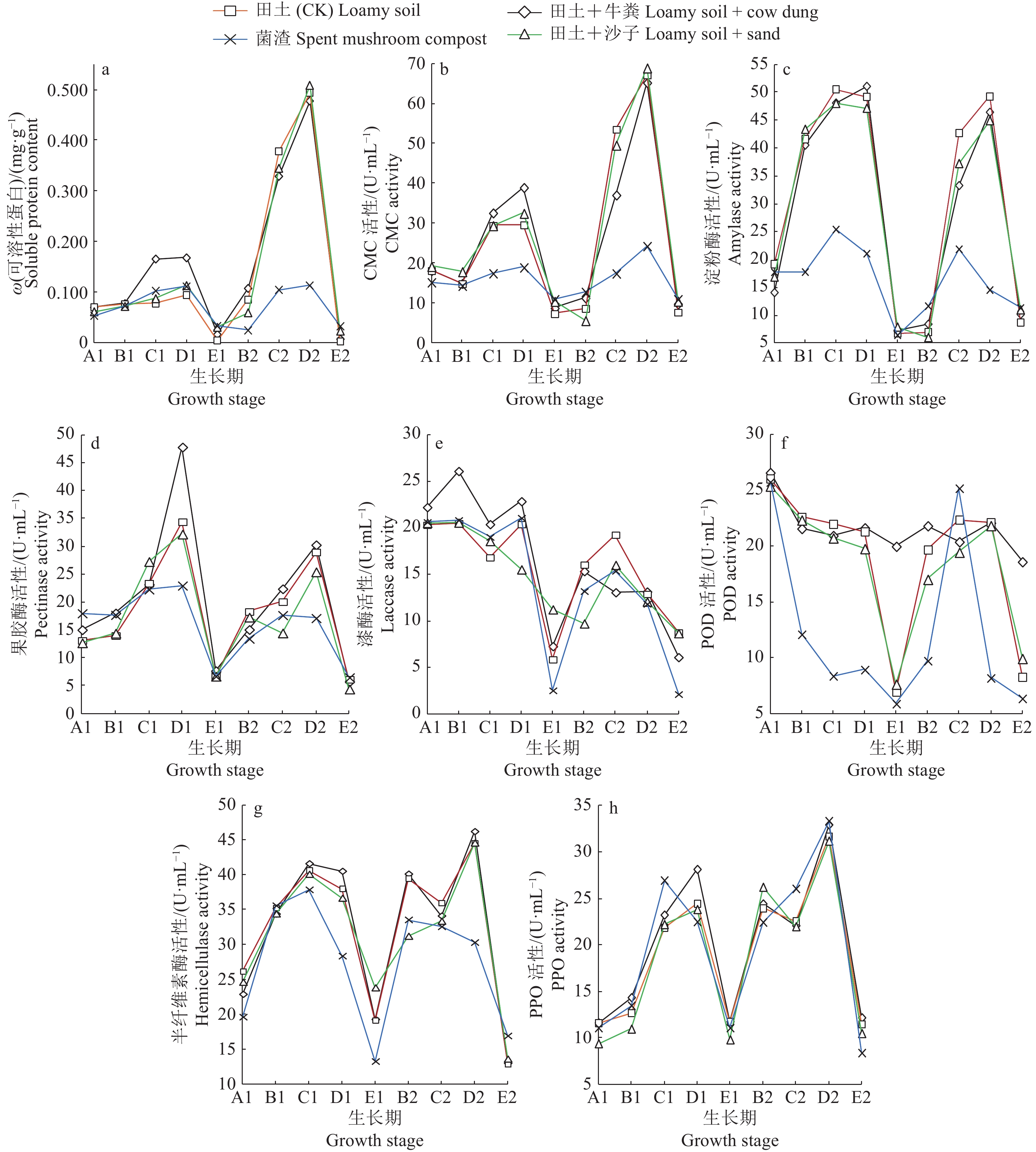
2.2 不同覆土材料对印度丽蘑菌丝体可溶性蛋白含量的影响不同覆土材料对印度丽蘑可溶性蛋白含量的影响见图1a。在第1潮菇期,印度丽蘑从菌丝期(A1)到成熟期(D1),各个处理可溶性蛋白的含量持续上升,其中田土+牛粪处理可溶性蛋白含量上升幅度最高,田土、田土+沙子、菌渣3个处理之间可溶性蛋白的含量相差不大,田沙、菌渣处理的可溶性蛋白含量在幼菇期(C1)和成熟期(D1)略高于对照。在印度丽蘑生长时期的间期1(E1),各处理的可溶性蛋白含量急剧下降。
|
图 1 不同覆土材料处理对印度丽蘑可溶性蛋白含量和胞外酶活性的影响 Fig. 1 Effects of different casing materials on soluble protein contents and extracellular enzyme activities of Calocybe indica A1:第1潮菇菌丝期;B1:第1潮菇原基期;C1:第1潮菇幼菇期;D1:第1潮菇成熟期;E1:间期1;B2:第2潮菇原基期;C2:第2潮菇幼菇期;D2:第2潮菇成熟期;E2:间期2 A1: Mycelium stage of flush 1; B1: Primordium stage of flush 1; C1: Young fruit body stage of flush 1; D1: Mature fruit body stage of flush 1; E1: Interphase 1; B2: Primordium stage of flush 2; C2: Young fruit body stage of flush 2; D2: Mature fruit body stage of flush 2; E2: Interphase 2 |
在第2潮菇期,可溶性蛋白含量迅速升高,原基期(B2)田土+牛粪处理可溶性蛋白含量明显升高,高于其他处理,在幼菇期(C2)和成熟期(D2)持续稳定升高,但含量低于对照,同时在这2个时期中,田土+沙子处理可溶性蛋白含量急速升高,但菌渣处理与第1潮菇含量相近。间期2(E2)4个处理的可溶性蛋白含量均迅速降低至与间期1相近水平。从2个潮菇的各个时期来看,田土+牛粪处理的可溶性蛋白含量整体较其他处理高。
2.3 不同覆土材料对印度丽蘑菌丝体胞外酶活性的影响 2.3.1 CMC活性由图1b可知,在生长的2个潮菇期,各处理印度丽蘑胞外CMC活性的变化规律基本一致,均出现2个酶活性峰值,分别出现在D1和D2这2个成熟期,且第1个峰值均低于第2个峰值,第1潮菇原基形成后,CMC活性逐渐升高,在D1期达到第1个峰值,之后逐渐下降,间期1(E1)达到最低值,但田土+沙子处理的最低值出现在第2潮菇原基期(B2)。两潮菇的原基期CMC活性均处于较低水平,在幼菇期开始明显升高,成熟期达到峰值,第2潮菇期CMC的活性明显高于第1潮菇期。其中田土+牛粪处理下CMC活性在高峰阶段略高于其他处理,菌渣处理下CMC活性变化范围最小,其活性水平总体最低。
2.3.2 淀粉酶活性由图1c可知,在印度丽蘑的2个潮菇期,除菌渣处理外,其他3种处理下淀粉酶活性变化规律基本一致,呈先升高后降低的波动,酶活性在幼菇期和成熟期达到最高峰。菌渣处理下2个潮菇期酶活性变化规律与其他3种处理相同,但各时期酶的活性明显低于其他3种处理,其波动的范围也比较小。
2.3.3 果胶酶活性不同覆土材料对印度丽蘑胞外果胶酶活性的影响如图1d所示,结果表明:4种处理下果胶酶的活性在2个潮期的变化规律基本一致,均在成熟期达到峰值,其中以田土+牛粪处理的酶活性为最高,尤其是在第1潮菇的成熟期(D1),远远高于其他3种处理,在第2潮菇期酶活性峰值相差不大,但田土+牛粪处理下酶活性依旧高于其余3种处理,在间期1(E1)4个处理酶活性均降低。菌渣处理各时期的酶活性几乎都低于其余3个处理,在第2潮菇的成熟期(D2)甚至出现轻微下降趋势。
2.3.4 漆酶和POD活性由图1e、1f可知,印度丽蘑胞外漆酶和POD具有基本相同的活性变化趋势,这2种酶均在栽培前期活性较高,在栽培过程中这2种酶的活性有所波动,但总体上均随栽培时间的延长逐渐下降。田土+牛粪处理漆酶活性下降趋势最大,且在第2潮菇期下降幅度变缓;而POD活性下降幅度较小,在整个过程中能维持相对较高的水平。田土+沙子处理的漆酶活性整体偏低,波动幅度最小;POD活性变动与田土类似。菌渣处理的漆酶活性下降最多,POD活性在第1潮菇时期迅速下降,而到第2潮菇幼菇期(C2)酶活性上升,之后急剧下降,整个过程酶活性变化不稳。
2.3.5 半纤维素酶活性由图1g可知,在第1潮菇期,4种处理下半纤维素酶活性变化规律基本一致,呈现先升高后降低的趋势,均在幼菇期(C1)达到酶活性的最高峰。第2潮菇期,菌渣处理酶活性的变化规律与其余3种处理不同,其在原基期(B2)出现最高峰,随后缓慢下降。其余3种处理下酶活性在原基期(B2)之后先下降后上升再下降,在成熟期(D2)达到峰值,其中田土+牛粪处理酶活性略高于其余3种处理。
2.3.6 PPO活性4种覆土材料对印度丽蘑PPO活性的影响如图1h所示,PPO活性在2个潮菇期均呈现先平稳上升后下降至与菌丝时期相近的活性水平,酶活性高峰几乎全部出现在成熟期。整个阶段中,田土+牛粪处理子实体发育各时期PPO活性基本处于最高或居于第2。
3 讨论与结论 3.1 覆土材料对印度丽蘑产量构成因子的影响印度丽蘑由营养生长向生殖生长过渡时覆土是重要的环节,覆土材料的选择在一定程度上对印度丽蘑的产量产生较大的影响。不适合的覆土材料将导致菌丝生长速度慢、生成量少、生长不均匀等情况,严重降低总产量。孙彬等[32]的研究表明,优质覆土材料应具备良好的透气性、持水性和均匀性等特点。本试验以田土、田土+牛粪、菌渣、田土+沙子为覆土材料,从产量结果可知,以田土+牛粪作为印度丽蘑覆土材料最合适,菌渣次之,田土+沙子最差。田土透气性、持水性一般,在多次施水后易板结,不利于菌丝的生长,这是产量不高的主要原因。在田土中加入沙子,能够提高其疏松程度,但沙子本身持水性差,营养物质含量少,不能有效地提高其产量。菌渣是食用菌生产的下脚料,可用于二次种菇,本身理化特性好,赵凤良等[33]研究表明菌渣的最大持水力在63%~64%之间,可为子实体发育提供必需的水分,但在本试验中菌渣现蕾的时间太长。前人研究表明,在覆土材料中添加牛粪,其电导性有剧烈升高现象,表明菌丝体在生长,这些离子进入菌丝体后引起底物降解进而导致电导性增高,也说明了菌丝体从覆土层中吸收了营养物质[34],因此,田土+牛粪处理的总产量最高。综上所述,在实际生产中建议采用田土+牛粪作为覆土材料。
3.2 不同覆土材料对印度丽蘑菌丝体可溶性蛋白含量的影响在印度丽蘑生长过程中,可溶性蛋白的含量伴随着菌体的生长发育产生变化。毛慧玲等[35]研究发现金针菇不同生长时期的菌丝生长量与可溶性蛋白含量变化有紧密联系。本试验采用4种覆土材料,研究结果表明可溶性蛋白含量均随着菌体的生长发育逐渐升高,直到间期时才急速下降。在第1潮菇期,除菌渣处理外,其他3种处理下可溶性蛋白含量的升高幅度更大。总体来看,田土+牛粪处理下可溶性蛋白含量较高。
3.3 不同覆土材料对印度丽蘑菌丝体胞外酶活性的影响CMC能够水解纤维素,在菌体生长发育的旺盛期,需要不断地吸收营养物质,在此时期,CMC活性较高。赵亚东[36]在试验中发现,侧耳和金针菇菌丝CMC活性与子实体的产量呈正相关。
淀粉酶在食用菌菌体生长发育过程中水解糖源和可溶性淀粉,提供碳源。在试验中发现,淀粉酶活性在幼菇和成熟期保持相对较高的活性水平。在前人试验中也发现,淀粉酶的活性最高峰保持在生长旺盛时期[37]。方新新[8]对印度丽蘑菌丝各个阶段果胶酶的研究中发现,酶的活性越高,子实体生长状况越好,并且原基的出现与酶的活性有一定的关联。试验结果表明,第1潮菇酶活性随着菌丝的生长逐渐增强,在成熟期达到高峰。
漆酶在食用菌生长中参与木质素的降解,为菌体的生长提供丰富的碳源。韩增华等[38]研究发现木耳产量与漆酶等纤维素酶活性呈正相关。陈建军等[39]在固体栽培试验中发现平菇漆酶的活性在菌丝体长到40 mm左右时最高,出菇之后活性降低,出现低峰期。在本次试验中,漆酶的活性变化规律与陈建军等[39]的结果相符,即在幼菇时期出现酶活性低峰,以田土+牛粪处理下酶活性变化最明显。POD被称为食用菌的保护酶。前人研究表明,温度胁迫能够造成POD活性的改变[40]。在试验过程中,POD的整体活性随着栽培时间的延长缓慢降低;在4种处理中,以田土+牛粪为覆土材料时,其酶活性波动范围较小,整体保持一个较高的活性水平。
半纤维素酶通过降解半纤维素为菌体的生长发育提供大量的碳源。研究发现,半纤维素酶活性在子实体形成阶段较高[41]。本次试验中,半纤维素酶活性的变化符合该研究结论,即在幼菇和成熟期分别达到一个高峰。
在食用菌中,PPO又被称为酪氨酸酶,位于一些衰老及受损的的细胞中,PPO能够将天然底物γ−谷氨酸−4−羟基苯、酪氨酸以及3,4−二羟基苯丙氨酸氧化成红色的醌类,这些酚类氧化成醌类可导致子实体褐变。也有试验表明,酚类物质被氧化后具有一定的毒性,可以避免其他微生物的侵入[42]。同时,多酚氧化酶在木质素降解过程中,对微生物代谢起到催化的作用,潘迎捷等[43]研究了香菇菌丝生长中PPO活性的动态变化,发现在菌丝生长前期,PPO活性较低,在接下来的时期,PPO活性达到一个高峰,本试验中酶活性测定结果与前人试验结论相符。
3.4 结论本文以田土、田土+牛粪、菌渣、田土+沙子为覆土材料,研究了印度丽蘑覆土后的农艺性状和产量,同时测定了可溶性蛋白含量及胞外酶活性的变化。结果表明,以田土+牛粪为覆土材料,现蕾时间最短、子实体产量最高、出菇密度最高;以菌渣为覆土材料时,产量和出菇密度次之,但现蕾时间最长。田土+沙土处理不适合作为覆土材料。在印度丽蘑不同生长期,各覆土处理的可溶性蛋白含量呈上升趋势,在整个生长期,以田土+牛粪为覆土材料时可溶性蛋白含量较高。
在印度丽蘑各生长期内,4种覆土材料处理后,印度丽蘑均有较完整的胞外酶体系,其中以田土+牛粪为覆土材料时,其胞外酶的活性变化最有利于菌体生长。综合印度丽蘑生长情况和经济效益等因素以田土+牛粪为覆土材料最有利于印度丽蘑生长并获得理想的产量。
| [1] |
AMIN R, KHAIR A, ALAM N, et al. Effect of different substrates and casing materials on the growth and yield of calocybe indica[J]. Mycobiology, 2010, 38(2): 97. DOI:10.4489/MYCO.2010.38.2.097 (  0) 0) |
| [2] |
SUBBIAH K A, BALAN V. A comprehensive review of tropical milky white mushroom (Calocybe indica P&C)
[J]. Mycobiology, 2015, 43(3): 184-194. DOI:10.5941/MYCO.2015.43.3.184 (  0) 0) |
| [3] |
SENTHILNAMBI D, ESWARAN A, BALABASKAR P. Cultivation of Calocybe indica (P and C) during different months and influence of temperature and relative humidity on the yield of summer mushroom
[J]. Afr J Agr Res, 2011, 6(3): 771-773. (  0) 0) |
| [4] |
CHANDRAVADANA M V, VEKATESHWARLU G, BABU C S B, et al. Volatile flavour components of dry milky mushrooms (Calocybe indica)
[J]. Flavour Frag J, 2010, 20(6): 715-717. (  0) 0) |
| [5] |
CHAKRABORTY U, SIKDAR S R. Intergeneric protoplast fusion between Calocybe indica (milky mushroom) and peurotus florida aids in the qualitative and quantitative improvement of sporophore of the milky mushroom
[J]. World J Microbiol Biotechnol, 2010, 26(2): 213-225. DOI:10.1007/s11274-009-0162-8 (  0) 0) |
| [6] |
PANI B K. Effect of spawning methods on sporophore production of Calocybe indica
[J]. Biosci Discov, 2011, 2(2): 189-190. (  0) 0) |
| [7] |
SATYANARAYANA B, RAMAN A V, DEHAIRS F, et al. Mangrove floristic and zonation patterns of Coringa, Kakinada Bay, East Coast of India[J]. Wetl Ecol Manag, 2002, 10(1): 25-37. DOI:10.1023/A:1014345403103 (  0) 0) |
| [8] |
方新新. 印度丽蘑生物学特性及适应性栽培研究[D]. 南宁: 广西大学, 2017.
(  0) 0) |
| [9] |
DOSHI A, SIDANA N, CHAKRAVARTI B P. Cultivation of summer mushroom Calocybe indica (P & C) in Rajasthan
[J]. Mushroom Science, 1989, 12(4): 187-191. (  0) 0) |
| [10] |
KASTHURI R, KARTHEESWARAN S, THANGAVEL K, et al. Studies on qualities of canned milky mushroom (Calocybe indica)
[J]. J Mol Biol, 2007, 209(3): 489-491. (  0) 0) |
| [11] |
PHAN C W, DAVID P, SABARATNAM V. Edible and medicinal mushrooms: Emerging brain food for the mitigation of neurodegenerative diseases[J]. J med Food, 2017, 20(1): 1. DOI:10.1089/jmf.2016.3740 (  0) 0) |
| [12] |
VIJAYKUMAR G, JOHN P, GANESH K, et al. Selection of different substrates for the cultivation of milky mushroom (Calocybe indica P & C)
[J]. Indian J Tradit Know, 2014, 13(2): 434-436. (  0) 0) |
| [13] |
SINGH M, SINGH A K, GAUTAM R K. Effect of casing and supplementation on yield of milky mushroom (Calocybe indica).
[J]. Indian Phytopathol, 2007, 60(2): 191-193. (  0) 0) |
| [14] |
赵嘉菱, 张猛, 韦锦范, 等. 不同添加物基料及覆土材料对印度丽蘑生长和产量的影响[J]. 南方农业学报, 2018, 49(8): 1581-1587. DOI:10.3969/j.issn.2095-1191.2018.08.17 (  0) 0) |
| [15] |
ALAM N, AMIN R, KHAIR A, et al. Influence of different supplements on the commercial cultivation of milky white mushroom[J]. Mycobiology, 2010, 38(3): 184-189. DOI:10.4489/MYCO.2010.38.3.184 (  0) 0) |
| [16] |
李传华, 刘培培, 赵春生, 等. 无需覆土的蘑菇属食用菌: 中国美味蘑菇[J]. 菌物学报, 2018, 37(5): 595-605. (  0) 0) |
| [17] |
李静, 赵洪, 马媛. 杏鲍菇覆土栽培及追肥对产量的影响[J]. 食用菌, 2012, 34(6): 37-38. DOI:10.3969/j.issn.1000-8357.2012.06.021 (  0) 0) |
| [18] |
NOBLE R, DOBROVIN-PENNINGTON A, EVERED C E, et al. Properties of peat-based casing soils and their influence on the water relations and growth of the mushroom (Agaricus bisporus)
[J]. Plant Soil, 1998, 207(1): 1-13. DOI:10.1023/A:1004316922627 (  0) 0) |
| [19] |
EGER-HUMMEL G. Blue-light photomorphogenesis in mushrooms (basidiomycetes)[C]// SENGER H. The blue light syndrome, Berlin: Springer-Verlag, 1980.
(  0) 0) |
| [20] |
NAIR N G, HAYES W A. Some effects of casing soil amendments on mushroom cropping[J]. Aust J Agr Res, 1975, 26(1): 181-188. DOI:10.1071/AR9750181 (  0) 0) |
| [21] |
SMERDON M. Thoughts on casing[J]. Mushroom Journal, 1983, 12(4): 193-194. (  0) 0) |
| [22] |
方白玉. 粤北野生灵芝与栽培灵芝同工酶及可溶性蛋白的研究[J]. 食用菌, 2013, 35(1): 9-11. DOI:10.3969/j.issn.1005-9873.2013.01.002 (  0) 0) |
| [23] |
STASZ T E, NIXON K, HARMAN G E, et al. Evaluation of phenetic species and phylogenetic relationships in the genus Trichoderma by cladistic analysis of isozyme polymorphism.
[J]. Mycologia, 1989, 81(3): 391-403. DOI:10.1080/00275514.1989.12025762 (  0) 0) |
| [24] |
顾雅君, 王英, 刘建荣, 等. 与食用菌相关主要酶的研究与应用[J]. 中国食用菌, 2006, 7(1): 40-42. DOI:10.3969/j.issn.1003-8310.2006.01.016 (  0) 0) |
| [25] |
CARLSSON N, BORDE A, WÖLFEL S, et al. Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers[J]. Anal Biochem, 2011, 411(1): 116-121. DOI:10.1016/j.ab.2010.12.026 (  0) 0) |
| [26] |
邵伟, 乐超银, 黄艺, 等. 蘑菇多酚氧化酶酶学特性初步研究[J]. 食用菌, 2007, 29(2): 5-6. DOI:10.3969/j.issn.1000-8357.2007.02.003 (  0) 0) |
| [27] |
张志良. 植物生理实验指导[M]. 2版. 北京: 高等教育出版社, 1990: 153-154.
(  0) 0) |
| [28] |
曾璐漫, 康信聪, 周荣辉, 等. 不同培养基成分对灵芝漆酶酶活的影响[J]. 食用菌, 2015, 37(3): 7-8. DOI:10.3969/j.issn.1000-8357.2015.03.003 (  0) 0) |
| [29] |
王玉万, 王云. 构菌栽培过程中对木质纤维素的降解和几种多糖分解酶活性的变化[J]. 微生物学通报, 1989, 16(3): 137-140. (  0) 0) |
| [30] |
SHAMALA T R, SCREEKANTIAN K R. Production of cellulases and D-xylanase by some selected fungal isolases
[J]. Enzyme Microb Technol, 1986, 8(3): 178-182. DOI:10.1016/0141-0229(86)90109-2 (  0) 0) |
| [31] |
吕春鹤, 孙婷婷, 张健, 等. 几种常见食用菌胞外酶活性测定方法的研究[J]. 中国林副特产, 2013(5): 93-96. (  0) 0) |
| [32] |
孙彬, 张楠, 汪潮柱, 等. 覆土对双孢菇生长发育的影响[J]. 安徽农业科学, 2018, 46(4): 45-46. DOI:10.3969/j.issn.0517-6611.2018.04.014 (  0) 0) |
| [33] |
赵凤良, 王尚堃, 雷新梅. 3种不同覆土材料对双孢蘑菇栽培的影响[J]. 安徽农业科学, 2006, 34(18): 4555-4557. DOI:10.3969/j.issn.0517-6611.2006.18.027 (  0) 0) |
| [34] |
(  0) 0) |
| [35] |
毛慧玲, 李思光. 金针菇菌丝生长量与可溶性蛋白含量变化比较研究[J]. 食用菌学报, 1998, 5(4): 34-36. (  0) 0) |
| [36] |
赵亚东. 不同培养料对秀珍菇生长发育、产量及胞外酶的影响[D]. 南京: 南京农业大学, 2011.
(  0) 0) |
| [37] |
俞苓, 刘民胜, 陈有容. 杏鲍菇液体培养中胞外酶活性变化[J]. 食用菌, 2003, 25(1): 7-8. DOI:10.3969/j.issn.1000-8357.2003.01.004 (  0) 0) |
| [38] |
韩增华, 张丕奇, 孔祥辉, 等. 黑木耳胞外酶活变化与栽培性状比较的研究[J]. 食用菌学报, 2007, 14(4): 41-46. DOI:10.3969/j.issn.1005-9873.2007.04.007 (  0) 0) |
| [39] |
陈建军, 杨清香, 王栋, 等. 不同生长阶段平菇漆酶、纤维素酶活性研究[J]. 西北农业学报, 2007, 16(1): 87-89. DOI:10.3969/j.issn.1004-1389.2007.01.019 (  0) 0) |
| [40] |
刘秀明, 郑素月, 图力古尔, 等. 温度胁迫对白灵侧耳菌丝保护酶活性的影响[J]. 食用菌学报, 2010, 17(2): 60-62. DOI:10.3969/j.issn.1005-9873.2010.02.012 (  0) 0) |
| [41] |
王伟科, 陆娜, 周祖法, 等. 8种胞外酶在香菇不同生长阶段的活性变化[J]. 浙江农业科学, 2014, 1(4): 501. DOI:10.3969/j.issn.0528-9017.2014.04.014 (  0) 0) |
| [42] |
郑海歌, 顾向红. 蘑菇中的多酚氧化酶及其同工酶[J]. 食用菌, 1990, 12(6): 17-18. (  0) 0) |
| [43] |
潘迎捷, 陈明杰. 香菇菌丝生长中多酚氧化酶的动态变化[J]. 食用菌, 1990, 12(3): 4-6. (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


