2. 广东省中医院,广东 广州 510120;
3. 中国科学院 南海海洋研究所/中国科学院 热带海洋生物资源与生态重点实验室/广东省海洋药物重点实验室,广东 广州 510301
2. Guangdong Provincial Hospital of Chinese Medicine, Guangzhou 510120, China;
3. South China Sea Institute of Oceanology, Chinese Academy of Sciences/CAS Key Laboratory of Tropical Marine Bio-resources and Ecology/Guangdong Key Laboratory of Marine Materia Medica, Guangzhou 510301, China
从20世纪60年代起,酶的固定化研究已成为酶工程领域中最受关注的研究方向之一,与游离酶相比,固定化酶具有易分离回收、稳定性好、可重复多批次利用等优点,使生物酶的工业应用更为经济可行[1-2]。酶的固定化方法很多,常用的有吸附法、包埋法、交联法和共价结合法[3-5],其中共价结合法由于其固定化酶通常具有良好的稳定性和可重复利用率而受到研究者的青睐[6]。环氧树脂是一种人工合成的高分子聚合材料,具有多孔立体结构,且在较长的生产周期内具有很强的耐微生物和耐酸碱腐蚀作用,也具有较强的机械性能;同时,环氧基团具有很高的活性和可塑性,在常温下可与酶蛋白表面的氨基酸残基(—NH2、—COOH、—HS等)发生温和的开环共价结合,将酶分子固定在载体表面,使得固定化操作简单方便,作为一种新型的固定化载体材料,被广泛应用于生物酶的固定化研究[7-8]。
利用环氧树脂固定化生物酶,得到的固定化酶的酶活力以及稳定性,主要受两方面因素的影响。一方面,某些生物酶吸附固定后,由于酶和环氧树脂的内部结构有较大差异,在短时间内并未形成多点共价链接,在碱性条件下孵育一段时间可形成牢固的多点共价链接,从而增加其温度稳定性[9]。Torres等[10]在利用环氧树脂固定化L−阿拉伯异构酶和D−葡萄糖异构酶时,2种固定化酶在pH8.5的缓冲液中孵育24 h后,在50 ℃条件下的半衰期都有了显著的提高;Mateo等[11]将在青霉素G酰基转移酶固定到Eupergit C的试验中也得到了类似的结果。另一方面,在生物酶的固定化过程中,载体内部的疏水微环境可以促进载体表面与蛋白质表面的接触,这是固定化生物酶所必须的条件,但在某些情况下,这种疏水微环境可能对酶的性质有强烈的负面影响[12],欧美国家的环氧树脂生产厂家推荐使用氨基酸等亲水试剂孵育固定化酶来消除载体上过剩的环氧基团,防止酶与载体继续发生疏水相互作用和化学反应,从而消除这一负面影响[11, 13]。本试验采用国产LXEP-120环氧树脂固定化脂肪酶,对阻断脂肪酶与固定化载体剩余环氧基团继续反应的孵育条件进行优化探索,考察氨基酸溶液的种类、浓度、pH以及孵育的温度和时间等因素对固定化酶的酶活力和温度稳定性的影响,从而为国产环氧树脂固定化脂肪酶的稳定性研究提供试验基础。
1 材料与方法 1.1 材料与仪器脂肪酶,购自深圳恒生生物科技有限公司;LXEP-120环氧树脂,西安蓝晓新材料股份有限公司生产;橄榄油、吡啶、无水醋酸铜,购自阿拉丁公司;丙氨酸、丝氨酸购自麦克林试剂公司;甘氨酸购自捷瑞生物工程有限公司;其他试剂皆为国产分析纯。
瑞士Tecan Infinite M200 Pro酶标仪;SCIENTZ-IID超声破碎仪。
1.2 固定化脂肪酶制备 1.2.1 环氧树脂固定化脂肪酶的制备准确称取LXEP-120环氧树脂5 g,加入4 mL脂肪酶液(脂肪酶酶粉用pH6.0的1 mol/L磷酸钾缓冲液溶解,至终质量浓度为2 g/L,10 000 r/min离心12 min),放入22 ℃摇床中,150 r/min条件下固定12 h。用缓冲液洗去载体表面残留的酶分子,抽滤后,4 ℃条件下密封保存。
1.2.2 氨基酸溶液孵育环氧树脂固定化脂肪酶准确称取5 g制备好的LXEP-120环氧树脂固定化脂肪酶,分别加入5 mL不同的氨基酸溶液,放入摇床中,25 ℃、150 r/min条件下孵育24 h。孵育完成后,用缓冲液洗去载体表面残留的酶分子,抽滤并干燥,冰箱4 ℃条件下密封保存备用。
1.3 固定化酶活力测定固定化脂肪酶活力测定采用改进的铜皂分光光度法。在测定过程中,只需将反应体系中的游离酶换成适量的固定化脂肪酶即可,其他操作均与游离酶测定酶活力方法相同。
酶活力定义:在测定条件下(40 ℃,pH 8.0),1 min内催化底物水解产生1 μmol脂肪酸所需的酶量为一个酶活力单位(U)。
相对酶活力定义:在同一组试验中,设定酶活力最高的一组为100%,其余组的酶活力与之相比,用百分数表示结果。
残余酶活力定义:经过不同温度或pH条件下处理一定时间后的相对酶活力(以处理前的酶活力为100%).
1.4 甘氨酸孵育环氧树脂固定化脂肪酶条件优化 1.4.1 孵育LXEP-120环氧树脂的氨基酸溶液的选择配制1.5 mol/L的pH为7.0的丙氨酸、丝氨酸和甘氨酸溶液,分别取5 mL溶液(每g固定化脂肪酶取1 mL溶液,下同)加入到制备好的固定化脂肪酶中,进行孵育操作(放入25 ℃摇床中,150 r/min条件下孵育24 h),测定酶活力。
1.4.2 孵育LXEP-120环氧树脂的甘氨酸浓度优化配制浓度为0.5、1.0、1.5、2.0、2.5和3.0 mol/L的甘氨酸溶液,分别取5 mL甘氨酸溶液加入到制备好的固定化脂肪酶中,按1.4.1进行孵育,测定酶活力。
1.4.3 孵育LXEP-120环氧树脂的甘氨酸溶液pH优化配制浓度为2.5 mol/L,pH为5.5、6.0、6.5、7.0、7.5和8.0的甘氨酸溶液,分别取5 mL甘氨酸溶液加入到制备好的固定化脂肪酶中,按1.4.1进行孵育,测定酶活力。
1.4.4 LXEP-120环氧树脂的孵育温度优化配制2.5 mol/L、pH为7.0的甘氨酸溶液,取5 mL甘氨酸溶液加入到制备好的固定化脂肪酶中,分别置于20、25、30、35、40、45和50 ℃摇床中,150 r/min条件下孵育24 h,测定酶活力。
1.4.5 LXEP-120环氧树脂的孵育时间优化配制2.5 mol/L、pH为7.0的甘氨酸溶液,取5 mL甘氨酸溶液加入到制备好的固定化脂肪酶中,放入25 ℃摇床中,150 r/min条件下,分别孵育0、6、12、18、24、30、36和48 h,测定酶活力。
1.5 固定化脂肪酶的酶学性质测定 1.5.1 固定化脂肪酶的最适反应pH测定40 ℃条件下,采用不同pH(6.0~10.0)的缓冲液测定甘氨酸孵育后的固定化脂肪酶和未孵育的固定化脂肪酶的酶活力,研究pH对其酶活力的影响。
1.5.2 固定化脂肪酶的最适反应温度测定设定缓冲液的pH=8.0,测定不同温度(25~60 ℃)孵育后的固定化脂肪酶和未孵育的固定化脂肪酶的酶活力,研究温度对其酶活力的影响。
1.5.3 固定化脂肪酶的pH耐受性测定分别将甘氨酸孵育后的固定化脂肪酶和未孵育的固定化脂肪酶放置在pH为4、5、6、7、8、9和10的浓度为0.5 mol/L的缓冲液中,室温条件下处理6 h,然后在最适反应条件下测定残余酶活力,对照组不做处理。
1.5.4 固定化脂肪酶热稳定性测定称取一定质量的甘氨酸孵育后的固定化脂肪酶和未孵育的固定化脂肪酶,在40~80 ℃(间隔5 ℃)条件下处理6 h,然后测定残余酶活力,以放置在4 ℃条件下的固定化脂肪酶为对照。
1.5.5 固定化脂肪酶操作稳定性测定称取一定质量的甘氨酸孵育后的固定化脂肪酶和未孵育的固定化脂肪酶,在40 ℃、pH7.0条件下连续不间断反应10次,每一次都测定酶活力,以第1次反应测得的酶活力为100%。
1.5.6 固定化脂肪酶储藏稳定性测定将抽滤干燥后的固定化脂肪酶密封保存在4 ℃冰箱中,每隔一段时间测定其45 ℃、pH8.0条件下的酶活力,以第1次反应测得的酶活力为100%。
1.6 数据分析采用SPSS 19软件,通过t检验对甘氨酸孵育前后的固定化脂肪酶的酶学性质差异显著性进行比较分析。
2 结果与分析 2.1 孵育环氧树脂的氨基酸溶液的选择由图1可知,在相同条件下使用不同氨基酸溶液孵育固定化脂肪酶后,甘氨酸、丙氨酸、丝氨酸孵育后得到的固定化脂肪酶的酶活力与对照组相比基本没有损失。同时,经70 ℃保温处理6 h后,这3个处理的固定化脂肪酶的残余酶活力基本相同。因此,基于经济角度以及氨基酸的溶解度考虑,选择甘氨酸作为孵育溶液进行后续试验。

|
图 1 氨基酸溶液孵育对固定化脂肪酶活力的影响 Fig. 1 Effect of incubation with amino acid solution on immobilized lipase activity |
由图2可知,在不同浓度甘氨酸溶液中孵育24 h后,当甘氨酸浓度为0.5~2.0 mol/L时,固定化脂肪酶的酶活力基本相同,其在70 ℃处理6 h后的残余酶活力也基本一致;当甘氨酸浓度为2.5 mol/L时,固定化脂肪酶的酶活力和残余酶活力都达到最大值;当甘氨酸浓度继续增大时,酶活力和残余酶活力都呈现出较为明显的下降趋势。因此,选择浓度为2.5 mol/L的甘氨酸作为孵育试剂。

|
图 2 不同浓度甘氨酸溶液孵育对固定化脂肪酶活力的影响 Fig. 2 Effect of incubation with different concentrations of glycine solution on immobilized lipase activity |
由图3可知,利用中性或碱性的甘氨酸溶液孵育固定化脂肪酶后,得到的固定化脂肪酶活力较高,其中当pH=7.0时最佳;碱性甘氨酸孵育后,固定化酶的残余酶活力相对较低。因此,选择pH为7.0的甘氨酸溶液进行后续的研究。

|
图 3 不同pH甘氨酸溶液孵育对固定化脂肪酶活力的影响 Fig. 3 Effect of incubation of glycine solution with different pH on immobilized lipase activity |
由图4可知,25 ℃条件下孵育后得到的固定化脂肪酶活力最高,之后随着温度的上升,固定化脂肪酶逐渐失活,当温度超过40 ℃后酶活力急剧下降。因此选择25 ℃条件进行固定化脂肪酶孵育的后续研究。

|
图 4 孵育温度对固定化脂肪酶活力的影响 Fig. 4 Effect of incubation temperature on immobilized lipase activity |
由图5可知,当孵育0~20 h时,孵育时间对固定化酶的酶活力基本没有影响;当温度从20 ℃升高到25 ℃时,固定化脂肪酶活力有较大的提高;超过25 ℃后,随着温度的不断升高,酶活力下降。从图5中可知,未孵育的固定化脂肪酶的残余酶活力为53%左右,而孵育后的固定化脂肪酶的残余酶活力都大于60%,说明甘氨酸孵育可以在一定程度上提高固定化脂肪酶的稳定性。因此选择24 h的孵育条件进行后续的研究。

|
图 5 孵育时间对固定化脂肪酶活力的影响 Fig. 5 Effect of incubation time on immobilized lipase activity |
由图6可知,固定化脂肪酶孵育前后在不同pH缓冲液中的酶活力变化趋势基本一致,最适反应pH都是8.0,在pH为6.0~9.0范围内的相对酶活力都在75%以上。在pH为6.0~8.0时,甘氨酸孵育后的固定化脂肪酶相对酶活力大于未孵育的固定化脂肪酶;而当pH>9.0时,未孵育的固定化脂肪酶的相对酶活力相对较大,且差异极显著(P>0.01)。说明甘氨酸孵育固定化脂肪酶这一操作,使固定化脂肪酶对反应环境pH的敏感性产生了一定的影响。
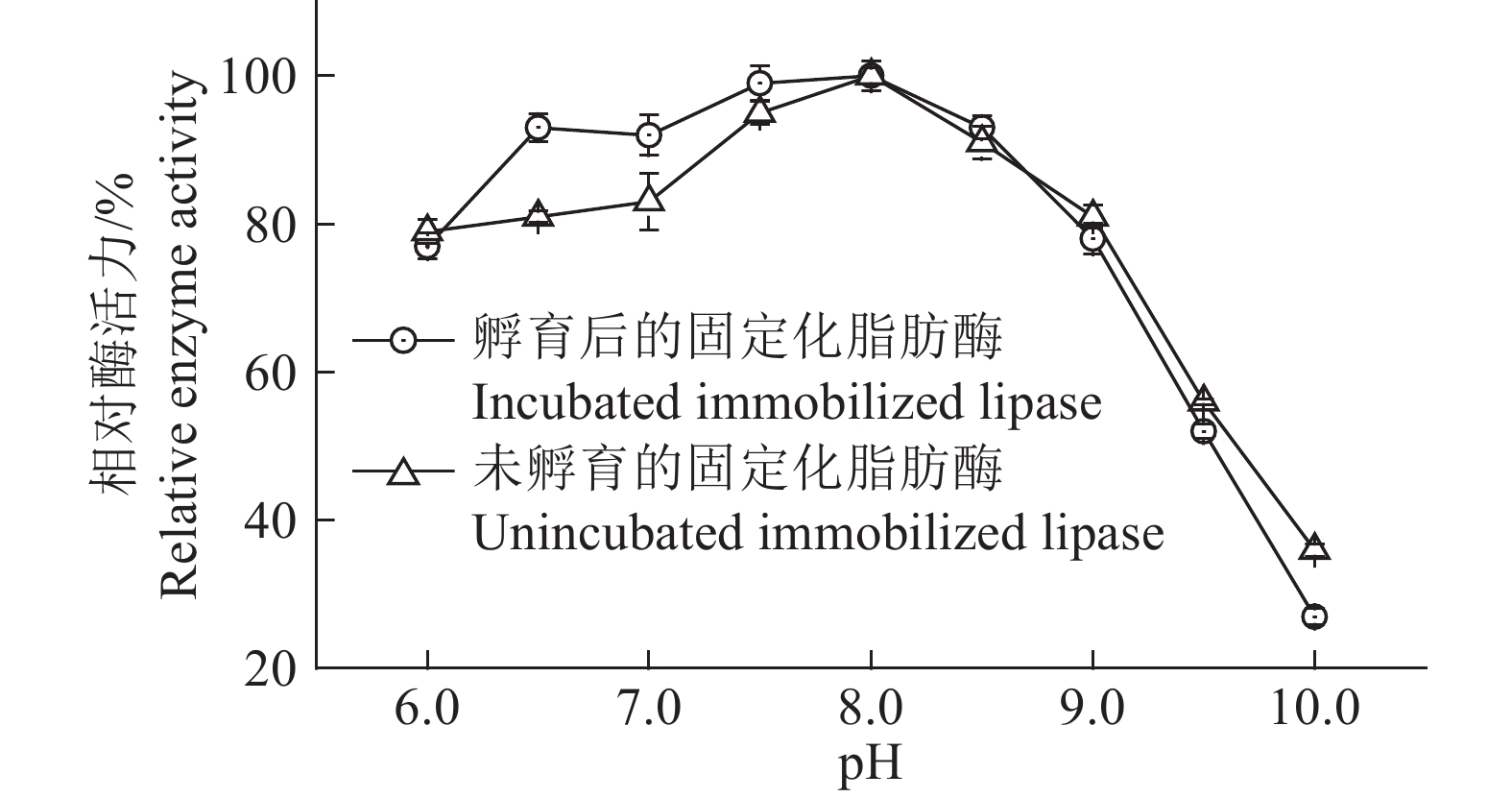
|
图 6 固定化脂肪酶的最适反应pH Fig. 6 The optimal reaction pH of immobilized lipase |
由图7可知,固定化脂肪酶孵育前后在不同反应温度中的酶活力变化趋势基本一致,最适反应温度均为45 ℃。但是当温度>55 ℃后,孵育后的固定化脂肪酶的相对酶活力比未孵育的高,且差异显著(P>0.05),随着温度的升高,这种趋势越明显。说明甘氨酸孵育后,固定化脂肪酶对温度的敏感性降低了,具有更宽广的温度适用性。

|
图 7 固定化脂肪酶的最适反应温度 Fig. 7 The optimal reaction temperature of immobilized lipase |
由图8可知,2种固定化脂肪酶在不同pH缓冲液中都表现出良好的耐受性,在pH5.0~9.0范围内处理6 h后,都保持90%以上的酶活力。其中,孵育后的固定化脂肪酶在pH8.0时耐受性最好,为最初酶活力的99%;未孵育的固定化脂肪酶在pH7.0时耐受性最好,为最初酶活力的97%。说明甘氨酸孵育对固定化脂肪酶的pH稳定性并未产生明显的影响(P>0.05)。

|
图 8 固定化脂肪酶的pH耐受性 Fig. 8 pH stability of immobilized lipase |
由图9可知,相较于未经孵育的固定化脂肪酶,甘氨酸孵育后的固定化脂肪酶显示出良好的温度耐受性。在80 ℃条件下处理6 h后仍保存60%左右的酶活力,而相同条件下处理后的未经孵育的固定化脂肪酶只剩下45%左右的酶活力,差异极显著(P<0.01)。说明甘氨酸孵育可以提高固定化脂肪酶的温度耐受性。

|
图 9 固定化脂肪酶的温度耐受性 Fig. 9 Thermal stability of immobilized lipase |
固定化酶的操作稳定性是衡量其是否具有工业使用价值的一个重要指标,因此试验比较了孵育后固定化脂肪酶和未孵育的固定化脂肪酶的操作稳定性。由图10可知,2种固定化脂肪酶的操作稳定性基本相似,在连续反应10批次后,相对酶活力都保持在初始酶活力的70%以上,整体上孵育后固定化脂肪酶的相对酶活力高于未孵育固定化脂肪酶或者与未孵育固定化脂肪酶基本持平,二者差异不显著(P>0.05),说明甘氨酸孵育对固定化脂肪酶的操作稳定性没有影响。

|
图 10 固定化脂肪酶的操作稳定性 Fig. 10 Operation stability of immobilized lipase |
由图11可知,2种固定化脂肪酶在4 ℃条件下储存10 d左右酶活力基本没有损失,储存4周后保持80%以上的酶活力,差异均不显著(P>0.05),说明该固定化脂肪酶较易储存,且甘氨酸孵育不影响固定化脂肪酶的储存稳定性。

|
图 11 固定化脂肪酶的储存稳定性 Fig. 11 Storage stability of immobilized lipase |
由于载体上剩余的环氧基团可以使得固定化的工业酶失活,因此孵育消除剩余环氧基团是环氧树脂固定化酶必不可少的一个技术环节。在过去的研究中,有人分别采用巯基乙醇和甘氨酸孵育环氧树脂Eupergit C青霉素G酰基转移固定化酶和胰凝乳蛋白固定化酶[11, 14],利用甘氨酸孵育环氧改性丙烯酸固定化半乳糖苷酶,对环氧树脂固定化酶的稳定性进行了初步的研究[15],但都未系统地研究孵育的具体条件以及孵育操作对固定化酶性状的影响,本研究系统地对甘氨酸孵育固定化脂肪酶的条件进行了优化,并研究了孵育后固定化酶的相关酶学性质。
本试验的最佳条件为选用pH7.0、浓度为2.5 mol/L的甘氨酸溶液,在25 ℃条件下孵育24 h。比较了甘氨酸孵育前后固定化脂肪酶的酶学性质,发现孵育后固定化脂肪酶的最适反应pH(8.0)和温度(45 ℃)不变,pH耐受性变化较小,但是对温度的敏感性降低,具有更为宽广的温度适用性。本试验探索了甘氨酸孵育对环氧树脂固定化脂肪酶稳定性的影响,发现甘氨酸孵育可以较大程度地增加固定化脂肪酶的温度稳定性,在最佳条件下孵育得到的固定化脂肪酶在80 ℃条件下处理6 h后仍保存60%左右的酶活力,而相同条件下处理后的未经孵育的固定化脂肪酶只剩下45%左右的酶活力。此外,甘氨酸孵育对于固定化脂肪酶的机械稳定性和储存稳定性的影响较小。
致谢:感谢“科学”号科考船对本工作的支持!
| [1] |
朱珊珊, 邵佩霞, 王永华. LipozymeTL100L脂肪酶的固定化及其性质研究[J]. 食品工业科技, 2010, 31(5): 97-100. (  0) 0) |
| [2] |
KIM H, CHOI N, OH S W, et al. Synthesis of alpha-linolenic acid-rich triacylglycerol using a newly prepared immobilized lipase[J]. Food Chem, 2017, 237: 654-658. DOI:10.1016/j.foodchem.2017.05.161 (  0) 0) |
| [3] |
FARIAS S, MAYER D A, DE OLIVEIRA D, et al. Free and Ca-alginate beads immobilized horseradish peroxidase for the removal of reactive dyes: An experimental and modeling study[J]. Appl Biochem Biotechnol, 2017, 182(4): 1290-1306. DOI:10.1007/s12010-017-2399-2 (  0) 0) |
| [4] |
VAZQUEZ-ORTEGA P G, ALCARAZ-FRUCTUOSO M T, ROJAS-CONTRERAS J A, et al. Stabilization of dimeric beta-glucosidase from Aspergillus niger via glutaraldehyde immobilization under different conditions
[J]. Enzyme Microb Technol, 2018, 110: 38-45. DOI:10.1016/j.enzmictec.2017.12.007 (  0) 0) |
| [5] |
AGHABABAIE M, BEHESHTI M, RAZMJOU A, et al. Covalent immobilization of Candida rugosa lipase on a novel functionalized Fe3O4@SiO2 dip-coated nanocomposite membrane
[J]. Food Bioprod Process, 2016, 100: 351-360. DOI:10.1016/j.fbp.2016.07.016 (  0) 0) |
| [6] |
刘文涛, 段洪东, 王兴建, 等. 环氧基固定化酶载体的研究进展[J]. 山东轻工业学院学报, 2012, 26(3): 40-44. (  0) 0) |
| [7] |
顾恺, 邹树平, 王志才, 等. 环氧树脂固定化卤醇脱卤酶的研究[J]. 现代化工, 2016, 36(11): 69-74. (  0) 0) |
| [8] |
SHELDON R A. Enzyme immobilization: The quest for optimum performance[J]. Adv Synth Catal, 2007, 349(8/9): 1289-1307. (  0) 0) |
| [9] |
BLANCO R M, CALVETE J J, GUISAN J M. Immobilization-stabilization of enzymes : Variables that control the intensity of the trypsin (amine) agarose (aldehyde) multipoint attachment[J]. Enzyme Microb Technol, 1989, 11(6): 353-359. DOI:10.1016/0141-0229(89)90019-7 (  0) 0) |
| [10] |
TORRES P, BATISTA-VIERA F. Immobilized trienzymatic system with enhanced stabilization for the biotransformation of lactose[J]. Molecules, 2017, 22(2): 284. DOI:10.3390/molecules22020284 (  0) 0) |
| [11] |
MATEO C, ABIAN O, FERNANDEZ-LAFUENTE R, et al. Increase in conformational stability of enzymes immobilized on epoxy-activated supports by favoring additional multipoint covalent attachment[J]. Enzyme Microb Technol, 2000, 26(7): 509-515. DOI:10.1016/S0141-0229(99)00188-X (  0) 0) |
| [12] |
MATEO C, GRAZU V, PESSELA B C C, et al. Advances in the design of new epoxy supports for enzyme immobilization-stabilization[J]. Biochem Society Trans, 2007, 35(6): 1593-1601. DOI:10.1042/BST0351593 (  0) 0) |
| [13] |
BARBOSA O, ORTIZ C, BERENGUER-MURCIA A, et al. Strategies for the one-step immobilization-purification of enzymes as industrial biocatalysts[J]. Biotechnol Adv, 2015, 33(5): 435-456. DOI:10.1016/j.biotechadv.2015.03.006 (  0) 0) |
| [14] |
GUISAN, JOSE M. Immobilization-stabilization of enzymes by multipoint covalent attachment on supports activated with epoxy groups[J]. Immobil Enzyme Cell, 2006, 22: 47-54.
(  0) 0) |
| [15] |
TORRES P, BATISTA-VIERA F. Immobilization of β-galactosidase from Bacillus circulans onto epoxy-activated acrylic supports
[J]. J Mol Catal B: Enzym, 2012, 74(3/4): 230-235. DOI:10.1016/j.molcatb.2011.11.006 (  0) 0) |
 2019, Vol. 40
2019, Vol. 40


